Анализ элюатов, получаемых в результате анионообменной хроматографии
Иллюстрации
Показать всеИзобретение относится к способу и устройству для анализа сахаридов. Устройство для анализа образца содержит колонку для анионообменной хроматографии, а также буфер для элюирования, содержащий ион, выбранный из группы, состоящей из нитрата и хлорида. Кроме того, устройство содержит амперометрический детектор и спектроскопический детектор. Причем два детектора расположены таким образом, чтобы получать элюат из колонки. Техническим результатом изобретения является обеспечение дополнительных и усовершенствованных способов и систем для осуществления определения характеристик сахаридов методом анионообменной хроматографии. 2 н.п. и 12 з.п. ф-лы., 19 ил.
Реферат
Все цитируемые в настоящем описании документы включены в него во всей полноте посредством ссылки.
Область техники изобретения
Настоящее изобретение относится к области анализа сахаридов.
Предшествующий уровень техники изобретения
Иммуногены, содержащие капсульные сахаридные антигены, конъюгированные с белками-носителями, хорошо известны в данной области техники. Конъюгирование превращает Т-независимые антигены в Т-зависимые антигены, тем самым усиливая реакции с созданием памяти и позволяя формироваться защитному иммунитету, и прототипной конъюгированной вакциной являлась вакцина против Haemophilus influenzae типа b (Hib) [см., например, главу 14 ссылки i]. После создания вакцины против Hib были разработаны конъюгированные сахаридные вакцины для защиты от Neisseria meningitidis (менингококка) и Streptococcus pneumoniae (пневмококка). Другие микроорганизмы, создание вакцины против которых представляет интерес, представляют собой Streptococcus agalactiae (стрептококк группы В), Pseudomonas aeruginosa и Staphylococcus aureus.
При включении в состав вакцин и других биологических продуктов сахаридов контролирующие органы, как правило, требуют, чтобы их характеристики были определены. Для определения характеристик сахаридов обычно используют метод анионообменной хроматографии и, в частности, высокоэффективной анионообменной хроматографии (НРАЕС), обычно с импульсным амперометрическим обнаружением (PAD) [ii, iii]. Подходящие системы HPAEC-PAD поставляются Dionex™ Corporation (Sunnyvale, CA), например, система BioLC™. Такие системы позволяют проводить количественный анализ отдельных сахаридов в составе смесей без необходимости получения производных или разделения перед проведением анализа, и для определения характеристик сахаридов может быть использован анализ смешанных сахаридов.
При проведении анализа сахаридов элюат из колонки для НРАЕС, как правило, подвергается анализу с помощью импульсного амперометрического детектора (PAD), т.е. обнаружение основано на электрическом токе. При подходящих (высоких) значениях рН углеводы могут быть электрокаталитически окислены на поверхности электродов путем приложения положительного потенциала. Ток, создаваемый таким образом, пропорционален концентрации углевода, что обеспечивает обнаружение и определение количества углевода по методу амперометрии. В отличие от простого амперометрического обнаружения в соответствии с методом PAD наряду со стандартным потенциалом обнаружения испускаются короткие импульсы очищающего и регенерирующего потенциала, что позволяет избегать трудностей, связанных с отравлением электродов продуктами окисления анализируемых веществ. Помимо использования в НРАЕС-анализе, PAD также используют для анализа по методу высокоэффективной катионообменной хроматографии [4] и другим методам ВЭЖХ-разделения.
Для получения дополнительной аналитической информации, особенно при проведении анализа амперометрически неактивных соединений и химически модифицированных соединений, авторы настоящего изобретения приняли решение анализировать элюаты спектроскопическими методами. К сожалению, высокие значения рН, используемые при проведении НРАЕС-анализа капсульных сахаридов, означают присутствие в элюате гидроксид-ионов, а высокие значения поглощения этих ионов (особенно в ультрафиолетовой области) означают, что проведение дополнительного спектроскопического анализа представляет собой непростую задачу. Гидроксид-ионы могут быть удалены с помощью микромембранного химического супрессорного устройства, но это создает новые проблемы, поскольку ацетат, обычно используемый в качестве "вытеснителя" для элюирования капсульных сахаридов, преобразуется супрессором в сильно поглощающую уксусную кислоту.
Задачей изобретения является обеспечение дополнительных и усовершенствованных способов и систем для осуществления определения характеристик сахаридов методом анионообменной хроматографии. В частности, целью является преодоление трудностей спектроскопического анализа элюатов, возникающих из-за присутствия либо гидроксид-ионов, либо, после преобразования гидроксид-ионов, уксусной кислоты.
Раскрытие изобретения
Для преодоления указанных трудностей, вызываемых использованием элюентов на основе гидроксида/ацетата, авторы изобретения использовали два подхода. Во-первых, они сделали выбор в пользу применения более слабых анионообменных носителей, для которых не требуется использование ацетатного вытеснителя. Такие колонки не используются в настоящее время для анализа углеводов, а более широко используются для разделения большого количества анионов неорганических и органических кислот [5]. Во-вторых, они сделали выбор в пользу применения вытеснителей со слабым спектроскопическим поглощением. Оба этих подхода позволили объединить спектроскопическое обнаружение с PAD-обнаружением. Более того, они также совместимы с обычными протоколами HPAEC-PAD и могут быть предпочтительно использованы даже в случаях, когда использование спектроскопического обнаружения считается нежелательным, в особенности потому, что они позволяют лучше разделить длинноцепочечные олигосахариды.
Таким образом, в соответствии с первым аспектом изобретения амперометрическое обнаружение сопрягается со спектроскопическим обнаружением, так что используются оба метода обнаружения. Таким образом, изобретение относится к способу анализа элюата из колонки для жидкостной хроматографии, в котором элюат анализируют как по методу амперометрии, так и по методу спектроскопии. Изобретение также относится к установке для анализа образца, причем в состав установки входят (i) колонка для жидкостной хроматографии, (ii) амперометрический детектор и (iii) спектроскопический детектор, причем два детектора расположены таким образом, чтобы получать элюат из колонки.
Сообщалось о раздельном использовании PAD или УФ-обнаружения для анализа элюатов колонок для НРАЕС [6], но использование и амперометрического, и спектроскопического методов для анализа одного элюата является новым. Объем информации, получаемый от использования обоих видов обнаружения, выгодно превышает таковой, получаемый каждым из двух методов обнаружения по отдельности, например, как видно на фиг.1, некоторые пики характеризуются лучшим динамическим диапазоном по данным УФ-обнаружения, чем по данным PAD, а некоторые пики получаются лучше по данным PAD, чем по данным УФ-обнаружения.
Во втором аспекте изобретение также относится к способу элюирования анализируемого капсульного сахарида с анионообменной хроматографической колонки, в котором анализируемое вещество элюируют элюентом, содержащим анион, отличный от ацетата или гидроксида. Элюент предпочтительно содержит анион, выбранный из группы, состоящей из нитрата; хлорида; карбоната и бората. Удобно использовать натриевые соли этих анионов. Этот способ особенно применим, если элюент является основным (например, с рН>9), и еще более применим, если используют химический супрессор гидроксид-ионов, и обеспечивает лучшее разрешение длинноцепочечных олигосахаридов. Более того, этот способ является особенно применимым для анализа ацетилированных сахаридов.
В третьем аспекте изобретение также относится к способу анализа сахарида по методу анионообменной хроматографии, в котором хроматографию проводят с использованием колонки, характеризующейся емкостью менее 50 мкэкв. (например, ≤40 мкэкв., ≤30 мкэкв., ≤20 мкэкв. и т.д.). Использование колонки низкой емкости означает, что элюция происходит быстро и необходимости использования вытеснителей нет. Таким образом, супрессия гидроксида может быть проведена без образования уксусной кислоты. Как правило, используют безацетатный гидроксидсодержащий элюент, и отказ от использования ацетатных ионов особенно полезен при анализе ацетилированных сахаридов. Использование колонок низкой емкости позволяет лучше разделить длинноцепочечные олигосахариды.
Второй и третий аспекты изобретения могут быть выгодно использованы совместно, т.е. изобретение относится к способу анализа анализируемого капсульного сахарида по методу анионообменной хроматографии, причем хроматографию проводят с использованием колонки, характеризующейся емкостью менее 50 мкэкв., и причем для элюирования с колонки используют элюент, содержащий ион, выбранный из группы, состоящей из нитрата и хлорида.
Изобретение также относится к элюату, получаемому в соответствии со способом по изобретению. Изобретение дополнительно относится к фармацевтическому препарату, содержащему в качестве активного ингредиента вещество, анализируемое в соответствии со способом по изобретению. В частности, изобретение относится к иммуногенной композиции, такой как вакцина, содержащей бактериальный капсульный сахарид, анализируемый в соответствии со способом по изобретению.
Колонка для жидкостной хроматографии
Первый аспект изобретения применим для анализа элюата из колонки для жидкостной хроматографии. Этот аспект может быть приложен к различным колонкам для жидкостной хроматографии, но предпочтительно он применим к высокоэффективной жидкостной хроматографии (ВЭЖХ). Изобретение особенно применимо для анализа результатов разделения по методу высокоэффективной анионообменной хроматографии (НРАЕС) или по методу высокоэффективной катионообменной хроматографии (НРСЕС).
Предпочтительными колонками являются колонки, которые спонтанно задерживают сахариды таким образом, что сахариды приходится элюировать с колонки. Элюция с хроматографической колонки может представлять собой изократическую элюцию или градиентную элюцию. Элюенты, содержащие гидроксид натрия и/или ацетат натрия, являются типичными элюентами, используемыми при анализе сахаридов по методам HPAEC-PAD. Однако в соответствии со вторым аспектом изобретения используют элюенты, содержащие нитрат и/или хлорид (как правило, натриевые соли), обычно по существу в отсутствие какого-либо ацетатного элюента. В этом случае для элюирования анализируемых веществ с анионообменных колонок, как правило, используют основный элюент, например, значение рН составляет >8, >9, >10, >11, >12, >13 и т.д. Для достижения желаемого значения рН могут быть использованы гидроксиды (например, NaOH), а в анионообменных элюентах, как правило, используют гидроксид-ионы.
Элюаты могут подвергаться химической супрессии гидроксид-ионов, особенно если ионы препятствуют осуществлению используемой методики аналитического обнаружения. Может быть удобно использован микромембранный супрессор, такой как продукты MMS от Dionex™. Продукт MMS III обеспечивает постоянную химическую супрессию для повышения значений проводимости анализируемого вещества при снижении проводимости элюента и делает возможным прямое определение проводимости путем применений ионного обмена с использованием изократической или градиентной элюции в широких интервалах концентраций. Использования супрессоров, образующих уксусную кислоту из ацетат-ионов, предпочтительно избегают, когда ацетат-ионы входят в состав элюента, а образующаяся уксусная кислота препятствует осуществлению используемой методики аналитического обнаружения.
Предпочтительными колонками для НРАЕС для использования в соответствии с первым и вторым аспектами изобретения являются колонки CarboPac, продаваемые Dionex, такие как колонки РА1 [диаметр 10 мкм, полистирольный субстрат, сшитый 2% дивинилбензола, аггломерированный с 500 нм функционализированным четвертичным аммонием латексом MicroBead (сшитым на 5%)], РА100, РА20, РАЮ [диаметр 10 мкм, этилвинилбензольный субстрат, сшитый 55% дивинилбензола, аггломерированный с 460 нм дифункционализированным ионом четвертичного аммония MicroBead (сшитым на 5%)], РА200 или МА1. Предпочтительными колонками для НРСЕС являются колонки lonPac, также продаваемые Dionex, включая колонку CS10.
В качестве альтернативы использованию жидкостной хроматографии первый аспект изобретения может быть использован для анализа выходных фракций разделения по методу капиллярного электрофореза, например, системы Beckman-Coulter P/ACE.
В соответствии с третьим аспектом изобретения анионообменная колонка характеризуется ионообменной емкостью менее 50 мкэкв. (микроэквивалентов заряда), например, <40 мкэкв., <30 мкэкв., <20 мкэкв. и т.д. Предпочтительными колонками для НРАЕС являются гидроксидселективные колонки lonPac AS, продаваемые Dionex, такие как колонка AS11 с алканольными четвертичноаммониевыми функциональными группами. При использовании в аналитическом формате 2×250 мм колонка AS11 характеризуется емкостью 11 мкэкв., повышающейся до 45 мкэкв. в формате 4×250 мм. Предпочтительными являются гидроксидселективные колонки низкой емкости.
Амперометрическое и спектроскопическое обнаружение
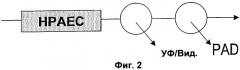
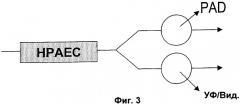
В соответствии с первым аспектом изобретения элюат из колонки для жидкостной хроматографии анализируют как амперометрически, так и спектроскопически. Вещество, элюируемое из колонки, может быть разделено с тем, чтобы одна часть была проанализирована амперометрически, а другая часть была проанализирована спектроскопически. В качестве альтернативы вещество, элюируемое из колонки, может быть проанализировано последовательно без разделения либо сначала амперометрически, а затем спектроскопически, либо сначала спектроскопически, а затем амперометрически. Эти два различных общих метода проиллюстрированы фиг.2 и 3. Если используют последовательный анализ, то может быть предпочтительно провести спектроскопическое обнаружение перед амперометрическим обнаружением, особенно если спектроскопическое обнаружение является неразрушительным по сравнению с амперометрическим обнаружением.
Амперометрическое обнаружение предпочтительно представляет собой импульсное амперометрическое обнаружение (PAD). При проведении PAD могут быть использованы различные формы импульса [7], включая любые из таковых с профилями, показанными на фиг.4. Предпочтительно использовать отрицательный потенциал для очистки электрода. Форма импульса на фиг.4А включает в себя отрицательный потенциал для очистки электрода и как улучшает долгосрочную воспроизводимость, так и уменьшает износ электрода.
Предпочтительно, электрод, используемый для амперометрического обнаружения, представляет собой золотой электрод.
Спектроскопическое обнаружение предпочтительно основано на поглощении и/или эмиссии электромагнитного излучения, предпочтительно с длиной волны от 100 нм до 900 нм (например, с длиной волны в интервале 100-200 нм, 150-250 нм, 200-300 нм, 250-350 нм, 300-400 нм, 350-450 нм, 400-500 нм, 450-550 нм, 500-600 нм, 550-650 нм, 600-700 нм, 650-750 нм, 700-800 нм, 750-850 нм, 800-900 нм). Используемая длина волны излучения может быть выбрана в зависимости от подлежащего обнаружению анализируемого(ых) вещества(веществ). Двумя особенно предпочтительными методами анализа сахаридов являются абсорбционная спектроскопия в ультрафиолетовом (УФ) диапазоне (например, при 220 нм) и абсорбционная спектроскопия в диапазоне видимого света.
В качестве альтернативы использованию амперометрического обнаружения в соответствии с изобретением может использоваться обнаружение по проводимости (включая супрессированное обнаружение по проводимости).
Анализируемые вещества
Изобретение используют для анализа элюата из колонки для жидкостной хроматографии. Элюат представляет собой результат хроматографического разделения одного или нескольких анализируемых веществ в образце.
Изобретение особенно применимо для анализа сахаридных веществ. Они могут представлять собой полисахариды (например, характеризующиеся степенью полимеризации, составляющей, по меньшей мере, 10, например, 20, 30, 40, 50, 60 или более), олигосахариды (например, характеризующиеся степенью полимеризации, составляющей от 2 до 10) или моносахариды. Олигосахариды и моносахариды могут являться результатом деполимеризации и/или гидролиза исходного полисахарида, например, анализируемое вещество может представлять собой сахаридсодержащий фрагмент более крупного сахарида.
Предпочтительными анализируемыми сахаридными веществами являются бактериальные сахариды и особенно бактериальные капсульные сахариды, например, Neisseria meningitidis (серогрупп А, В, С, W135 или Y), Streptococcus pneumoniae (серотипов 4, 6В, 9V, 14, 18С, 19F или 23F), Streptococcus agalactiae (типов Ia, Ib, II, III, IV, V, VI, VII или VIII), Haemophilus influenzae (типируемых штаммов а, b, с, d, e или f), Pseudomonas aeruginosa, Staphylococcus aureus и т.д. Другие анализируемые сахаридные вещества включают в себя глюканы (например, глюканы грибов, такие как глюканы Candida albicans) и капсульные сахариды грибов, например, из капсулы Cryptococcus neoformans. Капсульный сахарид N. meningitidis серогруппы А представляет собой гомополимер (α1→6-связанного N-ацетил-D-маннозамин-1-фосфата. Капсульный сахарид N. meningitidis серогруппы В представляет собой гомополимер (α2 8)-связанных сиаловых кислот. Капсульный сахарид N. meningitidis серогруппы С представляет собой гомополимер (α2 9)-связанных сиаловых кислот. Сахарид N. meningitidis серогруппы W135 представляет собой полимер, состоящий из дисахаридных звеньев сиаловой кислоты-галактозы [4)-D-Neup5Ac(7/9OAc)-α-(2 6)-D-Gal-α-(1]. Сахарид N. meningitidis серогруппы Y схож с сахаридом серогруппы W135, за исключением того, что дисахаридное повторяющееся звено содержит глюкозу вместо галактозы [4)-D-Neup5Ac(7/9OAc)-α-(2 6)-D-Glc-α-(1]. Капсульный сахарид Н. influenzae типа b представляет собой полимер рибозы, рибитола и фосфата ['PRP', (поли-3-β-D-рибозо-(1,1)-D-рибитол-5-фосфат)].
Помимо применимости для анализа полноразмерных капсульных сахаридов изобретение может быть применено и к их олигосахаридным фрагментам.
Другими предпочтительными сахаридными антигенами являются антигены, отщепленные от гликоконъюгатов, например, от сахаридно-белковых антигенов конъюгированных вакцин. Из трех конъюгированных вакцин против N. meningitidis серогруппы С, одобренных для использования у человека, Menjugate™ [8] и Meningitec™ основаны на олигосахаридах, тогда как в NeisVac-C™ использован полноразмерный полисахарид.
Другими предпочтительными сахаридными антигенами являются сахариды эукариот, например, сахариды грибов, сахариды растений, сахариды человека (например, раковые антигены) и т.д.
Предпочтительными анализируемыми веществами являются сахариды, заряженные (например, анионы) при нейтральном значении рН. Сахаридные анализируемые вещества с множественными фосфатными и/или множественными карбоксилатными группами могут подвергаться анализу в соответствии со способами по изобретению. Таким образом, изобретение особенно применимо для анализа полианионных сахаридных соединений.
Другими предпочтительными анализируемыми веществами являются липополисахариды и липоолигосахариды.
Изобретение особенно применимо к анализируемым веществам, содержащим разнообразные сахариды различной длины, например, различных фрагментов одного исходного сахарида.
Анализируемое вещество, как правило, находится в водном растворе, и этот раствор характеризуется высоким значением рН и высокой концентрацией солей в результате проведения НРАЕС.
Типичными анализируемыми веществами являются вещества, которые могут быть обнаружены как амперометрическим, так и спектроскопическим методами.
Помимо интересующего(их) анализируемого(ых) вещества(веществ), подлежащие анализу вещества могут содержать другие вещества. Они могут удерживаться или не удерживаться хроматографической колонкой и соответственно могут присутствовать или отсутствовать в элюате. Как правило, такие компоненты не связываются с колонкой.
Таким образом, элюаты, анализируемые в соответствии со способами по изобретению, содержат эти анализируемые вещества или содержат их предположительно.
Анализируемое вещество может представлять собой продукт, подлежащий тестированию перед выпуском (например, в процессе производства или контроля качества), или может представлять собой продукт, подлежащий тестированию после выпуска (например, для оценки стабильности, срока хранения и т.д.).
Дополнительные стадии
Перед анализом элюата из колонки для жидкостной хроматографии способ по изобретению может предусматривать нанесение содержащего анализируемое вещество (или предположительно содержащего анализируемое вещество) образца на колонку. Таким образом, изобретение относится к способу обнаружения присутствия анализируемого вещества в образце, предусматривающему следующие стадии: (а) нанесение образца на такую колонку для жидкостной хроматографии, что анализируемое вещество из образца удерживается колонкой; (b) элюирование анализируемого вещества с колонки; и (с) анализ элюата, как описано выше.
Для анализа сахаридов может быть желательно отфильтровать, по меньшей мере, некоторые неанализируемые вещества из образца перед нанесением на колонку, и Dionex™ производит для этих целей предколонки и ловушки, например, аминоуловитель для удаления аминокислот, боратный уловитель и т.д.
После элюирования и анализа изобретение может предусматривать дополнительную стадию определения характеристик обнаруженного анализируемого вещества, например, его DP (как правило, среднего значения DP), его молекулярной массы, его чистоты и т.д.
После прохождения через амперометрический и спектроскопический детекторы элюат может быть исследован с помощью масс-спектрометра, например, FAB/MS или ESI/MS.
Использование изобретения для отбора желаемых сахаридов
Изобретение особенно применимо до конъюгирования на стадии, когда необходимо убедиться в том, что для получения конъюгата выбраны сахаридные цепи надлежащего размера.
Изобретение позволяет контролировать или отслеживать ход фрагментации полноразмерного полисахарида до конъюгирования. Если желательно получить олигосахариды конкретной длины (или интервала длин), то важно, чтобы фрагментация полисахарида не была настолько глубокой, чтобы деполимеризация заходила за желаемую точку (например, в предельном случае, с получением моносахаридов). Изобретение обеспечивает мониторинг протекания этой частичной деполимеризации путем измерения длины цепи сахарида во времени. Таким образом, изобретение относится к способу анализа сахарида(ов) в композиции, предусматривающему следующие стадии: (а) начало деполимеризации сахарида(ов) в композиции; и в одной или нескольких временных точках после этого (b) анализ сахарида(ов), как описано выше. При первоначальном проведении экспериментов обычно проводят анализ в нескольких временных точках для определения хода процесса во времени, а после того, как стандартные условия определены, обычно проводят анализ в определенной временной точке для подтверждения. По достижении желаемой конечной точки способ может предусматривать следующую стадию: (с) остановки деполимеризации, например, путем промывания, разделения, охлаждения и т.д. Способ также может предусматривать дополнительную стадию конъюгирования деполимеризованного сахарида с белком-носителем после химической активации при необходимости.
Изобретение также позволяет проводить отбор желаемых олигосахаридных цепей после фрагментации. Таким образом, изобретение относится к способу отбора сахаридов для использования в получении гликоконъюгата, предусматривающему следующие стадии: (а) приготовление композиции, содержащей смесь различных полисахаридных фрагментов; (b) разделение смеси на подсмеси; (с) анализ одной или нескольких подсмесей в соответствии со способом, описанным выше; и (d) использование результатов стадии (с) для отбора одной или нескольких подсмесей для использования в конъюгировании. Способ может предусматривать фрагментацию полисахарида перед стадией (а) или может начинаться с использования заранее приготовленной смеси. Фрагменты могут представлять собой фрагменты одного и того же полисахарида, например, сахарида той же серогруппы. После стадии (d) способ может предусматривать стадию конъюгирования с белком-носителем после химической активации при необходимости.
Для сахарида перед конъюгированием вполне обычной является химическая активация с целью введения функциональной группы, способной реагировать с носителем. Условия активации сахарида могут вызвать гидролиз, и соответственно после активации полезно провести анализ сахарида. Термин "сахарид" следует, где уместно, понимать как охватывающий эти активированные сахариды. Более того, изобретение относится к способу получения активированного сахарида для использования в получении гликоконъюгата, предусматривающему следующие стадии: (а) получение сахарида; (b) химическая активация сахарида с целью введения функциональной группы, способной реагировать с белком-носителем; и (с) анализ продукта стадии (b), описанного выше. Способ может предусматривать дополнительную стадию (d) взаимодействия активированного сахарида с белком-носителем (который и сам может быть активирован) с получением гликоконъюгата. Способ может предусматривать фрагментацию полисахарида перед стадией (а) или может начинаться с использования заранее приготовленной смеси.
Изобретение также может быть использовано после конъюгирования. После конъюгирования композиции могут быть проанализированы с помощью изобретения тремя способами: во-первых, может быть измерено общее содержание сахаридов в композиции, например, перед смешиванием различных конъюгатов или перед выпуском вакцины (в целях соблюдения регламента или контроля качества); во-вторых, может быть измерено содержание свободного неконъюгированного сахарида в композиции, например, для контроля неполного конъюгирования или для слежения за гидролизом конъюгатов путем мониторинга повышения содержания свободного сахарида с течением времени; в-третьих, для тех же целей может быть измерено содержание конъюгированного сахарида в композиции. Для первого и третьего способов требуется, чтобы сахарид высвобождался из состава конъюгата до проведения анализа. Для раздельной оценки конъюгированных и неконъюгированных сахаридов они должны быть разделены. Свободный (т.е. неконъюгированный) сахарид в водной композиции может быть отделен от конъюгированного сахарида различными способами. Реакция конъюгирования изменяет различные химические и физические параметры сахарида, и различия могут быть использованы для разделения. Например, для разделения свободного или конъюгированного сахаридов может быть использовано разделение по размеру, поскольку конъюгированное вещество характеризуется более высокой массой благодаря наличию белка-носителя. Предпочтительным методом разделения по размеру является ультрафильтрация. В качестве дополнительной альтернативы, если конъюгаты адсорбированы на адъюванте, то центрифугирование позволяет отделить адсорбированный конъюгат (в осадке) от свободного сахарида (в супернатанте), который десорбируется после гидролиза.
Изобретение относится к способу анализа гликоконъюгата, предусматривающему следующие стадии: (а) обработка гликоконъюгата для высвобождения сахарида с носителя; и (b) анализ высвобожденного сахарида, как описано выше. Изобретение относится к способу анализа композиции гликоконъюгата, предусматривающему следующие стадии: (а) отделение неконъюгированного сахарида в составе композиции от конъюгированного сахарида; и (b) анализ неконъюгированного и/или конъюгированного сахарида, как описано выше.
Изобретение также относится к способу выпуска вакцины для клинического применения, предусматривающему следующие стадии: (а) производство вакцины, предусматривающее стадию анализа, как описано выше; и, если результаты стадии (а) свидетельствуют о приемлемости вакцины для клинического применения, (b) выпуск вакцины для клинического применения. Стадия (а) может быть осуществлена на упакованной вакцине, на неупакованной вакцине перед упаковкой, на сахаридах перед конъюгированием и т.д.
Изобретение также относится к партии вакцин, причем одну вакцину в составе партии анализируют в соответствии со способом по изобретению.
Общие определения
Термин "содержащий" охватывает термин "включающий в себя", равно как и "состоящий из", например, композиция, "содержащая" Х может состоять исключительно из Х или может включать в себя что-либо отличное, например, Х+Y.
Словосочетание "по существу" не исключает значения "полностью" или "абсолютно", например, композиция, "по существу не содержащая" Y может абсолютно не содержать Y. При необходимости словосочетание "по существу" может быть опущено из определения по изобретению.
Термин "около" применительно к численному значению х означает, например, x±10%.
Способы по изобретению могут быть использованы в аналитических и/или препаративных целях. Упоминание "проведения анализа", "анализа" и т.д. не следует понимать как исключающее препаративные методики.
Степень полимеризации (DP) сахарида определяется как число повторяющихся звеньев в этом сахариде. Таким образом, для гомополимера DP представляет собой то же, что и число моносахаридных звеньев. Однако для гетерополимера DP равна числу моносахаридных звеньев во всей цепи, деленному на число моносахаридных звеньев в минимальном повторяющемся звене, например, DP (Glc-Gal)10 равна 10, а не 20, a DP (Glc-Gal-Neu)10 равна 10, а не 30.
Краткое описание чертежей
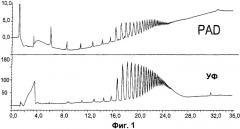
На фиг.1 показан выходной сигнал НРАЕС, проанализированный амперометрическим методом (верхний профиль) и УФ200нм-спектроскопии (нижний профиль). Единицами измерения в верхнем профиле являются нКл; в нижнем профиле использованы относительные единицы.
На фиг.2 показано последовательное расположение амперометрического и спектроскопического обнаружений, тогда как на фиг.3 показано параллельное расположение.
На фиг.4 показаны три формы импульса PAD. По оси х отложено время в секундах. По оси у отложен потенциал в вольтах относительно Ag/AgCl контрольного электрода. Все три формы импульса содержат период задержки (первый отрезок), период обнаружения (второй отрезок), а затем период очистки.
На фиг.5 проиллюстрирован анализ элюата из колонки РА1, причем обнаружение проводили по методу PAD (нижняя кривая) или по методу УФ-спектроскопии (верхняя кривая).
На фиг.6 проиллюстрирован анализ элюата образца сахарида серогруппы А, хранившегося в различных условиях, на колонке РА1. Программа элюции идентична таковой для фиг.19.
На фиг.7 и 8 проиллюстрирован анализ элюата сахаридов серогруппы W135 на колонке РА100 с использованием различных элюентов. На фиг.9 проиллюстрирована элюция того же анализируемого вещества на колонке РА1, а на фиг.10 проиллюстрирована элюция того же анализируемого вещества на колонке РА200.
На фиг.11 проиллюстрирован анализ элюата олигосахаридов Hib на колонке РА100.
На фиг.12 проиллюстрирован анализ элюата пула гидролизованного сахарида Hib на колонке AS11.
На фиг.13 проиллюстрирован анализ элюата полисахарида серогруппы А на колонке AS11. Такой же анализ после гидролиза сахарида проиллюстрирован на фиг.14.
На фиг.15 показаны результаты масс-спектрометрии MALDI-TOF стандарта сахарида серогруппы С, а на фиг.16 проиллюстрирован анализ элюата того же стандарта на колонке РА1. Также анализировали элюцию стандарта на колонке AS11, что показано на фиг.17.
На фиг.18 проиллюстрирован анализ элюции гидролизованного полисахарида серогруппы С на колонке AS11.
На фиг.19 показан профиль элюции воды, измеренный при 214 нм с использованием ацетат/гидроксидного и нитрат/гидроксидного элюентов на колонке РА1 с микромембранной супрессией. Программа элюции идентична таковой для фиг.6.
Способы осуществления изобретения
Обнаружение в ультрафиолетовом диапазоне в элюате НРАЕС
Высокое значение рН, используемое при анализе НРАЕС капсульных сахаридов, означает, что в элюате присутствуют гидроксид-ионы, а эти ионы характеризуются сильным поглощением в ультрафиолетовом диапазоне. Как показано на фиг.19, использование стандартного ацетат/гидроксидного элюента с простой водой на колонке CarboPac РА1 позволяет получить профиль элюции в УФ-диапазоне, в котором не выявляется(ются) никакое(ие) интересующее(ие) анализируемое(ые) вещество(а). Таким образом, для введения в программу анализа элюентов НРАЕС обнаружения в УФ-диапазоне требуется другая стратегия.
Объединенный PAD и УФ-спектроскопический анализ элюата НРАЕС
Капсульный сахарид менингококка серогруппы А подвергали деполимеризации с получением пула заряженных (за счет фосфата из маннозамин-1 -фосфатных мономеров) сахаридов переменной длины (с высоким значением DP). Смесь разделяли не с помощью колонки РА1 для НРАЕС-разделения, а с помощью колонки lonPac AS11 от Dionex с рекомендованной производителем предколонкой с использованием в качестве элюента градиента гидроксида натрия (скорость элюции 1,0 мл/мин). Элюат из колонки для НРАЕС анализировали последовательно с помощью электрохимического (PAD, золотой электрод) и УФ-детекторов. Выходной сигнал, полученный в результате интегрированного амперометрического обнаружения, показан в верхнем профиле на фиг.1, а выходной сигнал, полученный в результате обнаружения в УФ-видимом диапазоне (при 200 нм), приведен в нижнем профиле.
Колонка AS11 характеризуется низкой емкостью (11 мкэкв.). Такое же анализируемое вещество наносили на колонку высокой емкости CarboPac РА1 от Dionex (100 мкэкв.), а в качестве вытеснителя в элюенте использовали хлорид натрия. Как показано на фиг.5, элюат из колонки РА1 не поддается анализу по методу PAD (нижняя кривая), но позволяет проводить обнаружение по методу УФ-спектроскопии (верхняя кривая). Обнаружение по методу УФ-спектроскопии, таким образом, позволяет использовать колонки низкой емкости для АЕС в анализе капсульных сахаридов.
Сравнение нитратного и ацетатного элюентов
Пул олигосахаридных фрагментов капсульного сахарида менингококка серогруппы W135 анализировали в соответствии со стандартным протоколом HPAEC-PAD, используя колонку CarboPac РА100 с градиентной элюцией ацетатом натрия с 100 мМ гидроксидом натрия. Результаты показаны на фиг.7.
Для сравнения проводили такой же анализ, но с использованием в элюенте нитрата натрия вместо ацетата натрия. Как показано на фиг.8, динамический диапазон выходного сигнала был гораздо больше, а разрешение фрагментов с высоким значением DP было лучше. Поддавались обнаружению фрагменты с DP 50.
Замена колонки на CarboPac PA1 увеличила динамический диапазон еще больше (фиг.9), и обнаружению поддавались фрагменты с DP 40. При использовании 5 мкм колонки РА200 можно было наблюдать фрагменты с DP 80 (фиг.10).
Таким образом, нитраты применимы для элюирования капсульных сахаридов различной длины с анионообменных колонок.
Нитратный элюент для определения DP во времени
Сахаридный компонент конъюгированных вакцин может подвергаться постепенному гидролизу, а это приводит к уменьшению со временем значения DP и к меньшему количеству сахарида, связанного с белком-носителем. Мониторинг деполимеризации сахаридов менингококка серогруппы А при различных условиях рН проводили по методу HPAEC-PAD с использованием колонки CarboPac PA1. Элюент представлял собой смесь ацетата натрия и нитрата натрия в 100 мМ гидроксиде натрия при скорости элюции 1,0 мл/мин.
Использовали три различных набора условий хранения: (1) рН ~9 при 37°С в течение 4 суток; (2) рН ~4 при 37°С в течение 4 суток; и (3) рН ~7 при -20°С, т.е. при рекомендованных условиях хранения. Как показано на фиг.6, добавление в элюент нитрата позволяет применять к элюату PAD и обнаруживать фрагменты с низким значением DP после деполимеризации. Короткие фрагменты наблюдались в веществе, которое хранилось при 37°С, в областях, в которых в веществе, которое хранилось при отрицательных температурах, пиков отмечено не было (верхняя линия).
Анализ сахаридов Н. influenzae с помощью колонки низкой емкости
Пул олигосахаридов Hib (с DP 2-6) анализировали в соответствии со стандартным протоколом HPAEC-PAD на колонке CarboPac PA100. Элюент представлял собой градиент ацетата натрия от 30 мМ до 100 мМ с 100 мМ NaOH в течение 24 минут при скорости элюции 0,8 мл/мин. Результаты показаны на фиг.11.
Только короткоцепочечные олигомеры элюировались с CarboPac PA-100, и для элюирования требовалось высокое процентное содержание ацетата натрия в качестве вытеснителя. И даже тогда олигомеры с DP 5 и DP 6 разделялись плохо и с низкой чувствительностью. Таким образом, CarboPac РА-100 не подходит для определения профиля элюции пула олигосахаридов Hib с DP>4. Следовательно, исследовали возм