Лечение, диагностика или профилактика лейшманиоза, вызванного различными видами паразитов, кроме вида, из которого получены гистоны, с использованием всех четырех гистонов h2a, h2b, h3 и h4, выделенных из leishmania infantum с использованием вектора, содержащего нуклеотиды, кодирующие указанные гистоны
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к выделению гистоновых белков простейших Leishmania, и предназначено для лечения, диагностики или профилактики паразитарного заболевания. Используют комбинацию гистоновых белков Н2А, Н2В, Н3 и Н4, выделенных из Leishmania infantum, для получения фармацевтической композиции и диагностического средства. При этом применяют вектор, содержащий нуклеотиды, кодирующие указанные гистоны. Изобретение позволяет лечить и предотвращать паразитарное заболевание, вызванное одним видом, используя гистоны, происходящие из другого вида. 6 н. и 7 з.п. ф-лы, 4 ил.
Реферат
Область изобретения
Настоящее изобретение относится к применению гистонов при лечении, диагностике или профилактике паразитарного заболевания. В частности, данное изобретение относится к использованию одного или нескольких из гистоновых белков Н2А, Н2В, Н3 и Н4.
Предпосылки создания изобретения
Простейшие Leishmania являются облигатными внутриклеточными паразитами, которые инфицируют клетки линии мононуклеарных фагоцитов своих позвоночных хозяев. Эти паразиты являются возбудителями лейшманиозов, группы заболеваний, которые у людей характеризуются многообразием клинических проявлений: от самозаживающих кожных язв, до потенциально летальной висцеральной инфекции (Herwardt, Lancet (1999) 354: 1191). Развитие заболевания и распространение инфекции значительно различаются у различных индивидуумов, в зависимости от генетического фона и статуса иммунной системы инфицированного хозяина. Мышиные модели кожного лейшманиоза широко применяются для изучения требований к эффективной вакцинации. Введение мышам нескольких антигенов, кодируемых в ДНК-вакцинах, в некоторых случаях приводит к профилактике заболевания (рассмотрено в Handman, Clin. Microbiol. Rev. (2001) 14:229). Вакцинации с ДНК, кодирующими белки GP63, LACK и PSA-2, защищают мышей от инфицирования L.major (см., например, Xu et al., Immunology (1955) 84:173). Кроме того, доказано, что иммунизация комбинацией плазмид, экспрессирующих белки LACK, LmST11 и TSA, является высокоэффективной при провокационном заражении малой дозой L.major (Mendez et al. J. Immunol. (2001) 166: 5122), тогда как смесь двух плазмид, кодирующих цистеиновые протеиназы CPa и CPb, частично защищает мышей BALB/c при провокационном заражении высокой дозой L.major (Rafati et al., Vaccine (2001) 19 (25-26): 3369). Большинство экспериментальных исследований иммунитета ограничено лабораторным уровнем и экспериментальными моделями на животных. Таким образом, из-за недостаточного числа исследований на реальных организмах-хозяевах, не существует окончательных доказательств того, что кандидаты будут являться эффективными вакцинами.
Необходимо отметить, что антиген, на который вырабатывается высокий титр антитела, то есть который является иммуногенным, не всегда и по существу является защитой от болезни. Напротив, хотя некоторое антитело или клеточные ответы на антиген могут быть связаны с защитой, другое антитело или клеточные ответы на антиген могут быть связаны с предрасположенностью к заболеванию и/или обострением болезни. Кроме того, для защитного эффекта часто необходим адъювант, в связи с тем, что на антигены без адъюванта может вырабатываться иммунный ответ, но не обеспечивается защитное действие. Например, см. Stacey and Blackwell (Infect Immun. 1999 Aug; 67(8): 3719-26), которые сообщили, что подкожная вакцинация мышей только одним растворимым антигеном Leishmania (SLA), SLA вместе с квасцами, или SLA плюс не-олигодеоксинуклеотиды (ODN), которые включают в себя иммуностимуляторные CG мотивы (CpG ODN), приводит к обострению заболевания по сравнению с невакцинированными мышами. У мышей, получивших SLA плюс CpG ODN, выявлен высокозначимый защитный эффект по сравнению с мышами, вакцинированными SLA, и увеличение выживаемости по сравнению с невакцинированными мышами.
Антигенное разнообразие среди видов Leishmania, допускающее видоспецифические антигенные детерминанты, может являться одной из трудностей при создании вакцины, основанной на индивидуальных антигенах (Handman, 2001, см. выше). Известные ДНК-вакцины защищают только от тех видов микроорганизмов, из которых эти ДНК были получены. Melby и соавторы сообщали в Infect Immun. (2000) 68: 5595, что иммунизация с использованием библиотеки экспрессируемых последовательностей кДНК и суб-библиотек, кодирующих белки Leishmania donovani, защищает мышей против VL формы болезни, вызванной L.donovani. Gurunathan et al., J. Exp. Med. (1977) 186: 1137 сообщали, что вакцинация с применением ДНК, кодирующей иммунодоминантный LACK (гомолог рецепторов для активированной С киназы у лейшмании) антиген паразита L.major, обеспечивает защиту против Leishmania major. Melby et al. Infect Immun. (2001) 69: 4719 показали, что этот антиген не обеспечивает у мышей защиту против L.infantum. Они также сообщили, что, несмотря на то, что ДНК-вакцина L.donovani p36 (LACK) является высокоиммуногенной, она не обеспечивает защиту против исследуемого висцерального лейшманиоза. Этот феномен, что иммуногенная молекула не обеспечивает защиту, то есть не приводит к устранению инфекции или ослаблению клинических симптомов, является одной из проблем при получении эффективной вакцины. Если бы иммуногенная или антигенная молекула всегда автоматически обеспечивала защиту, то получение вакцины не представляло бы никаких трудностей. Получение вакцины, которая может быть использована против нескольких видов микроорганизмов, является еще более сложной задачей.
Подробное описание
Настоящее изобретение относится к применению любого из гистоновых белков H2A, H2B, H3 и H4 для лечения, диагностики или профилактики паразитарного заболевания. В одном варианте осуществления применяют только H4. Предпочтительно применяют два или более из гистонов H2A, H2B, H3 или H4, более предпочтительно применяют три или более из этих гистонов, наиболее предпочтительно применяют все четыре гистона H2A, H2B, H3 или H4.
Преимуществом настоящего изобретения является то, что оно позволяет получить лекарственное средство для лечения широкого спектра заболеваний, то есть лекарственное средство с межвидовой специфичностью. При многих паразитарных заболеваниях вакцина, индуцирующая антителогенез против определенного вида, работает только против этого определенного вида. Одним из примеров паразитарного заболевания, при котором это имеет место, является лейшманиоз. В настоящее время это заболевание контролируется приемом лекарственных средств, но применение лекарственных средств не предотвращает распространение заболевания и во многих случаях является не очень эффективным.
В одном аспекте данного изобретения гистоны применяют для получения фармацевтической композиции для лечения паразитарного заболевания.
В одном варианте осуществления данного изобретения в этой фармацевтической композиции все гистоны присутствуют в эквимолярных количествах. Это означает, например, что фармацевтический препарат, включающий в себя H2A и H2B, включает в себя X моль/л H2A и X моль/л H2B.
В другом варианте осуществления данного изобретения гистоны в фармацевтической композиции присутствуют в не эквимолярных количествах. Это означает, что фармацевтический препарат, включающий в себя, например, гистоны H2A, H3 и H4, может включать в себя X моль/л H2A, X моль/л H3 и Y моль/л H4; или, например, X моль/л H2A, Y моль/л H3 и Z моль/л H4. В предпочтительном варианте осуществления фармацевтическая композиция основана, главным образом, на гистоне H4.
Фармацевтическая композиция по данному изобретению может применяться для повышения способности иммунной системы человека или животного бороться с инфекциями. В частности, она может применяться для введения в организм человека или подопытного животного. Фармацевтическая композиция предпочтительно вводится в организм парентерально, например, инъекцией или инфузией внутривенно, внутрибрюшинно, внутримышечно, внутриартериально или внутрь поражения. Фармацевтическая композиция может быть комбинирована с фармацевтически приемлемой средой или носителем посредством обычных технологических приемов, известных в уровне техники. Способы получения композиций для парентерального введения хорошо известны из уровня техники и описаны более подробно в различных источниках, включающих, например, Remington's Pharmaceutical Sciences, Ed. AR Gennaro, 20th edition, 2000, Williams & Wilkins, PA, USA. Фармацевтическая композиция предпочтительно вводится в терапевтически эффективной дозе, то есть в такой дозе, которая повышает способность иммунной системы человека или животного бороться с инфекциями.
Особый интерес представляет фармацевтическая композиция, которая является вакциной. Вакцина может быть вакциной на белковой основе. Она может включать в себя один или несколько, но предпочтительно два или более, белка, кодируемых генами гистонов Н2А, Н2В, Н3 или Н4. Это означает, что белковая вакцина может быть основана, например, на H2A, H2B и H4, или, например, на H2A, H3 или H4, или на H2A и H3, или только на H4. В предпочтительном варианте осуществления вакцина основана на Н4.
Вакцина также может быть ДНК-вакциной. ДНК-вакцина может включать в себя ген каждого гистона, который присутствует в вакцине. Например, ДНК-вакцина, основанная на гистонах H2A, H2B и H3, может включать в себя ген, кодирующий гистон H2A, ген, кодирующий H2B, и ген, кодирующий гистон H3. Альтернативно, ДНК-вакцина, основанная на гистонах H2A, H2B и H3, может включать в себя два гена, один ген, который кодирует, например, оба гистона H2A и H3, и другой, который кодирует гистон H2B. Или она может включать в себя один ген, кодирующий все три гистона. В данной заявке такие гены, кодирующие несколько гистонов, именуются рекомбинантными генами.
Гены в ДНК-вакцине в соответствии с настоящим изобретении типично присутствуют в векторах. Примеры подходящих векторов хорошо известны специалисту из уровня техники, см., например Donnelly et al., Ann. Rev. Immunol. (1997) 15: 617, и включают в себя, но не ограничиваются, pcDNA3 и pcCMV.
Гистоны H2A, H2B, H3 и H4 являются очень консервативными ядерными белками, и их последовательности хорошо известны в уровне техники, см., например, Requena et al., Trends in Parasitol. (2000) 16: 246. Следовательно, для получения фармацевтической композиции, гистоны H2A, H2B, H3 и H4 могут быть получены из любого эукариотного организма, растения или животного, млекопитающих, рептилий, рыбы, насекомых, или любого другого организма, имеющего хромосомы, например простейшего. Предпочтительно гистоны получены из организма, который является эволюционно близким организму, вызывающему заболевание. Следовательно, особенный интерес в качестве источника гистонов, применяемых для лечения таких паразитарных заболеваний, как лейшманиоз, представляют простейшие и, в частности, члены семейства трипаносоматид, как, например, плазмодий, в частности различные виды трипаносомного простейшего Лейшмания (Leishmania).
ДНК в составе вакцины может быть любой ДНК, пригодной для экспрессии белка, например кДНК или двухцепочечная ДНК (дцДНК), но не геномная ДНК или одноцепочечная ДНК (оцДНК). Также может быть смесь белка и ДНК в одной вакцине посредством одновременного или последовательного введения ДНК и белка. Также могут применяться РНК-вакцины, хотя они нуждаются в стабилизаторах для стабилизирования вводимой РНК.
Существуют более 20 известных видов лейшмании, включающие в себя виды подпороды лейшмания, содержащие в себе комплекс L.major, включая L.major, комплекс L.Donovani, включая L.chagasi, L.donovani и L.infantum, комплекс L.Mexicanа, включая L.amazonensis и L.mexicanа, так же как подвид Viannia, содержащий в себе L.braziliensis, включая L.braziliensis и L.peruviana и комплекс L.guyanensis, включая L.guyanensis и L.panamensis. Виды Plasmodium, вызывающие особый интерес, представляют собой Plasmodium falciparum и Plasmodium vivax.
В одном варианте осуществления данного изобретения фармацевтическая композиция, содержащая в себе гистоны из одного вида, применяется для получения лекарственного средства для лечения паразитарного заболевания, вызванного другим видом.
В частности, лейшманиоз, вызванный одним видом рода Leishmania, может лечиться посредством применения фармацевтической композиции, основанной на гистонах из другого вида Leishmania. В одном варианте осуществления лейшманиоз, вызванный L.major, успешно лечится композицией, содержащей в себе гистоны из L.infantum.
Альтернативно, другие паразитарные заболевания, такие как малярия, можно успешно лечить фармацевтической композицией, основанной на гистонах из другого вида, например, основанной на двух или более гистонах H2A, H2B, H3 и H4 из L.infantum.
В другом аспекте данное изобретение обеспечивает диагностические средства, основанные на одном или нескольких, но предпочтительно на двух или более, гистонах H2A, H2B, H3 и H4. Диагностические средства могут представлять собой гистоновые белки, которые распознают антитела, присутствующие в сыворотке крови пациентов, вступающие в реакцию с некоторыми или всеми гистонами. Диагностический набор, содержащий в себе гистоновые белки по настоящему изобретению, также является частью данного изобретения. Гистоновые белки могут находиться каждый в отдельном контейнере. В дополнение к одному или нескольким, но предпочтительно к двум или более, гистонам H2A, H2B, H3 и H4, набор также может содержать в себе в отдельном контейнере антитела к этим белкам, например, для контрольных реакций.
В другом аспекте изобретение обеспечивает способ предотвращения паразитарной инфекции, функционируя в качестве терапевтической вакцины. В основном существует период времени между инфицированием и развитием болезни. В этом случае вакцина могла бы действовать в качестве фармакологического иммунного продукта, который мог бы излечить заболевание, вызывая в организме хозяина иммунный ответ, который противодействует патологическому эффекту инфекции. Терапевтическая вакцина отличается от профилактической вакцины тем, что терапевтическая вакцина будет индуцировать защиту у пациента, который уже имеет инфекцию или заболевание.
Краткое описание чертежей
Фиг.1
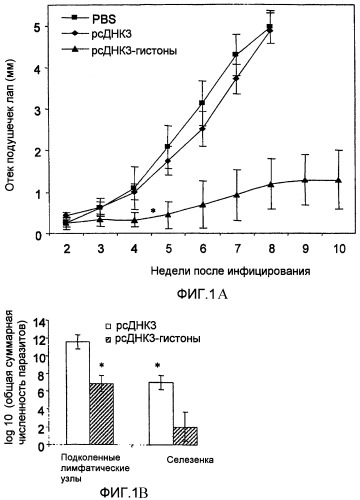
(A) Иммунитет у мышей, вакцинированных тремя дозами генных пулов гистонов. Мышам BALB/c, вакцинированным генами гистонов Leishmania и контролем (pcDNA3 или PBS), проводили провокационную вакцинацию 5×104 промастигот L.major, посредством инъекции в подушечку левой задней лапы.
Отек подушечек лап определяли как разницу между толщиной подушечки инфицированной лапы и подушечки противоположной неинфицированной лапы. Еженедельные измерения отека подушечки лапы представляют шкалу средней величины отека подушечки лап ±SD. Провокационная иммунизация L.major у иммунизированных ДНК мышей отражена в двух различных экспериментах по существу с одинаковыми результатами. На четвертой неделе различия между отеком подушечек лап в контрольной группе и у вакцинированных мышей были достоверными (Р<0,001).
(B) Паразитарная нагрузка в селезенке и лимфатических узлах через восемь недель после инфицирования у контрольных животных (pcDNA3) и через 10 недель после инфицирования у вакцинированных мышей (pcDNA3-гистоны). Клеточные суспензии были получены из подколенного лимфатического узла инфицированной лапы и селезенки. Количество жизнеспособных паразитов определяли посредством метода серийного разведения. Результаты выражены как среднее значение ±SD общего числа паразитов в ткани (выражены в виде десятичного логарифма). Различия между контрольными животными и вакцинированными мышами были достоверными и в селезенке, и в подколенных лимфатических узлах (Р<0,001).
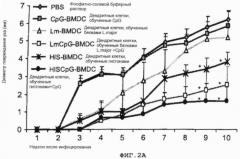
Фиг.2. Процесс инфицирования мышей Balb/c вирусом L.major
(A) животные были иммунизированы фосфатно-солевым буферным раствором (РВS) или обученными антигеном дендритными клетками костного мозга (ДККМ). Спустя один месяц после иммунизации животные были заражены вирусом 1000 L.major промастиготами в каждое ухо. Воспаление определялось путем измерения диаметра поражения уха.
(B) На 10-ю неделю после инфицирования заполнение паразитами зафиксировано в каждом ухе путем метода серийных разведений.
ПРИМЕРЫ
Пример 1
Получение ДНК-вакцины, содержащей гистоны из L.infantum.
Для определения того, способны ли ДНК-вакцины, кодирующие гистоны лейшмании, защищать мышей от инфицирования L.major, гены Н2А, Н2В, Н3 и Н4 L.infantum были субклонированы в эукариотный вектор экспрессии pcDNA3 для экспрессии под контролем промотора сильного цитомегаловируса (CMV). Затем экспрессию гистонов лейшмании оценивали в клетках COS7, трансформированных конструкциями pcDNA3. Экспрессия рекомбинантных белков в клетках млекопитающих, трансформированных плазмидной ДНК, является критическим условием для стимуляции иммунной системы. Трансформированные клетки COS7 культивировали в течение 3 дней и экспрессию гистонов лейшмании оценивали посредством вестерн-блоттинга.
1.1 Клонирование кДНК в вектор экспрессии pcDNA3 млекопитающего
Для экспрессии четырех основных гистонов Leishmania infantum в векторе экспрессии pcDNA3 млекопитающего использовали четыре полноразмерных клона кДНК: Н2А (клон cL72; Soto et al., Eur. J. Biochem. 1992, 205(1): 211-6); Н2В (клон LiH2B; Soto et al., Clin. Exp. Immunol., 1999, 115(2): 342-9); Н3 (клон LiB6; Soto et al., Biochim. Biophys. Acta, 1994, 18: 1219(2): 533-5) и Н4 (клон LiH4-1; Soto et al., Clin. Exp. Immunol. 1999, 115(2): 342-9). Все эти клоны кДНК предварительно выделяли из библиотеки экспрессируемых последовательностей кДНК L.infantum λgtl1. Вставки EcoRI из клонов кДНК субклонировали в соответствующий участок расщепления вектора экспрессии pCDNA3 млекопитающего. Образцы ДНК этих рекомбинантых плазмид pcDNA3 очищали с использованием свободного от эндотоксинов набора Giga-preparation Kit (Qiagen, Hilden, Germany).
1.2 Экспрессия гистонов лейшмании в клетках млекопитающего
Для подтверждения того, что конструкция ДНК была функциональна и экспрессирует упомянутые белки, клетки COS7 трансформировали 20 мкг каждой конструкции pcDNA3, полученные в разделе 1.1, используя реагент Lipofectin® (Gibco, BRL), в соответствии с протоколом производителя. 3×106 клеток высевали на 100 мм плашки в модифицированную по способу Дульбекко среду Игла с добавлением 5% FCS и трансформировали при достижении 50-75% слияния. Через 72 часа после трансформации клетки собирали, отмывали дважды ледяным PBS и незамедлительно лизировали посредством добавления буфера Лэммли. Белок, полученный из эквивалентного числа клеток, разделяли посредством электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) и переносили на нитроцеллюлозные мембраны (Amersham, Aylesbury, UK). Блоты были исследованы с сыворотками собак, страдающих висцеральным лейшманиозом (VCL), очищены посредством аффинной хроматографии против белков Н2В, Н3, Н4 в иммобилизированной фазе, или с сыворотками кроликов, иммунизированных rН2А.
Результаты показали, что трансформированные клетки экспрессировали определимые уровни белков Н2А, Н2В, Н3 и Н4.
1.3 Клонирование в вектор экспрессии pQE30
Для экспрессии в качестве рекомбинантных белков гистонов L.infantum, кодирующие области генов были амплифицированы посредством ПЦР, в качестве матрицы использовали конструкции pcDNA3 из раздела 1.1, а в качестве праймеров использовали следующие нуклеотидные последовательности:
для гена Н2А (прямой 5'-CGGGATCCATGGTACTCCTCGCAGC-3' (позиции 1-17 кодирующей области); обратный 5'-CCCAAGCTTACGCGCTCGGTGTCGCCC-3' (реверсивный и комплементарный к позициям кодирующей области));
для гена Н2В (прямой 5'-CGGGATCCGCCTCTTCTCGCTCTGC-3' (позиции 1-17 кодирующей области); обратный 5'-CCCAAGCTTCAAGCCGACGCGCTCGACAC-3' (реверсивный и комплементарный к позициям кодирующей области));
для гена Н3 (прямой 5'-CGGGATCCATGTCCCGCACCAAGGAGA-3' (позиции 1-19 кодирующей области); обратный 5'-CCCAAGCTTCTAGTGGCGCTCACCGCGCA-3' (реверсивный и комплементарный к позициям кодирующей области)); и
для гена Н4 (прямой 5'-CGGGATCCATGGCCAAGGGCAAGCGTT-3' (позиции 1-19 кодирующей области); обратный 5'-CCCAAGCTTACGCGTAGCCGTACAGGA-3' (реверсивный и комплементарный к позициям кодирующей области)).
Подчеркнутые нуклеотиды означают сайты расщепления рестриктазами BamHI и HindIII, включенные для обеспечения клонирования продуктов ПЦР в вектор экспрессии pQE30 (Qiagen, Hilden, Germany). Полученные в результате клоны обозначены как PQE-H2A, pQE-H2B, pQE-Н3 и pQE-H4.
1.4 Экспрессия и очистка рекомбинантных белков, меченных His
Экспрессию и очищение рекомбинантных белков, меченных His, осуществляли в Escherichia coli М15, посредством стандартных процедур (Qiagen). После индукции белка бактерии собирали и разрушали посредством ультразвуковой обработки в денатурирующих условиях (8 М мочевина, 0,5 М NaCl, 20 мМ Tris-HCl). Очистку белка осуществляли на агарозной колонке NI-NTA (Qiagen). Рекомбинантные белки фракционно укладывали на колонке для аффинной хроматографии, как описано (Shi, 1997). Затем рекомбинантные белки элюировали 0,3 М имидазолом. После элюирования фракции, содержащие рекомбинантные гистоны, объединяли и проводили диализ с PBS. Очищенный белок дополнительно пропускали через полимиксин-агарозную колонку (Sigma, St Louis, МО) для того, чтобы элиминировать эндотоксины. Остаточный эндотоксин определяли посредством количественного хромогенного анализа Limulus Amebocyte (QCL-1000, BioWhittaker, Walkersville, MD).
Пример 2. Иммуногенетические характеристики ДНК-вакцины
2.1 Получение общего антигена лейшмании (SLA)
Растворимый антиген лейшмании (SLA) получали в результате трех циклов заморозки-оттаивания неподвижных промастигот L.major, ресуспендированных в PBS. После лизиса клеток растворимые антигены отделяли от нерастворимой фракции посредством центрифугирования.
2.2 Иммунизации и провокационная иммунизация паразитом
Эксперименты по иммунизации проводили в группах из десяти мышей. Мышам трижды с интервалом в 2 недели внутримышечно в четырехглавые мышцы обеих задних конечностей делали прививку 50 мкг (25 мкг в каждую конечность) каждой из плазмидных ДНК (pcDNA3-H2A, pcDNA3-H2B, pcDNA3-H3 и pcDNA3-H4), полученных в разделе 1.1 в общем объеме PBS 100 мкл. Контрольным мышам в таком же режиме делали прививку, но по 200 мкг pcDNA3 в каждую вакцинацию или только PBS. Через четырнадцать дней после каждой прививки мышам проводили кровопускание посредством пункции глазничного сплетения. Через четыре недели после финальной прививки получали селезенки и лимфатические узлы (LN) от иммунизированных мышей, и в группах из пяти иммунизированных мышей проводили иммунизацию 5×104 культивированными неподвижными промастиготами, посредством инъекции в подушечки задних левых лап. Отек подушечек лап измеряли еженедельно и определяли как разницу между толщиной подушечки инфицированной лапы и подушечки противоположной контрольной лапы.
2.3 Определение титров и изотипов антител
Образцы сыворотки крови анализировали на специфические антитела против гистонов Leishmania. На стандартные планшеты для ELISA наносили 100 мкл rН2А, rН2В, rН3 и rН4 (1 мкг/мл в PBS) или SLA (2 мкг/мл в PBS) и инкубировали при комнатной температуре в течение ночи. Проводили последовательные разведения сывороток с целью определения титра, который определяется как обратная величина наибольшего коэффициента разбавления сыворотки, данный при абсорбции >0,2. Изотип-специфические анализы проводили со следующими конъюгированными пероксидазой хрена антимышиными иммуноглобулинами (Nordic Immunological Laboratories, Tilburg, The Netherlands): анти-IgG1 (1:1000) и анти-IgG2а (1:500). В качестве субстрата для пероксидазы использовали ортофенил диамин дигидрохлорид -OPD- (Dako, A/S, Glostrup, Denmark). Через 15 минут реакцию останавливали добавлением 100 мкл 1 М Н2SO4 и измеряли абсорбцию при длине волны 450 нм.
2.4 Определение цитокинов в супернатантах
Высвобождение IFN-γ и IL-4 определяли в супернатантах культур спленоцитов и LNC. Селезенки и лимфатические узлы удаляли у мышей BALB/c в асептических условиях после дислокации шейного отдела позвоночника. Суспензии спленоцитов и клеток лимфатических узлов высевали в полную среду RPMI (RPMI 1640 с добавлением 10% FCS, 2 мМ глютамина, и 10 мМ 2-меркаптоэтанола). 3×106 клетки высевали в 48-луночные планшеты и инкубировали 72 часа при температуре 37°С в присутствии rН2А, rН2В, rН3 и rН4 (12 мкг/мл), гистонов из тимуса теленка (SIGMA) или Con A (2 мкг/мл). Продукцию цитокинов определяли с использованием коммерческого набора для ELISA (Diaclone, Besancon, France).
2.5 Количественное определение паразита
Количество паразитов определяли в подколенных лимфатических узлах инфицированной лапы и в селезенке, посредством серийного разведения (Buffet, et al., 1995). Ткани гомогенизировали и последовательно разводили в 96-луночном плоскодонном микротитрационном планшете, содержащем среду Шнайдера и 20% FCS. Количество жизнеспособных паразитов на лимфатический узел определяли исходя из наибольшего разведения, при котором промастиготы могли бы расти до 7 дней инкубации при температуре 26°C.
2.6 Статистический анализ
Статистический анализ проводили с использованием t-критерия Стьюдента. Разницы рассматривались как достоверные при p<0,05.
2.7 Иммунный ответ после вакцинации ДНК-вакциной
Для изучения иммуногенетических свойств кДНК, мышей BALB/c иммунизировали внутримышечно два или три раза каждые две недели смесью полученных в разделе 1.1 четырех плазмид, кодирующих гистоны Leishmania infantum (50 мкг каждой кДНК). Антитела, специфичные для этих антигенов, оценивали через 2 недели после последней иммунизации. После двух вакцинаций посредством ELISA не было выявлено специфичных антител, в то время как IgG антитела становились выявляемыми в низких титрах после третьей вакцинации. Преобладающим во всех случаях изотипом антител был IgG2a. Только незначительная продукция IgG1 антител также была обнаружена против гистонов Н2А и Н4.
2.8 Т-клеточный ответ после вакцинации ДНК-вакциной
Для измерения Т-клеточного ответа после вакцинации мононуклеарные клетки селезенки и клетки лимфатических узлов (LNCs) получали через 4 недели после последней ДНК-иммунизации и стимулировали in vitro рекомбинантными белками, полученными в разделе 1.4. Через 3 дня инкубирования собирали супернатанты и анализировали и на IFNγ, и на IL-4.
Было отмечено, что у иммунизированных мышей рекомбинантные гистоновые белки стимулировали продукцию IFN-γ в большем количестве и в спленоцитах, и в клетках LNC, чем было обнаружено у контрольных мышей. Гистон-специфической продукции IL-4 не было определено в супернатантах любых культур.
2.9 Анализ IL-12-зависимости
Для более детальной характеристики иммунного ответа, установленного у мышей посредством ДНК-вакцинации генами гистонов L.infantum и его изменением после иммунизации L.major, исследовали антиген-специфическую продукцию IFN-γ в спленоцитах вакцинированных мышей. Через двадцать пять дней после инфицирования L.major спленоциты вакцинированных мышей продолжали продуцировать больше гистон-специфического IFN-γ, чем спленоциты контрольных мышей. Интересно, что продукция IFN-γ, опосредованная SLA, была в 2 раза выше в спленоцитах вакцинированных мышей по сравнению с контрольными животными. Поскольку, IL-12-зависимая продукция IFN-γ является главным механизмом, ассоциированным с контролем инфекции L.major, определяли, существенно ли ингибирует добавление к культуре анти-IL-12 моноклонального антитела продукцию IFN-γ в спленоцитах вакцинированных мышей. Было обнаружено, что ингибирование продукции IFN-γ было более 80% для использованных четырех различных стимулов (гистоны Н2А, Н2В, Н3 и Н4 L.infantum). Это означает, что гистон-специфическая продукция IFN-γ является IL-12-зависимой и, кроме того, что in vitro продукция IL-12 также стимулируется в спленоцитах посредством гистонов лейшмании.
2.10 Вовлечение CD4+ и CD8+ Т-клеток в продукцию IFN-γ
Были определены относительные вклады CD4+ и CD8+ Т-клеток в продукцию IFN-γ. Опосредованная стимулированием гистонами продукция IFN-γ в спленоцитах во всех группах была значительно ингибирована добавлением в культуры анти-CD4 моноклональных антител. Однако добавление в культуры анти-CD8 моноклональных антител индуцировало снижение секреции IFN-γ только в спленоцитах вакцинированных мышей и стимулированных in vitro любым гистоном Н2А или Н3. Таким образом, ДНК-вакцинация генами, кодирующими гистоны Н2А и Н3 Leishmania, представляется более примирующей клетки CD8, чем гены других двух гистонов (Н2В и Н4).
В заключение, для обеспечения дальнейшего понимания иммунного статуса, ассоциированного с иммунитетом, установившимся у мышей посредством ДНК-вакцинации генами, кодирующими гистоны L.infantum, частоту продуцирования IFN-γ CD4+ и CD8+ Т-клетками в LNC определяли посредством внутриклеточного окрашивания цитокинов в конце изучений иммунитета (8 контрольных мышей и 10 вакцинированных мышей). Частота продуцирования INF-γ и CD4+, и CD8+ Т-клетками, была выше у вакцинированных мышей по сравнению с контрольными животными. Таким образом, эти данные являются прямым подтверждением того, что иммунитет против инфекции L.major, достигнутый посредством ДНК-вакцинации гистонами Leishmania, имеет корреляцию с увеличенной частотой продуцирования IFN-γ Т-клетками (CD4+ и CD8+).
Эти результаты согласуются с преобладанием IgG2a антител в сыворотках крови иммунизированных мышей и означают, что ДНК-иммунизация генами гистонов Н2А, Н2В, Н3 и Н4 предпочтительно вызывает Th1-подобный иммунный ответ против этих антигенов. Дополнительные контрольные эксперименты (см. Пример 3) должны были показать, что эти гены также производят профилактический эффект.
Пример 3. Иммунитет против Leishmania major, индуцированный ДНК-вакцинами, кодирующими гистоны Leishmania infantum
Поскольку исследования иммуногенности выявили, что ДНК-иммунизация гистонами инициирует индукцию специфических Th1-подобных иммунных ответов, затем был поставлен вопрос, может ли схема кДНК-иммунизации с использованием генов Н2А, Н2В, Н3 и Н4 обеспечить у мышей иммунитет против инфекции L.major.
3.1 ДНК-вакцина, кодирующая гистоны L.infantum, защищает против инфекции L.major.
Группам семи мышей BALB/c два или три раза с интервалом в две недели внутримышечно проводили вакцинацию с использованием 50 мкг каждой из гистоновых ДНК конструкций, полученных в разделе 1.1. Контрольным животным таким же образом проводили вакцинацию с применением 200 мкг «пустого» вектора, используемого для кДНК клонирования генов гистонов, или вакцинацию только с использованием PBS. Через четыре недели после последней ДНК-иммунизации мышам в подушечку левой лапы проводили провокационную иммунизацию посредством инъекции культивированных 5×104 форм неподвижных промастигот L.major, полученных в разделе 2.1. Отек подушечек лап измеряли еженедельно.
Результаты, представленные на фиг.1А, показывают, что ДНК-вакцинация генами гистонов индуцирует иммунитет против инфекции, в то время как иммунизация только одним вектором не индуцирует. Авторы данного изобретения выявили у вакцинированных мышей явную отсрочку в развитии отека подушечек лап. Во всех случаях у иммунизированных мышей наблюдали более регулируемое воспаление (около 1 мм на восьмую неделю после инфицирования), чем у контрольных животных (около пяти мм на той же самой неделе). У четырех из семи мышей в течение инфекции не наблюдали вообще никаких повреждений. Этот эксперимент был воспроизведен с подобными результатами.
3.2 Паразитарная нагрузка селезенки и лимфатического узла после вакцинации ДНК-вакциной, кодирующей гистоны
Для определения того, существует ли корреляция между уменьшением отека подушечки лапы и паразитарной нагрузкой в селезенке и подколенных лимфатических узлах, мышей безболезненно умерщвляли: группу иммунизированных мышей через 10 недель после инфицирования, а контрольную группу через 8 недель после инфицирования. У вакцинированных мышей наблюдали значительно сниженную паразитарную нагрузку по сравнению с таковой, выявленной у контрольных животных (фиг.1В). Примечательно, что распределение паразита во внутренних органах в контрольной группе наблюдалось однородно (pcDNA3), в то время как у вакцинированных мышей паразитарная нагрузка была низкой, а в некоторых случаях паразиты не были выявлены. Все эти результаты указывают на то, что у вакцинированных мышей кожный лейшманиоз, индуцированный L.major, является регулируемым.
Пример 4. Иммунизация гистонами в индивидуальной форме
В предыдущих примерах показано, что инъекции смеси ДНК эукариотических экспрессионных плазмид pcDNA3, содержащей гены гистонов Leishmania infantum (H2A, Н2В, Н3 and H4) мышам BALB/c, приводили к специфическому Th1 иммунному ответу, что влечет за собой контроль инфекции L.major. В настоящем примере изучали эффект генетической иммунизации одной из этих pcDNA3, кодирующих нуклеосомальные Н2А, Н2В, Н3 и Н4, применяемые раздельно. Экспериментальные условия были, как описано выше.
Результаты показывают, что во всех случаях введение каждого гистона pcDNA3 индуцирует повышение и IL-4, и IL-10 Th2 цитокинов через 9 недель после инфекции L.major, с сопутствующим более низким гуморальным ответом против растворимого антигена лейшмании SLA, и ограниченным гуморальным ответом против гистонов (с преобладанием антител IgG2a), по сравнению с контрольными мышами, иммунизированными «пустой» pcDNA3. Кроме того, результаты анализа пролиферации спленоцитов у мышей контрольной группы показывают наличие подавленного клеточного иммунного ответа на Con A, LPS и на SLA. В течение инфекции у вакцинированных мышей наблюдали задержку отека подушечек лап и более низкую паразитарную нагрузку в подколенных лимфатических узлах, по сравнению с контрольными мышами. В заключение, введение каждого гистона pcDNA3, кодирующей нуклеосомальные гистоны Leishmania, снижает Th2-управляемый иммунитет, индуцированный инфекцией L.major, приводя к низкой продукции IL-4 и IL-10 в селезенке и низкому гуморальному ответу, что имеет корреляцию с иммунитетом против мышиного кожного лейшманиоза. Результаты также показывают, что среди гистонов Leishmania ДНК-иммунизация гистоном Н4 является наиболее эффективной при индукции защитного иммунитета против кожного лейшманиоза.
Фиг.2 Процесс инфицирования мышей Balb/c вирусом L.major
(A): животные были иммунизированы фосфатно-солевым буферным раствором (PBS) или обученными антигеном дендритными клетками костного мозга (ДККМ). Спустя один месяц после иммунизации животные были заражены вирусом 1000 L.major промастиготами в каждое ухо. Воспаление определялось путем измерения диаметра поражения уха.
(B) На 10-ю неделю после инфицирования заполнение паразитами зафиксировано в каждом ухе путем метода серийных разведений.
PBS: фосфатно-солевой буферный раствор
Lm: полные паразитные белки из L.major
CpG: Олигодеоксинуклеотиды, имеющие CpG мотивы
HIS: Белки гистона
HIS-BMDC: дендритные клетки, обученные гистонами
HISCpG-BMDC: дендритные клетки, обученные гистонами + CpG
Lm-BMDC: дендритные клетки, обученные белками L.major
LmCpG-BMDC: дендритные клетки, обученные белками L.major+CpG.
CpG-BMSC: дендритные клетки, обученные CpG.
Пример 5
В этом Примере показано, что дендритные клетки костного мозга (ДККМ), нагруженные Leishmania infantum белками гистона в отсутствие или присутствии CpG мотивов предоставляет защиту против экспериментальной инфекции Leishmania major.
Материалы и Методы
Мыши и паразиты L.major.
Шести-восьминедельные мыши Balb/c содержались в обычных условиях. Паразиты L. major (клон VI: MHOM/IL/80/Friedlin) культивировались при температуре 26°С в среде Шнейдера (Gibco, BRL). Метациклические промастиготы были получены ранее описанным способом (1). Используемые CpG ODN ((5'-TCAACGTTGA-3' и 5'-GCTAGCGTTAGCGT-3') были ранее описаны (1). L.major Ag (Lm), используемый для стимуляции культуры ДККМ, была изготовлена из стационарных культуризированных промастиготов, как ранее описано (2, 3).
Экспрессия Гистонов
Четыре основных гистона L.infantum (Н2А, Н2В, Н3 и Н4) были получены как рекомбинантные белки, следуя ранее описанному методу (4).
Получение ДККМ
ДККМ были получены и культивированы, следуя ранее описанному методу (1, 2). После 7 дней фенотип активации постоянного тока был оценен, базируясь на В220'', СВ8-, CD1 1с+, CD40+, CD80+ и CD86+ выражении. Клетки были повторно ресуспендированы при 1×106 миллифарад1 в культурной среде, содержащей 20 нанограммов колониестимулирующего фактора макрофага гранулоцита (G-CSF) (PeproTech, Лондон, Великобритания). Две группы выращивались в течение 18 часов с Lm (эквивалент 30 паразитам на клетку) в отсутствие или присутствии CpG (25 микрограмм миллифарад1). Другая группа клеток выращивалась со смесью гистонов Н2А, Н2В, Н3 и Н4 (HIS) L.infantum (2 микрограмм миллифарад1 на каждый гистон) в отсутствие или присутствии CpG. Последняя группа клеток выращивалась только с CpG.
Обнаружение паразитов
Обремененности паразитами определялись повреждением уха и селезенки после 10 недель после инфицирования. Кроме того, в повторно зараженных мышах число паразитов было проанализировано в относящемся к одной стороне тела подколенном-DLN на 10-ю неделю после повторного инфицирования предельно растворенной культурой (5). Участки подушечек стопы и ушей были получены от зараженных BALB/c и C57BL/6 мышей соответственно. Брюшные и спинные пласты клеток зараженных ушей были отделены. Участки подушечек стопы и пласты ушей были размещены в модифицированной по способу Дульбекко среде Игла, содержащей смесь фермента Liberase CI (50 fig мл-1). После 2 часов инкубации при температуре 37°С ткани были разрезаны на маленькие части, гомогенизированы и отфильтрованы с использованием клеточного сита (7-й размер пор). Гомогенизированная ткань была последовательно растворена в 96-well плоскодонной пластине микротитра, содержащей среду Шнейдера плюс 20% телячья сыворотка крови (FCS) или двухфазная среда, приготовленная с и