Способ измерения электродинамических параметров биологических тканей и устройство для его осуществления
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и медицинской техники и предназначена для измерения электродинамических параметров биологических тканей. Способ включает в себя формирование СВЧ-сигнала, облучение органа пациента, прием и обработку принятого сигнала. Формирование СВЧ-сигнала осуществляют с помощью генератора качающейся частоты, облучение органа пациента и прием сигнала от органа осуществляют с помощью контактного ближнепольного резонансного датчика. По резонансной кривой датчика определяют частотный сдвиг и изменение амплитуды резонанса принятого сигнала, по величине которых определяют диэлектрическую проницаемость и проводимость биологических тканей. Устройство включает источник СВЧ-сигнала, датчик и блок обработки и регистрации сигнала. Источник СВЧ-сигнала выполнен в виде генератора качающейся частоты, датчик в виде - контактного ближнепольного резонансного датчика. Вход датчика подключен к выходу генератора качающейся частоты, а выход через последовательно соединенные детектор и аналого-цифровой преобразователь подключен к блоку обработки и регистрации сигнала. Выход тактового сигнала генератора качающейся частоты подключен к входам тактового сигнала АЦП и блока обработки и регистрации сигнала, управляющий выход которого соединен с управляющим входом АЦП. Группа изобретений позволяет повысить точность измерения электродинамических параметров биологических тканей. 2 н. и 5 з.п. ф-лы, 7 ил.
Реферат
Изобретение относится к области медицины и медицинской техники и может быть использовано для ранней неинвазивной диагностики заболеваний в области онкологии, дерматологии и др.
Патологические и физиологические процессы в живых тканях, как правило, сопровождаются изменением их электродинамических свойств, задача измерения которых представляет значительный интерес в различных медицинских приложениях. Особенно это актуально при диагностике заболеваний в онкологии, которая осуществляется, как правило, инвазивными методами (экспресс биопсия на операционном столе, пункционная биопсия). Поэтому разработка неинвазивных методов определения неоднородности биологических тканей, позволяющих выявлять патологические образования, расположенные как на поверхности органов, так и скрытые под покровными структурами (эпителием), и определять их границы, является в настоящее время весьма актуальной.
В области дерматологии, которая характеризуется большим количеством нозологических форм заболеваний и синдромов, диагностика также часто клинически затруднена. В этих случаях используется гистоморфологический метод, который является инвазивным и относится к «малым» операциям. Особенно сложно взятие биопсии в педиатрической практике у больных сахарным диабетом, сосудистыми заболеваниями и др. Часто осложнена диагностика псориаза в первые месяцы заболевания, патологий кожи ладонно-подошвенной локализации и др.
В мире накоплен достаточно большой опыт по диагностированию неоднородностей в биологических тканях.
В настоящее время широкое развитие получила электроимпедансная томография. ЭИТ - методика, позволяющая визуализировать пространственное распределение проводимости (или электрического импеданса) внутри объекта, в частности, внутри тела человека, по результатам неинвазивных электрических измерений [S. Armstrong, D. Jennings // Physiological Measurement, 2004. №25. Р.797., Barber D.C., Brown B.H. // J.Phys.E: Sci. Instrum. 1984. V.17. №9. Р.723, Yu Z.Z., Peyton A.J., Conway W.F. et al. // Electronic Letters. 1993. V.29. №7. P.625., Al-Zeibak S., Goss D., Lyon G. et al. // Proc. IX Int. Conf. Electrical Bio-Impedance. Heidelberg, Germany, 1995. Р.426., Powell H.M., Barber D.C., Freeston I.L. // Clin. Phys. Physiol. Meas. 1987. V.8, Suppl. A.P. 109]. Через исследуемый объект, обладающий электрической проводимостью (в медицине это тело человека), с помощью находящихся на его поверхности инжектирующих электродов пропускают слабый переменный электрический ток. С помощью других измерительных электродов измеряют потенциалы на поверхности, возникающие при протекании тока через объект. Имея набор линейно независимых измерений, получаемых при различных комбинациях инжектирующих и измерительных электродов, реконструируется распределение электрического импеданса внутри объекта. Хотя предложено большое количество методов решения обратной задачи для этого случая, метод позволяет визуализировать только небольшие изменения проводимости внутри объекта, и требует наличия опорного набора данных, соответствующих начальным значениям проводимости.
В отличие от электроимпедансной, магнитоиндукционная томография (МИГ) [А.В.Котженевский, В.А.Черепенин, Магнитоиндукционная томография, // "Радиоэлектроника" №1, 1998., А.В.Котженевский, Использование искусственных нейронных сетей для решения обратных задач электроимпедансной и магнитоиндукционной томографии, // "Радиоэлектроника" №12, 2001] не требует электрического контакта с исследуемым объектом. В ней используется взаимодействие переменного магнитного поля с проводящей средой. Такое поле, которое может возбуждаться и регистрироваться с помощью компактных катушек, расположенных вокруг объекта, подвергается возмущению под воздействием вихревых токов, возникающих в объекте. Распределение электропроводности в объекте может быть реконструировано по результатам измерений возмущенного поля вне объекта. К недостаткам описанных методик можно отнести достаточную сложность и дороговизну используемого оборудования, неоднозначную интерпретацию полученных результатов, необходимость очень большой статистической базы.
Известен способ диагностики состояния биообъектов и устройство для его реализации (патент РФ №2195862, МПК А61В 5/05, 2003 г.). Способ диагностики основан на регистрации дистанционного изменения свойств чувствительного элемента датчика под воздействием физического поля биообъекта. Чувствительный элемент датчика выполнен из диэлектрика с линейной поляризационной характеристикой, а в качестве регистрируемых свойств указанного датчика используют изменение диэлектрической проницаемости его элемента, по которому судят о состоянии биообъекта. Устройство для диагностики состояния биообъектов содержит емкостной датчик, являющийся частотозадающим элементом ВЧ-автогенератора, который связан с индикатором и блоком питания. Чувствительный элемент датчика выполнен в виде диэлектрика с линейной поляризационной характеристикой и высокой стабильностью при температурных измерениях, преобразователь сигнала выполнен по аналогово-импульсной схеме, а ВЧ-автогенератор заключен в экранирующий корпус. Перед началом обследования задается базовая частота ВЧ-автогенератора. Далее датчиком прибора сканируют по поверхности биообъекта. В результате взаимодействия с полем биообъекта происходит изменение диэлектрической проницаемости чувствительного элемента датчика, которое пропорционально изменению электрического поля в зоне диагностики. Это изменение приводит к изменению емкости датчика и, как следствие, к изменению частоты ВЧ-автогенератора. Сигнал о разности частот обрабатывается преобразователем и сравнивается с заданными, заранее откалиброванными, значениями, соответствующими глубине патологии.
Недостатком известного способа и реализующего его устройства является низкая достоверность измерений, обусловленная тем, что на поверхности исследуемого объекта возникают заряды, и, соответственно, электрические поля достаточно большой амплитуды, присутствие которых не позволяет с достаточной степенью точности измерять поля биообъектов, которые имеют значительно меньшую величину. Кроме того, на процесс измерения и достоверность результатов оказывают влияние внешние электрические поля различных источников, имеющие различные амплитуды и направления.
Наиболее близким к изобретению по назначению и совокупности существенных признаков является устройство диагностики онкологических заболеваний человека с помощью СВЧ (патент РФ №2085112, МПК А61В 5/04, 1997 г.).
Способ включает формирование СВЧ-сигнала, облучение органа пациента, прием и обработку принятого сигнала. Облучение сигнала осуществляют с помощью излучающего аппликатора, прием - с помощью приемного аппликатора. После прохождения сигнала через орган пациента осуществляют селекцию поляризационных параметров с помощью приемного аппликатора, которые поступают на векторный вольтметр для сравнения с опорным СВЧ-сигналом. В соответствии с алгоритмом обработки поляризационных параметров выделяются признаки, которые сравниваются с эталонными числами, заложенными в память ЭВМ для здорового и больного человека и на основании такого сравнения классифицируют измеренные параметры объекта по типу «норма» или «патология».
Устройство диагностики включает источник СВЧ-сигнала, излучающий аппликатор (датчик) и блок обработки и регистрации сигнала. Прием отраженного сигнала осуществляется с помощью приемного аппликатора. Излучающий и приемный аппликаторы выполнены двухканальными и подключены через переключатели каналов к контроллеру, управляющий вход которого соединен с ЭВМ. Сравнение принятого и опорного сигналов осуществляется векторным вольтметром, выход которого соединен с ЭВМ. Кроме ЭВМ блок обработки и регистрации сигналов включает дисплей и принтер.
Недостатком способа и устройства диагностики онкологических заболеваний человека с помощью СВЧ является низкая достоверность измерений, а следовательно, и низкая точность диагностики, обусловленные тем, что диагностика основана на сравнении поляризационных характеристик СВЧ-излучений, прошедших через здоровую и больную ткани, которые мало отличаются между собой. Кроме того, данный метод требует очень большой базы данных, так как биологические ткани разных людей могут очень сильно отличаться между собой. Результаты зависят от пола, возрастной группы, сопутствующих заболеваний, принимаемых лекарственных средств и многого другого. Для набора такой статистики необходимы годы ежедневной работы.
Задача, на решение которой направлено изобретение, заключается в создании способа измерения электродинамических параметров, таких как диэлектрическая проницаемость и проводимость биологических тканей, и устройства для его реализации, обеспечивающих высокую точность и достоверность измерений, позволяющих на основе полученных данных проводить раннюю неинвазивную диагностику заболеваний в области онкологии, дерматологии и др.
Указанный технический результат достигается способом измерения электродинамических параметров биологических тканей, включающим формирование СВЧ-сигнала, облучение органа пациента, прием и обработку принятого сигнала, в котором согласно изобретению формирование СВЧ-сигнала осуществляют с помощью генератора качающейся частоты, облучение органа пациента и прием сигнала от органа осуществляют с помощью контактного ближнепольного резонансного датчика, по резонансной кривой датчика определяют частотный сдвиг и изменение амплитуды резонанса принятого сигнала датчика, по величине которых определяют диэлектрическую проницаемость и проводимость биологических тканей.
Указанный технический результат достигается также устройством для измерения электродинамических параметров биологических тканей, включающим источник СВЧ-сигнала, датчик и блок обработки и регистрации сигнала, в котором согласно изобретению источник СВЧ-сигнала выполнен в виде генератора качающейся частоты, а датчик - в виде контактного ближнепольного резонансного датчика, вход которого подключен к выходу генератора качающейся частоты, а выход через последовательно соединенные детектор и аналого-цифровой преобразователь подключен к блоку обработки и регистрации сигнала для определения по резонансной кривой датчика частотного сдвига и амплитуды резонанса, при этом выход тактового сигнала генератора качающейся частоты подключен к входам тактового сигнала АЦП и блока обработки и регистрации сигнала, управляющий выход которого соединен с управляющим входом АЦП.
Использование генератора качающейся частоты для формирования СВЧ-сигнала позволяет получить на экране блока обработки и регистрации сигнала всю резонансную кривую. При сканировании датчиком исследуемого объекта можно в реальном масштабе времени наблюдать (и измерять) сдвиг частоты и изменение амплитуды резонанса и тем самым исключить неопределенность, которая возникает при работе на одной частоте.
Использование контактного ближнепольного резонансного датчика позволяет для измерения электродинамических параметров - диэлектрической проницаемости и проводимости использовать параметры датчика - сдвиг его резонансной частоты и изменение амплитуды резонанса при взаимодействии с исследуемым объектом.
Контактный ближнепольный резонансный датчик согласно изобретению может содержать возбуждающую и приемную петли связи, подключенные коаксиальными линиями соответственно к входу и выходу датчика, четвертьволновой резонатор в виде отрезка коаксиальной линии, соединенной одним концом с магнитной рамкой для обеспечения магнитной связи с возбуждающей и приемной петлями связи, а другим концом - с цилиндрической измерительной емкостью. Датчик с четвертьволновым резонатором применяется при исследовании объектов, имеющих низкое значение проводимости.
Контактный ближнепольный резонансный датчик, согласно изобретению, может также содержать возбуждающую и приемную петли связи, подключенные коаксиальными линиями соответственно к входу и выходу датчика, полуволновой резонатор в виде отрезка коаксиальной линии, соединенной одним концом с магнитной рамкой для обеспечения магнитной связи с возбуждающей и приемной петлями связи, а другим концом - с параллельно соединенными индуктивностью и цилиндрической измерительной емкостью. Датчик с полуволновым резонатором целесообразно использовать при исследовании объектов, имеющих высокое значение проводимости.
Цилиндрическая измерительная емкость может быть выполнена в виде коаксиала, длина которого много меньше длины волны, с возможностью регулирования расстояния между центральным проводником и внешним экраном, что позволяет регулировать глубину проникновения ближнего квазистатического СВЧ поля в исследуемый объект и, тем самым, регулировать размер исследуемой области. Индуктивность может быть выполнена в виде закороченного отрезка коаксиального кабеля.
Контактный ближнепольный резонансный датчик и детектор установлены в экранирующем металлическом корпусе, что позволяет исключить влияние внешних электромагнитных полей на указанные элементы и, тем самым, повысить точность способа и устройства.
Сущность предложенного изобретения заключается в том, что авторами предлагается неинвазивный способ измерения электродинамических параметров биологических тканей, основанный на резонансном ближнепольном СВЧ-зондировании. В качестве зонда (датчика) удобно использовать резонатор на отрезке двухпроводной линии. При сканировании вдоль поверхности исследуемого объекта датчик реагирует на изменение диэлектрической проницаемости и проводимости на глубине порядка расстояния между проводами резонатора, что позволяет фиксировать неоднородность и определять ее характеристики. В плоскости, перпендикулярной двухпроводной линии, электромагнитное поле имеет квазистатическую структуру и проводимые измерения можно характеризовать как ближнепольные. Взаимодействие краевого электрического поля измерительной емкости с биологическим объектом оказывает влияние на резонансную частоту и максимальную амплитуду резонансной кривой. Известно, что частотный сдвиг резонансной кривой (ΔF) и максимальная амплитуда резонансной кривой (Umax) определяются соотношениями:
ΔF=-Re(q),
Umax=1-4Q0Im(q),
где Q0 - собственная добротность резонатора; ε - диэлектрическая проницаемость измеряемого вещества; σ - проводимость измеряемого вещества; ω - частота, подводимая к датчику; Re - реальная (действительная) часть параметра q; Im - мнимая часть параметра q, q - параметр, зависящий от диэлектрической проницаемости и проводимости исследуемого вещества, i - мнимая единица.
Используя компьютерную обработку продетектированного сигнала, получаемого с датчика, на экране монитора в реальном масштабе времени отображаются электродинамические характеристики поверхностных слоев (0,2 - 1,5 см) и границ исследуемого биологического объекта.
Далее изобретение поясняется с помощью чертежей.
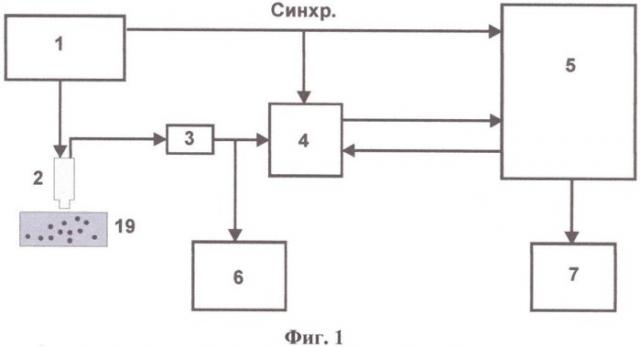
на фиг.1 представлена блок-схема устройства для измерения электродинамических параметров биологических тканей;
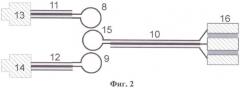
на фиг.2 представлена схема датчика с четвертьволновым резонатором;
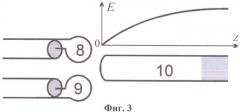
на фиг.3 представлено распределение электрического поля по длине четвертьволнового резонатора;
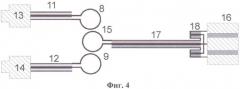
на фиг.4 представлена схема датчика с полуволновым резонатором;
на фиг.5 представлено распределение электрического поля по длине полуволнового резонатора;
на фиг.6 представлен график зависимости сдвига частоты, пропорционального диэлектрической проницаемости биологической ткани, от времени;
на фиг.7 представлен график зависимости изменения амплитуды резонанса, пропорционального проводимости (потерям) биологической ткани.
Устройство для измерения электродинамических параметров биологических тканей содержит (см. фиг.1) генератор качающейся частоты 1 (далее генератор 1), выход которого подключен к входу контактного резонансного датчика 2 (далее датчик 2). Выход датчика 2 через последовательно соединенные детектор 3 и АЦП 4 подключен к информационному входу блока обработки и регистрации сигнала, выполненному в виде ЭВМ 5. Тактовый выход генератора 1 подключен к тактовым входам АЦП 4 и ЭВМ 5. Управляющий выход ЭВМ 5 соединен с управляющим входом АЦП 4. Выход детектора 3 может быть соединен с цифровым осциллографом 6, выход ЭВМ 5 - с принтером 7. В качестве детектора 3 может быть использован стандартный высокочастотный диод с 50-омной нагрузкой для исключения отраженной от него волны. Датчик 2 и детектор 3 установлены в экранирующем металлическом корпусе (на фигурах не показан), обеспечивающем защиту от внешних электромагнитных полей. ЭВМ 5 наделена программой для управления работой АЦП 4 и построения графиков резонансной кривой, зависимостей сдвига частоты и амплитуды резонанса от времени, а также хранения полученных файлов в памяти. АЦП 4 представляет собой универсальный скоростной восьмиканальный аналогово-цифровой преобразователь USB3000, предназначенный для построения мобильных компактных систем сбора и обработки аналоговой и цифровой информации на базе IBM-совместимых компьютеров. АЦП 4 сопрягается с ЭВМ 5 стандартным разъемом с помощью порта USB.
Датчик 2 (см. фиг.2) содержит возбуждающую 8 и приемную 9 петли связи и четвертьволновой резонатор 10 (далее резонатор 10) в виде отрезка коаксиальной линии. Петли связи 8 и 9 подключены коаксиальными линиями 11, 12 через разъемы 13, 14 соответственно к входу и выходу датчика 2. Резонатор 10 соединен одним концом с магнитной рамкой 15 для обеспечения магнитной связи с возбуждающей 8 и приемной 9 петлями связи, а другим концом - с цилиндрической измерительной емкостью 16. Распределение электрического поля датчика 2 с четвертьволновым резонатором представлено на фиг.3. Датчик 2 с четвертьволновым резонатором (фиг.2) применяется при исследовании объектов, имеющих низкое значение проводимости. При исследовании объектов, имеющих высокое значение проводимости, с целью уменьшения импеданса измерительной емкости 16 используется другой тип резонатора - полуволновой.
В этом случае датчик 2 (см. фиг.4) содержит возбуждающую 8 и приемную 9 петли связи и полуволновой резонатор 17 (далее резонатор 17) в виде отрезка коаксиальной линии. Петли связи 8 и 9 подключены коаксиальными линиями 11, 12 через разъемы 13, 14 соответственно к входу и выходу датчика 2. Резонатор 17 соединен одним концом с магнитной рамкой 15 для обеспечения магнитной связи с возбуждающей 8 и приемной 9 петлями связи, а другим концом - с параллельно соединенными цилиндрической измерительной емкостью 16 и индуктивностью 18. В качестве индуктивности 18 может использоваться закороченный отрезок коаксиального кабеля. Распределение электрического поля датчика 2 с полуволновым резонатором представлено на фиг.5.
В зависимости от объекта исследования в устройство устанавливают датчик 2 либо с четвертьволновым резонатором (фиг.2), либо с полуволновым резонатором (фиг.4). Датчик 2 располагают непосредственно на объекте исследования 19 (органе пациента) и в процессе исследования сканируют его поверхность.
Способ измерения электродинамических параметров биологических тканей осуществляют с помощью устройства следующим образом.
Работа устройства синхронизируется тактовым сигналом с генератора качающейся частоты 1. Генератором качающейся частоты 1 формируют СВЧ-сигнал в диапазоне 600-800 МГц, который поступает через разъем 13 и коаксиальную линию 11 на возбуждающую петлю связи 8 датчика 2. Собственная частота датчика 2 составляет приблизительно 760 МГц. При этом через магнитную рамку 15 происходит возбуждение четвертьволнового резонатора 10 или полуволнового резонатора 17. При контакте датчика 2 с объектом исследования 19 осуществляют зондирование объекта 19 краевым полем измерительной емкости 16. При этом в зависимости от вида биологической ткани и ее состояния (нормальное состояние ткани или ткань с патологией) происходит изменение частоты и амплитуды резонанса резонатора 10 или резонатора 17 по сравнению с этими величинами до контакта с объектом 19 (диэлектрическая проницаемость воздуха равна 1, проводимость равна 0). Высокочастотный сигнал через магнитную рамку 15, приемную петлю связи 9, коаксиальную линию 12 и разъем 14 поступает на детектор 3. С помощью осциллографа 6 при необходимости осуществляют контроль продетектированного сигнала. Продетектированный СВЧ-сигнал в виде резонансной кривой поступает на АЦП 4. После оцифровки с шагом, задаваемым с помощью ЭВМ 5, в реальном масштабе времени сигнал записывается в ЭВМ 5. На экран монитора выводятся графики резонансной кривой, зависимости сдвига частоты (фиг.6) и изменения амплитуды резонанса (фиг.7) от времени. На графике фиг.6 показаны величины сдвига частоты (без пересчета в диэлектрическую проницаемость разных тканей) от времени в процессе измерения на печени. Как видно из графика, частота датчика до измерения - 771 МГц. При прикосновении к опухоли она сдвигается до величины 744 МГц. При прикосновении к жировому слою сдвиг частоты резонанса меньше (756 МГц). С помощью принтера 7 результаты выводят на печать. По изменению частоты судят о величине диэлектрической проницаемости исследуемого объекта, по изменению амплитуды - о его проводимости (потерях). Результаты измерений сохраняются в памяти ЭВМ в виде отдельных файлов.
Неинвазивное определение неоднородности биологических тканей позволяет выявлять патологические образования, расположенные как на поверхности органов, так и скрытые под покровными структурами (эпителием). Помимо обнаружения неоднородностей в тканях возможно определение и их границ. Подобная методика необходима при диагностике и лечении воспалительных, диспластических и онкологических заболеваний печени, почек, желудочно-кишечного тракта и мочевыделительной системы. Особенно актуальными следует считать исследования при интраоперационном (в ходе операции) определении границ патологических образований.
Кроме этого, метод позволяет определить степень реваскуляризации (наполняемость кровью мелких сосудов) органов и тканей при проведении операции по реплантации и трансплантации за счет оценки кровенаполнения органов. На сегодняшний день в трансплантологии в пересаженном органе определяется кровоток только по магистральным сосудам без учета полноты включения микроциркуляторного русла, что не отражает эффективности кровоснабжения.
Для подтверждения эффективности предлагаемого способа и устройства проводились исследования по диагностике и дифференциальной диагностике патологических процессов внутренних органов и кожи, а также определение их границ.
1. Использование для диагностики в области онкологии.
В качестве объектов использовался операционный материал: удаленные или резецированные органы с опухолевым ростом. Измерение проведено на 4 почках, селезенке. Также проводилось интраоперационное обследование с использованием стерильного датчика. Измерения проведены в 2-х случаях на печени с метастатическим процессом, в одном случае обследована печень с крупнонодулярным (крупноузловым) циррозом вирусной этиологии (причина), однократно проведено исследование желудка с опухолью тела. Во время всех экспериментов использовались полипозиционные измерения, измерения сигнала с соседних органов и структур с целью количественного и качественного сравнения результатов.
Полученные данные позволяют определить наличие опухолевого очага в ткани исследуемого органа, определить границу роста. В ряде случаев граница по данным исследования отличалась от видимой на глаз, однако, при исследовании удаленного материала подтверждалась точность и чувствительность измерительного комплекса.
2. Оценка степени и характера кровотока в паренхиматозных органах (печень, почки) в норме и патологии.
Продемонстрировано изменение электродинамических характеристик в условиях тепловой и холодовой ишемии (недостаточность кровоснабжения) в зависимости от температуры и времени.
Пример. Апробация способа при тепловой и холодовой ишемии на лабораторных животных.
Проведена экспериментальная работа на кроликах. Полностью имитировался процесс мультиорганного забора для трансплантации. Под наркозом, в условиях сохраненного кровотока проводилось изъятие почек и печени с фрагментами аорты и нижней полой вены. Через аорту и соответствующие артерии выполнялось промывание почек охлажденным раствором кустодиола до полного вымывания крови из органа. Органокомплекс помещался в раствор кустодиола со льдом при температуре +4 градуса. Проводилось разделение почек по сосудам. Одна из почек изымалась из консервирующего раствора и помещалась в раствор кустодиола комнатной температуры (+19÷20 градусов). В дальнейшем проводилось измерение электродинамических характеристик паренхимы почек в условиях тепловой и холодовой ишемии в динамике по времени. В ходе эксперимента создавались «зеркальные» условия для органов, за исключением температуры консервации.
Проведены измерения электродинамических характеристик (сдвиг резонансной частоты датчика от времени) почек при холодовой и тепловой ишемии. Сопоставляя эти экспериментальные результаты, легко заметить, что изменение частоты сигнала находится в прямой зависимости от скорости течения процессов ишемического повреждения. При холодовой ишемии изменение частоты за 1200 секунд составило ~250 КГц, тогда как при тепловой за то же время ~ 1000 КГц.
Исходя из приведенных результатов, можно отметить разницу между холодовой и тепловой ишемией органов, появляющейся через 20 минут с момента появления тепловой ишемии.
Исходя из литературных данных о скорости ишемического повреждения органов, можно предположить возможность использования данного метода для выявления ранних ишемических повреждений паренхимы органа при трансплантации.
3. Оценка проводимости при реперфузии (восстановление кровотока) органа с целью определения его потенциальной пригодности для трансплантации, контроль качества консервации и состояние органа после пересадки. Проведена серия экспериментов на лабораторных крысах, заключающаяся в заборе почек, их консервации с измерением электродинамических характеристик на всех этапах.
В качестве результата можно сказать, что измерительный комплекс обладает чувствительностью к любым, даже незначительным изменениям кровотока в тканях, богатых кровеносными сосудами, что позволяет оценить состояние до забора, во время консервации органа и прогнозировать его пригодность для последующей пересадки.
4. Использование метода ближнепольного зондирования в дерматологии для диагностики заболеваний без нарушения целостности кожи.
Проведены исследования электродинамических характеристик кожи двадцати двух больных псориазом и пяти больных атопическим дерматитом. Установлено, что диэлектрическая проницаемость и проводимость кожи у дерматологических больных (псориаз, атопический дерматит) ниже, чем у здоровой кожи. У больных псориазом исследования проводились до лечения, в процессе и по окончании терапии. По мере выздоровления диэлектрическая проницаемость и проводимость тканей в области заболевания приближалась к показаниям здоровой кожи.
При атопическом дерматите изучаемые показатели имели аналогичный характер, но были значительно менее выражены.
В стадии обострения различия между здоровой и больной кожей были более выраженными при псориазе. В стадии регресса диэлектрическая проницаемость и проводимость тканей в области псориатических очагов была аналогичной с диэлектрической проницаемостью и проводимостью тканей при атопическом дерматите. Таким образом, диагностическая значимость метода в случае псориаза и атопического дерматита имеет место лишь при активности заболевания.
При исследовании электродинамических характеристик кожи больных красным плоским лишаем (КПЛ) установлено, что при совпадении диэлектрической проницаемости тканей при псориазе и КПЛ проводимость кожи у этих пациентов отличалась в 2 раза. Это позволяет сделать вывод о возможности проведения диагностики при псориазе и КПЛ на любых стадиях заболевания.
Таким образом, способ и устройство для измерения электродинамических параметров биологических тканей, включающее четвертьволновый и полуволновый контактные резонансные датчики, является простым и многофункциональным прибором, применение которого возможно в различных отраслях медицины.
1. Способ измерения электродинамических параметров биологических тканей, включающий формирование СВЧ-сигнала, облучение органа пациента, прием и обработку принятого сигнала, отличающийся тем, что формирование СВЧ-сигнала осуществляют с помощью генератора качающейся частоты, облучение органа пациента и прием сигнала от органа осуществляют с помощью контактного ближнепольного резонансного датчика, по резонансной кривой датчика определяют частотный сдвиг и изменение амплитуды резонанса принятого сигнала, по величине которых определяют диэлектрическую проницаемость и проводимость биологических тканей.
2. Устройство для измерения электродинамических параметров биологических тканей, включающее источник СВЧ-сигнала, датчик и блок обработки и регистрации сигнала, отличающееся тем, что источник СВЧ-сигнала выполнен в виде генератора качающейся частоты, а датчик - в виде контактного ближнепольного резонансного датчика, вход которого подключен к выходу генератора качающейся частоты, а выход через последовательно соединенные детектор и аналого-цифровой преобразователь подключен к блоку обработки и регистрации сигнала для определения по резонансной кривой датчика частотного сдвига и амплитуды резонанса, при этом выход тактового сигнала генератора качающейся частоты подключен к входам тактового сигнала АЦП и блока обработки и регистрации сигнала, управляющий выход которого соединен с управляющим входом АЦП.
3. Устройство по п.2, отличающееся тем, что контактный ближнепольный резонансный датчик содержит возбуждающую и приемную петли связи, подключенные коаксиальными линиями соответственно к входу и выходу датчика, четвертьволновой резонатор в виде отрезка коаксиальной линии, соединенной одним концом с магнитной рамкой для обеспечения магнитной связи с возбуждающей и приемной петлями связи, а другим концом-с цилиндрической измерительной емкостью.
4. Устройство по п.2, отличающееся тем, что контактный ближнепольный резонансный датчик содержит возбуждающую и приемную петли связи, подключенные коаксиальными линиями соответственно к входу и выходу датчика, полуволновой резонатор в виде отрезка коаксиальной линии, соединенной одним концом с магнитной рамкой для обеспечения магнитной связи с возбуждающей и приемной петлями связи, а другим концом - с параллельно соединенными индуктивностью и цилиндрической измерительной емкостью.
5. Устройство по любому из пп.3 и 4, отличающееся тем, что цилиндрическая измерительная емкость выполнена в виде коаксиала, длина которого много меньше длины волны, с возможностью регулирования расстояния между центральным проводником и внешним экраном.
6. Устройство по п.4, отличающееся тем, что индуктивность выполнена в виде закороченного отрезка коаксиального кабеля.
7. Устройство по любому из пп.2-4, отличающееся тем, что контактный ближнепольный резонансный датчик и детектор установлены в экранирующем металлическом корпусе.