Замещенные n-арилбензамиды и родственные соединения для лечения амилоидных заболеваний и синуклеинопатии
Иллюстрации
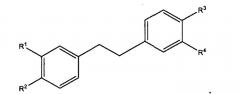
Показать всеИзобретение относится к новым замещенным диарильным соединениям формул, представленных ниже, в которых М представляет собой S(O)2, Rx означает алкил, R1, R2, R3 и R4 каждый независимо выбран из ОН и -NR7S(O)2R8, R5 и R7 каждый независимо означает водород или алкил, R8 означает алкил, и их фармацевтически приемлемым производным, а также к содержащим их фармацевтическим композициям и их применению для получения лекарственного средства, обладающего ингибирующей активностью в отношении Аβ, IAPP амилоидных фибрилл или синуклеиновых фибрилл. 5 н. и 6 з.п. ф-лы, 6 табл.
,
.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
В рассматриваемой заявке заявлен приоритет в соответствии с п.35 U.S.C. § 119(e) на основании предварительной заявки США 60/570669, озаглавленной "Substituted N-Aryl Benzamides and Related Compounds for Treatment of Amyloid Diseases and Synucleinopathies" Snow et al., поданной 12 мая 2004 г., и 60/629525, озаглавленной "Substituted N-Aryl Benzamides and Related Compounds for Treatment of Amyloid Diseases and Synucleinopathies" Snow et al., поданной 18 ноября 2004 г. Содержание этих предварительных заявок включено сюда для ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к замещенным N-арилбензамидам и родственным соединениям, фармацевтическим композициям и способам лечения амилоидных заболеваний, включая бета-амилоидный белок (Aβ) такой, который наблюдается при болезни Альцгеймера и синдроме Дауна, островковый амилоидный полипептид (IAPP) такой, который наблюдается при диабете 2 типа, и альфа-синуклеин такой, который наблюдается при болезни Паркинсона.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
Болезнь Альцгеймера характеризуется накоплением пептида из 39-43 аминокислот, оканчивающегося β-амилоидным белком или Aβ, в фибриллярной форме, существующего в виде внеклеточных амилоидных бляшек, и как амилоид - внутри стенок церебральных кровеносных сосудов. Считают, что отложение фибриллярного Aβ амилоида при болезни Альцгеймера оказывается вредным для пациента и в конечном счете приводит к токсичности и к гибели нейрональных клеток, что является отличительными признаками болезни Альцгеймера. Накапливающиеся свидетельства позволяют предположить, что амилоид и, более конкретно, образование, отложение, накопление и/или персистентность Aβ фибрилл являются основным причинным фактором патогенеза болезни Альцгеймера. Кроме того, помимо болезни Альцгеймера, целый ряд других амилоидных заболеваний включает образование, отложение, накопление и персистентность Aβ фибрилл, включая синдром Дауна, нарушения, включающие конгофильную ангиопатию, такие как, но не ограничиваясь перечисленным, наследственная церебральная геморрагия голландского типа, миозит с включениями телец, боксерская деменция, церебральная β-амилоидная ангиопатия, деменция, связанная с прогрессирующим надъядерным параличом, деменция, связанная с кортикальной базальной дегенерацией и умеренной потерей познавательных способностей.
Болезнь Паркинсона представляет собой другое нарушение у человека, характеризующееся образованием, отложением, накоплением и/или персистентностью ненормальных отложений фибриллярного белка, что демонстрируют многие из характеристик амилоида. Считают, что при болезни Паркинсона накопление цитоплазмических телец Леви, состоящих из нитей α-синуклеин/NAC (не-Aβ компонента), играет важную роль в патогенезе и в качестве терапевтических мишеней. Новые агенты или соединения, способные ингибировать образование, отложение, накопление и/или персистентность α-синуклеина и/или NAC или разрушать ранее образованные α-синуклеин/NAC фибриллы (или их части) рассматривают как потенциальные лекарства для лечения синуклеопатий Паркинсона и родственных синуклеинопатий. NAC представляет собой фрагмент из 35 аминокислот α-синуклеина, который способен образовывать амилоидоподобные фибриллы либо in vitro, либо как наблюдалось в мозге у пациентов c болезнью Паркинсона. NAC фрагмент α-синуклеина представляет собой относительно важную терапевтическую цель, так как считают, что эта часть α-синуклеина критична для образования телец Леви, как наблюдается у всех пациентов с болезнью Паркинсона, синуклеинопатиями и родственными нарушениями.
Множество других заболеваний человека также демонстрируют амилоидные отложения и обычно включают системные органы (т.е. органы или ткани, расположенные вне центральной нервной системы), причем накопление амилоидов приводит к дисфункции органов или к их гибели. Такие амилоидные заболевания (обсуждающиеся далее), приводящие к заметным накоплениям амилоидов в ряде различных органов и тканей, известны как системные амилоидозы. При других амилоидных заболеваниях могут быть поражены отдельные органы, такие как поджелудочная железа у 90% пациентов с диабетом 2 типа. Считают, что при этом типе амилоидного заболевания бета-клетки в островках Лангерхенса в поджелудочной железе разрушаются за счет накопления фибриллярных амилоидных отложений, состоящих, главным образом, из белка, известного как островковый амилоидный полипептид (IAPP). Ингибирование или уменьшение образования, отложения, накопления и персистентности таких IAPP амилоидных фибрилл, как считают, обеспечивает новые эффективные способы лечения диабета 2 типа. При болезни Альцгеймера, Паркинсона и "системных" амилоидных заболеваниях в настоящее время не существует лечения или эффективной терапии, и обычно пациент умирает в течение от 3 до 10 лет после заболевания.
Амилоидные заболевания (амилоидоз) классифицируют в соответствии с типом присутствующего амилоидного белка, также как и лежащего в основе заболевания. Амилоидные заболевания обладают рядом общих характеристик, включая каждый амилоид, состоящий из уникального типа амилоидного белка. Амилоидные заболевания включают, но не ограничиваются перечисленным, амилоид, связанный с болезнью Альцгеймера, синдромом Дауна, наследственной церебральной геморрагией с амилоидозом Голландского типа, деменцией pugilistica, миозит с включениями телец (Askanas et al., Ann. Neurol. 43:521-560, 1993) и умеренную потерю познавательных способностей (где специфический амилоид называют бета-амилоидным белком или Aβ), амилоид, связанный с хроническим воспалением, различными формами злокачественной лихорадки и семейной средиземноморской лихорадки (где специфический амилоид носит название AA амилоидного или связанного с воспалением амилоидоза), амилоид, связанный с множественной миеломой и другими B-клеточными дискразиями (где специфический амилоид называют AL амилоидом), амилоид, связанный с диабетом 2 типа (где специфический амилоидный белок называют амилином или островковым амилоидным полипептидом или IAPP), амилоид, связанный с прионовыми заболеваниями, включая болезнь Крейтцфельдта-Якоба, синдром Герштман-Штраусслера, куру и скрепи животных (где специфический амилоид носит название PrP амилоида), амилоид, связанный с длительным гемодиализом и запястным туннельным синдромом (где специфический амилоид носит название α2-микроглобулинового амилоида), амилоид, связанный со старческим кардиоамилоидозом и семейной амилоидотной полинефропатией (где специфический амилоид носит название транстиретина или преальбумина), и амилоид, связанный с эндокринными злокачественными заболеваниями, такими как медуллярная карцинома щитовидной железы (где специфический амилоид носит название вариантов прокальцитонина). Кроме того, α-синуклеиновый белок, которой образует амилоидоподобные фибриллы, и является позитивным в отношении Конго красного и Тиофлавина S (специфические красители, которые используют для детектирования амилоидных фибриллярных отложений), обнаружен как часть телец Леви в мозге пациентов с болезнью Паркинсона, болезнью телец Леви (Lewy in Handbuch der Neurologie, M. Lewandowski, ed., Springer, Berlin, pp.920-933, 1912; Pollanen et al., J. Neuropath. Exp.Neurol. 52:183-191, 1993; Spillantini et al., Proc. Natl. Acad. Sci. USA 95:6469-6473, 1998; Arai et al., Neurosci. Lett. 259:83-86, 1999), с множественной системной атрофией (Wakabayashi et al., Acta Neuropath. 96:445-452, 1998), деменцией с тельцами Леви и вариантом телец Леви при болезни Альцгеймера. В контексте рассматриваемого описания болезнь Паркинсона ввиду того, что фибриллы развиваются в мозге пациентов с этим заболеванием (которые позитивны в отношении Конго красного и Тиофлавина S и которые содержат доминирующие бета-складчатые пластинчатые вторичные структуры, рассматривают в настоящее время как заболевание, которое также демонстрирует характеристики амилоидоподобного заболевания.
Системные амилоидозы, которые включают амилоид, связанный с хроническим воспалением, с различными формами злокачественной лихорадки или семейной средиземноморской лихорадки (т.е. AA амилоидный или связанный с воспалением амилоидоз) (Benson и Cohen, Arth. Rheum. 22:36-42, 1979; Kamei et al. Acta Path. Jpn. 32:123-133, 1982; McAdam et al., Lancet 2:572-573, 1975; Metaxas, Kidney Int. 20:676-685, 1981), и амилоид, связанный с множественной миеломой и другими B-клеточными дискразиями (т.е. AL амилоид) (Harada et al., J. Histochem. Cytochem. 19:1-15, 1971); например, как известно, включают амилоидные отложения во множестве различных органов и тканей, которые обычно расположены вне центральной нервной системы. Амилоидные отложения при указанных заболеваниях могут находиться, например, в печени, сердце, селезенке, желудочно-кишечном тракте, почках, коже и/или легких (Johnson et al., N. Engl. J. Med. 321:513-518, 1989). Для большинства из этих амилоидозов не существует подходящего или эффективного лечения, и, следовательно, амилоидные отложения могут оказаться вредными для пациента. Например, амилоидные отложения в почках могут привести к почечной недостаточности, тогда как амилоидные отложения в сердце могут привести к сердечной недостаточности. Для таких пациентов, амилоидные накопления в системных органах приводят к возможной смерти обычно в течение 3-5 лет. Другие амилоидозы могут повреждать отдельный орган или ткань, например, как наблюдают при Aβ амилоидных отложениях, встречающихся в мозге пациентов с болезнью Альцгеймера и синдромомом Дауна; при PrP амилоидных отложениях, обнаруженных в мозге пациентов с болезнью Крейтцфельдта-Якоба, с синдромом Герштман-Штраусслера и куру; при островковых амилоидных (IAPP) отложениях, обнаруженных в островках Лангерханса в поджелудочной железе 90% пациентов с диабетом 2 типа (Johnson et al., N. Engl. J. Med. 321:513-518, 1989; Lab. Invest. 66:522 535, 1992); при α2-микроглобулиновых амилоидных отложениях в медиальном нерве, приводящих к запястным туннельным синдромам, которые наблюдаются у пациентов, подвергавшихся длительному гемодиализу (Geyjo et al., Biochem. Biophys. Res. Comm. 129:701-706, 1985; Kidney Int. 30:385-390, 1986); при преальбумин/транстиретиновом амилоиде, наблюдаемом в сердцах пациентов со старческим кардиоамилоидозом, и при преальбумин/транстиретиновом амилоидозе, наблюдающемся в периферических нервах пациентов с семейной амилоидотичной полинефропатией (Skinner and Cohen, Biochem. Biophys. Res. Comm. 99:1326-1332, 1981; Saraiva et al., J. Lab. Clin. Med. 102:590-603, 1983; J. Clin. Invest. 74:104-119, 1984; Tawara et al., J. Lab. Clin. Med. 98:811-822, 1989).
Болезнь Альцгеймера, кроме того, налагает тяжелое экономическое бремя на общество. Последние исследования оценивают стоимость лечения пациентов с болезнью Альцгеймера с тяжелыми нарушениями познавательных функций дома или в доме инвалидов более чем в $47000 в год (A Guide to Understanding Alzheimer's Disease and Related Disorders). Для заболевания, которое может длиться от 2 до 20 лет, полная стоимость лечения болезни Альцгеймера для семьи и общества ошеломляюща. Ежегодная экономическая стоимость лечения болезни Альцгеймера в Соединенных Штатах с точки зрения ухода за больными дорожает, и денежные потери как пациентов, так и тех, кто за ними ухаживает, оцениваются как $80-$100 биллионов (2003 Progress Report on Alzheimer's Disease).
Амилоид как терапевтическая мишень при болезни Альцгеймера
Болезнь Альцгеймера характеризуется отложением и накоплением пептида из 39-43 аминокислот, оканчивающегося бета-амилоидным белком, Aβ или β/A4 (Glenner and Wong, Biochem. Biophys. Res. Comm. 120:885-890, 1984; Masters et al., Proc. Natl. Acad. Sci. USA 82:4245-4249, 1985; Husby et al., Bull. WHO 71:105-108, 1993). Aβ образуется в результате протеазного отщепления от более крупного протеина-предшественника, оканчивающегося β-амилоидными протеинами-предшественниками (APPs), чем и объясняются несколько альтернативных вариантов сплайсинга. Наиболее многочисленные формы APPs включают белки, состоящие из 695, 751 и 770 аминокислот (Tanzi et al., Nature 31:528-530, 1988).
Небольшой Aβ пептид является основной компонентой, которая составляет амилоидные отложения "бляшек" в мозге пациентов с болезнью Альцгеймера. Кроме того, болезнь Альцгеймера характеризуется присутствием многочисленных нейрофибриллярных "клубков", состоящих из спаренных спиральных нитей, которые ненормально накапливаются в нейрональной цитоплазме (Grundke-Iqbal et al., Proc. Natl. Acad. Sci. USA 83:4913-4917, 1986; Kosik et al., Proc. Natl. Acad Sci. USA 83:4044-4048, 1986; Lee et al., Science 251:675-678, 1991). Поэтому патологической меткой болезни Альцгеймера, является присутствие "бляшек" и "клубков", причем амилоидные отложения расположены в центральной части указанных бляшек. Другим основным типом поражений, обнаруженных в мозге при болезни Альцгеймера, является накопление амилоида в стенках кровеносных сосудов как внутри паренхимы мозга, так и в стенках менингеальных сосудов, которые расположены вне мозга. Амилоидные отложения, локализованные на стенках кровеносных сосудов, называют цереброваскулярным амилоидом или конгофильной ангиопатией (Mandybur, J. Neuropath. Exp.Neurol. 45:79-90, 1986; Pardridge et al., J. Neurochem. 49:1394-1401, 1987).
В течение многих лет происходят непрекращающиеся дебаты относительно важности "амилоида" при болезни Альцгеймера и того, является ли наличие "бляшек" и "клубков", характеризующих это заболевание, причиной или они просто являются следствием этого заболевания. Проведенные в последние несколько лет исследования показывают, что амилоид действительно является причинным фактором болезни Альцгеймера, и его не следует рассматривать как просто доброкачественный побочный агент. Было показано, что Aβ белок Альцгеймера в культуре клеток является причиной дегенерации нервной клетки за короткий промежуток времени (Pike et al., Br. Res. 563:311-314, 1991; J. Neurochem. 64:253-265, 1995). Исследования позволяют предположить, что он представляет собой фибриллярную структуру (состоящую из доминирующих β-складчатых пластинок вторичной структуры), являющуюся характеристикой всех амилоидов, которая ответственна за нейротоксические эффекты. Было также обнаружено, что Aβ является нейротоксичным в культуре срезов гиппокампа (Harrigan et al., Neurobiol. Aging 16:779-789, 1995) и индуцирует гибель нервных клеток у трансгенных мышей (Games et al., Nature 373:523-527, 1995; Hsiao et al., Science 274:99-102, 1996). Инъекции Aβ Альцгеймера в мозг крыс также вызывает ухудшение памяти и нейрональную дисфункцию (Flood et al., Proc. Natl. Acad. Sci. USA 88:3363-3366, 1991; Br.Res. 663:271-276, 1994).
Вероятно, наиболее убедительное свидетельство того, что Aβ амилоид непосредственно включен в патогенез болезни Альцгеймера, проистекает из генетических исследований. Было обнаружено, что продуцирование Aβ может возникнуть в результате мутаций в кодировании гена, его предшественника, β-амилоидного белка-предшественника (Van Broeckhoven et al., Science 248:1120-1122, 1990; Murrell et al., Science 254:97-99, 1991; Haass et al., Nature Med. 1:1291-1296, 1995). Идентификация мутаций в бета-амилоидном предшественнике белкового гена, которые вызывают раннее наступление семейной болезни Альцгеймера, является самым сильным аргументом в пользу того, что амилоид играет центральную роль в патогенетическом процессе, лежащем в основе этого заболевания. Были обнаружены четыре вызывающие заболевание мутации, которые демонстрируют важность Aβ в возникновении семейной болезни Альцгеймера (обзор в Hardy, Nature Genet. 1:233-234, 1992).
Во всех этих исследованиях предполагают, что введение лекарства для уменьшения, исключения или предотвращения образования фибриллярных Aβ отложений, накоплений и/или персистентности в мозге пациента-человека окажется эффективным терапевтическим методом.
Болезнь Паркинсона и синуклеинопатии
Болезнь Паркинсона является нейродегенеративным нарушением, которое патологически характеризуется присутствием интрацитоплазмических телец Леви (Lewy in Handbuch der Neurologie, M. Lewandowski, ed., Springer, Berlin, pp.920-933, 1912; Pollanen et al., J. Neuropath. Exp.Neurol. 52:183-191, 1993), основными компонентами которых являются нити, состоящие из α-синуклеина (Spillantini et al., Proc. Natl. Acad. Sci. USA 95:6469-6473, 1998; Arai et al., Neurosci. Lett. 259:83-86, 1999), белка, состоящего из 140 аминокислот (Ueda et al., Proc. Natl Acad. Sci. USA 90:11282-11286, 1993). Две доминантные мутации в α-синуклеине, вызывающие раннее наступление семейной болезни Паркинсона, были описаны с предположением, что тельца Леви механистически вносят вклад в дегенерацию нейронов при болезни Паркинсона и при родственных нарушениях (Polymeropoulos et al., Science
276:2045-2047, 1997; Kruger et al., Nature Genet. 18:106-108, 1998). Недавно in vitro исследования продемонстрировали, что рекомбинантный α-синуклеин действительно может образовывать фибриллы, подобные тельцам Леви (Conway et al.,
Nature Med. 4:1318-1320, 1998; Hashimoto et al., Brain Res. 799:301-306, 1998; Nahri et al., J. Biol. Chem. 274:9843-9846, 1999). Самое важное, что связанные с болезнью Паркинсона мутации α-синуклеина ускоряют этот процесс агрегации, демонстрируя, что такие in vitro исследования могут оказаться важными для патогенеза болезни Паркинсона. Агрегация альфа-синуклеина и образование фибрилл составляют критерий зависящего от нуклеации полимеризационного процесса (Wood et al., J. Biol. Chem. 274:19509-19512, 1999). В этой связи образование α-синуклеиновых фибрилл напоминает образование фибрилл β-амилоидного белка Альцгеймера (Aβ). Альфа-синуклеиновый рекомбинантный белок и не-Aβ компонента (известная как NAC), которая представляет собой пептидный фрагмент из 35 аминокислот α-синуклеина, оба обладают способностью к образованию фибрилл, если их инкубируют при 37°C, и являются позитивными в отношении амилоидных красителей, таких как Конго красный (демонстрирующий красное/зеленое двойное лучепреломление в поляризованном свете) и тиофлавин S (демонстрирующий позитивную флуоресценцию) (Hashimoto et al., Brain Res. 799:301-306, 1998; Ueda et al., Proc. Natl. Acad. Sci. USA 90:11282-11286, 1993).
Синуклеины представляют собой семейство небольших пресинаптических нейрональных белков, состоящих из α-, β-, и γ-синуклеинов, причем из них только α-синуклеиновые агрегаты связаны с несколькими неврологическими заболеваниями (Ian et al., Clinical Neurosc. Res. 1:445-455, 2001; Trojanowski and Lee., Neurotoxicology 23:457-460, 2002). Роль синуклеинов (и, в частности, альфа-синуклеина) в этиологии ряда нейродегенеративных и/или амилоидных заболеваний была выяснена в результате нескольких наблюдений. Патологически синуклеин был идентифицирован как основная компонента телец Леви, признак включений болезни Паркинсона, и его фрагмент выделяют из амилоидных бляшек при различных нейрологических заболеваниях, болезни Альцгеймера. Биохимически было показано, что рекомбинантный α-синуклеин образует амилоидоподобные фибриллы, которые повторяют ультраструктурные особенности альфа-синуклеина, выделенного у пациентов с деменцией с тельцами Леви, с болезнью Паркинсона и множественной системной атрофией. Кроме того, идентификация мутаций внутри гена синуклеина, хотя в редких случаях и является причиной семейной болезни Паркинсона, демонстрирует однозначную связь между синуклеиновой патологией и нейродегенеративными заболеваниями. Обычное включение α-синуклеина в спектр заболеваний, таких как болезнь Паркинсона, деменция с тельцами Леви, множественная системная атрофия и вариант болезни Альцгеймера с тельцами Леви, привело к классификации указанных заболеваний под общим названием "синуклеинопатии".
α-синуклеиновые фибриллы болезни Паркинсона, подобно Aβ фибриллам болезни Альцгеймера, также состоят из доминирующих β-складчатых пластинчатых структур. Поэтому соединения, которые, как обнаружено, ингибируют образование Aβ амилоидных фибрилл болезни Альцгеймера, будут также предположительно эффективны для ингибирования образования α-синуклеин/NAC фибрилл, что показано в представленных здесь примерах. Поэтому указанные здесь соединения могут также служить лекарствами при лечении болезни Паркинсона и других синуклеинопатий, кроме того, могут оказаться эффективными в качестве лекарств при лечении болезни Альцгеймера, диабета 2 типа и других амилоидных нарушений.
Существует настоятельная необходимость в обнаружении и идентификации новых соединений или агентов в качестве потенциальных лекарств для прекращения амилоидных образований, отложений, накопления и/или персистентности, которые наблюдаются при болезни Альцгеймера, болезни Паркинсона, диабете 2 типа и других амилоидозах.
СУЩНОСТЬ ИЗОБЕТЕНИЯ
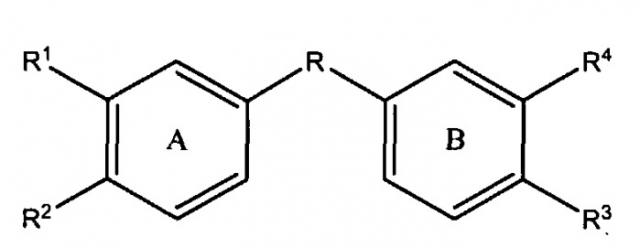
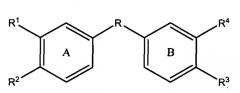
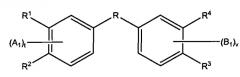
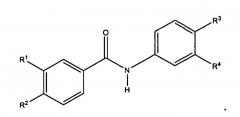
Настоящее изобретение представляет собой соединения и фармацевтические композиции, содержащие соединения формул:
и
или их фармацевтически приемлемые производные, где R выбирают из 1) CONR' и 2) C1-С10алкиленовой группы, в которой: (a) если число атомов углерода составляет, по меньшей мере, 2, присутствуют необязательно 1 или 2 двойные связи; (b) 1-3 несмежные метиленовые группы необязательно заменены NR', O или S; (c) 1 или 2 метиленовые группы необязательно заменены карбонильной или гидроксиметиленовой группой; и (d) 1 или 2 метиленовые группы необязательно заменены циклоалкильной или гетероциклильной группой, которая необязательно замещена одним или более заместителей, выбранных из низшего алкила, NR', O или S;
R1 представляет H, алкил или ацил;
R1, R2, R3 и R4 независимо выбирают следующим образом:
i) R1, R2, R3 и R4 независимо выбирают из ОН, -NR5C(=O)R6 и -NR7S(O2)R8, где R5 и R7 каждый независимо представляет водород, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный аралкил, замещенный или незамещенный гетероарил, замещенный или незамещенный гетероаралкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил; и R6 и R8 каждый независимо представляет замещенный или незамещенный алкокси, замещенный или незамещенный аралкокси, замещенный или незамещенный алкил, замещенный или незамещенный гетероарил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или -NR9R10, где R9 и R10 каждый независимо представляет водород, алкил, аралкил, арил, гетероарил, гетероаралкил или гетероциклил при условии, что, по меньшей мере, один из R1, R2, R3 и R4 не представляет OH;
ii) R1 и R2 и/или R3 и R4 вместе представляют -NH-C(=O)-NH-, -NH-S(O2)-NH-, -CH2-C(=O)-NH- или -CH2-S(O2)-NH и вместе с атомами углерода, к которым они присоединены, образуют 5-членное гетероциклическое кольцо, и другие из R1, R2, R3 и R4 независимо выбирают как в i); или
iii) по меньшей мере, один из R1, R2, R3 и R4 представляет
-NH-CRa=CRb- или -NH-S(O2)CRcRd- и вместе с двумя смежными атомами углерода фенильного кольца образует замещенное или незамещенное гетероциклическое или замещенное или незамещенное гетероароматическое кольцо, и другие из R1, R2, R3 и R4 независимо выбирают как в i) или ii); и
где кольца A и B замещены одним или более заместителей,
выбранных из электроноакцепторной группы, включая, но не ограничиваясь перечисленным, галоген, псевдогалоген, нитро,+NH3, SO3H, карбокси и галогеноалкил.
В одном из вариантов R1-R10, Ra, Rb, Rc и Rd соответствующим образом выбирают так, чтобы оптимизировать физико-химические и/или биологические характеристики, такие как биодоступность, фармакокинетика, проницаемость гематоэнцефалического барьера, оптимизированный метаболизм и повышенная эффективность при лечении амилоидных заболеваний и синуклеинопатий.
Также предложены любые фармацевтически приемлемые производные, включая соли, сложные эфиры, енольные простые эфиры или сложные эфиры, ацетали, кетали, сложные ортоэфиры, гемиацетали, гемикетали, сольваты, гидраты или пролекарственные формы соединений. Фармацевтически приемлемые соли включают, но не ограничиваются перечисленным, соли аминов, такие как, но не ограничиваясь перечисленным, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, аммиак, диэтаноламин и другие гидроксиалкиламины, этилендиамин, N-метилглюкамин, прокаин, N-бензилфенэтиламин, 1-пара-хлорбензил-2-пирролидин-1'-илметилбензимидазол, диэтиламин и другие алкиламины, пиперазин, трис(гидроксиметил)аминометан, соли щелочных металлов, такие как, но не ограничиваясь перечисленным, соли лития, калия и натрия, и соли щелочноземельных металлов, такие как, но не ограничиваясь перечисленным, соли бария, кальция и магния, соли переходных металлов, такие как, но не ограничиваясь перечисленным, соли цинка и других металлов, такие как, но не ограничиваясь перечисленным, гидрофосфат натрия и динатрий фосфат, и также включая, но не ограничиваясь перечисленным, соли минеральных кислот, такие как, но не ограничиваясь перечисленным, гидрохлориды и сульфаты, соли органических кислот, такие как, но не ограничиваясь перечисленным, ацетаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, валераты и фумараты.
Предложены также фармацевтические препараты для введения соответствующим способом и средства, содержащие эффективные концентрации одного или более из представленных здесь соединений или фармацевтически приемлемых производных, таких как соли, сложные эфиры, енольные простые эфиры или сложные эфиры, ацетали, кетали, сложные ортоэфиры, гемиацетали, гемикетали, сольваты, гидраты или пролекарственные формы, соединений которые обеспечивают количества, эффективные для лечения амилоидных заболеваний.
Препараты должны быть композициями, подходящими для введения любым необходимым способом, и они включают растворы, суспензии, эмульсии, таблетки, диспергируемые таблетки, пилюли, капсулы, порошки, сухие порошки для ингаляции, композиции с замедленным выделением, аэрозоли для введения в нос и дыхательные пути, пластыри для трансдермального введения и любые другие подходящие формы. Композиции должны быть пригодны для перорального введения, парентерального введения путем инъекций, включая подкожные, внутримышечные или внутривенные, в виде водных или масляных растворов или эмульсий, трансдермального введения и других выбираемых способов.
Предложены способы использования таких соединений и композиций для разрушения, дезагрегации и способствующие удалению, уменьшению или выведению амилоида или синуклеиновых фибрилл, тем самым предоставляя новые способы лечения амилоидных заболеваний и синуклеинопатий.
Предложены также способы лечения, предотвращения или улучшения состояния одного или более из симптомов амилоидных заболеваний или амилоидозов, включая, но не ограничиваясь перечисленным, заболевания, связанные с образованием, отложениями, накоплением или персистентностью амилоидных фибрилл, например фибрилл амилоидного белка, выбранных из Aβ амилоида, AA амилоида, AL амилоида, IAPP амилоида, PrP амилоида, α2-микроглобулинового амилоида, транстиретина, преальбумина и прокальцитонина.
Способы лечения амилоидных заболеваний, включают, но не ограничиваются перечисленным, болезнь Альцгеймера, синдром Дауна, боксерскую деменцию, множественную системную атрофию, миозит с включениями телец, наследственную церебральную геморрагию с амилоидозом голландского типа, болезнь Неймана-Пика типа C, церебральную β-амилоидную ангиопатию, деменцию, связанную с кортикальной базальной дегенерацией, амилоидоз диабета 2 типа, амилоидоз хронического воспаления, амилоидоз злокачественной и семейной средиземноморской лихорадки, амилоидоз множественной миеломы и B-клеточной дискразии, амилоидоз прионовых заболеваний, болезнь Крейтцфельдта-Якоба, синдром Герштмана-Штраусслера, куру, скрепи, амилоидоз, связанный с запястным туннельным синдромом, старческий кардиоамилоидоз, семейная амилоидотическая полинефропатия и амилоидоз, связанный с эндокринными заболеваниями.
Предложены также способы лечения, предотвращения или улучшения состояния одного или более из симптомов синуклеинового заболевания или синуклеинопатии. В одном из вариантов указанные способы ингибируют или предотвращают образование α-синуклеин/NAC фибрилл, ингибируют или предотвращают рост α-синуклеин/NAC фибрилл и/или вызывают демонтаж, разрушение и/или дизагрегацию сформированных ранее α-синуклеин/NAC фибрилл и связанные с α-синуклеин/NAC отложения белка. Синуклеиновые заболевания включают, но не ограничиваются перечисленным, болезнь Паркинсона, семейную болезнь Паркинсона, заболевание с тельцами Леви, вариант болезни Альцгеймера с тельцами Леви, деменцию с тельцами Леви, множественную системную атрофию и комплекс Паркинсонизм-деменция острова Гуам.
ПОДРОБНОЕ ОПИСАНИЕ
A. Определения
Если нет других указаний, все использованные здесь технические и научные термины имеют те же значения, которые обычно подразумевают специалисты, имеющие отношение к рассматриваемому изобретению. Все патенты, заявки, опубликованные заявки и другие публикации включены сюда для ссылки во всей полноте. В том случае, если существует многозначность определений для используемых здесь терминов, те, что приведены в этом разделе, имеют преимущество перед другими.
В том смысле, как здесь использован, термин "амилоидные заболевания" или "амилоидозы" представляет заболевания, связанные с образованием, отложением, накоплением или персистентностью амилоидных фибрилл, включая, но не ограничиваясь перечисленным, фибриллы амилоидного белка, выбранные из Aβ амилоида, AA амилоида, AL амилоида, IAPP амилоида, PrP амилоида, α2-микроглобулинового амилоида, транстиретина, преальбумина и прокальцитонина. Указанные заболевания включают, но не ограничиваются перечисленным, болезнь Альцгеймера, синдром Дауна, боксерскую деменцию, множественную системную атрофию, миозит с включениями телец, наследственную церебральную геморрагию с амилоидозом голландского типа, болезнь Неймана-Пика типа C, церебральную β-амилоидную ангиопатию, деменцию, связанную с кортикальной базальной дегенерацией, амилоидоз диабета 2 типа, амилоидоз хронического воспаления, амилоидоз злокачественной и семейной средиземноморской лихорадки, амилоидоз множественной миеломы и B-клеточной дискразии, амилоидоз прионовых заболеваний, болезнь Крейтцфельдта-Якоба, синдром Герштмана-Штраусслера, куру, скрепи, амилоидоз, связанный с запястным туннельным синдромом, старческий кардиоамилоидоз, семейную амилоидотическую полинефропатию и амилоидоз, связанный с эндокринными заболеваниями.
В том смысле, как здесь использован, термин "синуклеиновые заболевания" или "синуклеинопатии" обозначает заболевания, связанные с образованием, отложением, накоплением или персистентностью синуклеиновых фибрилл, включая, но не ограничиваясь перечисленным, α-синуклеиновые фибриллы. Указанные заболевания включают, но не ограничиваются перечисленным, болезнь Паркинсона, семейную болезнь Паркинсона, болезнь с тельцами Леви, вариант болезни Альцгеймера с тельцами Леви, деменцию с тельцами Леви, множественную системную атрофию и комплекс Парксонизм-деменция острова Гуам.
Термин "фибриллогенез" относится к образованию, отложению, накоплению и/или персистентности амилоидных фибрилл, нитей, включений, отложений, также как синуклеиновых (обычно включающих α-синуклеин) и/или NAC фибрилл, нитей, включений, отложений или т.п.
Термин "ингибирование фибриллогенеза" относится к ингибированию образования, отложения, накопления и/или персистентности указанных амилоидных фибрилл или синуклеиновых фибриллоподобных отложений.
"Разрушение фибрилл или фибриллогенеза" относится к разрушению образованных ранее амилоидных или синуклеиновых фибрилл, которые обычно существуют преимущественно в β-складчатой пластинчатой вторичной структуре. Указанное разрушение представленными здесь соединениями может включать заметное уменьшение или демонтаж амилоидных или синуклеиновых фибрилл, которые оценивают различными способами, такими как флуориметрия с тиофлавином T, связывание Конго красного, SDS-PAGE/вестерн-блоттинг, что продемонстрировано примерами, представленными в рассматриваемой заявке.
Термин "млекопитающее" включает как людей, так и других млекопитающих, таких как домашние животные (кошки, собаки и т.п.), лабораторные животные (такие как мыши, крысы, морские свинки и т.п.) и хозяйственные животные (рогатый скот, лошади, овцы, козы, свиньи и т.п.).
Термин "фармацевтически приемлемый эксципиент" означает эксципиент, который обычно используют при получении фармацевтических композиций, которые обычно безопасны, нетоксичны и желательны, и включает эксципиенты, которые приемлемы для использования в ветеринарии или для фармацевтического использования у людей. Указанные эксципиенты могут быть твердыми, жидкими, полутвердыми или, в случае аэрозольной композиции, газообразными.
Термин "терапевтически эффективное количество" означает количество, которого при введении субъекту или животному для лечения заболевания достаточно для достижения желательной степени лечения, предотвращения или симптомов улучшения состояния при заболевании. "Терапевтически эффективное количество" или "терапевтически эффективная доза" в некоторых вариантах ингибирует, уменьшает, разрушает, демонтирует образование, отложение, накопление и/или персистентность амилоидных или синуклеиновых фибрилл или лечит, осуществляет профилактику или облегчает один или более из симптомов заболевания, связанного с указанными состояниями, такими как амилоидное заболевание или синуклеинопатия, в измеряемом количестве в одном из вариантов, по меньшей мере, на 20%, в другом варианте, по меньшей мере, на 40%, в другом варианте, по меньшей мере, на 60% и в еще одном варианте, по меньшей мере, на 80% по сравнению с не подвергавшимся обработке субъектом. Эффективные количества представленных здесь соединений или их композиций для лечения млекопитающих составляют от около 0,1 до около 1000 мг/кг веса тела субъекта/день, например от около 1 до около 100 мг/кг/день, в другом варианте от около 10 до около 100 мг/кг/день. Считают, что широкий интервал доз раскрытых композиций является и безопасным и эффективным.
Термин "компонент с замедленным выделением" определяется здесь как соединение или соединения, включая, но не ограничиваясь перечисленным, полимеры, полимерные матрицы, гели, проницаемые мембраны, липосомы, микросферы или т.п., или их комбинации, которые облегчают замедленное выделение активного ингредиента.
Если комплекс растворим в воде, его можно приготовить в подходящем буфере, например в забуференном фосфатом солевом растворе или в других физиологически совместимых растворах. В другом варианте, если полученный комплекс плохо растворяется в водных растворителях, тогда его можно приготовить с неионным поверхностно-активным агентом, таким как Tween или полиэтиленгликоль. Так, соединения и их физиологические растворители можно приготовить, например, для введения путем ингаляции или вдувания (или через рот, или через нос) или для перорального, буккального, парентерального или ректального введения.
В том смысле, как здесь использованы, фармацевтически приемлемые производные соединения включают соли, сложные эфиры, енольные простые эфиры, енольные сложные эфиры, ацетали, кетали, сложные ортоэфиры, гемиацетали, гемикетали, сольваты, гидраты или их пролекарственные формы. Такие производные могут легко получить специалисты, используя известные способы для получения таких производных. Полученные соединения можно вводить животным или людям без значительных токсических эффектов независимо от того, являются ли они фармацевтически активными или являются пролекарственными формами. Фармацевтически приемлемые соли включают, но не ограничиваются перечисленным, соли аминов, такие как, но не ограничиваясь перечисленным, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, аммиак, диэтаноламин и другие гидроксиалкиламины, этилендиамин, N-метилглюкамин, прокаин, N-бензилфенэтиламин, 1-пара-хлорбензил-2-пирролидин-1'-илметилбензимидазол, диэтиламин и другие алкиламины, пиперазин и трис(гидроксиметил)аминометан; соли щелочных металлов, таких как, но не ограничиваясь перечисленным, литий, калий и натрий; соли щелочноземельных металлов, таких как, но не ограничиваясь перечисленным, барий, кальций и магний; соли переходных металлов, таких как, но не ограничиваясь перечисленным, цинк; и соли других металлов, такие как, но не ограничиваясь перечисленным, гидрофосфат натрия и динатрийфосфат; и также включая, но не ограничиваясь перечисленным, соли минеральных кислот, такие как, но не ограничиваясь перечисленным, гидрохлориды и сульфаты; и соли органических кислот, такие как, но не ограничиваясь перечисленным, ацетаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, валераты и фумараты. Фармацевтически приемлемые сложные эфиры включают, но не ограничиваются перечисленным, алкильные, алкенильные, алкинильные, арильные, гетероар