Способ исследования биосовместимости синтетического материала медико-биологического назначения с биологическими тканями
Иллюстрации
Показать всеИзобретение относится к способам исследования синтетических материалов на биосовместимость с тканями живого организма. Способ исследования биосовметимости синтетическиого материала медико-биологического назначения с биологическими тканями, при котором проводят исследование имплантата методом микроскопии с получением изображения поверхности с нанометровым разрешением. При этом ведут исследование среза имплантата методами атомно-силовой микроскопии, причем исследование среза имплантата методом атомно-силовой микроскопии ведут в двух контактных режимах: постоянной силы и латеральных сил. Контактные режимы осуществляют на воздухе при комнатной температуре с использованием контактных кантилеверов с радиусом кривизны острия зонда менее 10 нм. Затем по изображениям, зарегистрированным в режиме постоянной силы, рассчитывают параметры шероховатости и перепада высот, режим регистрации латеральных сил позволяет различать области сканирования с различными коэффициентами трения, а также особенности рельефа поверхности среза имплантата. А методом атомно-силовой спектроскопии регистрируют силы адгезии между зондом кантилевера и поверхностью среза имплантата по результатам обработки силовых кривых подвода-отвода кантилевера от среза имплантата, причем измерение силы адгезии проводят на нескольких участках исследуемого среза имплантата. Целью предложенного изобретения является оценка степени проникновения компонентов соединительной ткани внутрь имплантата и степени фиксации имплантата в организме. 3 ил.
Реферат
Изобретение относится к способам исследования синтетических (полимерных) материалов на биосовместимость с тканями живого организма и может быть использовано в медицине, бионанотехнологии и химии при определении биосовместимости полимеров медико-биологического назначения с окружающими тканями и с культивированными популяциями клеток.
Известен способ исследования биосовместимости полимеров с биологическими тканями с использованием оптической микроскопии (Штильман М.И. Полимеры медико-биологического назначения. - М.: ИКЦ «Академкнига», 2006. - 400 с.). Метод оптической микроскопии осуществляется при помощи оптического микроскопа, который представляет собой комбинацию двух оптических систем - объектива и окуляра, разделенных значительным по сравнению с фокусными расстояниями объектива и окуляра расстоянием. Малый объект помещают вблизи переднего фокуса объектива, дающего его увеличенное действительное перевернутое изображение, которое рассматривают с помощью окуляра. Для увеличения разрешающей способности микроскопа освещение предмета широкими пучками света производят с помощью конденсора, фокус которого располагают в плоскости предмета. Увеличение микроскопа зависит от фокусных расстояний объектива и окуляра и может достигать 2000. Минимальный размер предмета, который различают в оптический микроскоп, составляет 0,2-0,3 мкм.
С помощью оптической микроскопии подробно изучены морфологические, гистохимические и иммунологические взаимодействия имплантата с окружающими тканями и с культивированными популяциями клеток. Установлено, что внедрение чужеродного тела, каковым является имплантат, вызывает нормальный воспалительный процесс, выражающийся в появлении около и на поверхности имплантата, с одной стороны, различных молодых клеток новой растущей ткани, с другой стороны, защитных клеток, стремящихся поглотить и метаболизировать находящиеся в этой зоне фрагменты разрушенных клеток, биополимеры, а также введенный чужеродный материал. Таким образом, имплантат окружен плотной оболочкой (капсулой, мембраной), которая фиксирует имплантат в тканях реципиента и в то же время отделяет его от них.
Недостатком данного способа является то, что
- исследования ограничены лишь процессами, происходящими вокруг синтетического материала в прилегающих тканях, из-за недостаточной разрешающей способности оптических микроскопов (порядка сотен нанометров);
- отсутствуют возможности исследования поперечного среза имплантата;
- исследования ограничены невозможностью получения трехмерного изображения исследуемой поверхности и исследования физических характеристик анализируемого образца, отсутствие возможности получения изображения исследуемой поверхности в режиме латеральных сил (см. абзац 2 с.8 материалов - определение);
- отсутствуют возможности определения феноменологических характеристик поверхности (параметры шероховатости и перепада высот), необходимых для количественного анализа исследуемой поверхности.
Наиболее близким к заявляемому способу является способ исследования биосовместимости полимеров с биологическими тканями с использованием метода сканирующей электронной микроскопии. Метод электронной микроскопии предназначен для наблюдения и фотографирования многократно увеличенного изображения объектов (до 106 раз), в котором вместо световых лучей используют пучки электронов, ускоренные до больших энергий в условиях глубокого вакуума. В отличие от оптического микроскопа в электронном микроскопе вместо лучей света используют быстрые электроны, а вместо стеклянных линз электромагнитные катушки или электронные линзы. Движущийся электрон ведет себя, как волна, причем длина волны электрона примерно в 50000 раз короче световой, значит, и размеры рассматриваемого объекта могут быть намного меньше. Проекционная система электронного микроскопа проецирует действительное изображение на люминесцентный экран или фотографическую пластинку. Источником электронов обычно служит нагреваемый катод. Поскольку электроны сильно рассеиваются на постороннем веществе (атомах и молекулах газа), в колонне микроскопа, где движутся электроны, должен быть вакуум, что сохраняет изображение неискаженным. Электронное изображение формируют электрическими и магнитными полями примерно так же, как световое - оптическими линзами.
Магнитное поле, создаваемое витками катушки, по которой проходит ток, действует как собирающая линза, фокусное расстояние которой изменяют, изменяя ток. Поскольку оптическая сила такой линзы, т.е. способность фокусировать электроны, зависит от напряженности магнитного поля вблизи оси, для ее увеличения концентрируют магнитное поле в минимально возможном объеме.
Методом электронной микроскопии исследовались два полипропиленовых эндопротеза через 2 года после имплантации в биологические ткани (Alain M. Danino, Gabriel Malkab, Marc Revola, Jean-Marie Servant. A scanning electron microscopical study of the two sides of polypropylene mesh (Marlex) and PTFE (Gore Тех) mesh 2 years after complete abdominal wall reconstruction. A study of 15 cases // The British Association of Plastic Surgeons. - 2005. - 58. - P. 384-388). Для ламинарного эндопротеза получили, что после имплантации на поверхности волокон поры уменьшились, изменилась структура поверхности, наблюдались небольшие включения эритроцитов. Для сетчатого эндопротеза поверхность волокон сетки предположительно покрыта тонким слоем ткани, по их мнению, состоящего из фагоцитирующих клеток.
Недостатками известного способа являются:
- невозможность получения трехмерного изображения исследуемой поверхности;
- невозможность исследования физических характеристик анализируемого образца;
- известный способ основан на сложной многоступенчатой методике подготовки и анализа образца и требует больших затрат времени, дорогостоящих оборудования и реактивов;
- отсутствие возможности получения изображения исследуемой поверхности в режиме латеральных сил (см. абзац 2 с.8 материалов - определение);
- отсутствие возможности исследования поперечного среза имплантата;
- отсутствие возможности определения феноменологических характеристик поверхности (параметры шероховатости и перепада высот), необходимых для количественного анализа исследуемой поверхности.
Как известно из доступных источников информации (например, Штильман М.И. Полимеры медико-биологического назначения. - М.: ИКЦ «Академ-книга», 2006. - 400 с.), введение чужеродного материала в организм - сложная хирургическая операция, сопровождающаяся нарушением живой ткани, вызывающим ряд местных и общих изменений, в том числе приводящих к биосовместимости имплантата с тканями организма или его биодеградации и биодеструкции.
Под биосовместимостью понимают свойство материала (в частности, имплантата) выполнять определенную функцию в организме в течение требуемого времени без вреда для него, другими словами, имплантат должен повышать комфортность пациентов, проявлять высокую восприимчивость организмом пациента, т.е. имплантат должен быстро и прочно срастаться с тканью организма, обеспечивать минимальные сроки интеграции.
Задачей заявленного технического решения является создание способа исследования биосовместимости преимущественно синтетических материалов медико-биологического назначения с биологическими тканями с использованием методов атомно-силовой микроскопии и спектроскопии (В.Л.Миронов. Основы сканирующей зондовой микроскопии. - Нижний Новгород: изд-во РАН, 2004. - 114 с.), которые позволяют:
- получить трехмерное изображение исследуемой поверхности;
- исследовать физические характеристики анализируемого образца;
- снизить сложность и многоступенчатость самой методики подготовки и анализа образца;
- снизить затраты времени и расхода реактивов на исследование (кроме расходного материала - кантилевера);
- обеспечить возможность получения изображения исследуемой поверхности в режиме латеральных сил;
- обеспечить возможность исследования поперечного среза имплантата;
- обеспечить возможность определения феноменологических характеристик поверхности (параметров шероховатости и перепада высот), необходимых для количественного анализа исследуемой поверхности имплантата.
Таким образом, заявленный способ позволит оценить степень проникновения компонентов соединительной ткани внутрь имплантата и, следовательно, степень фиксации имплантата в организме, а также оптимизировать процесс интеграции имплантата в окружающие ткани (выбор наилучшего материала имплантата, место и способ его введения в организм человека) с целью исключения послеоперационных осложнений.
Поставленная задача решается за счет того, что в способе исследования биосовместимости синтетического материала медико-биологического назначения с биологическими тканями, включающем исследование имплантата методом микроскопии с получением изображения поверхности с нанометровым разрешением, при котором ведут исследование среза имплантата методами атомно-силовой микроскопии, причем исследование среза имплантата методом атомно-силовой микроскопии ведут в двух контактных режимах: постоянной силы и латеральных сил, контактные режимы осуществляют на воздухе при комнатной температуре с использованием контактных кантилеверов с радиусом кривизны острия зонда менее 10 нм; при этом по изображениям, зарегистрированным в режиме постоянной силы, рассчитывают параметры шероховатости и перепада высот, режим регистрации латеральных сил позволяет различать области сканирования с различными коэффициентами трения, а также особенности рельефа поверхности среза имплантата, а методом атомно-силовой спектроскопии регистрируют силы адгезии между зондом кантилевера и поверхностью среза имплантата по результатам обработки силовых кривых подвода-отвода кантилевера от среза имплантата, причем измерение силы адгезии проводят на нескольких участках исследуемого среза имплатата.
Существенным отличием заявленного способа является то, что впервые предлагается способ исследования биосовместимости материала по анализу поверхности среза имплантата (а не только внешней поверхности имплантата) с использованием комплекса показателей, которые ранее не использовались для исследования биосовместимости материала с тканями организма с помощью АСМ: по изображениям с нанометровым разрешением, полученным в режиме латеральных сил, визуально на качественном уровне определяют характер и особенности изменения рельефа поверхности среза имплантата; по рассчитанным значениям параметров шероховатости, перепада высот и силам адгезии на количественном уровне определяют микрогеометрические и физические свойства поверхности среза анализируемого имплантата.
Заявленный способ применим для исследования биосовместимости с биологическими тканями широкого ряда полимеров медико-биологического назначения, которые используются для изготовления имплантатов, например полипропилен, политетрафторэтилен, полиметилметакрилат, полиэтилентерефталат и т.д. (Штильман М.И. Полимеры медико-биологического назначения. - М.: ИКЦ «Академ-книга», 2006. - 400 с.).
Заявленный способ осуществляют с использованием различных типов атомно-силовых микроскопов как отечественного (Solver P47H, Solver Pro, Ntegra (ЗАО «НТ-МДТ»), так и импортного производства (BioScope («Veeco»)), для которых описанные ниже режимы сканирования идентичны.
Заявленный способ реализуется следующим образом.
Преимущественно полимерный имплантат вводят в организм животного (например, крысы) хирургическим методом. Через определенный временной промежуток получают образец ткани с имплантированным полимерным материалом, используя известный способ фиксации в парафине, из которого при помощи микротома приготавливают тонкие срезы (опытные образцы). Срез закрепляют на покровном стекле и помещают на столик атомно-силового микроскопа. Измерения проводят в течение первых трех часов после приготовления образцов.
В качестве контрольных образцов для идентификации структуры полимерного материала и соединительной ткани вокруг имплантата используют срезы исходного синтетического материала, не имевшего контакт с биологической тканью (контрольный образец 1), и срезы соединительной ткани, окружающей имплантат (контрольный образец 2).
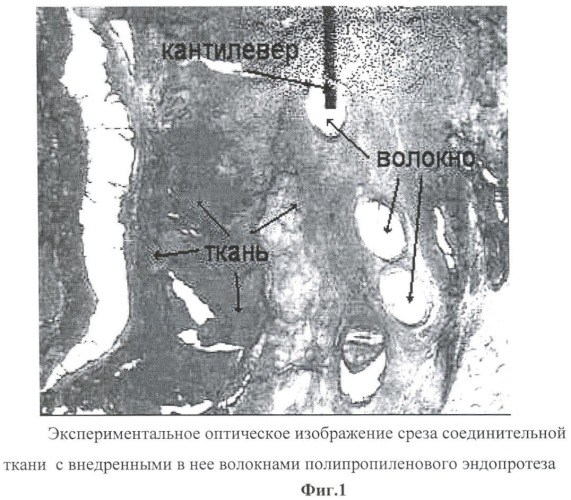
Перед АСМ-измерениями для точного позиционирования области сканирования используют цифровую видеокамеру с оптическим микроскопом (фиг.1).
Исследования срезов проводят контактным методом атомно-силовой микроскопии при комнатной температуре на воздухе с использованием стандартных контактных кремниевых кантилеверов с малыми коэффициентами жесткости (сотые доли Н/м). Кантилеверы используют с разной формой острия зонда с радиусами кривизны от 2 нм до 10 нм. Сканирование проводят с разрешением не менее 512×512 точек. Применяют два контактных режима: постоянной силы (регистрация топографии поверхности) и латеральных сил (В.Л.Миронов. Основы сканирующей зондовой микроскопии. - Нижний Новгород: изд-во РАН, 2004. - 114 с.).
В контактных методиках атомно-силовой микроскопии острие зонда находится в непосредственном соприкосновении с поверхностью. Получение АСМ-изображений рельефа поверхности связано с регистрацией малых изгибов балки кантилевера при помощи оптической системы атомно-силового микроскопа: излучение полупроводникового лазера фокусируют на балке кантилевера, а отраженный от балки пучок попадает в центр фоточувствительной области фотоприемника. Основные регистрируемые оптической системой параметры - это деформация изгиба балки кантилевера под действием сил притяжения или отталкивания (режим постоянной силы) и деформации кручения балки под действием латеральных компонентов сил взаимодействия зонда с поверхностью (режим латеральных сил). Вертикальные смещения сканера пропорциональны рельефу поверхности образца, что позволяет регистрировать изображения рельефа исследуемой поверхности и рассчитать параметры шероховатости и перепада высот по описанным ниже формулам, используя изображения поверхности среза имплантата в режиме постоянной силы.
Для описания и детализации структуры поверхности срезов имплантата применяют феноменологические характеристики (параметры шероховатости и перепада высот), которые определяют наиболее общие свойства, отражающие состояние рельефа всех видов поверхности, в том числе и биологических объектов. В данном случае их применяют для идентификации поверхности, используя изображения, полученные в режиме постоянной силы. Для описания микрогеометрии поверхности снимают серию АСМ-изображений с одинаковыми размерами кадра с различных участков поверхности среза имплантата и определяют параметры шероховатости по формулам (1)-(3).
а) Среднеарифметическая шероховатость поверхности, которая определяет центр симметрии:
где z(i, j) - значение высоты рельефа в точке с координатами (i, j), измеренное с помощью АСМ, N - количество точек в строке сканирования; - среднее значение высоты рельефа на изображении.
б) Среднеквадратичная шероховатость поверхности, которая определяет дисперсию случайной величины и характеризует рассеяние отдельных ее значений от центра распределения:
в) Перепад высот, который определяет разницу между наибольшим (zmax) и наименьшим (zmin) значениями высот рельефа на изображении:
Методика определения параметров шероховатости и перепада высот заложена в программу обработки результатов сканирования атомно-силовым микроскопом и производится автоматически.
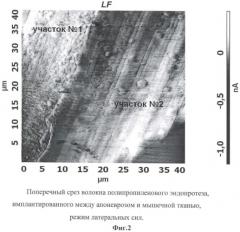
При сканировании перпендикулярно продольной оси кантилевера помимо изгиба кантилевера в нормальном направлении происходит также и деформация кручения балки кантилевера. Она обусловлена моментом силы, действующей на зонд. Для малых отклонений угол закручивания пропорционален поперечной (латеральной) силе. Режим регистрации латеральных сил позволяет различать области сканирования с различными коэффициентами трения, а также подчеркивать особенности рельефа анализируемой поверхности (фиг.2).
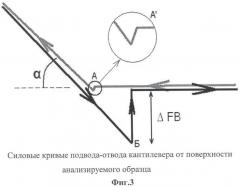
Для идентификации материала поверхности среза проводят анализ сил адгезии между зондом и поверхностью имплантата с использованием атомно-силовой спектроскопии путем регистрации силовых кривых подвода-отвода кантилевера от поверхности анализируемого образца, которые отражают отклонение гибкой балки кантилевера при взаимодействии острия зонда с поверхностью образца в зависимости от расстояния между ними (фиг.3).
В большинстве случаев силы адгезии F являются комбинацией электростатических сил, сил Ван-дер-Ваальса, капиллярных сил и сил, обусловленных химическими связями. В нашем случае адгезионные силы будут определяться силами Ван-дер-Ваальса, которые в большинстве случаев являются притягивающими, и капиллярными силами за счет адсорбции тонких водных пленок на зонде кантилевера и исследуемой поверхности.
При подводе кантилевера к поверхности в момент контакта зонда кантилевера с поверхностью на силовой кривой наблюдается малый скачок, а при отводе - аналогичный, но более интенсивный скачок, который отражает адгезионное взаимодействие между зондом и поверхностью. При отводе зонда от образца (после приведения их в контакт) за счет действия сил адгезии зонд не отрывается от образца до тех пор, пока сила упругости гибкой балки кантилевера не превысит силы взаимодействия зонда с образцом. В этот момент происходит отрыв зонда от образца и балка кантилевера возвращается в исходное недеформированное состояние.
В режиме атомно-силовой спектроскопии регистрация силовых кривых подвода-отвода осуществлялась с помощью программного обеспечения управления АСМ. Из силовых кривых подвода-отвода (фиг.3) по формуле (4) вычислялась сила адгезии (F) между зондом и поверхностью образца:
где k - коэффициент жесткости кантилевера, Н/м, - прикладывается к паспорту кантилевера; ΔFB - скачок сигнала от фотоприемника при отрыве кантилевера от поверхности, нА; α - угол наклона кривой подвода при контакте зонда кантилевера с поверхностью.
Проводят 50-150 измерений силы адгезии на нескольких участках исследуемого образца.
Получение изображений среза имплантата методом атомно-силовой микроскопии в двух контактных режимах: постоянной силы и латеральных сил; расчет параметров шероховатости и перепада высот рельефа поверхности среза (формулы (1)-(3)); определение силы адгезии между зондом кантилевера и поверхностью среза имплантата (формула (4)) производят как для опытных, так и для контрольных образцов.
Проведенные экспериментальные исследования АСМ-изображений распределения латеральных сил на поверхности среза имплантата (опытные образцы) показали отчетливые различия в структуре исследуемой поверхности. Выявлены участки, структура которых идентична структуре синтетического материала (контрольный образец 1), а также участки, структура которых идентична структуре поверхности соединительной ткани (контрольный образец 2). На выявленных участках опытных образцов осуществляли сравнительный анализ параметров шероховатости, перепада высот и сил адгезии с аналогичными параметрами для контрольных образцов. Получено, что значения параметров для поверхности среза имплантата (опытный образец) в несколько раз отличаются от значений параметров для поверхности среза исходного синтетического материала (контрольный образец 1) и хорошо коррелируют с аналогичными значениями для поверхности среза соединительной ткани, окружающей имплантат (контрольный образец 2).
Аналогичные измерения проводят для опытных образцов, полученных из разных мест хирургического введения имплантата в организм животного (например, между апоневрозом и подкожной клетчаткой и между апоневрозом и мышечными слоями). Проводят сравнительный анализ всех полученных результатов: АСМ-изображений распределения латеральных сил на поверхности среза имплантата, параметров шероховатости, перепада высот и сил адгезии, по которым судят о степени прорастания соединительной ткани внутрь имплантата, что позволяет определить оптимальное расположение имплантата в ходе оперативного вмешательства.
Приводим конкретные примеры исследования биосовместимости полипропиленового эндопротеза, например, для хирургического лечения грыж.
Пример 1. Полипропиленовый сетчатый эндопротез имплантируют между апоневрозом и мышечными слоями спины половозрелым лабораторным крысам-самцам массой 320-360 г. Исследования по предлагаемому способу проводят через 90 суток после имплантации эндопротеза. Это продиктовано необходимостью формирования соединительной ткани и неоваскуляризации вокруг волокон синтетического материала.
Перед АСМ-измерениями для выбора точного места сканирования используют цифровую видеокамеру в комплексе с оптическим микроскопом с увеличением
ZOOM-128. На фиг.1 приведено оптическое изображение поверхности среза соединительной ткани с внедренными в ее структуру волокнами сетчатого полипропиленового эндопротеза (вид сверху).
Исследования проводят контактным методом при комнатной температуре на воздухе на атомно-силовом микроскопе Solver P47H (ЗАО «НТ-МДТ», Россия). Используют стандартные кремниевые кантилеверы CSG11 (ЗАО «НГ-МДТ», Россия) длиной 350 мкм и 250 мкм с коэффициентами жесткости 0,03 Н/м и 0,1 Н/м соответственно. Типичный радиус кривизны острия зонда кантилевера - менее 10 нм. Сканирование проводят с разрешением 1024×1024 точек. Феноменологические характеристики (параметры шероховатости и перепада высот) вычисляют по формулам (1)-(3), используя АСМ-изображения с размером кадра 4×4 мкм, полученные в режиме постоянной силы; локальную силу адгезии определяют по формуле (4), используя силовые кривые подвода-отвода зонда от поверхности образца.
В качестве контрольных образцов для идентификации структуры полимерного материала и соединительной ткани со структурой имплантата исследованы поперечные срезы исходного полипропиленового волокна (контрольный образец 1) и соединительной ткани, окружающей полипропиленовые волокна эндопротеза после имплантации (контрольный образец 2).
АСМ-изображения поверхности среза исходного полипропиленового волокна (контрольный образец 1) показали, что поверхность носит ламинарный характер, сила адгезии при взаимодействии зонда с поверхностью среза исходного полипропилена, параметры шероховатости и перепада высот составили F=(5.6±2.1) нН, Ra=(92.2±10.1) нм, Rq=(117.8±26.1) нм, Ry=(649.0±68.7) нм соответственно.
На АСМ-изображениях поверхности среза соединительной ткани, окружающей волокна эндопротеза (контрольный образец 2), выявлена неровная ячеистая структура поверхности с феноменологическими характеристиками, в три раза меньшими (Ra=(32.6±9.0) нм, Rq=(40.8±11.6) нм, Ry=(267.9±78.1) нм), а значениями сил адгезии, почти в пять раз большими (F=(24.0±5.8) нН), чем для исходного полипропиленового волокна.
АСМ-изображения распределения латеральных сил на поверхности среза волокон сетчатого полипропиленового эндопротеза, имплантированного между апоневрозом и мышечными слоями (опытный образец), показали отчетливые различия в структуре исследуемой поверхности (фиг.2). Выявлены участки, структура которых аналогична структуре поверхности среза исходного полипропиленового волокна (участок №2) и структуре поверхности среза соединительной ткани (участок №1). АСМ-исследования провели на 9 участках для каждого из 3 срезов специально обработанных кусочков тканей с имплантированным сетчатым полипропиленовым эндопротезом (фиг.1).
Анализ значений феноменологических параметров и локальных сил адгезии показал существенные различия между структурами, визуализированными на участках №1 и №2. На участке №2 феноменологические параметры равны: Ra=(73.4±12.0) нм; Rq=(85.1±11.6) нм; Ry=(507.0±78.1) нм; локальная сила адгезии при взаимодействии зонда с поверхностью - F=(4.4±1.6) нН. Эти данные достаточно хорошо коррелируют с результатами, полученными при исследовании исходного полипропиленового волокна (контрольный образец 1). На участке №1 феноменологические параметры равны: Ra=(32.5±5.1) нм; Rq=(41.4±6.8) нм; Ry=(300.6±79.5) нм; локальная сила адгезии при взаимодействии зонда с поверхностью - F=(30.7±11.9) нН. В общей сложности на срезах волокон сетчатого эндопротеза, при локализации эндопротеза между апоневрозом и мышечными слоями, выявлено большое количество участков соединительной ткани, значения сил адгезии которых колеблются в пределах от 16.4 нН до 73.7 нН, преимущественно идентичных по структуре поверхности среза соединительной ткани, визуализированной на участке №1. АСМ-изображения поверхности среза соединительной ткани, идентичных участку №1, показали, что все значения феноменологических параметров, с одной стороны, в 2-3 раза меньше, силы адгезии - в 7-12 раз больше аналогичных значениям для поверхности среза исходного полипропиленового волокна, с другой стороны, эти результаты хорошо коррелируют с данными, полученными при исследовании поверхности среза соединительной ткани, окружающей полипропиленовые волокна эндопротеза (контрольный образец 2).
Результаты проведенных экспериментов позволяют показать, что заявленным способом можно установить активное врастание соединительной ткани во внутреннюю структуру полипропиленового волокна сетчатого эндопротеза, что ранее известными методами невозможно было определить.
Пример 2. Полипропиленовый сетчатый эндопротез имплантируют в другую зону спины половозрелым крысам-самцам, а именно между апоневрозом и подкожной клетчаткой (в отличие от примера 1). Исследования по предлагаемому способу проводят через 90 суток после имплантации эндопротеза.
Перед АСМ-измерениями для выбора точного места сканирования используют цифровую видеокамеру в комплексе с оптическим микроскопом с увеличением
ZOOM-128. На фиг.2 приведено оптическое изображение поверхности среза соединительной ткани с внедренными в ее структуру волокнами сетчатого полипропиленового эндопротеза (вид сверху).
Исследования проводят контактным методом при комнатной температуре на воздухе на атомно-силовом микроскопе Solver P47H (ЗАО «НТ-МДТ», Россия). Используют стандартные кремниевые кантилеверы CSG11 (ЗАО «НТ-МДТ», Россия) длиной 350 мкм и 250 мкм с коэффициентами жесткости 0,03 Н/м и 0,1 Н/м соответственно. Типичный радиус кривизны острия зонда кантилевера - менее 10 нм. Сканирование проводят с разрешением 1024×1024 точек. Феноменологические характеристики (параметры шероховатости и перепада высот) вычисляют по формулам (1)-(3), используя АСМ-изображения с размером кадра 4×4 мкм, полученные в режиме постоянной силы; локальную силу адгезии определяют по формуле (4), используя силовые кривые подвода-отвода зонда от поверхности образца.
Исследования осуществляют аналогично примеру 1. В качестве контрольных образцов для идентификации структуры полимерного материала и соединительной ткани со структурой имплантата исследованы поперечные срезы исходного полипропиленового волокна (контрольный образец 1) и соединительной ткани, окружающей полипропиленовые волокна эндопротеза после имплантации (контрольный образец 2).
АСМ-исследования поверхности срезов волокон эндопротеза, имплантированного между апоневрозом и подкожной клетчаткой, зарегистрировали большое количество поверхностей с рельефом и рассчитанными значениями феноменологических параметров и силы адгезии (Ra=(103.9±34.7) нм; Rq=(127.3±35.4) нм; Ry=(693.1±84.3) нм, F=(1.3±0.6) нН), аналогичными структуре поверхности исходного полипропиленового волокна (Ra=(92.2±10.1) нм, Rq=(117.8±26.1) нм, Ry=(649.0±68.7) нм, F=(5.6±2.1) нН). АСМ-изображения поверхности срезов волокон полипропиленового эндопротеза, полученные в режиме регистрации латеральных сил, также показали включения (соединительную ткань) внутри синтетического материала, но характер и размеры включений существенно отличались от вышеописанных в примере 1.
По АСМ-исследованиям поверхности среза волокон эндопротеза с включениями соединительной ткани все значения феноменологических параметров - в 3-5 раз больше (Ra=(142.1±31.2) нм; Rq=(171.5±36.0) нм; Ry=(799.7±107.2) нм); а силы адгезии при взаимодействии зонда с поверхностью - в 3-6 раз меньше (F=(9.2±4.0) нН), чем для поверхности среза волокон полипропиленового эндопротеза, имплантированного между апоневрозом и мышечными слоями спины крыс (из примера 1: Ra=(32.5±5.1) нм; Rq=(41.4±6.8) нм; Ry=(300.6±79.5) нм; F=(30.7±11.9) нН). Эти результаты хорошо коррелируют с данными, полученными при исследовании поверхности среза исходного полипропиленового волокна (контрольный образец 1): Ra=(92.2±10.1) нм, Rq=(117.8±26.1) нм, Ry=(649.0±68.7) нм, F=(5.6±2.1) нН.
Полученные результаты отчетливо указывают на слабое врастание соединительной ткани внутрь полипропиленовых волокон эндопротеза при имплантации его между апоневрозом и подкожной клетчаткой по сравнению с эндопротезом, имплантируемым между апоневрозом и мышечными слоями спины крыс, что приводит к худшей адаптации имплантата к окружающим тканям.
Результаты, приведенные в примерах 1 и 2, позволяют определить активное врастание соединительной ткани внутрь волокон сетчатого эндопротеза и его оптимальное расположение при локализации между апоневрозом и мышечными слоями, обеспечивающее максимальную степень его интеграции с окружающими тканями.
Заявленное техническое решение позволит с повышенной точностью, надежностью и информативностью определять биосовместимость полимеров медико-биологического назначения с биологическими тканями. Использование заявленного технического решения даст возможность по АСМ-изображениям, полученным в режиме латеральных сил, параметрам шероховатости, перепада высот и сил адгезии определять степень проникновения компонентов соединительной ткани внутрь полимера, оценить степень фиксации имплантата в организме и оптимизировать процесс его интеграции в окружающие ткани, что позволит исключить послеоперационные осложнения. Способ позволит определить наилучший материал в качестве биоимплантата, выбрать место и способ введения имплантата в организм человека.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, т.к. заявленная совокупность признаков с достигаемыми техническими результатами не известна из исследованного уровня техники.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, т.к. не является очевидным для специалиста (специалистов) как в области медицины, так и в области атомно-силовой микроскопии, кроме этого заявленное техническое решение разрешает казалось бы не разрешимые для специалистов противоречия, т.к., с одной стороны, позволяет значительно снизить затраты и при этом одновременно позволяет решить одновременно ряд технических задач, которые не разрешимы для специалистов из разных областей техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», т.к. может быть реализовано в любом специализированном медицинском учреждении посредством применения известных приборов, материалов с привлечением к работе квалифицированного персонала (медиков и специалистов по атомно-силовой микроскопии).
Способ исследования биосовместимости синтетического материала медико-биологического назначения с биологическими тканями, включающий исследование имплантата методом микроскопии с получением изображения поверхности с нанометровым разрешением, при котором ведут исследование среза имплантата методами атомно-силовой микроскопии, причем исследование среза имплантата методом атомно-силовой микроскопии ведут в двух контактных режимах: постоянной силы и латеральных сил, контактные режимы осуществляют на воздухе при комнатной температуре с использованием контактных кантилеверов с радиусом кривизны острия зонда менее 10 нм, при этом по изображениям, зарегистрированным в режиме постоянной силы, рассчитывают параметры шероховатости и перепада высот, режим регистрации латеральных сил позволяет различать области сканирования с различными коэффициентами трения, а также особенности рельефа поверхности среза имплантата, а методом атомно-силовой спектроскопии регистрируют силы адгезии между зондом кантилевера и поверхностью среза имплантата по результатам обработки силовых кривых подвода-отвода кантилевера от среза имплантата, причем измерение силы адгезии проводят на нескольких участках исследуемого среза имплантата.