Реагенты для внутреннего флуоресцентного контроля при определении генотипа и подтипа вируса гепатита с на олигонуклеотидном микрочипе и способ их получения
Иллюстрации
Показать всеНастоящее изобретение относится к новым реагентам для внутреннего флуоресцентного контроля при идентификации генотипа и подтипа вируса гепатита С на олигонуклеотидном микрочипе и способу их получения. Предложенные реагенты представляют собой фосфорамидиты флуоресцентных красителей. Способ их получения включает взаимодействие соответствующих активированных эфиров индокарбоцианиновых красителей с функциональным аминолинкером с последующим взаимодействием полученного продукта с 2-цианэтил-N,N,N',N'-тетраизопропилфосфорамидитом. Технический результат - разработка нового способа получения новых реагентов, содержащих индокарбоцианиновые красители, флуоресцирующие в узком диапазоне длин волн с максимумом на 550-555 нм, что позволяет избежать наложения флуоресцентного сигнала внутреннего контроля на сигналы детектируемых образцов, которые маркированы красителями индодикарбоцианинового ряда с максимумом эмиссии в диапазоне 650-660 нм. 2 н.п. ф-лы, 3 ил.
Реферат
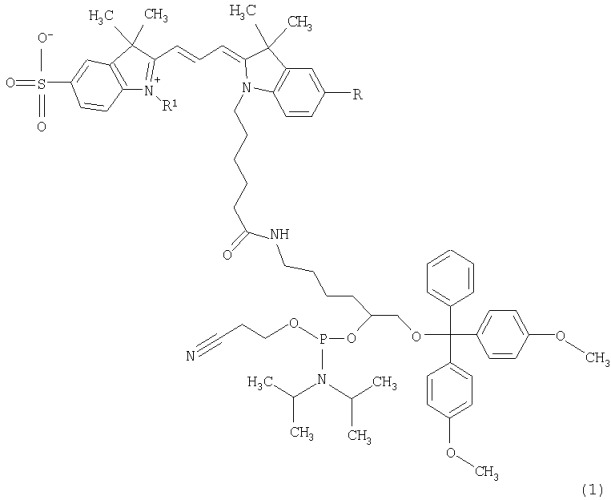
Изобретение относится к области молекулярной диагностики, молекулярной биологии, вирусологии и биоорганической химии. Предлагаются новые реагенты для введения внутреннего флуоресцентного контроля в методе идентификации генотипа и подтипа вируса гепатита С (ВГС) с использованием специализированного олигонуклеотидного микрочипа (биочипа). Новые реагенты представляют собой реакционноспособные фосфорамидиты флуоресцентных красителей (Фиг.1), аналогов цианинового красителя Су3. Внутренний флуоресцентный контроль на микрочипах осуществляется путем введения в состав проб олигонуклеотидов, меченных новыми реагентами. Индокарбоцианиновые красители, входящие в состав реагентов, флуоресцируют в узком диапазоне длин волн с максимумом на 550-555 нм. Это позволяет избежать наложения флуоресцентного сигнала внутреннего контроля на сигналы детектируемых образцов, которые маркированы красителями индодикарбоцианинового ряда с максимумом эмиссии в диапазоне 650-660 нм.
Биочипы для идентификации генотипа и подтипа ВГС представляют собой подложку, содержащую множество дискретных элементов, в каждом из которых иммобилизован уникальный олигонуклеотидный зонд, имеющий генотип-специфичную или подтип-специфичную последовательность фрагмента области NS5B генома ВГС.
Метод определения генотипа и подтипа ВГС основан на двухстадийной ПЦР с получением флуоресцентно меченного, преимущественно одноцепочечного, фрагмента области NS5B с последующей гибридизацией этого фрагмента на биочипе, содержащем набор специфичных дискриминирующих олигонуклеотидов. Исследуемый фрагмент области NS5B образует совершенные гибридизационные дуплексы только с соответствующими (полностью комплементарными) олигонуклеотидами. Со всеми остальными олигонуклеотидами изучаемый фрагмент ДНК дает несовершенный дуплекс. Дискриминацию совершенных и несовершенных дуплексов выполняют путем сравнения интенсивностей флуоресценции ячеек, в которых образовались дуплексы. Идентификацию генотипа и подтипа ВГС проводят путем выявления ячеек, в которых образовались совершенные гибридизационные дуплексы.
Применение реагентов для внутреннего флуоресцентного контроля позволяет проводить оценку концентрации специфичных олигонуклеотидов, иммобилизованных в элементах биочипа, и нормировать гибридизационные флуоресцентные сигналы с учетом концентраций олигонуклеотидов. Нормировка флуоресцентных сигналов используется для точного вычисления дискриминационных отношений между ячейками, в которых образовались совершенные и несовершенные гибридизационные дуплексы, что необходимо для однозначного определения генотипа и подтипа ВГС.
Настоящее изобретение рассматривает новые реагенты для введения индокарбоцианиновой флуоресцентной метки в синтетические олигонуклеотиды, используемые при анализе на биочипах. Такого рода реагенты могут быть использованы для флуоресцентного мечения олигонуклеотидов, используемых в различных областях молекулярной биологии и медицины.
Синтетические олигонуклеотиды могут быть маркированы цианиновыми красителями либо после автоматического синтеза, либо во время автоматического синтеза на ДНК синтезаторе. Первый способ широко известен и основан на использовании активированных производных красителей - сукцинимидных эфиров, нитрофениловых эфиров и т.д. Таким образом можно присоединить флуоресцентную метку к синтетическому олигонуклеотиду, содержащему аминогруппу. Другой способ основан на использовании фосфорамидитов цианиновых красителей и позволяет проводить флуоресцентное мечение олигонуклеотидов в процессе их синтеза. Помимо этого, для введения метки в данном случае не требуется наличие аминогруппы. Более того, аминогруппа может быть введена в состав олигонуклеотида независимо, наряду с флуоресцентной меткой. Последнее обстоятельство является очень важным для синтеза контрольных флуоресцентно меченных олигонуклеотидных проб.
Существует целый ряд фосфорамидитов красителей цианинового ряда. Описаны как гидрофобные, так и гидрофильные фосфорамидиты на основе индоцианинов с числом атомов в полиметиновой цепи от 3 до 7 [1-7]. Некоторые из этих соединений могут служить лишь терминаторами в олигонуклеотидном синтезе, другие позволяют продолжать синтез цепи после своего включения.
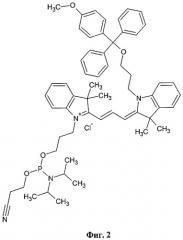
Из этого ряда соединений известен лишь один фосфорамидитный реагент (Фиг.2), позволяющий осуществлять маркирование олигонуклеотидов в процессе их автоматического синтеза индокарбоцианиновым красителем с приемлемыми для целей внутреннего контроля спектральными характеристиками. Этот продукт поставляется компанией Glen Research по лицензии корпорации Amersham. Данный фосфорамидит содержит индокарбоцианиновое ядро и две функциональные боковые цепи, присоединенные к атомам азота. Наличие защищенного 4-метокси-трифенилметильной (MMTr) группой гидроксипропильного фрагмента в структуре фосфорамидита позволяет, при необходимости, вводить флуорофор в произвольное положение олигонуклеотида (кроме 3' положения). В молекуле отсутствуют какие-либо гидрофильные заместители, которые могли бы увеличить растворимость красителя в воде. Деблокирование флуоресцентно меченных олигонуклеотидов, т.е. удаление защитных групп, после автоматического синтеза проводят в мягких условиях, чтобы избежать разрушения цианинового фрагмента.
Вышеуказанный фосфорамидит обладает двумя существенными недостатками, которые осложняют использование его для целей флуоресцентного мечения контрольных олигонуклеотидных проб. Во-первых, он содержит в своем составе MMTr защитную группу, которая не является стандартной для олигонуклеотидного синтеза. Это приводит к необходимости корректировки протокола синтеза и невозможности адекватной оценки степени включения флуоресцентной метки во время синтеза. Во-вторых, гидрофобный характер красителя приводит к повышенной склонности проб к самоассоциации, что негативно сказывается на результатах анализа.
В основу изобретения положена задача синтеза фосфорамидитов индокарбоцианиновых красителей, содержащих в своем составе гидрофильный заместитель и стандартную 4,4'-диметокси-трифенилметильную группу (DMTr), характеризующихся заданными спектральными характеристиками и позволяющих проводить флуоресцентное мечение в процессе автоматического синтеза олигонуклеотида как по 5' концу, так и в середине цепи.
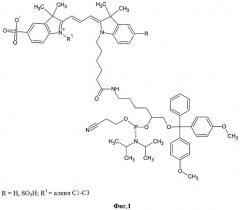
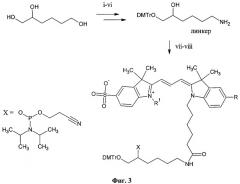
Задача решена тем, что гидрофильный сульфозамещенный индокарбоцианин присоединен к фунциональному линкеру, содержащему первичную гидроксильную группу, защищенную DMTr фрагментом (Фиг.3). Полученный конъюгат преобразуется в дальнейшем в реакционноспособный фосфорамидит. Для синтеза функционального линкера используется 1,2,6-гексантриол. Вицинальный диол селективно защищают изопропилиденовой группой, после чего производят трасформацию гидроксильной группы в положении 6 в амин через стадию азида. Первичный гидроксил диольной системы селективно защищают DMTr группой после удаления изопропилиденовой защиты. Синтез фосфорамидита после конъюгации красителя с функциональным линкером осуществляется с использованием 2-O-цианэтил-N,N,N',N'-тетраизопропилфосфорамидита в присутствии тетразолида пиридиния.
С использованием полученного гидрофильного сульфозамещенного фосфорамидита синтезируют флуоресцентные контрольные олигонуклеотиды, содержащие также аминогруппу для иммобилизации на чипах для генотипирования вируса гепатита С. Деблокирование модифицированных олигонуклеотидов проводят концентрированным водным аммиаком в мягких условиях.
Биочипы для идентификации генотипа и подтипа вируса гепатита С получают путем фотоинициируемой полимеризации микрокапель, содержащих необходимые мономеры и флуоресцентно меченный олигонуклеотид по методу, описанному ранее [8].
Пример 1
3,3,3',3'-Тетраметил-5-сульфо-1-этил-1'-N-[6-0-(4,4'-диметокстритил)-5-гидроксигексил]карбоксамидопентил индокарбоцианин
К раствору карбоцианина (R=H, R1=C2H5) (100 мг, 0.18 ммоль) и N-гидроксисукцинимида (30 мг, 0.27 ммоль) в безводном диметилформамиде (2 мл) добавили дициклогексилкарбодиимид (50 мг, 0.24 ммоль). Дополнительные порции дициклогексилкарбодиимида (20 мг, 0.097 ммоль) добвляли каждые 12 ч до полной конверсии. Ход реакции контролировали по обращено-фазной ТСХ. Затем смесь отфильтровали и добавили к ней раствор линкера (150 мг, 0.345 ммоль) и iPr2EtN (50 мкл, 0.287 ммоль) в диметилформамиде (300 мкл). Через 20 мин реакционная смесь была разбавлена этилацетатом (30 мл). Осадок конъюгата красителя был отделен центрифугированием и высушен. Выход 130 мг (73.9%). 1Н NMR (DMSO-d6, 400MHz) δ 8.35 (1Н, t, J13.5, β-СН), 6.86-7.95 (20Н, m, DMTr and dye aromatics), 6.51 (2H, d, J13.5, α,α'-CH), 4.00-4.20 (6H, m., CH3 CH 2N+, CH2 CH 2N+, CH 2NHCO), 3.73 (6H, s, OCH3), 3.50-3.51 (1H, m, CHOH), 2.70-3.05 (2H, m, CH 2ODMTr), 2.04 (2H, t, J7.16, CH 2CONH), 1.69 and 1.70 (12H, s, 4×CH3), 1.15-1.61 (15H, m, CH 3CH2). 13C NMR (DMSO-d6, 100MHz) δ 173.9, 173.6, 171.5, 157.9, 149.9, 145.9, 145.1, 141.8, 141.3, 140.6, 140.0, 135.9, 135.8, 129.6, 128.6, 127.7, 127.6, 126.4, 126.2, 125.2, 122.4, 119.9, 113.0, 111.5, 110.3, 102.7, 102.4, 84.9, 68.9, 67.6, 54.9, 48.9, 48.8, 47.4, 45.6, 43.7, 35.1, 33.5, 33.3, 29.2, 27.4, 27.3, 26.7, 25.7, 25.3, 25.2, 24.8, 24.4, 22.4, 12.2. MS (MALDI): m/z=968.4 (M+), рассч. для C58H69N3O8S 968.24.
Пример 2
3,3,3',3'-Тетраметил-5-сульфо-1-этил-1'-N-{6-O-[4,4'-диметокситритил]-5-O-[(N,N-диизопропиламино)(2-цианэтокси)фосфинил]гексил}карбоксамидопентил индокарбоцианин
Конъюгат красителя с линкером (60 мг, 62 мкмоль) растворили в 300 мкл безводного MeCN. К раствору добавили тетразол (22 мг, 310 мкмоль), сухой пиридин, (30 мл) и молекулярные сита (4Å; прибл. 5% по объему). Через 30 мин 2-цианэтил N,N,N',N'-тетраизопропилфосфорамидит (92 мкл, 310 мкмоль) был добавлен к смеси при интенсивном перемешивании. Фосфитилирование прошло за 15 мин по данным ТСХ. Затем в реакционную смесь был добавлен холодный насыщенный водный NaHCO3 (30 мл) и продукт экстрагирован хлористым метиленом (30 мл). Органический слой был высушен над Na2SO4, раствор сконцентрирован при пониженном давлении. К остатку добавили этилацетат (30 ml). Осадок продукта отделяли центрифугированием и высушивали. Выход 60 мг (86%). 1Н NMR (DMSO-d6, 400MHz), выборочные сигналы δ 8.36 (1H, t, J13.4, β-CН), 6.85-7.82 (20Н, m, DMTr и ароматика), 6.52 (2Н, d, J13.4, α,α'-CH), 4.10-4.20 (4Н, m., СН3 CH 2N+, CH2 CH 2N+), 3.73 (6Н, s, ОСН3), 2.04 (2Н, m, CH 2CONH), 1.69 and 1.70 (12Н, s, 4×СН3), 0.96-1.62 (15Н, m, СН 3СН2), 13С NMR (DMSO-d6, 100MHz) δ173.9, 173.7, 171.5, 158.0, 149.9, 146.0, 144.9, 141.8, 141.2, 140.6, 140.1, 135.7, 135.6, 129.6, 128.6, 127.7, 126.5, 126.2, 125.2, 122.4, 119.9, 113.0, 111.5, 110.3, 102.7, 102.4, 85.2, 65.6, 58.0, 57.8, 55.0, 54.8, 48.8, 45.7, 43.7, 42.5, 42.4, 35.1, 33.0, 32.7, 29.1, 27.4, 27.3, 26.7, 25.7, 25.5, 24.9, 24.3, 24.3, 24.2, 24.1, 22.6, 21.9, 21.7, 19.7, 19.7, 19.0, 12.1. 31P NMR (DMSO-d6, 162MHz) δ 150.2. MS (MALDI): m/z=1168.4 (M+), рассч. для C67Н86N5O9S 1168.47.
Пример 3
Синтез олигонуклеотидов
Олигонуклеотиды синтезировали на автоматическом ДНК синтезаторе ASM-102U (Biosset Ltd., Россия) или ABI 3400 (Applied Biosystems, Forster City, CA, USA) фосфорамидитным способом в масштабе 0.2-мкмоль.
Деблокирование флуоресцентно меченных олигонуклеотидов проводили в концентрированном водном аммиаке при 25°C в течение 8 ч.
Очистку олигонуклеотидов проводили с использованием обращено-фазовой хроматографии на колонке Hypersil (5 мм; 4.6×250 мм) в градиенте ацетонитроила (0-50%) в 0.05 М ТЕАА (рН 7.0). Скорость потока - 1 мл/мин.
Нуклеотидные последовательности контрольных олигонуклеотидов
GCC TGT CGA GC(C/T) GC олигонуклеотид для идентификации генотипа 1 ВГС
ТАС AGG CG(C/T) TG(C/T) CGC олигонуклеотид для идентификации генотипа 2 ВГС
AC TGA GAG CGA CAT СС олигонуклеотид для идентификации подтипа 1а ВГС
ATA A(A/G)G TCG СТС АСА GAG олигонуклеотид для идентификации подтипа lb ВГС
ТАС ACT CGC TGA CTG AGA олигонуклеотид для идентификации подтипа 2а ВГС
ТАС ACT CGC ТСА CTG AGA олигонуклеотид для идентификации подтипа 2b ВГС
Краткое описание фигур
Фиг.1. Новые фосфорамидитные реагенты.
Фиг.2. Коммерчески доступный фосфорамидитный реагент с приемлемыми для целей внутреннего контроля спектральными характеристиками.
Фиг.3. Синтез линкера и фосфорамидитов, R=Н, SO3H; R1=алкил С1-С3. Условия реакций: (i) ацетон, п-толуолсульфокислота, хлороформ, кипячение с азеотропной отгонкой воды; (ii) MsCl в пиридине, 25°C, 12 часов; (iii) LiN3 в ДМФА, 12 часов, 70°C; (iv) 80% АсОН, 15 мин, 60°C; (v) DMTrCl в пиридине, 25°C, 12 часов; (vi) Ph3P в пиридине; (vii) активированные эфиры красителей в ДМФА, 25°C, 2 часа; (viii) 2-цианэтил-N,N,N',N'-тетраизопропилфосфорамидит, тетразол, пиридин в MeCN, 25°С, 30 мин.
Литература
1. Квач М.В., Гонтарев СВ., Прохоренко И.А., Степанова И.А., Шменай В.В., Коршун В.А. Известия АН, Серия химическая, 2006, 154-158.
2. Anderson, Е.Synthesis of a Carbocyanine Phosophoramidite and its use in Oligonucleotide Labeling; International Conference on Nucleic Acid Medical Applications, Jan. 25-29, Cancun, Mexico, 1993.
3. Narayanan, N., Little, G., Lugade, A., Gibson, J., Prescott, C, Raghavachari, R., Reimen, K., Roemer, S., Sutter, S., Draney D. New NIR Dyes: Synthesis, Spectral Properties and Applications in DNA Analyses; Daehne, S.; Resch-Genger, U.,
Wolfbeis, О.S. Eds. Near-infrared Dyes for High Technology Applications, Kluwer Academic Publishers, 1998, 141-158.
4. Michael M.A., Farooqui F., Reddy M.P., Li H. Патент США 7,230,117, 2007.
5. Brush C.K., Anderson E.D. Патент США 5,556,959, 1996.
6. Brush C.K., Anderson E.D. Патент США 5,808,044, 1998.
7. Reddy M.P., Farooqui F., Michael M.A. Патент США 6,331,632, 2001.
8. Rubina A.Yu., Pan'kov S.V., Dementieva E.I., Pen'kov D.N., Butygin A.V., Vasiliskov V.A., Chudinov A.V., Mikheikin A.L., Mikhailovich V.M, Mirzabekov A.D. Anal. Biochem. 2004, V.325, 92-106.
1. Фосфорамидитные реагенты формулы где R=H, SO3Н; R1=алкил С1-С3.
2. Способ синтеза фосфорамидита формулы (1) по п.1, отличающийся тем, что способ осуществляют посредством реакции функционального аминолинкера формулы (2) с соответствующими активированными эфирами индокарбоцианиновых красителей, после чего полученные конъюгаты красителей формулы (3) подвергают взаимодействию с 2-цианэтил-N,N,N',N'-тетраизопропилфосфорамидитом, получая фосфорамидитный реагент формулы (1) по п.1 где R=H, SO3H; R1=алкил С1-С3, DMTr - диметокситритильная группа.