Способ количественного определения проникновения сукцината марганца тетрагидрата в инкубационные яйца кур
Иллюстрации
Показать всеИзобретение относится к птицеводству, а именно к способу количественного учета проникновения марганца через скорлупу в яйца при предынкубационной вакуумной обработке растворами сукцината марганца. Способ характеризуется тем, что инкубационные яйца контрольной и опытных партий подвергают обработке раствором Succ-Mn методом вакуумного подсоса. После обработки яйца инкубируют в инкубаторе в течение 24 часов. После чего отбирают от каждой партии яйца для дальнейших исследований, при этом из яиц берут пробы белка и желтка, которые помещают в термостат при температуре +60°С и высушивают до постоянной массы. Полученный таким образом биоматериал методом атомно-абсорбционной спектрометрии исследуют на содержание микроэлементов марганца, меди, цинка, железа, а также на содержание натрия пламенно-фотометрическим методом. На 19 сутки от каждой партии отбирают несколько яиц с развивающимися эмбрионами. Эмбрионы с желточным мешком, а затем и без него взвешивают, после чего каждый эмбрион без желточного мешка подвергают гомогенизации. Расчет количества микромолей Succ-Mn, прошедшего через скорлупу, определяют по формуле: , где: Х - количество Succ-Mn, тетрагидрата, проникшего в яйцо, мкмоль; 288,94 - молекулярная масса Succ-Mn (C8H10O8Mn), моль; T - концентрация марганца в опытной пробе, мкмоль/яйцо; K - концентрация марганца в контрольной пробе, мкмоль/яйцо; 54,94 - атомная масса марганца. Определяется структура и физико-химические свойства сукцината магния тетрагидрата, а также количественный учет его проникновения при однократной предынкубационной обработке яиц различными по концентрации растворами. 2 ил.
Реферат
Изобретение относится к птицеводству, а именно к способу количественного учета проникновения марганца через скорлупу в яйца при предынкубационной вакуумной обработке растворами сукцината марганца.
Известен способ глубинной обработки яиц перед инкубированием для предотвращения трансовариальной передачи микоплазмоза птиц (Воробьев С.А., Умняшкин В.Г., Сухарев Ю.Н., 1981; Бессарабов Б.Ф., Сушкова Н.К., 1990; Андреев Е.М., Желаннова М.Е., Тегина Е.Е. и др., 1992). Данный метод, взятый нами в качестве прототипа, заключается в том, что лекарственное вещество проникает через поры яичной скорлупы в инкубационные яйца по методу прямого перепада давления. Однако этот способ имеет ряд недостатков: не проводится количественный учет проникшего вещества в инкубационные яйца, распределение препарата в белке и желтке яиц, а также нетехнологичность обработки яиц.
Задачей настоящего изобретения является определение структуры и физико-химических свойств сукцината марганца (Succ-Mn) тетрагидрата, а также количественного учета проникновения его при однократной предынкубационой обработке яиц различными по концентрации растворами.
Технический результат заключается в том, что при проникновении через скорлупу Succ-Mn тетрагидрата изменяется соотношение микроэлементов в желтке и белке яйца, увеличивается масса марганца в желтке, повышается активность фермента аспартатаминотрансферазы (АсАТ), а активность щелочной фосфатазы снижается в гомогенате 19-сут эмбрионов и активируются различные процессы эмбриогенеза.
Технический результат достигается тем что способ количественного определения проникновения сукцината марганца тетрагидрата через скорлупу в инкубационное яйцо кур характеризуется тем, что инкубационные яйца контрольной и опытных партий подвергают обработке раствором Succ-Mn методом вакуумного подсоса, после обработки яйца инкубируют в инкубаторе в течение 24 часов, после чего отбирают от каждой партии яйца для дальнейших исследований, при этом из яиц берут пробы белка и желтка, которые помещают в термостат при температуре +60°С и высушивают до постоянной массы, а полученный таким образом биоматериал методом атомно-абсорбционной спектрометрии исследуют на содержание микроэлементов марганца, меди, цинка, железа, а также на содержание натрия пламенно-фотометрическим методом, на 19 сутки от каждой партии отбирают несколько яиц с развивающимися эмбрионами, при этом эмбрионы с желточным мешком, а затем и без него взвешивают, после чего каждый эмбрион без желточного мешка подвергают гомогенизации, расчет количества микромолей Succ-Mn, прошедшего через скорлупу определяют по формуле: где:
Х - количество Succ-Mn, тетрагидрата, проникшего в яйцо, мкмоль;
288,94 - молекулярная масса Succ-Mn (C8H10O8Mn), моль;
T - концентрация марганца в опытной пробе, мкмоль/яйцо;
K - концентрация марганца в контрольной пробе, мкмоль/яйцо;
54,94 - атомная масса марганца.
Биоматериалом исследований служат: желток, белок и скорлупа яиц, а также 19-сут эмбрионы, полученные из яиц, которые подверглись предынкубационной обработке различными по концентрации растворами Succ-Mn тетрагидрата методом вакуумного подсоса. После обработки яйца инкубируют при стандартных условиях в течение суток. По истечению 24 ч от каждой партии отбирают необходимое количество яиц для дальнейших исследований. Из яиц берут пробы белка и желтка, которые помещают в термостат при температуре +60ºС и высушивают до постоянной массы. На 19 сут инкубации от каждой партии отбирают несколько яиц с развившимися эмбрионами. Эмбрионы вместе с желточным мешком, а затем без него взвешивают. После этого каждый эмбрион без желточного мешка подвергается гомогенезированию.
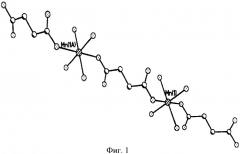
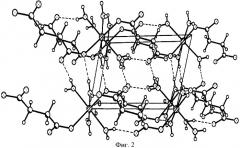
Пример 1. Рентгенодифракционным исследованием монокристалла размером 0,45×0,30×0,25 мм устанавливают структуру сукцината марганца тетрагидрата на дифрактометре CAD 4 Enraf-Nonius при 293 К. Структура расшифрована прямым методом и уточнена в анизотронном приближении. Установлено, что монокристалл сукцината марганца тетрагидрата кристаллизируется в рацемической (центросимметрической) пространственной группе. Структура олигомерная: {Mn2+·4H2O·2(-ООС-СН2-СН2-СОО-)}n, катион тетрагидрат Mn2+·4H2O координирует с двумя дианионами янтарной кислоты, образуя олигомерные цепочки (фиг.1, 2). Основные физико-химические показатели сукцината марганца тетрагидрата представлены в таблице 1.
Пример 2. Инкубационные яйца кур кросса СК-4 «Русь», полученные от контрольной и четырех опытных партий, подвергались обработке растворами Succ-Mn с различной концентрацией методом вакуумного подсоса. После обработки яйца инкубировали в инкубаторе при стандартных условиях в течение суток. По истечении 24 ч от каждой партии отбирали необходимое количество яиц для дальнейших исследований. Из яиц берут пробы белка и желтка, которые помещают в термостат при температуре +60°С и высушивают до постоянной массы. Полученный таким образом биоматериал методом атомно-абсорбционной спектрофотометрии (прибор AAA1N) исследуют на содержание микроэлементов: марганца, меди, цинка, железа по ГОСТу РФ 51637-2000, а также на содержание натрия по ГОСТу 30503-97 пламенно-фотометрическим методом на приборе ПАЖ-2.
На 19 сут инкубации от каждой партии отбирали несколько яиц с развившимися эмбрионами. Эмбрионы вместе с желточным мешком, а затем без него взвешивали. После этого каждый эмбрион без желточного мешка подвергался гомогенизированию. Микро- и макроэлементный состав желтка яиц после предынкубационой обработки представлен в таблице 2.
Пример 3. Способ по примеру 2. Микро- и макроэлементный состав белка яиц после предынкубационой обработки представлен в таблице 3. Как видно из таблицы 3, не во всех случаях отмечаются достоверные различия по содержанию Mn в белке яиц опытных групп по сравнению с контрольной. В белке яиц 1 опытной группы отмечается достоверно низкое (Р<0,05) содержание цинка по сравнению с контролем на 0,1007 мкмоль. Количество других микроэлементов в белке яиц 1 опытной группы, также занижено по сравнению с другими группами, но содержание натрия выше.
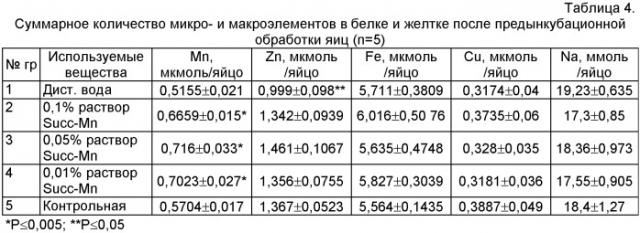
Пример 4. Способ по примеру 2. Суммарное количество микро- и макроэлементов в белке и желтке после предынкубационой обработки яиц представлено в таблице 4. Из данных таблицы 4 видно, что количество марганца во 2, 3 и 4 опытных группах достоверно (p<0,05) превышает на 0,0955, 0,1456 и 0,1319 мкмоль, соответственно, количество данного микроэлемента в контрольной группе. Также следует отметить достоверное (p<0,05) снижение количества цинка в 1 группе на 0,368 мкмоль, по сравнению с контролем. Количество других микро- и макроэлементов в желтке и белке опытных яиц существенно не изменяется по сравнению с показателями с контрольной.
Пример 5. Способ по примеру 2. Масса тела и значения биохимических показателей 19-сут эмбрионов представлены в таблице 5. Как видно из таблицы 5, масса тела эмбрионов той группы, в которой яйца были обработаны дистиллированной водой, самая низкая по сравнению с другими группами. Масса тела эмбрионов опытной группы, где в предынкубационной обработке использовали 0,01% раствор Succ-Mn, оказалась самой высокой. Активность фермента АлАТ в гомогенате эмбриона этой опытной группы была значительно ниже, а активность АсАТ самой высокой по сравнению с другими группами. В гомогенате эмбрионов, взятых из яиц обработанных растворами Succ-Mn, уровень активности щелочной фофтазазы достоверно (p<0,05) ниже по сравнению с контрольной и другими группами. У эмбрионов 6 группы в гомогенате отмечается достоверно низкое содержание D-глюкозы и мочевой кислоты по сравнению с контрольной группой.
Экспериментально доказано, что при предынкубационной обработке яиц растворами Succ-Mn тетрагидрата происходит проникновение через скорлупу в основном в желток яйца не только марганца, но и частиц органического лиганда - сукцината в составе Succ-Mn. Об этом свидетельствуют результаты количественного определения содержания марганца в желтке и белке опытных партий яиц, обработанных растворами Succ-Mn, а также исследования активности щелочной фосфатазы и других биохимических процессов в развивающихся эмбрионах, характерных отдельно только для сукцината и марганца.
Литература
1. Андреев Е.М., Желаннова М.Е., Тегина Е.Е, и др. Способ обработки яиц перед инкубированием. А.С. 1780667 СССР, МКИ А01К 41/00. - №-4917342/15; Заявл. 19.12.90; Опубл. 15.12.92, Бюл. №46.
2. Бессарабов Б.Ф., Сушкова Н.К. Влияние глубинного обеззараживания инкубационных яиц на естественную резистентность птицы. // Резервы повышения жизнеспособности и продуктивности птицы. - М., 1990. - С.62-64.
3. Воробьев С.А., Умняшкин В.Г., Сухарев Ю.Н. Глубинная обработка инкубационных яиц. - Проспект ВДНХ СССР, 1981. - с.4.
4. Тен А.Э. Рост и физиолого-биохимические показатели бройлеров под влиянием предынкубационой вакуумной обработки яиц растворами соединений марганца. Дисс. канд. биол. наук / Ульяновская гос. с.-х. академия. Ульяновск, 2000. - 111 с.
| Таблица 1 | |
| Физико-химические константы сукцината марганна тетрагидрата | |
| Физико-химические константы | Значение константы |
| 1. Внешний вид | Кристаллический порошок светло-розового цвета, кристаллы розового цвета |
| 2. Вкус | Кисловатый |
| 3. Запах | Без запаха |
| 4. Массовая доля марганца, % | 22,6 |
| 5. Температура плавления, °С | 103 |
| 6. Растворимость | В воде растворим 7,9·10-2 моль/л, в спирте, бензоле не растворим |
| 7. Практический выход, % | 80-83 |
| 8. Молярный коэффициент погашения (ελ), 0,1 М раствора Mn-Suc | 35,72 |
| 9. Длина волны, при которой происходит максимальное спектральное поглощение ОД М раствора сукцината марганца (λмакс), НМ | 226 |
| Таблица 2 | ||||||
| Микро- и макроэлементный состав желтка яиц после предынкубационной обработки (n=5) | ||||||
| № гр | Используемые вещества | Mn, мкмоль/яйцо | Zn, мкмоль /яйцо | Fe, мкмоль/ яйцо | Cu, мкмоль /яйцо | Na, ммоль/ яйцо |
| 1 | Дист. вода | 0,3816±0,017 | 1,020±0,10 04 | 4,869±0,4166 | 0,1687±0,017 | 6,014±0,65 |
| 2 | 0,1% раствор Succ-Mn | 0,510±0,0195* | 1,172±0,0943 | 4,686±0,4024 | 0,1906±0,02 | 5,358±0,61 |
| 3 | 0,05% раствор Succ-Mn | 0,4962±0,028* | 1,282±0,0781 | 4,420±0,3469 | 0,1615±0,017 | 6,614±0,48 |
| 4 | 0,01% раствор Succ-Mn | 0,502±0,026* | 1,230±0,0703 | 4,097±0,2914 | 0,1766±0,012 | 6,379±0,532 |
| 5 | Контрольная | 0,3968±0,309 | 1,213±0,0517 | 3,776±0,3897 | 0,1973±0,015 | 5,91±0,675 |
| *Р<0,05 |
| Таблица 3 | ||||||
| Микро- и макроэлементами состав белка яиц после предынкубационной обработки (n=5) | ||||||
| № гр | Используемые вещества | Mn, мкмоль/яйцо | Zn, мкмоль/яйцо | Fe, мкмоль/яйцо | Cu, мкмоль/яйцо | Na, ммоль/яйцо |
| 1 | Дист. вода | 0,1339±0,016 | 0,0534±0,001* | 1,176±0,2915 | 0,1486±0,018 | 13,21±0,833 |
| 2 | 0,1% раствор Succ-Mn | 0,1559±0,024 | 0,1578±0,025 | 1,401±0,2425 | 0,1829±0,026 | 11,9±0,951 |
| 3 | 0,05% раствор Succ-Mn | 0,219±0,018 | 0,1853±0,036 | 1,998±0,1523 | 0,1662±0,029 | 11,74±0,643 |
| 4 | 0,01% раствор Succ-Mn | 0,2001±0,017 | 0,1263±0,028 | 1,795±0,1845 | 0,1405±0,031 | 11,17±0,897 |
| 5 | Контрольная | 0,1751±0,017 | 0,1541±0,025 | 1,757±0,2231 | 0,1914±0,039 | 12,49±0,759 |
| *Р≤0,05 |
| Таблица 5 | ||||||
| Масса тела и значения биохимических показателей сут эмбрионов (n=10) | ||||||
| Показатели Группы цыплят | Масса тела эмбрионов, г | D-Глюкоза, ммоль/л | Мочевая кислота, ммоль/л | Активность, мкат/л | ||
| АлАТ | АсАТ | Щ.Ф. | ||||
| 1. Контроль | 42,06±3,121 | 44,94±15,22 | 78,15±4,455 | 10,4±1,44 | 10±0,414 | 29,95±3,182 |
| 2. Вода дист. | 32,56±0,805 | 39,24±16,55 | 85,43±11,83 | 11,73±1,358 | 11,23±0,2887 | 23,8±3,495 |
| 3. 0,1% раствор Succ-Mn | 41,4±1,553 | 63,28±2,52 | 86,5±31,3 | 10,3±1,039 | 10,23±2,082 | 1,53±1,32* |
| 4. 0,05% раствор Succ-Mn | 43,28±0,641 | 44,72±6,372 | 57,3±14,8 | 8,833±1,185 | 10,07±1,124 | 2,667±1,514* |
| 5. 0,01% раствор Succ-Mn | 46,88±1,804 | 37,55±6,97 | 57,33±12,63 | 7,967±1,266 | 12,07±0,757 | 3,433±3,707* |
| 6. 0,1% раствор MnCl2 | 35,4±5,805 | 18,99±17,72* | 46,87±6,25* | 8,6±0,8544 | 11,3±1,253 | 21,75±16,19 |
| 7. 0,05% раствор MnCl2 | 44,19±1,829 | 43,67±2,687 | 87,5±17,68 | 10,5±1,556 | 10,45±0,777 | 10,33±12,1 |
| 8. 0,01% раствор MnCl2 | 41,44±3,175 | 32,49±19,17 | 68,77±18,75 | 12,73±1,457 | 11,9±0,5 | 10,33±12,1 |
| *Р≤0,05 |
Способ количественного определения проникновения сукцината марганца тетрагидрата через скорлупу в инкубационное яйцо кур, характеризующийся тем, что инкубационные яйца контрольной и опытных партий подвергают обработке раствором Succ-Mn методом вакуумного подсоса, после обработки яйца инкубируют в инкубаторе в течение 24 ч, после чего отбирают от каждой партии яйца для дальнейших исследований, при этом из яиц берут пробы белка и желтка, которые помещают в термостат при температуре +60°С и высушивают до постоянной массы, а полученный таким образом биоматериал методом атомно-абсорбционной спектрометрии исследуют на содержание микроэлементов марганца, меди, цинка, железа, а также на содержание натрия пламенно-фотометрическим методом, на 19 сутки от каждой партии отбирают несколько яиц с развивающимися эмбрионами, при этом эмбрионы с желточным мешком, а затем и без него взвешивают, после чего каждый эмбрион без желточного мешка подвергают гомогенизации, расчет количества микромолей Succ-Mn, прошедшего через скорлупу определяют по формуле: ,где Х - количество Succ-Mn, тетрагидрата, проникшего в яйцо, мкмоль;288,94 - молекулярная масса Succ-Mn (C8H10O8Mn), моль;Т - концентрация марганца в опытной пробе, мкмоль/яйцо;K - концентрация марганца в контрольной пробе, мкмоль/яйцо;54,94 - атомная масса марганца.