Имплантат межпозвонковый неподвижный из изотропного пиролитического углерода
Иллюстрации
Показать всеИзобретение относится к медицинской технике. Имплантат изготовлен из монолитного изотропного пиролитического углерода, без легирующих элементов или легированного бором или кремнием, с пределом прочности на сжатие не менее 450 МПа. Изобретение обеспечивает повышение биосовместимости, биомеханических свойств, улучшение остеоинтеграции имплантата в костных тканях и уменьшение травматичности при проведении операции с помощью имплантатов из изотропного пиролитического углерода. 3 з.п. ф-лы, 2 табл., 2 ил.
Реферат
Изобретение относится к медицинской технике и может быть использовано в хирургии позвоночника для коррекции повреждений и нестабильности в телах позвонков человека во всех отделах позвоночника (шейном, грудном, поясничном).
При необратимых изменениях анатомической структуры межпозвонковых дисков или тел позвонков вследствие болезни или травмы прибегают к их протезированию. Для протезирования межпозвонковых дисков применяют неподвижные и подвижные имплантаты. Протезирование неподвижными имплантатами приводит к костному анкилозу между телами позвонков и межтеловому спондилодезу.
Неподвижный имплантат должен воссоздавать биомеханические свойства естественного диска. После установки имплантата восстанавливается высота дискового промежутка и увеличиваются межпозвонковые отверстия, что предупреждает компрессию корешков.
Кроме того, материалы, из которых изготавливают имплантаты, должны удовлетворять ряду требований:
- Отсутствие токсичности и коррозии;
- Прочность;
- Технологичность;
- Износостойкость;
- Близкие к кости физико-механические свойства.
Несоответствие материала хотя бы по одному из параметров снижает функциональную ценность имплантата и сроки его функционирования. Оптимальное сочетание характеристик материала обеспечивает биосовместимость (в т.ч. биомеханическую) имплантата.
Требования к имплантату неподвижному очень высокие. Он не должен ломаться. Кроме того, он должен быть биологически инертен для организма, не приводить к развитию воспалительного процесса.
Изначально для имплантатов неподвижных использовали аутокость в виде цилиндрических или прямоугольных имплантатов.
Bagby и Kuslich в 1992 г. вместо костных аутоимплантатов впервые использовали цилиндрический имплантат, наполняемый аутокостью (ВАК, Spine-Tech, Minneapolis, MN). Цилиндрический имплантат имел резьбу по окружности, которая позволяла его ввинчивать между замыкательными пластинками и образовывать жесткую фиксацию сразу же после операции. В дальнейшем были разработаны различные конструкции металлических имплантатов. В настоящее время широко используются следующие конструкции протезов [1]:
1. Металлические:
- Цилиндрические титановые кейджи с резьбой (ВАК, Spine-Tech, Minneapolis, MN; RTFC, Surgical Dynamics, Norwalk, CT; and Inter Fix, Sofamor Danek Group, Memphis, TN).
- Прямоугольные титановые кейджи (Harms titanium-mesh cage, DePuy-Acromed, Cleveland, OH).
- Имплантаты из пористого никелида титана [2,3].
Применение металлических имплантатов всегда осложняется гальваноэлектрическими явлениями, приводящими к металлозу окружающих тканей и коррозии деталей. Металлам свойственно вызывать резорбцию костной ткани.
2. Из пластика:
- Имплантаты, которые подвержены биологической резорбции. Они состоят из полиактиднокислотного (PLA) полимера, который распадается на СО2 и воду [4].
- PEEK - пластический полукристалл полиароматического линейного полимера. Он обладает остеокондуктивными и остеоиндуктивными свойствами, а также эластичностью, практически не отличающейся от эластичности человеческой кости [5].
- Прямоугольные кейджи из синтетического волокна (Brantigan carbon fiber cages, DePuy-Acromed, Cleveland, OH; and Femoral Ring Allograft-FRA Spacer, Synthes, Paoli, PA).
Имплантаты из пластика могут изнашиваться со временем и обладают «холодной текучестью» и старением, типичной для пластика, что приводит к деформации и разрушению имплантата. Кроме того, продукты износа полимерных материалов нередко вызывают злокачественные перерождения окружающих тканей.
3. Керамические имплантаты [5, 6], выбранные в качестве прототипа.
Для применения керамических имплантатов существуют серьезные ограничения. Естественная хрупкость керамики не позволяет сделать стенки керамических имплантатов менее 5 мм. Общепринятым недостатком этих имплантатов является слабая устойчивость к ударным нагрузкам. При прыжках, беге пациента, или при хирургических процедурах на имплантат воздействуют ударные нагрузки, вызывающие образование микротрещин в керамике, которые вырастают в процессе эксплуатации и могут вызвать разрушение имплантата.
Целью изобретения является повышение биосовместимости, биомеханических свойств, улучшение остеоинтеграции имплантата в костных тканях и уменьшение травматичности при проведении операции с помощью имплантатов из изотропного пиролитического углерода.
Достижение указанной цели обеспечивается тем, что:
- имплантат межпозвонковый неподвижный изготовлен из монолитного изотропного пиролитического углерода, без легирующих элементов или легированного бором или кремнием, с пределом прочности на сжатие не менее 450 МПа;
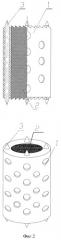
- внутренняя часть имплантата заполнена пористым углеродным материалом;
- пористый углеродный материал выполнен в виде пены на основе углеродного нанокомпозита;
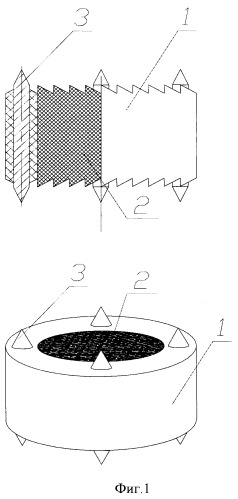
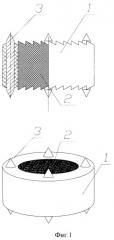
- имплантат имеет на каждом торце 4 шипа из титана.
Перечисленные отличия предлагаемого имплантата сообщают ему ряд важных преимуществ по сравнению с прототипом.
Развитие техники получения многочисленных видов углеродных материалов наряду с выявленной совместимостью с живой тканью привело к активизации исследований, разработке новых и композиционных материалов на основе углерода для медицины. К настоящему времени достоверно установлено, что углеродные материалы не имеют конкурентов по степени удовлетворения биохимических и физико-механических требований, предъявляемым к медицинским изделиям.
К этим требованиям относятся:
- отсутствие токсичности и канцерогенности;
- неизменность под воздействием биологических сред произвольной активности;
- отсутствие коррозионных явлений при контакте с живыми тканями;
- близость физико-механических свойств;
- отсутствие усталостных напряжений и, как следствие, долговечность имплантата;
- наличие у поверхности имплантата остеогенной активности;
- низкий износ в условиях трения и индифферентность продуктов износа, накапливающихся в лимфатических узлах;
- способность стимулировать рост тканей или регенерацию основной ткани;
- электропроводность, близкая к тканевой, без выделения ионов в окружающую среду;
- возможность получения поверхности практически любого класса чистоты и простого изготовления пористой структуры;
- безусловной и быстрой стерилизации любого вида.
Ни один из применяемых в настоящее время для эндопротезов и имплантатов металлов или видов керамики не способен выполнить эти требования.
Сродство углеродных материалов с биологическими тканями определяется не только низкой химической активностью, но и проявлением биоактивности, в результате которой поверхность углеродных материалов покрывается ориентированной и организованной пленкой белкового происхождения, аналогичной замещаемой ткани.
Скорость и ориентация осаждаемой пленки белкового происхождения зависят от поверхностных свойств углеродного материала. Например, поверхностная энергия изотропного пиролитического углерода составляет 50 эрг/см2, но в контакте с плазмой крови или лимфой резко снижается до 20-30 эрг/см2. Эта величина свободной поверхностной энергии наиболее выгодна для длительного контакта с биологическими средами.
Материалы, используемые для изготовления эндопротезов и имплантатов, по величине нормального электрохимического потенциала в плазме крови можно расположить в следующий ряд: стеклоуглерод (+0,329 мВ), платина (+0,332 мВ), золото (+0,334 мВ), пирографит (+0,344 мВ). Известно, что стеклоуглерод обладает аморфной структурой, а пирографит близок к монокристаллу. Можно сказать, что таким образом все углеродные материалы с различной структурой, имея нормальный электрохимический потенциал в пределах от +0,329 мВ до +0,344 мВ, т.е. сравнимый с этими показателями наиболее пассивных из всех элементов золота и платины. Углеродные материалы наиболее близки по электрохимическому потенциалу к биологической среде живого организма.
Как показали морфологические исследования, проведенные на кроликах в Московском научно-исследовательском институте глазных болезней им. Гемгольца с использованием прочного мелкодисперсного графита МПГ-6, синтактической углеродной пены, углеродного войлока Карботекстим-М и углеродной ткани ТГН-2М, все углеродные материалы в течение года не отторгались, не изменяли своей формы и обрастали соединительной пленкой белкового происхождения.
Поэтому по показателям биосовместимости, токсичности и коррозии углеродные материалы являются лучшими для использования в качестве имплантатов.
Изотропный пиролитический углерод имеет однородную, изотропную, мелкокристаллическую структуру. Изотропный пиролитический углерод благодаря своим уникальным свойствам (высокая плотность, прочность, износостойкость, биологическая совместимость с кровью и тканями организма) нашел применение в медицине. Из него изготавливают основные элементы искусственных клапанов сердца. К настоящему времени в мире изготовлены, поставлены и успешно функционируют сотни тысяч искусственных клапанов сердца. А это один из самых ответственных имплантатов человека. Сейчас проводятся работы по изготовлению из этого материала зубных имплантатов и элементов тазобедренных суставов.
Основные физико-механические и теплофизические свойства изотропного пиролитического углерода приведены в таблице 1.
Самый нагруженный у человека поясничный отдел позвоночника подвергается большим нагрузкам. Нагрузки варьируют от 400 Н в положении стоя до 7000 Н при подъеме тяжестей. Биомеханические исследования показали, что тело позвонка (без явлений остеопороза) в норме выдерживает нагрузку до 10000 Н. Физико-механические свойства изотропного пиролитического углерода наиболее близки к свойствам кости, как это показано в таблице 2. При этом нагрузка, которую может выдержать имплантат из изотропного пиролитического углерода, составляет более 30000 Н, что более чем в 3 раза выше максимальных физиологических нагрузок. Из таблицы видно, что физико-механические свойства титана на порядок выше свойств кости. Поэтому при одинаковых деформациях в титане и кости будут возникать различные напряженные состояния, что и является основной причиной расшатывания металлических имплантатов.
Использование изотропного пиролитического углерода для изготовления имплантатов позволит значительно повысить их биомеханические свойства.
Для улучшения остеоинтеграции на каждом торце имплантата имеется 4 шипа из титана, которые врезаются в костные ткани позвонков и обеспечивают первичную фиксацию имплантата. Вторичная и полная фиксация имплантата достигается за счет прорастания костной ткани в пористый углеродный материал, который в этом процессе служит матрицей.
По общепринятой методике установки имплантатов неподвижных их внутреннее пространство заполняют костным аутотрансплантатом для прорастания костной ткани и обеспечения межтелового спондилодеза. Аутотрансплантат берут у самого пациента из подвздошной кости или ребра, что приводит к дополнительной травматичности операции. При использовании имплантатов неподвижных из пиролитического углерода, заполненных пористым углеродным материалом, забирать аутотрансплантат у пациента не надо. Это позволяет уменьшить травматичность при проведении операции.
Еще одним из преимуществ изготовления имплантатов из изотропного пиролитического углерода является их технологичность и относительно низкая стоимость. Изотропный пиролитический углерод обрабатывается на токарных, фрезерных, сверлильных, шлифовальных и полировальных станках с помощью стандартных режущих инструментов. Мелкозернистая структура изотропного пиролитического углерода позволяет изготавливать изделия толщиной 0,8-1 мм с кромками 0,03 мм и получать поверхности 12-13 класса чистоты.
Изобретение поясняется чертежами. На фиг.1 изображен имплантат неподвижный для замены межпозвоночного диска, на фиг.2 имплантат неподвижный для замены одного или нескольких тел позвонков. Имплантат неподвижный состоит из втулки из изотропного пиролитического углерода 1, внутреннее пространство которой заполнено пористым углеродным материалом 2, например пеной на основе углеродного нанокомпозита. Имплантат имеет на каждом торце по четыре шипа 3 из титана.
Реализуют предлагаемое изобретение следующим образом.
Изотропный пиролитический углерод получается при пиролизе углеводородного сырья при высокой температуре путем отложения на внутренней поверхности цилиндрической графитовой подложки. После окончания процесса получения втулки изотропного пиролитического углерода путем механической обработки получается имплантат неподвижный со стержнями из титана на каждом торце. Внутренняя часть имплантата заполняется пористым углеродным материалом. Имплантат моется в специальном растворе в ультразвуковой ванне при температуре около 100°С. Затем имплантат упаковывается и стерилизуется или в потребительской таре, или непосредственно перед операцией любым методом.
Операция установки имплантата производится следующим образом.
Имплантаты могут быть внедрены с переднего или заднего доступов. Задний доступ используется при необходимости удаления остеофитов или грыжи межпозвонкового диска. В этих случаях имплантаты могут быть установлены с заднего доступа, при этом не надо делать дополнительный разрез в брюшной стенке (через живот).
Чаще всего имплантаты все-таки устанавливают через передний доступ к позвоночному столбу, разрез выполняется по переднебоковой стенке живота. Крупные кровеносные сосуды и органы аккуратно смещаются в сторону, удаляется нужный межпозвонковый диск или одно или несколько тел позвонков, а на это место устанавливается имплантат. Между сосудами и дисковым промежутком прокладывают гемостатическую губку, устанавливают дренаж. Рану послойно зашивают.
После установки имплантата хирург проводит контроль с помощью передвижного рентгеновского аппарата.
При изготовлении имплантатов из изотропного пиролитического углерода будут повышены биосовместимость, биомеханические свойства, улучшены остеоинтеграции имплантата в костных тканях и уменьшена травматичность при проведении операции.
1. Здеблик Т.А., Филлипс Ф.М. Интеркорпоральные клеточные изделия // Позвоночник. - 2003. - Авг.1; 28 (15 Приложение): с.2-7. (Zdeblick ТА., Phillips F.M. Interbody cage devices. Spine. 2003 Aug. 1; 28 (15 Suppl):S2-7).
2. Епифанцев А.Г. Хирургическое лечение спондилолистеза с использованием имплантатов из пористого никелида титана: Автореф. дис.… канд. мед. наук. - Кемерово, 1993. - 13 с.
3. Симонович А.Е. Применение имплантатов из пористого никелида титана в хирургии дегенеративных поражений поясничного отдела позвоночника // Хирургия позвоночника. - 2004. - №4. - С.8-17.
4. Ван Дайк М., Смит Т.Х., Бургер Е.Х., Вайсман П.И. Биорассасывающиеся клетки из поли-L-лактидной кислоты для поясничного интекорпорального спондилодеза: радиографический, гистологический и гистоморфометрический анализ в козах в течение 3-летнего наблюдения // Позвоночник. - 2002. - Дек. 1; 27 (23): 2706-14. (Van Dijk М., Smit Т.Н., Burger E.H., Wuisman P.I. Bioabsorbable poly-L-lactic acid cages for lumbar interbody fusion: three-year follow-up radiographic, histologic, and histomorphometric analysis in goats. Spine. 2002 Dec.1; 27(23):2706-14).
5. Чо Д., Лиау В., Ли В. и соавт. Предварительный опыт применения политеретеркетонового (PEEK) кейджа при лечении болезни шейного диска // Нейрохирургия. - 2002. - 51:1343-1350. (Cho D., Liau W., Lee W., et al. Preliminary experience using a polyetheretherketone (PEEK) cage in the treatment of cervical disk disease. Neurosurgery. 2002; 51:1343-1350).
6. Грунтовский Г.Х. Обоснование и клиническое применение керамических имплантатов при хирургическом лечении некоторых заболеваний и повреждений опорно-двигательного аппарата: Автореф. Дис.… докт.мед. наук. -X., 1988. - 28 с.
7. Грунтовский Г.Х. Первично-стабильный спондилодез эндопротезами из корундовой керамики у больных остеохондрозом поясничного отдела позвоночника // Остеохондроз позвоночника. - М., 1992. - С.18-23.
| Таблица 1 | ||
| Физико-механические и теплофизические свойства изотропного пиролитического углерода | ||
| № пп | Характеристика | Свойства |
| 1 | Плотность, кг/м3 | (1,80-2,10)×103 |
| 2 | Микротвердость, МПа | 1000-1500 |
| 3 | Предел прочности при изгибе, МПа | 300-360 |
| 4 | Предел прочности при сжатии, МПа | 450-600 |
| 5 | Коэффициент теплопроводности, Вт/м×°К | 23-25 |
| 6 | Коэффициент теплового линейного расширения, °К-1 (293-473°К) | 5,5×10-6 |
| 7 | Удельное электросопротивление, Омхм | (1,4-1,5)×10-5 |
| Таблица 2 | ||||
| Физико-механические свойства материалов | ||||
| Модуль упругости, ГПа | Плотность, кг/м3 | Предел прочности, МПа | Коэффициент Пуассона | Материал |
| 110 | 4,5×103 | 600 | 0,32 | Титан |
| 350 | 3,99×103 | 500 | 0,3 | Керамика |
| 15 | 2,4×103 | 100 | 0,3 | Костная ткань |
| 20-23 | (1,8-2,1)×l03 | 450 | 0,3 | Изотропный пиролитический углерод |
1. Имплантат межпозвонковый неподвижной конструкции для замены межпозвонкового диска или одного или нескольких тел позвонков, отличающийся тем, что он изготовлен из монолитного изотропного пиролитического углерода без легирующих элементов или легированного бором или кремнием, с пределом прочности на сжатие не менее 450 МПа.
2. Имплантат по п.1, отличающийся тем, что внутренняя часть имплантата заполнена пористым углеродным материалом.
3. Имплантат по п.2, отличающийся тем, что пористый углеродный материал выполнен в виде пены на основе углеродного нанокомпозита.
4. Имплантат по п.1, отличающийся тем, что имплантат имеет на каждом торце по 4 шипа из титана.