Способ локального разрушения опухолей с помощью свч-нагрева магнитных наночастиц
Иллюстрации
Показать всеИзобретение относится к медицине, онкологии. Используют магнитоуправляемые наночастицы из магнетита Fe3O4 в физиологическом растворе. Максимальный размер наночастиц не превышает 100 нм, частицы имеют покрытие из биологически совместимого материала. Создают пространственное локальное постоянное магнитное поле, имеющее конфигурацию, соизмеримую по объему с опухолью, и имеющее напряженность, не превышающую 0.1 Тл. После достижения максимальной концентрации наночастиц в опухоли ее облучают импульсным СВЧ-излучением с частотой в диапазоне 2.4 ГГц-10 ГГц. Способ позволяет локально разрушать глубоко расположенные новообразования при минимальном разрушении окружающих здоровых тканей, позволяет проводить операцию без общей анестезии. 4 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к медицине и предназначено для селективной деструкции раковых клеток опухолевой ткани.
Известен способ близкофокусной рентгенотерапии с суммарной очаговой дозой 100-120 Гр и дистанционной гамма-терапии при лучевом разрушения злокачественных клеток с суммарной очаговой дозой 30-40 Гр (см. Ш.Х.Ганцев. Онкология, М.: Медицинское информационное агентство. 2004, с.190-204; Stephen J., Withrow Е., MacEwen G. Smal animal clinical oncology - 2001, p.305-308).
Однако данный способ, несмотря на распространенность, обладает следующими недостатками. При лечении некоторых типов злокачественных новообразований, например меланомы, с помощью дистанционной гамма-терапии даже в сочетании с иммунотерапией, как показывает опыт, приводит к 75-90% рецидиву опухолей, а через 2-6 месяцев возникают метастазы.
Известен нейтрон-захватный способ селективного разрушения меланомы (см. В.Н.Митин, Н.Г.Козловская, A.M.Арнопольская Нейтрон-захватная терапия опухолей ротовой полости у собак. Всероссийский ветеринарный журнал. 2006. №1, с.9-10).
Способ включает введение в кровь внутривенно L-борфенилаланина, который селективно накапливается в определенной опухоли - меланоме, так как L-фенилаланин является незаменимой аминокислотой, из которой вырабатывается меланин, образующий меланоциты, содержащиеся в клетках меланомы. Таким образом, происходит селективное накопление L-борфенилаланина в клетках меланомы. При облучении пространственной зоны, соизмеримой с опухолью, содержащей L-борфенилаланин, пучком медленных нейтронов, получаемых по нейтроноводу из ядерного реактора, происходит разрушение клеток меланомы вследствие индуцированного вторичного локального излучения бора.
Однако данный способ обладает следующими недостатками.
1. Радиационное облучение пациентов, которое лишь частично уменьшается при использовании литиевого защитного фартука.
2. Сложная и очень дорогая установка, включающая компактный ядерный реактор, требующий для обслуживания квалифицированных специалистов немедицинского профиля, в частности физиков-ядерщиков.
3. Длительное время облучения пациентов в течение часа при мониторинге сердечно-сосудистой системы.
4. Применение общей анестезии.
Известен способ фотодинамического разрушения опухолей, включающий внутривенное введение фотосенсибилизатора и облучение опухоли непрерывным лазерным излучением с длиной волны, совпадающей с полосой поглощения фотосенсибилизатора (см. Photodynamic therapy / Ed.T.J.Dougherty / J.Clin.Laser Med Surg. 1996, Vol.14, P.219-348; Патент РФ №2184578, МПК A61N 5/06). Селективный фотодинамический механизм разрушения раковых клеток основан на более высокой плотности (контрастности) накопления фотосенсибилизатора в опухолевых клетках по сравнению со здоровыми клетками, что связано с большей плотностью кровеносных сосудов в опухоли по сравнению со здоровой биотканью.
Однако этот контраст для различных опухолей не превышает двух-трех раз. При поглощении лазерного излучения фотосенсибилизатором молекулы красителя переходят в возбужденное электронное состояние и при столкновении с молекулами кислорода, растворенного в биоткани, переводят его из невозбужденного в возбужденное электронное синглетное состояние, с типичным временем жизни несколько микросекунд. За это время молекулы синглетного кислорода, пройдя характерный путь, соизмеримый с размерами клеток при взаимодействии с плазматической мембраной клетки, повреждают ее, и клетка гибнет вследствие некроза. Таким образом, разрушение клеток происходит лишь во время воздействия лазерного излучения в пространственной области облучения лазерным пучком.
Фотодинамический способ при разрушении раковых клеток имеет ряд недостатков. Используемые в практике фотосенсибилизаторы - фталационины, порфирины, хлорины имеют полосы поглощения фотосенсибилизаторов в ультрафиолетовой или видимой области спектра, и используемые лазеры не могут эффективно проникать на глубину, не превышающую нескольких миллиметров. Кроме того, фотодинамический способ обладает малой контрастностью накопления фотосенсибилизаторов в раковых клетках.
Известен способ лазерного фототермолиза опухолей на основе плазмонно-резонансных золотых наночастиц (см. Р.K.Jain, I.Н.El-Sayed, М.A.El-Sayed. Au nanoparticles target cancer. Nanotoday, 2007, v.2, №1, p.18-29). Способ включает локальное введение золотых плазмонно-резонансных наночастиц в область опухоли и облучение лазерным излучением с длиной волны, совпадающей с полосой поглощения наночастицами и вызывающей локальный нагрев наночастиц и, соответственно, некроз раковых клеток.
Однако данный способ имеет ряд недостатков, связанных трудностью доставки лазерного излучения в опухоль, находящуюся не на поверхности тела. Даже при выборе длины волны лазерного излучения в ближней ИК-области, соответствующей области прозрачности биотканей, где наблюдается минимальное поглощение белками, жирами, клетками крови, сильный эффект рассеяния света приводит к невозможности эффективного облучения ткани на глубине более нескольких миллиметров.
Известен способ разрушения раковых клеток при СВЧ-облучении (см. патент РФ №2174021, МПК A61N 5/02). Перед воздействием гипертермии осуществляют воздействие на опухоль СВЧ-излучения с длиной волны 1,3-2 см и выявляют значение резонансной частоты поглощения опухоли. После чего осуществляют аналогичное воздействие на пограничные с опухолью здоровые ткани и выявляют значение резонансной частоты поглощения этих здоровых тканей. Одновременно с гипертермией осуществляют контроль значений резонансных частот поглощения опухоли и здоровых тканей и при сближении значений резонансных частот поглощения опухоли и здоровых тканей судят об эффективности лечения. Способ позволяет повысить эффективность лечения опухолей методом СВЧ-гипертермии.
Основным недостатком данного способа является малая глубина проникновения в биоткань, составляющая несколько мм, вследствие сильного поглощения СВЧ-излучения с длиной волны 1,3-2 см молекулами воды.
Известен способ деструкции раковых клеток опухолевой ткани (см. патент РФ №2106159, МПК A61N 5/02, A61N 5/06). Сущность изобретения включает введение в область локализации опухоли ферромагнитных частиц с последующим индукционным локальным нагревом в диапазоне температур от 42°C до 45°C в течение времени, определяемого видом опухоли, ее размерами, локализацией и типом ферромагнитных частиц, выбранных для индукционного нагрева, при этом нагрев производят только в моменты уменьшения кровенаполнения ткани, т.е. в моменты выдоха и диастолы сердца пациента. Диапазон нагрева контролируют по СВЧ глубинному термометру, а нагрев ведут автоматически с помощью компьютера в режиме биоуправления по алгоритмам математической модели колебаний теплопроводности и теплоемкости ткани, гистерезиса нагрева и теплоотвода.
Основными недостатками данного способа являются малая локализация магнитных частиц в опухоли и трудности поддержания фиксированной температуры в различных пространственных областях опухоли.
Известен способ разрушения раковых опухолей при использовании магнитных наночастиц (Presentation of a new magnetic field therapy system for the treatment of human solid tumors with magnetic fluid hyperthermia. Andreas Jordan, Regina Scholz, Klaus Maier-Hau, Manfred Johannsen, Peter Wust, Jacek Nadobny, Hermann Schirra, Helmut Schmidt, Serdar Deger, Stefan Loening, Wolfgang Lanksch, Roland Felix. Journal of Magnetism and Magnetic Materials 225 (2001) 118-126).
Разрушение раковых клеток основано на термолизе магнитных наночастиц, вводимых в опухоль, и индукционного их нагрева в переменном магнитном поле на частотах 50-100 кГц. Однако данный способ не позволяет локально разрушить раковые клетки и требует мощных электромагнитов с токами в десятки кА на относительно высоких частотах. Кроме того, мощные переменные магнитные поля могут оказывать влияние на процессы движения и диффузии ионов через мембраны клеток, а также порождать индукционные переменные электрические поля, влияющие на работу нейронных сетей в организме человека.
Наиболее близким к заявляемому является способ проведения магнитной терапии злокачественных образований (см. патент РФ №2295933, МПК A61F 7/00, A61K 50/00). Изобретение относится к физике магнитных материалов и медицине и касается гипертермической электромагнитной терапии злокачественных новообразований. Магнитная терапия злокачественных новообразований осуществляется путем введения внутрь опухоли частиц с последующим воздействием - нагревом энергией электромагнитного поля. В качестве материала частиц используют вещество с большой величиной магнитокалорического эффекта и имеющее температуру магнитного фазового перехода, лежащую вблизи температуры человеческого тела, и выбранное из группы, включающей редкоземельные, переходные и благородные металлы, а также их сплавы и интерметаллические соединения. В качестве магнитного материала используют частицы сплава железо-родий, в частности Fe0,49Rh0,51. Способ позволяет повысить эффективность лечения злокачественных новообразований.
Однако данный способ обладает существенным недостатком, связанным с нагревом не только магнитных частиц, но и всех клеток, находящихся в области введения магнитных частиц, и сильной пространственной неоднородностью температуры нагрева как внутри опухоли, так и здоровых тканей.
Задачей настоящего изобретения является локальное разрушение глубоко расположенных в биотканях злокачественных новообразований при импульсном СВЧ-нагреве и минимальном разрушении окружающих здоровых клеток биоткани.
Технический результат заключается в селективном повреждении злокачественных новообразований при проведении операции без общей анестезии.
Поставленная задача решается тем, что в способе разрушения опухолей, включающем введение раствора магнитных частиц и облучение опухоли электромагнитным излучением, согласно решению в качестве магнитных частиц используют магнитоуправляемые наночастицы из магнетита Fe3O4 в физиологическом растворе при концентрации наночастиц, не превышающей 1010/см3, создают пространственное локальное постоянное магнитное поле, имеющее конфигурацию, соизмеримую по объему с опухолью, и имеющее напряженность, не превышающую 0.1 Тл, через время, соответствующее достижению максимальной концентрации наночастиц в опухоли, облучают опухоль с магнитными наночастицами импульсным СВЧ-излучением с частотой в диапазоне 2.4 ГГц-10 ГГц, при этом максимальный размер наночастиц не превышает 100 нм, частицы имеют покрытие из биологически совместимого материала. Наночастицы вводят внутривенно. Наночастицы вводят путем обкалывания опухоли. В качестве материала покрытия наночастиц выбран полиэтиленгликоль. Длительность импульсов СВЧ-излучения выбирают в диапазоне от 100 мкс до 100 нс, скважность не менее 3 при плотности СВЧ-энергии 100-200 Дж/см2.
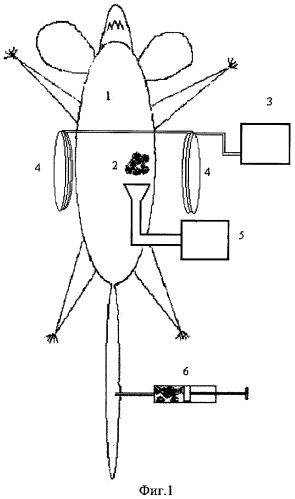
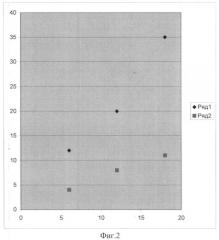
Изобретение поясняется чертежами, где на фиг.1 представлена блок-схема установки для локального разрушения опухолей с помощью импульсного СВЧ-нагрева магнитных наночастиц, локализованных в опухоли, с помощью внешнего магнитного поля с пространственной конфигурацией, соизмеримой с раковой опухолью. На фиг.2 представлена экспериментально измеренная сравнительная зависимость температуры (°C) суспензии магнитных наночастиц (сферы диаметром 80 нм из магнитита Fe3O4) при концентрации 109/мл, растворенных в физрастворе (ромб), от уровня СВЧ-энергии (кДж) и изменения температуры физраствора без магнитных наночастиц (квадрат). На фиг.3 показан эффект локализации магнитных микрокапсул, растворенных в физрастворе при воздействии постоянного магнитного поля напряженностью 0.02 Тл., измеренный с помощью оптического низко-когерентного томографа ОСТ-3 "Carl Zeiss" (зондирующее оптическое излучение томографа с длиной волны 820 нм); на фиг.3(а) показано двумерное изображение кюветы толщиной 1 мм с суспензией магнитных микрокапсул в физрастворе (диаметром 10 микрон с оболочкой из наночастиц магнитита) без магнитного поля; на фиг.3(б) - кювета с магнитными микрокапсулами при воздействии постоянного поперечного магнитного поля напряженностью 0.02 Тесла (магнит на расстоянии 1 см от нижней поверхности через 18 секунд).
На фиг.4 показана динамика локализации магнитных микрокапсул, растворенных в физрастворе, при воздействии поперечного магнитного поля 0.02 Тс на основе интенсивности рассеяния зондирующего лазерного пучка (длина волны 633 нм): а - без магнитного поля, б - через 10 секунд воздействия магнитного поля, в - через 20 секунд воздействия магнитного поля, когда практически все микрокапсулы локализованы у стенки кюветы, где находился магнит (размеры кюветы: диаметр 10 мм). При замене физраствора на глицерин характерные времена диффузии и пространственной локализации магнитных наночастиц увеличиваются до часа.
Позициями на чертежах обозначены: 1 - пациент (лабораторная крыса), 2 - пространственная локализация опухоли, диагностируемая с помощью, например, магниторезонансного томографа; 3 - блок питания электромагнита; 4 - устройство, создающего пространственно управляемое локальное магнитное поле (типа колец Гельмгольца), соизмеримое по размеру с опухолью; 5 - импульсный СВЧ-генератор с облучающей антенной, 6 - шцриц с магнитными наночастицами, растворенными в физрастворе, вводимые в вену.
Способ осуществляется следующим образом: пациенту вводится в вену физиологический раствор с магнитными наночастицами. Одновременно включается постоянное магнитное поле с пространственной конфигурацией, соизмеримой с опухолью. Через время, соответствующее максимальному накоплению магнитных наночастиц в опухоли (оценки показывают, что в зависимости от типа опухоли типичное время накопления наночастиц составляет не более часа), опухоль облучают импульсным СВЧ электромагнитным излучением. Длительность импульсов устанавливают от 100 мкс до 100 нс и скважностью не менее 3-х с помощью импульсного генератора с рупорной антенной, создающей поле, совпадающее с поперечным сечением опухоли. Параметры длительности СВЧ-импульсов и скважности выбираются из соображения локального нагрева магнитных наночастиц, при котором будут повреждаться мембраны клеток, находящихся в пределах нескольких микрон от наночастиц. Динамика нагрева наночастиц и пространственного распределения температуры исследовалась как в эксперименте, так и моделировалась на основе поглощения наночастицами импульсного электромагнитного излучения оптического диапазона (Лазерный фототермолиз биотканей с использованием плазмонно-резонансных наночастиц. Максимова И.Л., Акчурин Г.Г., Терентюк Г.С, Хлебцов Б.Н., Акчурин Г.Г. мл., Ермолаев И.А., Скапцов А.А., Ревзина Е.М., Тучин В.В, Хлебцов Н.Г. Квантовая электроника, 2008, т.38, №6, с.536-542). Необходимая плотность СВЧ-энергии для нагрева наночастиц установлена из измерений на фантомах биотканей и измерений температуры с помощью тепловизора.
Верхняя граница диапазона частот воздействующего СВЧ электромагнитного излучения связана с глубиной проникновения излучения в биоткани, которая в основном определяется спектральным коэффициентом поглощения воды и, соответственно, определяет эффективность нагрева магнитных наночастиц в биотканях. Как показали проведенные измерения эффективной глубины нагрева слоя воды от частоты, при зондировании СВЧ-излучением на частоте 10 ГГц при толщине образца 5 мм 80% СВЧ-энергии от вводимой поглощается, а на частоте 2,4 ГГц эффективная глубина поглощения может достигать более 10 см в зависимости от типа биоткани, что и определяет выбранный СВЧ-диапазон воздействия для предлагаемого способа СВЧ-термолиза с помощью магнитных наночастиц в зависимости от вида опухоли и глубины ее положения. Магнитные наночастицы синтезируются определенного размера, который определяется возможностью их диффузии через сосудистую кроветворную систему через фенестрированные артериальные капилляры, а также возможностью вывода наночастиц из организма через фильтрующие системы почек.
1. Способ разрушения опухолей, включающий введение раствора магнитных частиц и облучение опухоли электромагнитным излучением, отличающийся тем, что в качестве магнитных частиц используют магнитоуправляемые наночастицы из магнетита Fe3O4 в физиологическом растворе при концентрации наночастиц, не превышающей 1010/см3, создают пространственное локальное постоянное магнитное поле, имеющее конфигурацию, соизмеримую по объему с опухолью и имеющее напряженность, не превышающую 0,1 Тл, через время, соответствующее достижению максимальной концентрации наночастиц в опухоли, облучают опухоль с магнитными наночастицами импульсным СВЧ-излучением с частотой в диапазоне 2,4-10 ГГц, при этом максимальный размер наночастиц не превышает 100 нм, частицы имеют покрытие из биологически совместимого материала.
2. Способ по п.1, отличающийся тем, что наночастицы вводят внутривенно.
3. Способ по п.1, отличающийся тем, что наночастицы вводят путем обкалывания опухоли.
4. Способ по п.1, отличающийся тем, что в качестве материала покрытия наночастиц выбран полиэтиленгликоль.
5. Способ по п.1, отличающийся тем, что длительность импульсов СВЧ-излучения выбирают в диапазоне от 100 мкс до 100 нс, скважность не менее 3 при плотности СВЧ-энергии 100-200 Дж/см2.