Производные арилсульфонилстильбена для лечения бессонницы и связанных с ней расстройств
Иллюстрации
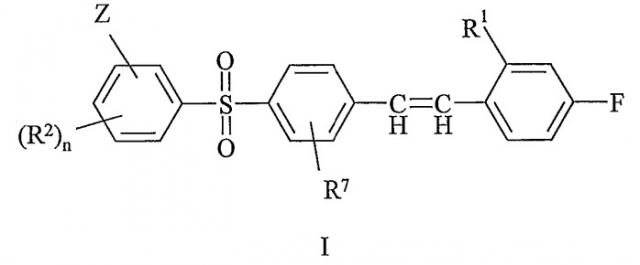
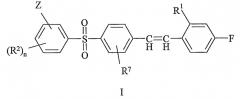
Показать всеИзобретение относится к новым соединениям формулы I
или к его фармацевтически приемлемым солям, где n является 0 или 1; R1 обозначает Н или F; R2 обозначает С1-4алкил; R7 обозначает Н или С1-4алкил; и Z обозначает гидроксиС1-6алкил или C1-6балкоксикарбонил, или 5- или 6-членное гетероароматическое кольцо, которое относится к ароматическим кольцам, имеющим указанное число атомов, из которых, по меньшей мере, один является N, О или S, а остальные являются атомами углерода, а также которое необязательно имеет метальную замещающую группу. Изобретение также относится к фармацевтической композиции, к применению соединений, а также к способу получения соединений формулы I. Технический результат - получение новых биологически активных соединений, обладающих активностью антагонистов рецептора 5-НТ2А. 4 н. и 5 з.п. ф-лы.
Реферат
Данное изобретение относится к классу сульфонильных производных, которые воздействуют на серотониновые (также известные как 5-гидрокситриптаминовые) или 5-HT-рецепторы. Более конкретно, данное изобретение относится к арилсульфонилстильбенам и их производным. Эти соединения являются сильнодействующими и селективными антагонистами рецептора 5-HT2A человеческого организма и поэтому пригодны в качестве фармацевтических средств, особенно для лечения и/или предотвращения неблагоприятных состояний центральной нервной системы, включая нарушения сна, такие как бессонница, психотические расстройства, такие как шизофрения, и психиатрические расстройства, такие как состояние тревоги.
Соединения, предлагаемые в данном изобретении, обычно проявляют более эффективное связывание с рецептором 5-HT2A человеческого организма по сравнению с другими рецепторами человеческого организма, такими как D2, 5HT2C и IKr. Вследствие этого можно ожидать, что они будут вызывать меньше побочных эффектов по сравнению с соединениями, которые не ограничены в своем связывающем сродстве с такими рецепторами. В частности, данные соединения оказывают меньшее влияние на рецепторы IKr, и имеет место отделение желаемого эффекта от побочных эффектов, таких как кардиологические эффекты.
Посредством того преимущества соединений, предлагаемых в данном изобретении, что они проявляют сильную активность в качестве антагониста человеческого рецептора 5-HT2A, данные соединения эффективны при лечении неврологических состояний, включая нарушения сна, такие как бессонница, психотические расстройства, такие как шизофрения, а также депрессию, состояние тревоги, паническое расстройство, обсессивно-компульсивное расстройство, боли, расстройства, связанные с приемом пищи, такие как анорексия (anorexia nervosa), и зависимость или острый токсический эффект, обусловленные наркотическими средствами, такими как ЛСД или МДМА; также они действуют положительным образом при урегулировании экстрапирамидных симптомов, связанных с приемом нейролептических средств. Они могут быть, кроме того, эффективны в отношении снижения внутриглазного давления и могут также эффективно использоваться для устранения симптомов, вызванных менопаузой, в частности приливов крови (см. Waldinger et al, Maturitas, 2000, 36, 165-8).
Различные классы соединений, содержащие, помимо прочего, сульфонильную часть, описаны в WO 01/74797, WO 2004/101518, WO 2005/047246, WO 00/43362, WO 96/35666, EP-A-0261688, EP-0304888 и патентах США 4218455 и 4128552, DE-A-3901735 и в Fletcher et al, J. Med. Chem., 2002, 45, 492-503. Ни в одной из этих публикаций, однако, не раскрывается и не предлагается особый класс соединений, представленный в данном изобретении.
Эти соединения по данному изобретению являются сильнодействующими и селективными антагонистами рецептора 5-HT2A, соответственно имеющими сродство к связыванию человеческого рецептора 5-HT2A (Ki) 100 нМ или менее, обычно 50 нМ или менее и предпочтительно 10 нМ или менее. Соединения, предлагаемые в данном изобретении, могут обладать, по меньшей мере, 10-кратным селективным сродством, обычно, по меньшей мере, 20-кратным селективным сродством и предпочтительно, по меньшей мере, 50-кратным селективным сродством для человеческого рецептора 5-HT2A по отношению к человеческому рецептору допамина D2 и/или человеческим рецепторам IKr и/или 5-HT2c. Предпочтительные соединения проявляют, по меньшей мере, 100-кратную селективность по отношению к человеческому рецептору 5-HT2c
Данное изобретение включает соединение формулы I:
или его фармацевтически приемлемые соль или гидрат, где:
n является 0 или 1;
R1 обозначает H или F;
R2 обозначает галоген, CN, CONH2, C1-4-алкил или C1-4-алкокси;
R7 обозначает H или C1-4-алкил; и
Z обозначает гидроксиС1-6алкил или C1-6алкоксикарбонил или 5- или 6-членное гетероароматическое кольцо, которое необязательно имеет метильную замещающую группу.
Использованное здесь выражение «C1-халкил», где x является целым числом больше 1, относится к алкильным группам с неразветвленной цепью и с разветвленной цепью, в которых число конституэнтных атомов углерода находится в интервале от 1 до x. Характерными алкильными группами являются метил, этил, н-пропил, изопропил и трет-бутил. Производные выражения, такие как «гидроксиС1-6алкил» и «C1-6алкокси», должны истолковываться аналогичным образом.
Используемый здесь термин «галоген» включает в себя фтор, хлор, бром и йод, из которых предпочтительны фтор и хлор, а фтор особенно предпочтителен.
Используемый здесь термин «гетероароматический» относится к ароматическим кольцам, имеющим указанное число атомов, из которых, по меньшей мере, один является N, O или S, а остальные являются атомами углерода. В случае 6-членных гетероароматических колец один, два или три (предпочтительно один или два) атома кольца являются атомами азота. В случае 5-членных гетероароматических колец один, два, три или четыре атома кольца выбраны из N, O и S с тем условием, что не более чем один атом кольца является O или S.
Для использования в медицине соединения формулы I могут быть в виде фармацевтически приемлемых солей. Другие соли, тем не менее, могут быть пригодны для получения соединений формулы I или их фармацевтически приемлемых солей. Подходящие фармацевтически приемлемые соли соединений по данному изобретению включают кислотно-аддитивные соли, которые могут быть образованы смешиванием раствора соединения по данному изобретению с раствором фармацевтически приемлемой кислоты, такой как соляная кислота, серная кислота, метансульфоновая кислота, бензолсульфоновая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, щавелевая кислота, лимонная кислота, винная кислота, угольная кислота или фосфорная кислота. В качестве альтернативы в том случае, если соединение по данному изобретению содержит кислый компонент, соль, пригодная для фармацевтических целей, может быть образована нейтрализацией указанного кислого компонента подходящим основанием. Примеры образованных при этом солей, пригодных для фармацевтических целей, включают соли щелочного металла, такие как соли натрия или калия; соли аммония; соли щелочноземельных металлов, такие как соли кальция или магния; и соли, образованные при использовании подходящих органических оснований, такие как соли амина (включая соли пиридиния) и соли четвертичного аммония.
Если соединения в соответствии с данным изобретением имеют один или несколько асимметрических центров, то они могут соответственно существовать в виде энантиомеров. Если соединения в соответствии с данным изобретением имеют два или более асимметрических центра, то они могут в дополнение к этому существовать в виде диастереоизомеров. Следует принимать во внимание, что все такие изомеры и их смеси в любой пропорции входят в объем данного изобретения.
В формуле I R1 обозначает H или F. В отдельных вариантах осуществления R1 обозначает H.
В формуле I n является 0 или 1. В отдельных вариантах осуществления n является 0. В случае наличия группы R2 она может быть присоединена в любом приемлемом положении кольца, однако предпочтительно в орто- или мета-положении по отношению к сульфоновому компоненту, наиболее предпочтительно в орто-положении. Группы, подходящие в качестве R2, включают галоген (в частности фтор), C1-4алкил (в частности метил), или C1-4алкокси (такой как метокси), CN и CONH2. В предпочтительном варианте осуществления R2 отсутствует или представляет собой метил.
В формуле I R7 обозначает H или C1-4алкил, и если R7 обозначает C1-4алкил, то указанная алкильная группа может быть присоединена в любом возможном положении кольца, однако в большинстве случаев она присоединена в орто-положении по отношению к олефиновому компоненту. Предпочтительно R7 обозначает H или метил, наиболее предпочтительно H.
Олефиновая двойная связь в формуле I может быть в любой из двух геометрических конфигураций, однако предпочтительно в E-конфигурации.
Группа Z может быть присоединена в любом приемлемом положении кольца, однако предпочтительно в орто- или мета-положении по отношению к сульфоновому компоненту, наиболее предпочтительно - в орто-положении.
В одном из вариантов данного изобретения Z обозначает гидроксиС1-6алкильную группу. В этом варианте осуществления данная алкильная группа может быть с неразветвленной цепью или с разветвленной цепью и предпочтительно содержит до 4 атомов углерода включительно. Гидроксильная группа может быть присоединена в любом приемлемом положении данной алкильной группы с образованием первичного, вторичного или третичного алканола. Примеры подходящих гидроксиС1-6алкильных групп включают гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил и 2-гидрокси-2-пропил, из которых особенно подходит 1-гидроксиэтил. Указанная 1-гидроксиэтильная группа очень подходит в S-конфигурации. Конкретные примеры соединений в этом варианте осуществления данного изобретения включают:
(1S)-1-[2-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)фенил]этанол;
(1S)-1-[2-({4-[(E)-2-(2,4-дифторфенил)винил]фенил}сульфонил)фенил]этанол;
(1S)-1-[2-({4-[(E)-2-(4-фторфенил)винил]-3-метилфенил}сульфонил)фенил]этанол;
[2-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)фенил]метанол;
[2-({4-[(E)-2-(2,4-дифторфенил)винил]фенил}сульфонил)фенил]метанол;
2-[2-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)фенил]пропан-2-ол;
2-[2-({4-[(E)-2-(2,4-дифторфенил)винил]фенил}сульфонил)фенил]пропан-2-ол; и
2-[2-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)фенил]этанол.
Во втором варианте осуществления данного изобретения Z обозначает C1-6алкоксикарбонил, в частности C1-4алкоксикарбонил, такой как CO2Me, CO2Et и CO2 iPr. Конкретные примеры соединений в этом втором варианте осуществления данного изобретения включают:
метил-2-({4-[(E)-2-(2,4-дифторфенил)винил]фенил}сульфонил)бензоат;
метил-2-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)бензоат;
метил-3-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)бензоат; и
метил-2-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)-3-метилбензоат.
В третьем варианте осуществления данного изобретения Z обозначает 5- или 6-членное гетероароматическое кольцо, которое необязательно имеет метильную замещающую группу. В случае, когда группа Z представляет собой необязательно замещенное пятичленное гетероароматическое кольцо, оно предпочтительно является азотсодержащим кольцом, таким как пиррол, имидазол, пиразол, оксазол, тиазол, 1,3,4-оксадиазол, 1,2,4-оксадиазол, 1,3,4-тиадиазол, 1,2,4-тиадиазол, 1,2,3-триазол, 1,2,4-триазол или тетразол; любое из таких колец может быть необязательно замещено метильной группой. Такие кольца могут быть соединены через атом углерода или (при химической осуществимости) через атом азота, однако соединение через атом углерода предпочтительно. Подходящие примеры включают пиразол-1-ил, имидазол-1-ил, 2-метил-1,2,4-триазол-3-ил, оксазол-2-ил, тиазол-2-ил, имидазол-2-ил, 1-метилимидазол-2-ил, пиразол-3-ил, 1,2,3-триазол-4-ил и 1,3,4-оксадиазол-2-ил, из которых особенно подходят имидазол-2-ил и 1,3,4-оксадиазол-2-ил.
В случае, когда группа Z представляет собой необязательно замещенное шестичленное гетероароматическое кольцо, оно предпочтительно является пиридином, пиразином, пиримидином, пиридазином или триазином; любое из таких колец может необязательно быть замещено метильной группой. Предпочтительно шестичленное гетероароматическое кольцо, обозначенное как Z, содержит по меньшей мере 2 атома азота и наиболее предпочтительно, чтобы оно являлось пиридилом. Конкретные примеры шестичленного гетероароматического кольца, обозначенного как Z, включают в себя 2-пиридил и 3-пиридил.
Конкретные примеры соединений в этом третьем варианте осуществления данного изобретения включают:
2-[2-({4-[(E)-2-(2,4-дифторфенил)винил]фенил}сульфонил)фенил]-1H-имидазол;
2-[2-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)фенил]-1H-имидазол;
2-[2-({4-[(E)-2-(2,4-дифторфенил)винил]фенил}сульфонил)фенил]-1,3,4-оксадиазол;
и
2-[2-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)фенил]-1,3,4-оксадиазол.
Соединения, предлагаемые в данном изобретении, обладают активностью в качестве антагониста человеческого рецептора 5-HT2A и, следовательно, находят применение для лечения или предотвращения расстройств, обусловленных активностью рецептора 5-HT2A.
Данное изобретение также предоставляет фармацевтические композиции, которые содержат одно или несколько соединений по данному изобретению и фармацевтически приемлемый носитель. Предпочтительно, эти композиции находятся в дозированных формах, таких как таблетки, пилюли, капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозированные аэрозоли, капельно-жидкие спреи, капли, ампулы, трансдермальные пластыри, автоинжекционные устройства или суппозитории, для орального, парентерального, интраназального, сублингвального или ректального введения или для введения посредством ингаляции или инсуффляции. Основной активный компонент обычно смешивают с фармацевтическим носителем, например обычными компонентами для изготовления таблеток, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния и двухкальциевый фосфат, или смолами, диспергирующими агентами, суспендирующими агентами или поверхностно-активными веществами, такими как сорбитанмоноолеат и полиэтиленгликоль, и другими фармацевтическими разбавителями, например водой, для образования гомогенной предварительной композиции, содержащей соединение, предлагаемое в данном изобретении, или его соль, пригодную для фармацевтических целей. При рассмотрении этих предварительных композиций как гомогенных имеется в виду то, что их активные компоненты распределены равномерно по всему объему композиции, и такая композиция может быть легко разделена на равные дозированные формы, такие как таблетки, пилюли и капсулы. Данную предварительную композицию затем разделяют на дозированные формы указанных выше видов, которые содержат от 0,1 до примерно 500 мг активного компонента, предлагаемого в данном изобретении. Типичные дозированные формы содержат от 1 до 100 мг, например 1, 2, 5, 10, 25, 50 или 100 мг активного компонента. Таблетки или пилюли данной новой композиции могут быть покрыты или объединены иным образом для получения дозированных форм, реализующих преимущество продленного действия. Например, таблетка или пилюля может содержать составляющие внутренней дозы и внешней дозы, вторая из которых находится в виде оболочки поверх первой составляющей. Эти две составляющие могут быть разделены энтеросолюбильным слоем, который противостоит разложению в желудке и дает возможность внутренней составляющей проходить нетронутой в двенадцатиперстную кишку или же высвобождаться с задержкой. Для такого энтеросолюбильного слоя или покрытия может быть использовано множество материалов; подобные материалы включают в себя ряд полимерных кислот и их смесей с такими материалами как шеллак, цетиловый спирт и ацетат целлюлозы.
Жидкие формы, в которых новые композиции по данному изобретению могут быть объединены для приема внутрь или посредством инъекции, включают в себя водные растворы, капсулы, заполненные жидкостью или гелем, сиропы с соответствующей ароматизацией, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло или кокосовое масло, а также эликсиры и другие подобные фармацевтические носители. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают в себя синтетические и натуральные смолы, такие как трагакантовая камедь, аравийская камедь, альгинат, декстран, карбоксиметилцеллюлоза натрия, метилцеллюлоза, поли(этиленгликоль), поли(винилпирролидон) или желатин.
Данное изобретение также предоставляет соединение формулы I или его фармацевтически приемлемую соль для применения в способе лечения человеческого организма. Предпочтительно, лечение выполняется в случае расстройств, обусловленных активностью рецептора 5-HT2A.
Данное изобретение также предоставляет применение соединения формулы I или его фармацевтически приемлемой соли при получении лекарственного средства для лечения или предотвращения расстройства, обусловленного активностью рецептора 5-HT2A.
Также раскрыт способ лечения субъекта, страдающего от нарушений, обусловленных активностью рецептора 5-HT2A, или предрасположенного к таким нарушениям, который включает введение такому субъекту эффективного количества соединения в соответствии с формулой I или его фармацевтически приемлемой соли.
В одном аспекте данного изобретения нарушением, обусловленным активностью рецептора 5-HT2A, является нарушение сна, в частности бессонница. В другом аспекте данного изобретения нарушение, обусловленное активностью рецептора 5-HT2A, выбрано из психотических расстройств (таких как шизофрения), депрессии, состояния тревоги, панического расстройства, обсессивно-компульсивного расстройства, болей, расстройств, связанных с приемом пищи (таких как анорексия (anorexia nervosa)), зависимости или острого токсического эффекта, обусловленных наркотическими средствами, такими как ЛСД или МДМА, и приливов крови, связанных с менопаузой.
В рассмотренном здесь лечении, например, бессонницы или шизофрении подходящая доза составляет примерно от 0,01 до 250 мг/кг в день, предпочтительно примерно от 0,05 до 100 мг/кг в день, и особенно предпочтительно примерно от 0,05 до 5 мг/кг в день. Данные соединения могут приниматься 1-4 раза в день, однако предпочтительно один раз в день, например, перед отходом ко сну.
При необходимости соединения в соответствии с данным изобретением могут приниматься совместно с другим снотворным, противошизофреническим или антифобическим седативным лекарственным средством. Такой совместный прием может быть желателен, если пациент уже адаптировался к режиму лечения снотворными, противошизофреническими или антифобическими седативными средствами, включая и другие обычные лекарственные средства. В частности, для лечения расстройств сна соединения по данному изобретению могут приниматься совместно с антагонистами рецептора GABAA, такими как габоксадол, или снотворными средствами кратковременного действия и/или быстродействующими снотворными средствами, такими как золпидем или бензодиазепин, барбитурат, модулятор прокинетицина, антигистамин, тразодон или производное тразодона, как это раскрыто в WO 03/068148.
В соответствии с другим аспектом данного изобретения предложена комбинация соединения формулы I или его фармацевтически приемлемых соли или гидрата и габоксадола для лечения или предотвращения расстройств сна, шизофрении или депрессии.
Также в соответствии с данным изобретением предложен способ лечения или предотвращения расстройств сна, шизофрении или депрессии, включающий введение субъекту, нуждающемуся в этом, соединения формулы I или его фармацевтически приемлемых соли или гидрата в комбинации с габоксадолом.
Использованное здесь выражение «в комбинации с» требует, чтобы данному субъекту вводились терапевтически эффективные количества соединения формулы I или его фармацевтически приемлемых соли или гидрата и габоксадола, однако оно не вносит ограничений в отношении способа, посредством которого это может быть достигнуто. Так, оба средства могут быть объединены в одну дозированную форму для одновременного приема пациентом или могут быть предоставлены в виде отдельных дозированных форм для одновременного или последовательного введения. Последовательный прием может быть разделен небольшим или длительным промежутком времени, например одно средство может быть принято утром, а другое - вечером. Эти отдельные средства могут приниматься с одной и той же периодичностью или же с разной периодичностью, например одно средство принимается один раз в день, а другое - два раза в день или чаще. Эти отдельные средства могут приниматься одним и тем же или разным образом, например одно средство принимается приемом внутрь, а другое вводится парентерально, хотя для обоих средств предпочтителен, при возможности, прием внутрь.
В соответствии с другим аспектом данного изобретения предложена фармацевтическая композиция, которая содержит фармацевтически приемлемый носитель, соединение формулы I или его фармацевтически приемлемые соль или гидрат и габоксадол.
Данное изобретение также включает применение соединения формулы I или его фармацевтически приемлемых соли или гидрата и габоксадола для изготовления лекарственного средства для лечения или предотвращения расстройств сна, шизофрении или депрессии.
Данное изобретение также включает набор, содержащий первое лекарственное средство, включающее соединение формулы I или его фармацевтически приемлемые соль или гидрат, и второе лекарственное средство, содержащее габоксадол, вместе с инструкциями по последовательному или одновременному введению указанных лекарственных средств пациенту, страдающему от расстройства сна, шизофрении или депрессии.
Использованный здесь термин «габоксадол» включает 4,5,6,7-тетрагидроизоксазоло[5,4-c]пиридин-3-ол в форме свободного основания или в цвиттер-ионной форме, а также его фармацевтически приемлемые кислотно-аддитивные соли, такие как гидрохлорид. В большинстве случаев габоксадол находится в виде кристаллического моногидрата цвиттер-ионной формы.
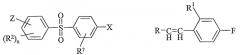
Соединения формулы I могут быть получены посредством реакционного взаимодействия соединения формулы (1a) со стиролом формулы (2a):
| (1) | (a) X=Hal | (2) | (a) R=H |
| (b) X=CHO | (b) R=B(OH)2 |
где Hal обозначает Cl, Br или I, а все другие обозначения те же, что приведены выше. Данное реакционное взаимодействие происходит при повышенной температуре (например, 130°C) в 1-метилпирролидоне в присутствии ацетата палладия и ацетата натрия. «Hal» предпочтительно является Br.
В качестве альтернативы соединение формулы (1a) может взаимодействовать с производным бороновой кислоты (2b), обычно в растворе тетрагидрофурана (THF) в присутствии (PPh3)4Pd(0) и основания, такого как карбонат натрия, при нагревании (например, до 150°C посредством микроволнового излучения).
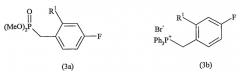
В другом альтернативном варианте альдегид формулы (1b) связывается с бензилфосфонатом, таким как (3a), или бензилфосфониевой солью, такой как (3b):
где R1 имеет то же значение, как описано выше. Данная реакция может быть проведена в тетрагидрофуране (THF) в присутствии сильного основания, такого как BuLi или комбинация гидрида натрия с краун-эфиром.
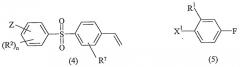
В другом альтернативном варианте соединение формулы (1a) может быть обработано трибутил(винил)оловом с образованием алкена (4), который может быть связан с бромбензолом или йодбензолом (5):
где X1 обозначает Br или I, а все другие обозначения те же, что и прежде. Связывание происходит при условиях, аналогичных условиям связывания (1a) с (2a).
Соединения формулы (1a) и (1b) могут быть получены реакционным взаимодействием соединений (6) с соединениями (7) с последующим окислением образованного тиоэфира (8):
где Y1 обозначает I, а Y2 обозначает SH, или же Y1 обозначает SH, а Y2 - I, а все другие обозначения те же, что и прежде. Образование тиоэфиров (8) происходит в присутствии CuI, этиленгликоля и основания, такого как карбонат натрия, в растворителе, таком как изопропанол. Окисление тиоэфиров (8) двумя или более эквивалентами окислителя (например, м-хлорпероксибензойной кислотой или озоном) приводит к образованию сульфонов (1a).
В качестве альтернативы сульфоны (1a) могут быть получены непосредственным образом посредством реакционного взаимодействия между соединением формулы (6) и соединением формулы (7), в которых одна из групп Y1 и Y2 представляет собой I или Br (предпочтительно I), а другая - SO2 -Na+. Эта реакция может быть проведена в полярном апротонном растворителе, таком как диметилсульфоксид (DMSO), при повышенной температуре (например, примерно при 110°C), в присутствии соли Cu(I), такой как иодид или трифлат. Предпочтительно используют примерно 3 молярных эквивалента соли Cu(I).
Легко можно заметить, что можно варьировать порядок, в котором выполняются указанные выше этапы реакции. Например, возможно связывание соединения формулы (2a), (2b), (3a) или (3b) с соединением формулы (7) (X=Hal или CHO, в зависимости от того, что подходит) и приведение полученного продукта в реакционное взаимодействие с соединением формулы (6) при условиях, аналогичных описанным выше. Соответственно, предпочтительный синтез соединений формулы I включает в себя реакцию производного бром- или иодбензола (9) с солью стильбенсульфиновой кислоты (10):
где X2 обозначает Br или I, а все другие обозначения те же, что приведены выше.
Предпочтительно, X2 обозначает I, и реакцию проводят в диметилсульфоксиде (DMSO) примерно при 110°C в присутствии CuI. Производные стильбена (10) могут быть получены связыванием соединений (2a), (2b), (3a) или (3b) с соединениями формулы (7), в которой Y2 обозначает SO2 -Na+, а X обозначает Hal или CHO, в зависимости от того, что подходит. Во время указанного связывания группа SO2 -Na+ предпочтительно защищена в качестве аддукта акрилонитрилом. Это может быть достигнуто посредством реакционного взаимодействия соответствующего соединения формулы (7) (Y2=SO2 -Na+) с 2 эквивалентами акрилонитрила в смеси уксусной кислоты и воды при 100°C с образованием соответствующего арилсульфонилпропаннитрила. После связывания функциональность группы SO2 -Na+ может быть восстановлена обработкой алкоголятом, например метилатом натрия, при комнатной температуре в спиртовом растворителе, например смеси метанола и тетрагидрофурана (THF).
В случае невозможности использования товарных продуктов исходные материалы и реагенты, описанные выше, могут быть получены из имеющихся в продаже предшественников посредством хорошо известных процедур синтеза. Подходящие способы раскрыты здесь в разделе «Примеры». Соответственно, соединения формулы (6) или формулы (9), в которых Z обозначает гидроксиС1-6алкил, могут быть получены (при необходимости) восстановлением соответствующих соединений, в которых Z обозначает подходящий альдегид или кетон, с боргидридом натрия или посредством реакции соответствующего альдегида или кетона с соответствующим алкильным реактивом Гриньяра. Соединения формулы (6) или формулы (9), в которых Z обозначает 5-членное гетероароматическое кольцо, соединенное через N, могут быть получены (при необходимости) реакционным взаимодействием соответствующих соединений, в которых Z обозначает F, с подходящим N-гетероциклом (например, нагреванием в растворе диметилсульфоксида (DMSO)). Соединения формулы (6) или формулы (9), в которых Z обозначает 5- или 6-членное гетероароматическое кольцо, соединенное через C, могут быть получены (при необходимости) реакционным взаимодействием соответствующих соединений, в которых Z обозначает Br или I, с подходящим гетероарилцинком или производным гетероарилтрибутилстаннана, обычно при нагревании в апротонном растворителе, таком как диметилформамид (DMF), в присутствии катализатора, такого как (Ph3P)4Pd(0). В качестве альтернативы, 5- или 6-членное гетероароматическое кольцо, обозначенное как Z, может быть образовано при использовании обычных методик гетероциклического синтеза. Например, метоксикарбонильная или этоксикарбонильная группа, обозначенная как Z, может быть преобразована в 1,3,4-оксадиазол-2-ильную группу посредством последовательной обработки гидразингидратом и триэтилортоформиатом. Аналогичным образом, соединения, в которых Z обозначает 1,2,3-триазол-4-ил, могут быть получены обработкой соответствующих соединений, в которых Z является этинилом, азидотриметилсиланом (например, в герметизированной трубе при 150°C в течение ночи). Аналогичным образом, соединения, в которых Z обозначает 1,2,4-триазол-3-ил, могут быть получены обработкой соответствующих соединений, в которых Z является CN, 4H-1,2,4-триазол-4-амином и этилатом натрия в этаноле с обратным холодильником с последующим проведением реакции образованного N'-4H-1,2,4-триазол-4-ил-карбоксимидамида с этилхлорформиатом (например, в ацетонитриле с обратным холодильником). Аналогичным образом, соединения, в которых Z обозначает тиазол-2-ил, могут быть получены обработкой соответствующих соединений, в которых Z является C(S)NH2, с бромацетальдегидом или его диэтилацеталем (например, в дефлегмируемом этаноле). Аналогичным образом, соединения, в которых Z обозначает 2-пиридил, могут быть получены диазотированием соответствующих соединений, в которых Z является NH2, и обработкой полученных солей диазония избытком пиридина (например, при 80°C).
Следует принимать во внимание, что вышеописанные превращения замещающей группы Z могут быть выполнены в качестве конечного этапа при синтезе соединений формулы I, если это необходимо.
Аналогичным образом, идентичность группы R2 (при ее наличии) в соединениях формулы I или их предшественниках может быть изменена при использовании стандартных методик синтеза. Например, соединения, в которых R2 представляет собой CN, могут быть получены из соответствующих соединений, в которых R2 является Br, посредством обработки ZnCN в присутствии (Ph3P)4Pd(0), и результирующие нитрилы могут быть преобразованы в соответствующие карбоксамиды (R2=CONH2) посредством кислотного гидролиза или обработки триметилсиланолатом натрия (например, в тетрагидрофуране с обратным холодильником).
В случае если вышеописанные процессы получения соединений, пригодных для использования в данном изобретении, предоставляют смеси стереоизомеров, эти изомеры могут быть разделены обычными методиками, такими как препаративная хроматография. Эти соединения могут быть получены в рацемической форме, или же могут быть получены индивидуальные энантиомеры посредством энантиоспецифического синтеза или посредством разделения. Соединения могут быть, например, разделены на составляющие энантиомеры стандартными методиками, такими как препаративная высокоэффективная жидкостная хроматография (HPLC), или вслед за образованием диастереометрических пар посредством образования соли с оптически активной кислотой, такой как ди-п-толуоил-D-винная кислота и/или ди-п-толуоил-L-винная кислота, выполняют фракционированную кристаллизацию и восстановление свободного основания. Соединения могут быть также разделены посредством образования диастереометрических эфиров или амидов с последующим разделением и удалением хиральных добавок.
При проведении любой из вышеуказанных последовательностей синтеза может понадобиться и/или желательна защита чувствительных или реакционноспособных групп в любой из участвующих молекул. Это может быть реализовано посредством обычных защитных групп, таких как группы, описанные в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; и T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991. Эти защитные группы могут быть удалены на подходящем последующем этапе при использовании методик, известных в данной области.
Соединения были испытаны на их связывание с рецептором 5-HT2A и с другими рецепторами, такими как 5-HT2C и Ikr, при использовании методики, описанной в Fletcher et al, J. Med. Chem., 2002, 45, 492-503.
ПРИМЕРЫ
Промежуточный продукт 1
4-[(E)-2-(4-фторфенил)винил]бензолсульфинат натрия
Этап 1
К суспензии дигидрата 4-бромфенилсульфината натрия (130 г, 0,53 моль) в воде (600 мл) добавляли акрилонитрил (70 мл, 1,07 моль) и уксусную кислоту (62 мл, 1,07 моль). Реакцию проводили при перемешивании в течение 1,5 ч при 100°C, после чего охлаждали до комнатной температуры. Твердый компонент отфильтровывали, тщательно промывали водой и сушили над P2O5, получая 3-[(4-бромфенил)сульфонил]пропаннитрил (125 г). δH (400 МГц, CDCl3): 7,27-7,22 (4H, м), 2,85 (2H, т, J=7,6), 2,30 (2H, т, J=7,6).
Этап 2
К суспензии ацетата натрия (54 г, 0,66 моль) и 4-фторстирола (90 г, 0,74 моль) в 1-метил-2-пирролидиноне (500 мл) добавляли 3-[(4-бромфенил)сульфонил]пропаннитрил (этап 1, 90 г, 0,33 моль) и ацетат палладия (II) (1,4 г, 6,2 ммоль). Смесь погружали в масляную ванну при 100°C и нагревали до 135°C в течение 20 минут. Охлажденную реакционную смесь разбавляли водой и EtOAc и фильтровали через Hyflo®. Органический слой фильтрата промывали водой (×3), после чего концентрировали в вакууме. Остаток растирали в порошок с изогексаном, получая 3-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)пропаннитрил (73 г). δH (360 МГц, CDCl3): 7,88 (2H, д, J=8,0), 7,69 (2H, д, J=8,3), 7,51 (2H, дд, J=5,6, 8,3), 7,22 (1H, д, J=15,0), 7,10-7,02 (3H, м), 3,39 (2H, т, J=7,7), 2,83 (2H, т, J=7,7).
Этап 3
К смеси 3-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)пропаннитрила (этап 2, 75 г, 0,24 моль) в тетрагидрофуране (THF) (1 л) и MeOH (500 мл) добавляли метилат натрия (13 г, 0,24 моль). Смесь перемешивали в течение 1 ч при комнатной температуре, после чего разбавляли изогексаном и Et2O. Твердый компонент отфильтровывали, растирали в порошок с изогексаном и сушили в вакууме, получая 4-[(E)-2-(4-фторфенил)винил]бензолсульфинат натрия (66 г). δH (500 МГц, d6 DMSO): 7,65 (2H, т, J=6,8), 7,53 (2H, д, J=7,8), 7,45 (2H, д, J=7,7), 7,26-7,18 (4H, м). m/z (ES-) 261 [(M-Na)-].
Промежуточный продукт 2
4-[(E)-2-(2,4-дифторфенил)винил]бензолсульфинат натрия
Получали таким же образом, как и промежуточный продукт 1, при использовании 2,4-дифторстирола вместо 4-фторстирола на этапе 2. δH (400 МГц, d6 DMSO): 7,84 (1H, кв., J=8,1), 7,55 (2H, д, J=8,0), 7,47 (2H, д, J=8,0), 7,32-7,20 (3H, м), 7,15-7,11 (1H, м). m/z (ES-) 279 [(M-Na)-].
Пример 1
(1S)-1-[2-({4-[(E)-2-(4-фторфенил)винил]фенил}сульфонил)фенил]этанол
Этап 1
В каждый из трех одинаковых реакционных сосудов Emrys с микроволновым подогревом добавляли (S)-1-(2-бромфенил)этанол (1,67 г, 8,3 ммоль), CuI (189 мг, 1,0 ммоль), 1,4-диоксан (12,4 мл), N,N'-диметилэтилендиамин (0,18 мл, 1,7 ммоль) и дигидрат иодида натрия (3,1 г, 16,6 ммоль). Каждый сосуд герметизировали и нагревали в реакторе Emrys с микроволновым подогревом до 150°C в течение 2 ч. После охлаждения смеси взаимно объединяли и затем распределяли между водой (20 мл) и EtOAc (20 мл). Органическую фазу промывали соляным раствором (20 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме. Полученный черновой продукт помещали в изогексан (50 мл) и выдерживали раствор при -15°C в течение 16 ч, получая (S)-1-(2-иодфенил)этанол в виде белого кристаллического твердого вещества (4,95 г).
Этап 2
Суспензию (S)-1-(2-иодфенил)этанола (этап 1; 4,4 г, 17,7 ммоль), промежуточного продукта 1 (5,54 г, 19,5 ммоль), CuI (10,1 г, 53,0 ммоль) и диметилсульфоксида (DMSO) (80 мл) дегазировали повторяющимся вакуумированием и освобождали от N2, после чего нагревали в масляной ванне при 110°C в течение 75 минут. Охлажденную смесь распределяли между концентрированным раствором гидроксида аммония (100 мл) и EtOAc (100 мл), водную фазу экстрагировали дополнительным количеством EtOAc (50 мл). Органическую смесь промывали водой (2Ч100 мл) и соляным раствором (100 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме. Полученный черновой продукт очищали флэш-хроматографией на силикагеле (элюант 25-35-45% EtOAc/изогексан) и затем снова с помощью 5% Et2O/CH2Cl2. Образованную пену перемешивали с пентаном в течение 1 ч, получая чистый продукт в виде белого аморфного твердого вещества (3,97 г). Этот материал перекристаллизовывали из смеси примерно 90% MeOH/вода, получая бесцветные кристаллы; т.пл. 75°C. δH (500 МГц, d6 DMSO): 8,02 (1H, д, J=7,3), 7,81-7,78 (5H, м), 7,73-7,67 (3H, м), 7,52 (1H, т, J=7,2), 7,43 (1H, д, J=16,5), 7,29 (1H, д, J=16,4), 7,22 (2H, т, J=8,8), 5,44-5,40 (1H, м), 5.28 (1H, д, J=4,0), 1,09 (3H, д, J=6,2); m/z (ES+) 365 [(M-OH)+].
Пример 2
(1S)-1-[2-({4-[(E)-2-(2,4-дифторфенил)винил]фенил}сульфонил)фенил]этанол
Получали так же, как это описано в примере 1, при замене промежуточного продукта 1 на промежуточный продукт 2. δH (500 МГц, d6 D