Способ определения констант скоростей газожидкостных химических реакций
Иллюстрации
Показать всеИзобретение относится к химической технологии и может быть использовано при разработке и проектировании промышленных массообменных газожидкостных аппаратов, в том числе при изучении кинетики газожидкостных химических реакций. Способ включает приведение в контакт газа и жидкости при пропускании одиночной ламинарной струи жидкости диаметром d через центр цилиндрической реакционной камеры диаметром D и длиной L, заполненной газовой компонентой реакции, подаваемой в составе газовой смеси, которую с выхода реакционной камеры подают в измерительную ячейку и производят измерение концентраций газовой компоненты реакции в указанной смеси n0 и n до и после подачи в реакционную камеру струи жидкости соответственно, причем параметры сред и установки выбирают таким образом, чтобы удовлетворить следующим неравенствам: и , где - коэффициент массопередачи газовой компоненты из поверхности в раствор в условиях, когда отношение n/n0 не зависит от парциального давления газовой компоненты реакции в реакторе; βg, β1 - коэффициенты массоотдачи в газе и жидкости соответственно; U - скорость газа; - концентрация жидкостной компоненты в ядре жидкого потока; - концентрация газового компонента в ядре потока;
Dc - коэффициент диффузии абсорбированной компоненты в жидкости;
Нc - константа растворимости Генри, а константа скорости жидкофазной реакции K1 рассчитывается из соотношения . Достигается повышение информативности определения. 3 з.п. формулы, 1 ил.
Реферат
Изобретение относится к химической технологии и может быть использовано при разработке и проектировании промышленных массообменных газожидкостных аппаратов, в том числе при изучении кинетики газожидкостных химических реакций.
Скорость абсорбции, сопровождаемой химической реакцией, зависит от величины константы скорости реакции:
протекающей в узком приповерхностном слое раствора между абсорбированной из газовой фазы компонентой С и жидкостной компонентой Н. В общем случае продукты реакции Z и М могут оставаться или в растворе, или одна из них может десорбироваться в газовую фазу. Знание величины константы скорости реакции К1 важно при проектировании производственных аппаратов.
Процесс измерения величины К1 в лабораторных установках усугублен одновременным протеканием большого числа сопутствующих процессов. На точность определения константы скорости реакции (1) большое влияние оказывают процессы массоотдачи в газовой и жидкой фазах. Поэтому важно проводить измерение величины К1 в условиях, при которых скорость абсорбции лимитируется только химической реакцией. Иными словами, скорости поставки реагентов в реакционную зону из газовой фазы и из ядра потока жидкой фазы должны быть намного выше, чем скорость их вступления в химическую реакцию. Коэффициент массоотдачи в газе тем выше, чем ниже давление газа и чем меньше характерный масштаб газофазной области. Коэффициент массоотдачи в жидкой фазе увеличивают за счет интенсификации процессов, обновляющих поверхность контакта фаз. Важной задачей является поиск режимов, при которых скорость химической реакции намного меньше скоростей массоотдачи в газе и жидкости.
Сформулируем условия, при которых поглощение газовой компоненты С будет лимитироваться только химической реакцией, протекающей в приповерхностном слое раствора. В стационарных условиях потоки жидкой компоненты и газовой компоненты в реакционную зону равны скорости химической реакции:
(Азязов В.Н., Куприянов Н.Л. Теоретическое моделирование химических генераторов синглетного кислорода для кислородно-йодного лазера. - Труды ФИАН им П.Н.Лебедева, 1989, том 194, с.148-170). , NH - концентрация жидкостной компоненты Н в ядре и на поверхности потока жидкости соответственно; , Nc, - концентрация компонента С в ядре газового потока, у поверхности раствора и в растворе соответственно; βl, βg - коэффициенты массоотдачи в жидкой и газовой фазах соответственно; l - координата, отсчитываемая от поверхности в глубь раствора. Коэффициент массоотдачи газовой компоненты C с поверхности в раствор определяется из следующего выражения (Данкверс П.В. Газожидкостные реакции. - М.: Химия, 1973, с.45):
,
которое получено в предположении, что NH=const по всей глубине реакционной зоны. Это предположение верно, если NH>>Nc. Здесь Dc - коэффициент диффузии компонента С в растворе. Нc - константа растворимости Генри, равная отношению концентраций С в газе к его концентрации в растворе при термодинамическом равновесии.
Из равенства jg=jc находится условие, при котором скорость массоотдачи в газовой фазе не будет лимитировать скорость поглощения компонента С:
.
Отсюда отношение концентраций газовой компоненты равно:
При b=βc/βg<<1 отношение концентраций в ядре газового потока к концентрации у поверхности раствора . В этом случае скорость поглощения не лимитируется массоотдачей в газовой фазе. Коэффициент массоотдачи в газовой фазе βg зависит от давления в газе, скорости, газофазного масштаба и т.д. Эти зависимости для различных типов массообменных аппаратов приведены в работе В.М.Рамма «Абсорбция газов», М.: Химия, 1976, с.379-405.
Из равенства потоков jl=jc находится условие, при котором скорость поглощения С не будет лимитироваться скоростью массоотдачи в жидкой фазе:
Данное равенство преобразуется к виду:
где
.
Из данного уравнения следует, что , если параметр
Выполнение данного условия означает, что скорость массоотдачи в жидкости не лимитирует скорость хемосорбции.
Таким образом, скорость поглощения лимитируется только химической реакцией на поверхности раствора, если
b<<1 и b'<<1.
Выполнения данных условий можно добиться за счет подбора концентраций, вступающих в реакцию реагентов С и Н, за счет конструкции массообменного аппарата и режимов его работы. Из данных неравенств следует, что рост концентрации жидкофазной компоненты уменьшает параметр b' но с другой стороны он увеличивает и параметр b, т.к. βc, пропорционален . Таким образом, за счет подбора только концентрации NH нельзя удовлетворить неравенствам. Параметр b' можно уменьшить, понижая до известной степени концентрацию газовой компоненты. Удовлетворение неравенствам таким способом сталкивается с трудностями регистрации низких концентраций газовой компоненты. Уменьшить параметр b можно, повышая коэффициент массоотдачи βg, который растет как с уменьшением газофазного масштаба, так и с уменьшением давления газа. Рост коэффициента массоотдачи в жидкости β1 можно обеспечить за счет увеличения скорости обновления поверхности контакта фаз. Параметры b и b' позволяют проводить поиск режимов работы массообменных аппаратов, при которых скорость хемосорбции лимитируется только скоростью химической реакции.
Известен способ, в котором для определения констант скоростей газожидкостных химических реакций поверхность контакта газ-жидкость организуется на смоченной раствором внешней поверхности вращающегося цилиндра (О.С.Sandal, I.B.Goldberg, S.C.Hurlock, H.O.Laeger, R.I.Wagner, Solubility and rate of hydrolysis in aqueous sodium hydroxide at 273 К, AlChE Journal, 1981, vol.27, No.5, pp.856-859). Газ подают в щель, образованную с одной стороны поверхностью цилиндра, а с другой стороны стенкой реакционной камеры. Количество реагента, вступившего в реакцию, определяют по падению давления в реакционной камере. Очевидно, что данный способ не применим для изучения процессов, в которых продукт реакции выделяется в газовую фазу. Например, для реакции газообразного хлора с щелочным раствором перекиси водорода, в которой продукт реакции кислород выделяется в газовую фазу. Недостатком данного метода является низкая скорость массоотдачи в жидкой фазе. В результате чего, концентрация реагента Н в приповерхностном слое раствора истощается.
Этот способ был использован для измерения константы скорости реакции
Для условий эксперимента (газофазный масштаб составлял 0,6 см, Dc=6,8×10-6 см2/с, коэффициент диффузии хлора в газе Dg≈70 см2/с, Hс=0,15, Nc≈3×1016 см-3, NH≈3×1021 см-3, K2≈7×10-13 см2/с, скорость газа U≈10 м/с) коэффициенты массообмена равны: βg≈117 см/с, βl≈2×10-3, см/с. Отсюда b и b' равны:
b≈7; b'≈4.
Таким образом, в данном способе скорость хемосорбции лимитируется скоростями массообмена как в жидкой, так и в газовой фазе. В связи с этим измеренная данным способом константа реакции (2) будет существенно занижена.
Известен также способ определения констант скоростей газожидкостных реакций, с помощью которого кинетику газожидкостной реакции изучают на основе использования массообменного аппарата с одиночной ламинарной струей (G.Ruiz-Ibanez, O.C.Sandall, Kinetics for the reaction between chlorine and basic hydrogen peroxide, Ind. Eng. Chem. Res., 1991, vol.30, No.6, pp.1105-1110). В реакционную камеру, представляющую собой цилиндр, напускают газовую компоненту при атмосферном давлении. Раствор в виде одиночной ламинарной струи подается по оси цилиндрической реакционной камеры. На выходе из реакционной камеры струю вводят в трубку с диаметром чуть большим, чем диаметр струи. В трубке струя притормаживается таким образом, чтобы образовывать жидкостный затвор для предотвращения проникновения газа в приемный бак для раствора. Это является важным моментом в данном способе, поскольку скорость реакции определяется по содержанию продуктов реакции в растворе, прошедшем через реакционную камеру.
Данный способ определения констант скоростей газожидкостных реакций является наиболее близким к заявляемому изобретению и выбран в качестве прототипа. В данном способе высокая скорость массообмена в газовой фазе обеспечивается за счет высокой концентрации газофазной компоненты (1 атм). Однако при измерении констант скоростей реакций (2), а также реакции
скорости хемосорбции лимитируются скоростями массообмена в жидкости. Для условий эксперимента прототипа Nc≈2,4×1019 см-3, NH≈2,4×1021 см-3 при времени контакта струи раствора с газом t≈5×10-3 коэффициенты массоотдачи равны βl≈4×10-2 см/с и см/с. При этом получается, что b'≈2. Таким образом, способы, предложенные в аналоге и прототипе, не позволяют проводить измерения констант скоростей реакций, контролируемых диффузией, таких как реакции (2) и (3).
Задачей изобретения является определение констант скоростей газожидкостных реакций в условиях, когда скорости массопереноса в газовой и жидкой фазах намного выше, чем скорость химической реакции.
Это достигается тем, что в способе определения констант скоростей газожидкостных химических реакций, включающем организацию контакта фаз газ-жидкость за счет пропускания одиночной ламинарной струи жидкости диаметром d через центр цилиндрической реакционной камеры диаметром D и длиной L, заполненной газовой компонентой реакции, подаваемой в составе газовой смеси, которую с выхода реакционной камеры подают в измерительную ячейку и производят измерение концентраций газовой компоненты реакции в указанной смеси n0 и n до и после подачи в реакционную камеру струи жидкости соответственно, причем параметры сред и установки выбирают таким образом, чтобы удовлетворить следующим неравенствам: и ,
где
- коэффициент массопередачи газовой компоненты из поверхности в раствор в условиях, когда отношение n/n0 не зависит от парциального давления газовой компоненты реакции в реакторе; βg, β1, - коэффициенты массоотдачи в газе и жидкости соответственно; U - скорость газа; - концентрация жидкостной компоненты в ядре жидкого потока; - концентрация газового компонента в ядре потока; Dc - коэффициент диффузии абсорбированной компоненты в жидкости; Нc - константа растворимости Генри, а константа скорости жидкофазной реакции К1 рассчитывается из соотношения .
Кроме того, смесь газов из инертного газа гелия и реагента прокачивают через реакционную камеру в направлении, противоположном движению струи.
Кроме того, смесь газов из инертного газа гелия и реагента подают в реакционную камеру через концентрическую щель, стенки которой образованы боковыми поверхностями конусов с одинаковыми углами при основании со значениями углов при основании от 30° до 60°.
Кроме того, для формирования однородного профиля скорости в струе жидкости используют сопло в виде отверстия с резкими краями в тонкой пластине.
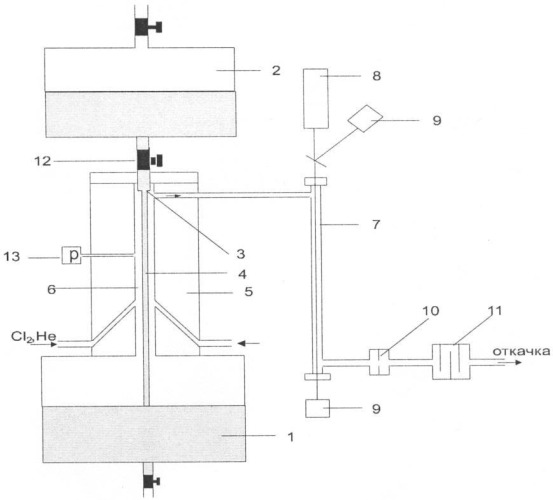
На фиг.1 схематически изображена установка для осуществления способа определения констант скоростей газожидкостных реакций.
Реакционная камера 6 проточного реактора 5 представляет собой вертикальную цилиндрическую полость длиной L и диаметром D. По центру реакционной камеры подается ламинарная струя раствора 4 из питающего бака 2. В качестве сопла 3 для получения струи, близкой к идеальной (скорость жидкости равномерна по сечению струи, форма струи подобна жесткому цилиндрическому стержню), используется отверстие, сделанное в тонкой пластине. Диаметр струи раствора составляет d. Прошедший через реакционную камеру раствор поступает в приемный бак 1.
Газовую смесь из гелия и реагента С непрерывно подают снизу реактора через концентрическую щель, стенки которой образованы боковыми поверхностями конусов с одинаковыми углами при основании в диапазоне от 30° до 60°. После реактора газ прокачивают через измерительную ячейку 7, в которой измеряют концентрацию газовой компоненты С в смеси до и после пуска струи раствора. На приведенном примере концентрацию реагента С определяют по поглощению света. В качестве источника света 8 используют лампу накаливания, лазер и т.д. Прошедший через измерительную ячейку свет детектируют фотодетектором 9. Объемную скорость прокачки газовой смеси через реактор регулируют, например, сменной расходной диафрагмой 10. Для сохранения режима течения газа через расходную диафрагму содержание разбавителя (Не) должно намного превышать содержание реакционной компоненты С. Во избежание попадания агрессивных компонент в систему откачки в тракт установки помещают криогенную ловушку 11. Подачу раствора в реакционную камеру регулируют краном 12. Датчиком 13 измеряют давление газовой смеси в реакционной камере.
Процедура измерений состоит в следующем. В момент времени t0 смесь С+Не продувают через реактор, измеряют концентрацию компонента С-n0. После стабилизации всех измеряемых параметров в реактор подают струю раствора. После вторичной стабилизации измеряемых параметров производят измерение нового значения концентрации компоненты n и находят их отношение ηc=n/n0.
Связь между величинами ηc, βc, U находят из уравнения, описывающего изменение суммарного расхода газовой компоненты Gc по потоку, в предположении, что скорость поглощения газовой компоненты С лимитируется только протеканием химической реакции в растворе:
,
где
- удельная поверхность контакта фаз, S - площадь поперечного сечения реакционной камеры за вычетом площади сечения струи, G=nUS. Для постоянных величин U, S вдоль потока и в любом поперечном сечении реакционной камеры правую и левую часть предыдущего уравнения делят на n0US и получают:
Для постоянных значений , d и D по всей длине реакционной камеры получают решение:
Из уравнения (4) следует, что скорость хемосорбции лимитируется только химической реакцией, когда реализуются следующие условия:
- линейность функции ln ηс от времени пребывания газа в реакционной зоне L/U;
- линейность функции ln ηс от квадратного корня концентрации жидкостной компоненты реакции ;
- независимость относительного содержания ηс от парциального давления газовой компоненты реакции в реакторе.
На практике удобнее пользоваться последним условием для нахождения режимов работы реактора, в которых скорость хемосорбции лимитируется химической реакцией. Из уравнения (4) находится коэффициент массопередачи газовой компоненты из поверхности в раствор
С другой стороны из равенства легко может быть найдено значение константы скорости реакции
Пример. Найдем значение константы скорости реакции (3) с использованием полученных соотношений. Для условий d=1 мм, D=5 мм, скорости газа U=15 м/с, концентраций хлора - Nc≈1×1016 см-3, концентраций ионов НО2 - - NH≈6×1020 см-3, концентраций гелия - NHe≈4×1017 см-3, L=5 см, ηc=0,3 коэффициенты массообмена в газе и жидкости равны соответственно: βg≈350 см/с, βl≈4×10-2 см/с. Значение коэффициента массопередачи хлора из поверхности в раствор, найденное из соотношения (5), равно см/с. Для этих условий параметры b и b' равны 0,6 и 0,035 соответственно. Для выбранных условий скорость хемосорбции лимитируется скоростью химической реакции (3) в растворе. В этом случае значение константы скорости реакции (3) может быть найдено из соотношения (6). Подставляя в это соотношение значения коэффициента массопередачи см/с, растворимости Генри для хлора в растворе Нc=0,15, коэффициента диффузии хлора в растворе Dc=2,4·10-6 см2/с и концентрации ионов НO2 - в растворе NH≈6×1020 см-3 находим, что К3=6,7×10-13 см3/с. Необходимо отметить, что найденное значение К3 близко к значению константы скорости диффузионно контролируемой реакции.
Таким образом, предложенный способ позволяет проводить измерение констант скоростей быстрых контролируемых диффузией реакций, таких как реакций (2) и (3).
1. Способ определения констант скоростей газожидкостных химических реакций, включающий приведение в контакт газа и жидкости при пропускании одиночной ламинарной струи жидкости диаметром d через центр цилиндрической реакционной камеры диаметром D и длиной L, заполненной газовой компонентой реакции, подаваемой в составе газовой смеси, которую с выхода реакционной камеры подают в измерительную ячейку и производят измерение концентраций газовой компоненты реакции в указанной смеси n0 и n до и после подачи в реакционную камеру струи жидкости соответственно, причем параметры сред и установки выбирают таким образом, чтобы удовлетворить следующим неравенствам: и , где - коэффициент массопередачи газовой компоненты из поверхности в раствор в условиях, когда отношение n/n0 не зависит от парциального давления газовой компоненты реакции в реакторе; βg, β1 - коэффициенты массоотдачи в газе и жидкости соответственно; U - скорость газа; - концентрация жидкостной компоненты в ядре жидкого потока; - концентрация газового компонента в ядре потока;Dc - коэффициент диффузии абсорбированной компоненты в жидкости;Нc - константа растворимости Генри, а константа скорости жидкофазной реакции K1 рассчитывается из соотношения .
2. Способ по п.1, отличающийся тем, что в качестве газовой компоненты используют реагент, находящийся в смеси с инертным газом гелием, которую прокачивают через реакционную камеру в направлении, противоположном движению струи жидкости.
3. Способ по п.2, отличающийся тем, что смесь газов из инертного газа гелия и реагента подают в реакционную камеру через концентрическую щель, стенки которой образованы боковыми поверхностями конусов с одинаковыми углами при основании со значениями углов при основании от 30 до 60°.
4. Способ по п.1, отличающийся тем, что для формирования однородного профиля скорости в струе жидкости используют сопло в виде отверстия с резкими краями в тонкой пластине.