Способ диагностики гипер- и гипофункции щитовидной железы
Иллюстрации
Показать всеИзобретение относится к медицине, эндокринологии, патофизиологии и биологии. Для диагностики гипер- и гипофункции щитовидной железы используют физический метод исследования. На поверхность кожи шеи в зону проекции щитовидной железы помещают стеклянную пластину, на которую предварительно в виде дорожки наносят 1% водный раствор аспарагиновой аминокислоты (1% ВРАА) объемом 0,03-0,05 мл. Пластину выдерживают на поверхности шеи в зоне проекции щитовидной железы на протяжении 3-5 минут. Препарат высушивают в термостате при Т=+18-20°С в течение 2-3 минут, затем исследуют в поляризованном свете с кварцевым компенсатором. При наличии в препарате кристаллов - мелких перистых с отдельными ромбическими включениями диагностируют гиперфункцию щитовидной железы. При наличии только ромбических включений диагностируют гипофункцию щитовидной железы. Способ прост в исполнении, высокоинформативен, сокращает время исследования и материальные затраты. 10 ил.
Реферат
Предлагаемое изобретение относится к медицине, а именно к эндокринологии, патофизиологии, биологии, и может быть использовано для диагностики гиперфункции (тиреотоксикоз) и гипофункции (гипотиреоз) щитовидной железы.
Щитовидная железа (ЩЖ) - эндокринный орган. Вырабатываемые ею тиреоидные гормоны - тироксин (Т4) и трийодтиронин (Т3) обладают высокой биологической активностью, регулируют все виды обменов, синтез ДНК, РНК, проницаемость клеточных мембран, тканевое дыхание.
При повышении функции ЩЖ развивается тиреотоксикоз, характеризующийся стойким патологическим повышением продукции тиреоидных гормонов. Избыток гормонов вызывает нарушение функционирования большинства органов и систем организма.
Снижение функции ЩЖ приводит к замедлению течения обменных процессов, накоплению в тканях мукополисахаридов, нарушению электролитного баланса.
Среди способов лабораторной диагностики тиреотоксикоза (гипертиреоза) и гипотиреоза наибольшее значение придается гормональному исследованию. При этом определяют уровни Т3, Т4 и тиреотропного гормона (ТТГ).
Ключевыми гормональными маркерами при диагностике являются свободный тироксин (св.Т4) и ТТГ. Концентрация св.Т4 удерживается в равновесии механизмами регуляции гипоталамо-гипофизарно-тиреоидной системы и буферными возможностями связывания тироксинсвязывающего глобулина, альбумина и преальбумина. Поэтому концентрация св.Т4 не зависит от содержания тироксинсвязывающего глобулина. Изменение св.Т4 является объективным критерием оценки функции ЩЖ.
Известен иммунометрический способ определения гормонов ЩЖ. Способ основан на применении меченых антител. Благодаря его высокой специфичности и чувствительности, обеспечиваемой моноклональными антителами, можно ин-витро детектировать наличие в биологических жидкостях многих веществ (гормонов, ферментов, опухолевых маркеров и т.д.). К этой категории методов относятся радиоиммунологический (РИА), иммуноферментный (ИФА) и иммунофлюоресцентный, получившие свои названия из-за компонентов и характера метки. (Вуд У.Г., Соколовский Г. Теория и практика радиоиммуноанализа. Руководство для персонала лабораторных служб. «Глобус», Вена, 1981; Резников А.Г. Методы определения гормонов «Наукова Думка», Киев, 1990.)
Аналог - радиоиммунологический способ, фундаментальным принципом которого является конкурентное взаимодействие молекул гормона и специфического антитела или другого связанного белка.
В основе способа лежит использование в качестве метки радиоактивного изотопа (Вуд У.Г., Соколовский Г. Теория и практика радиоиммуноанализа. Руководство для персонала лабораторных служб. «Глобус», Вена, 1981).
Основные этапы способа:
- приготовление проб,
- использование радиоактивного изотопа,
- применение гамма-счетчика.
Недостатки способа:
- облучение,
- применение гамма-счетчика,
- дороговизна оборудования.
Ближайший аналог - иммуноферментный способ для определения свободного тироксина в сыворотке, плазме крови человека (Инструкция по применению набора реактивов для качественного иммуноферментного анализа свободного тироксина в сыворотке, плазме человека. Регистрационная комиссия МЗ РФ. Р/у №2000/93 от 06.04.2000. Набор «{FT4 EIA COBAS CORE. СТ ИФА COBAS CORE}» Кат. №2051915/20736015, S508062).
Сущность иммуноферментного способа состоит в том, что белковый гормон-лиганд метят не радиоактивным изотопом, а ферментом, в частности пероксидазой из хрена.
Активность пероксидазы и, следовательно, содержание конъюгированного с ней гормона измеряют фотометрическим способом с использованием перекиси водорода в качестве субстрата.
Осуществление способа.
ПОСЛЕДОВАТЕЛЬНОСТЬ ПОСТАНОВКИ АНАЛИЗА РУЧНЫМ МЕТОДОМ СТ ИФА COBAS CORE.
Доводят все реактивы до комнатной температуры (перед использованием встряхнуть). Подготавливают пробирки в дублях (+1 для фоновой пробы).
I инкубация
Вносят реагенты: 20 мкл рекалибратора (3 с), или 20 мкл контрольной сыворотки (4), или 20 мкл образца пациента и 250 мкл аналитического буфера (5).
Добавляют 1 шарик. Тщательно перемешивают. Инкубируют 30 минут при 37°С при постоянном встряхивании. Промывают на промывателе Roche по заданной программе.
II инкубация
Вносят 200 мкл холодного конъюгата (2).
Инкубируют 15 минут в холодильнике при 4-8°С без встряхивания. Промывают на промывателе по заданной программе. Готовят рабочий раствор субстрата за 10 минут перед использованием из расчета: 1 объем субстратного раствора ТМБ (8)+4 объема субстратного буфера H2O2 (10).
Добавляют 250 мкл рабочего раствора субстрата. Тщательно перемешивают. Инкубируют 15 минут при 37°С и постоянном встряхивании.
Добавляют 2 мл серной кислоты (12). Тщательно перемешивают. Измеряют поглощение при 450 нм против ФП, рассчитывают концентрацию СТ4 при помощи программы ELA на компьютере.
Недостатки способа:
1. Специфичность проб не является абсолютной. Вполне возможно, что кросс-реагирующие субстанции могут фальсифицировать результаты.
2. Иммунометрический анализ - это сложное исследование, требующее высокой квалификации персонала и тщательнейшего проведения всех процедур. Любая мелкая техническая оплошность из-за чрезвычайно высокой чувствительности тестов и очень низких концентраций определяемых веществ приводит к искажению конечного результата.
3. Дороговизна.
Задачи предлагаемого изобретения.
1. Обеспечение экспресс-диагностики функции ЩЖ - гипер-, гипофункция.
2. Повышение информативности диагностики.
3. Снижение материально-технических затрат.
Для разработки предлагаемого изобретения использовали возможность регистрации биоэнергетического излучения живых объектов (в данном случае щитовидной железы).
Известно, что от живого объекта во все стороны излучаются модулированные электромагнитные излучения. Возникают сложные информационно закодированные многочастотные паттерны колебаний, индивидуальные информационно-энергетические коды (Электромагнитное поле в биосфере. T.1, 2. - М. - 1984; Гуляев Ю.В., Годик Э.Э. Физические поля биологических объектов. В кн.: Кибернетика живого. Биология и информация - М. - 1984 - С.39-60; Ананин В.Ф. Биоэнергетика человека - М. - 1993).
Функционирующая клетка является источником и носителем сложного излучения, структура клетки может меняться в зависимости от характера и частоты ритма излучения, обусловленного ходом обменных процессов в самой клетке (В.П.Казначеев, Л.П.Михайлова. Биоинформационная функция естественных электромагнитных полей. Новосибирск, 1985).
Структура - мгновенный снимок внутренних энергетических взаимодействий в биологической системе (А.А.Малиновский. Теория структур и ее место в системном подходе. - М., 1970 - С.10-31).
При избытке или недостатке тиреоидных гормонов, в первую очередь, страдает обмен аминокислот, при тиреотоксикозе в начале заболевания их количество возрастает (глютаминовая, аспарагиновая и др.), при гипотиреозе замедляется синтез белка и уменьшается количество аминокислот (Бородина Л.В. Секреция некоторых гормонов и их влияние на аминокислотный состав крови при тиреотоксикозе и гипотиреозе. Авт. канд. дис. М., 1982). Нарушение обмена аминокислот также отражается на интенсивности хода энергетического обмена в ЩЖ, а следовательно, и на структуре органа (гиперплазия, дистрофия).
Технической новизной предложения является физический метод исследования функции щитовидной железы, отличающийся тем, что на поверхность шеи в зону проекции щитовидной железы помещают стеклянную пластину, на которую в виде дорожки наносят 1% водный раствор аспарагиновой аминокислоты (1% ВРАА) объемом 0,03-0,05 мл, выдерживают пластину на поверхности органа на протяжении 3-5 минут, препарат высушивают в термостате при Т=+18-20°С в течение 2-3 минут, затем исследуют в поляризованном свете с кварцевым компенсатором и при наличии в препарате кристаллов - мелких перистых с отдельными ромбическими включениями диагностируют гиперфункцию щитовидной железы, а при наличии только ромбических включений - гипофункцию щитовидной железы.
Преимущества предложенного способа. Для диагностики гипер- и гипофункции ЩЖ применен 1% раствор аспарагиновой аминокислоты, который регистрирует биологическое излучение железы.
При микроскопии препарата возникает возможность оценить функциональное состояние ЩЖ - гипо- или гиперфункцию. Способ обеспечивает высокую информативность, эффективность диагностики. Соблюдается физиологичность и нативность способа. По сравнению с базовыми способами диагностики функции ЩЖ время исследования сокращается на 75%, а материальные затраты - на 80-85%.
Способ осуществляют следующим образом:
1. Готовят 1% водный раствор аспарагиновой аминокислоты (1% ВРАА).
2. Тарированной пипеткой 1% ВРАА наносят на стеклянную пластину в виде тонкой пленки-дорожки, объем жидкости 0,03-0,05 мл.
3. Стеклянную пластину с нанесенным на нее 1% ВРАА помещают на исследуемый участок кожи в зоне проекции ЩЖ (доли, перешеек), выдерживают на поверхности зоны проекции органа на протяжении 3-5 минут.
4. Препарат высушивают в термостате при Т=+18-20°С на протяжении 2-3 минут.
5. Образец исследуют в поляризованном свете с кварцевым компенсатором.
6. При наличии в препарате кристаллов - мелких перистых с отдельными ромбическими включениями регистрируют гиперфункцию щитовидной железы, при наличии только ромбических включений - гипофункцию.
Приводим структуру высушенного 1% водного раствора аспарагиновой аминокислоты, фиг.1, присутствуют крупные и мелкие зерна, представленные, преимущественно, ромбической формой.
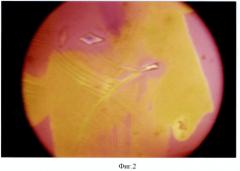
На фиг.2 приведена типовая структура 1% ВРАА, полученная при помещении стеклянной пластины с нанесенным на нее 1% ВРАА на зону проекции ЩЖ здорового человека. Видны крупные перистые кристаллы с единичным ромбическим включением.
Проведено 217 клинических исследований.
Приводим примеры.
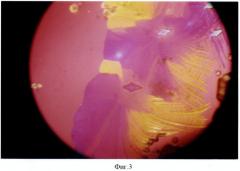
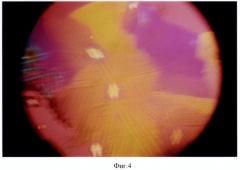
Пример 1, фиг.3, 4. Исследовали функцию щитовидной железы больной К. Диагноз (DS): Диффузный токсический зоб, средняя степень тяжести, впервые выявлен. История болезни (ИБ) №4812. На фиг.3, 4 приведены мелкие перистые кристаллы с ромбическими включениями.
Технология. На стеклянную пластину нанесли 0,03 мл 1% ВРАА в виде дорожки. Пластину расположили на поверхности шеи в зоне проекции ЩЖ и выдержали 5 минут. Затем высушили в термостате при Т=+18°С на протяжении 3 минут и исследовали в поляризованном свете с кварцевым компонентом (КК). Присутствуют мелкие перистые кристаллы с отдельными ромбическими включениями. Одновременно в СК больной определили содержание св. Т4, оно оказалось повышенным - 29 пмоль/л, (норма - 16,1±0,18 пмоль/л). Диагноз: гиперфункция (тиреотоксикоз) подтвердился.
Пример 2, фиг.5, 6. Исследовали ЩЖ больного У. DS: Смешанный токсический зоб, впервые выявлен. ИБ №4951. На фиг.5, 6 приведены мелкие перистые кристаллы с ромбическими включениями.
Технология. На стеклянную пластину нанесли 0,04 мл 1% ВРАА в виде дорожки и поместили на поверхность шеи в зону проекции щитовидной железы. Пластину выдержали на протяжении 4 минут, затем высушили при Т=+19°С на протяжении 3 минут и исследовали в поляризованном свете с кварцевым компонентом. Видны мелкие перистые кристаллы с отдельными ромбическими включениями. Одновременно в СК больного определили содержание св. Т4, оно оказалось повышенным - 34,5 пмоль/л. Диагноз гиперфункции ЩЖ подтвердился.
Пример 3, фиг.7. Исследовали ЩЖ больной Г. DS: Диффузный токсический зоб, впервые выявлен. ИБ №695. На фиг.7 приведены мелкие перистые кристаллы с ромбическими включениями.
Технология. На стеклянную пластину нанесли 0,05 мл 1% ВРАА в виде дорожки. Пластину поместили на поверхность шеи в зону проекции ЩЖ, выдержали на протяжении 5 минут, затем высушили при Т=+20°С на протяжении 2 минут и исследовали в поляризованном свете с КК. Видны мелкие перистые кристаллы с отдельными ромбическими включениями. Одновременно в СК больной определили содержание св. Т4, оно оказалось повышенным - 43,0 пмоль/л. Диагноз гиперфункции ЩЖ подтвердился.
Пример 4, фиг.8. Исследовалась функция ЩЖ больной Ф. DS: Узловой зоб I, гипотиреоз впервые выявлен. ИБ №349. На фиг.8 приведены только кристаллические ромбические включения.
Технология. На стеклянную пластину нанесли 0,05 мл 1% ВРАА в виде дорожки. Пластину поместили на поверхность шеи в зону проекции ЩЖ, выдержали 5 минут, препарат высушили при Т=+20°С на протяжении 3 минут. Изучили пробу в поляризованном свете с КК. В поле зрения присутствуют только кристаллические ромбические включения. Одновременно в СК больной определили содержание св. Т4, оно оказалось сниженным - 10,2 пмоль/л, норма - 16,1±0,18 пмоль/л. Диагноз гипофункции ЩЖ подтвердился.
Пример 5, фиг.9. Исследовалась функция ЩЖ больной Ш. DS: Послеоперационный гипотиреоз, впервые выявлен. ИБ №7918. На фиг.9 приведены кристаллические ромбические включения.
Технология. На стеклянную пластину нанесли 0,04 мл 1% ВРАА в виде дорожки. Пластину поместили в зону проекции ЩЖ, выдержали 4 минуты, затем высушили при Т=+19°С. При микроскопии в поляризованном свете с КК обнаружили кристаллические только ромбические включения. Одномоментно в СК больной определили уровень св. Т4, который оказался понижен - 7,2 пмоль/л. Диагноз гипофункции ЩЖ подтвердился.
Пример 6, фиг.10. Исследовалась функция ЩЖ больной Ж. DS: Аутоиммунный тиреоидит, гипотиреоз, впервые выявлен. ИБ №6152. На фиг.10 приведены кристаллические ромбические включения.
Технология. На стеклянную пластину нанесли 0,03 мл 1% ВРАА в виде дорожки, поместили в зону проекции ЩЖ, выдержали в ней 3 минуты, препарат высушили при Т=+18°С и подвергли микроскопии в поляризованном свете с КК. В поле зрения присутствуют только кристаллические ромбические включения. Одномоментно в СК больной определили уровень св. Т4, который оказался понижен - 9,0 пмоль/л. Диагноз: гипофункция ЩЖ подтвердился.
Способ диагностики гипер- и гипофункции щитовидной железы, включающий физический метод исследования, отличающийся тем, что на поверхность кожи шеи в зону проекции щитовидной железы помещают стеклянную пластину, на которую в виде дорожки наносят 1%-ный водный раствор аспарагиновой аминокислоты (1% ВРАА) объемом 0,03-0,05 мл, выдерживают пластину на поверхности шеи в зоне проекции щитовидной железы на протяжении 3-5 мин, препарат высушивают в термостате при Т=18-20°С в течение 2-3 мин, затем исследуют в поляризованном свете с кварцевым компенсатором и при наличии в препарате кристаллов - мелких перистых с отдельными ромбическими включениями диагностируют гиперфункцию щитовидной железы, при наличии только ромбических включений - гипофункцию щитовидной железы.