Не содержащая животных белков среда для культивирования клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению питательных сред для культивирования клеток, и может быть использовано для значительного снижения вариаций продукции рекомбинантных белков, которые имеют место при культивировании клеток с использованием разных партий коммерчески доступного соевого гидролизата. Получают не содержащую животных белков среду для культивирования клеток путем дополнения сред, не содержащих животные белки, гидролизатом сои и дополнительно - биогенным амином в диапазоне 1-18 мг/л. Полученную среду используют для получения рекомбинантных белков, посредством процессов культивирования соответствующих клеток. Изобретение позволяет понизить контагиозность продукта, а также увеличить эффективность роста и продуктивность клеток. 3 н. и 9 з.п. ф-лы, 9 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к не содержащей животных белков среде для культивирования клеток, содержащей полиамин и растительный и/или дрожжевой гидролизат. Это изобретение также относится к процессам культивирования без участия животных белков, где клетки можно культивировать, размножать и пересевать без добавления дополнительных животных белков в среду для культивирования. Эти процессы пригодны для культивирования клеток, таких как рекомбинантные клетки или клетки, инфицированные вирусом, и для получения биологических продуктов посредством процессов культивирования клеток.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Для культивирования клеток, в частности эукариотических клеток и, более конкретно, клеток млекопитающих, существует постоянная необходимость в применении специальных культуральных сред, которые обеспечивают доступность ростовых питательных веществ, которые необходимы для эффективного роста клеток и для продукции требуемых белков или вирусов. Для эффективной продукции биологических продуктов, таких как вирусы или рекомбинантные белки, важно достигать оптимальной клеточной плотности, а также увеличивать саму экспрессию белка для получения максимального выхода продукта.
Составы сред для культивирования клеток дополняют рядом добавок, включая компоненты с неопределенным составом, такие как эмбриональная телячья сыворотка (ЭТС), несколько белков и/или белковых гидролизатов животного происхождения, полученных от жвачных животных.
Как правило, сыворотка или полученные из сыворотки вещества, такие как альбумин, трансферрин или инсулин, могут содержать нежелательные вещества, которые могут загрязнять клеточные культуры и получаемые из них биологические продукты. Более того, добавки, получаемые из сыворотки человека, необходимо тестировать на все известные вирусы, включая вирус гепатита и ВИЧ, которые могут передаваться через сыворотку. Более того, бычья сыворотка и получаемые из нее продукты обладают риском заражения BSE. Кроме того, все получаемые из сыворотки продукты могут содержать примеси неизвестных составляющих. В случае добавок в виде сыворотки или белка, которые получают из человека или других животных источников в культуре клеток, существует ряд проблем (например, изменяющееся качество композиции различных партий и риск заражения микоплазмой, вирусами или BSE), особенно если клетки используют для продукции лекарственных средств или вакцин для введения человеку.
Таким образом, было предпринято множество попыток создать эффективные системы хозяев и условия культивирования, для которых не требуется сыворотка или другие смеси с животными белками. Как правило, простая среда, не содержащая сыворотки, включает в себя основную питательную среду, витамины, аминокислоты, органические или неорганические соли и необязательно дополнительные компоненты для получения комплексной питательной среды.
Известно, что гидролизаты сои пригодны для процессов выращивания и они могут усиливать рост множества требовательных к питательным средам организмов, дрожжей и грибов. В WO 96/26266 описано, что продукты расщепления соевой муки папаином являются источником углеводов и азота и многие из компонентов можно использовать при культивировании тканей. В Franek et al. (Biotechnology Progress (2000) 16, 688-692) описаны действия определенных пептидных фракций гидролизата сои на рост и повышение продуктивности.
В WO 96/15231 описана среда, не содержащая сыворотки, состоящая из синтетической минимальной поддерживающей среды и дрожжевого экстракта, для процессов размножения клеток позвоночных и продукции вирусов. Состав среды, состоящий из основной питательной среды для культивирования клеток, содержащей пептид риса и экстракт из дрожжей и продукты их ферментативного расщепления, и/или растительный липид для роста клеток животных, описан в WO 98/15614. Среда, содержащая очищенный гидролизат сои, для культивирования рекомбинантных клеток описана в WO 01/23527. В WO 00/03000 описана среда, которая содержит гидролизат сои и дрожжевой экстракт, но для которой также необходимо наличие рекомбинантных форм животных белков, таких как факторы роста.
В EP-A-O481791 описана культуральная среда с определенным биохимическим составом для культивирования полученных способами инженерии клеток CHO, которая не содержит белков, липидов и углеводов, выделенных из животного источника, дополнительно содержащая рекомбинантный инсулин или аналог инсулина, от 1% до 0,025% мас./об. пептона из расщепленной папаином сои и путресцин. В WO 98/08934 описана не содержащая сыворотки культура эукариотических клеток, содержащая гидролизованные пептиды сои (1-1000 мг/л), от 0,01 до 1 мг/л путресцина и ряд компонентов животного происхождения, включая альбумин, фетуин, различные гормоны и другие белки. В данном случае, следует также отметить, что путресцин, как известно, также содержится в стандартных средах, таких как DMEM/Ham F12 в концентрации 0,08 мг/л.
Однако среды, известные на существующем уровне техники, часто являются питательно неполными, и/или их необходимо дополнять белковыми добавками животного происхождения или рекомбинантными вариантами белков, таких как инсулин, инсулиноподобный фактор роста или другие факторы роста.
Таким образом, в настоящее время существует необходимость в повышении выхода экспрессируемого рекомбинантного белка или любого другого продукта экспрессии, удельной скорости роста клеток и в получении оптимальной среды для культивирования клеток, абсолютно не содержащей животных белков, для продукции биологических продуктов, таких как продукты, используемые в качестве фармацевтических средств или вакцин у человека.
На основе экстрактов пептона сои (также обозначаемых «гидролизатами сои») были разработаны среды, которые не содержат животных белков. Однако качество коммерчески доступных партий гидролизатов сои варьирует в высокой степени, и в результате происходят большие отклонения в продукции рекомбинантных белков или вирусных продуктов (отклонения вплоть до коэффициента, равного 3) в зависимости от используемых партий гидролизатов сои («отклонение от партии к партии»). Этот недостаток влияет на пролиферацию клеток, а также экспрессию клеткой белков.
Таким образом, существует необходимость в не содержащей животных белков культуральной среде, которая полностью не содержит животных белков и позволяет решить по меньшей мере одну из упомянутых выше проблем.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение не содержащей животных белков среды для культивирования клеток, которая не содержит каких-либо добавленных дополнительных белков, полученных из животных, и/или рекомбинантных животных белков, которая обеспечивает эффективный рост клеток и, в частности, продукцию белка постоянного качества в отношении экспрессируемого количества на клетку. Дополнительной целью настоящего изобретения является создание способа культивирования клеток и способа эффективной экспрессии рекомбинантных белков, которые не включают в себя животных белков.
Другой целью настоящего изобретения является уменьшение количества гидролизата растительного и/или животного происхождения в целях устранения ингибиторных эффектов, которые могут отрицательно влиять на выход требуемого рекомбинантного или вирусного продукта. Было выявлено, что гидролизаты являются причиной отклонений от партии к партии при продукции.
Не содержащая животных белков среда для культивирования клеток в соответствии с этим изобретением содержит по меньшей мере один полиамин и гидролизат растительного и/или дрожжевого происхождения, где источником полиамина предпочтительно служит источник, отличный от белкового гидролизата.
Удивительно, что добавление по меньшей мере одного полиамина, в частности добавление путресцина, в не содержащую животных белков среду для культивирования клеток приводит к положительному эффекту не только в отношении поддержания роста клеток, но, особенно, в отношении экспрессии белка на клетку и, в частности, экспрессии рекомбинантного белка на клетку.
Кроме того, не содержащая животных белков среда в соответствии с настоящим изобретением обеспечивает постоянный рост клеток и повышенный выход требуемых продуктов, в частности белков-мишеней, таких как рекомбинантные белки, независимый от качества и связанный с партией отклонений белкового гидролизата, в частности растительного гидролизата, в не содержащей животных белков среде для культивирования клеток. Определенное дополнение среды для культивирования клеток полиаминами и гидролизатом растительного и/или животного происхождения оказывает синергичное воздействие, повышая рост клеток, удельную клеточную продуктивность и конечную плотность клеток.
Таким образом, не содержащая животных белков среда в соответствии с настоящим изобретением является более пригодной в отношении экспрессии рекомбинантных белков и скорости роста клеток по сравнению со средами, известными в данной области. Более того, не содержащая животных белков среда в соответствии с настоящим изобретением дает возможность уменьшения количества белкового гидролизата, добавляемого в данный объем среды для культивирования клеток.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
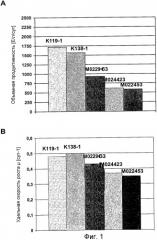
На фиг.1 представлен график для сравнения (A) объемной продуктивности для FVIII-CoA (выраженной в [Е/л/сут] =количество единиц FVIII-COA на объем реактора в литрах в сутки) и (B) удельной скорости роста (μ, выраженной в [сут-1] =1 в сутки) клеток GD8/6, в зависимости от используемых для культивирования сред, которые дополняли гидролизатом сои (0,4% (мас./об.)) из различных партий (K119-1, K138-1, M022963, M024423, M022453).
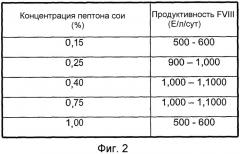
На фиг.2 представлена таблица для сравнения объемной продуктивности для FVIII-CoA клеток GD8/6, выращенных на средах с различными концентрациями гидролизата сои.
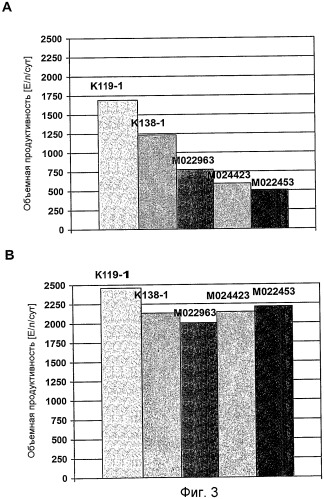
На фиг.3 представлен график для сравнения объемной продуктивности для FVIII-CoA клеток GD8/6, в зависимости от используемых для культивирования сред, которые дополняли гидролизатами сои (0,25% (мас./об.)) из 5 различных партий (K119-1, K138-1, M022963, M024423, M022453) (A) в отсутствии путресцина и (B) в присутствии 1 мг/л путресцина·2HCl.
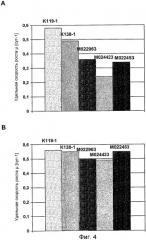
На фиг.4 представлен график для сравнения удельных скоростей роста клеток GD8/6, в зависимости от используемых для культивирования сред, которые дополняли гидролизатами сои (0,25% (мас./об.)) из 5 различных партий (K119-1, K138-1, M022963, M024423, M022453) (A) в отсутствии путресцина и (B) в присутствии 1 мг/л путресцина·2HCl.
На фиг.5 представлена таблица для сравнения объемной продуктивности в отношении FVIII-CoA (QP [Е/л/сут]) и удельной скорости роста (μ[сут-1]) с их стандартными отклонениями для клеток GD8/6, выращенных на средах с гидролизатами сои (0,4% (мас./об.) или 0,25% (мас./об.)) из 5 различных выбранных партий (К119-1, К138-1, М022963, М024423, М022453), с указанными гидролизатами сои (0,25% (мас./об.)) с путресцином·2HCl в концентрации 1 мг/л и без него.
На фиг.6 представлена таблица, в которой показаны средние концентрации путресцина, выявленные в гидролизатах сои (0,4% (мас./об.) в среде для культивирования клеток), от различных производителей.
На фиг.7 представлена таблица для сравнения эффекта гидролизата сои (0,4% (мас./об.)) и гидролизата сои (0,25% (мас./об.))+1,8 мг/л путресцина·2HCl на объемную продуктивность (QP, выраженную в [мг IgGl/объем реактора в литрах/сутки] и удельную клеточную продуктивность (Qp [мкг IgGl/10E06 клеток/сут]) в клетках ARH77, секретирующих моноклональные антитела.
На фиг.8 представлен график для сравнения эффекта гидролизата сои (0,25% (мас./об.)) и гидролизата сои (0,25% (мас./об.))+1 мг/л путресцина (1,8 мг/л путресцина·2НСl) на удельную клеточную продуктивность эритропоэтина ЕРО в клетках ВНК (продукция ЕРО (единицы)/потребление глюкозы (г)).
На фиг.9 представлена таблица для сравнения эффекта путресцина, орнитина и спермина в широком диапазоне концентраций (0-18 мг/л) на удельный рост (абсолютное значение µ, относительное значение µ) и клеточную удельную продуктивность (абсолютное значение Qp, относительное значение Qp) в клетках GD8/6, культивируемых в среде BAV, не содержащей гидролизат сои и не содержащей аминов, или в среде BAV, содержащей сниженную концентрацию гидролизата сои, составляющую 0,25%, дополненной полиаминами в концентрациях, находящихся в указанном выше диапазоне. BAV - SP 0,25% =среда BAV, содержащая 0,25% гидролизат сои; BAV - SP 0,4% =среда BAV, содержащая 0,4% гидролизат сои; BAV w/o сои без полиаминов =среда BAV, не содержащая ни гидролизата сои, ни полиаминов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Один аспект этого изобретения относится к не содержащей животного белка среде для культивирования клеток, содержащей по меньшей мере один полиамин и гидролизат растительного и/или дрожжевого происхождения в достаточно уменьшенной концентрации для избежания возможных ингибиторных эффектов гидролизата.
Термин «полиамин» относится к любому из группы органических соединений, состоящих из углерода, азота и водорода и содержащих две или более аминогруппы. Например, термин включает в себя молекулы, выбранные из группы, состоящей из кадаверина, путресцина, спермидина, спермина, агматина и орнитина.
Если нет иных указаний, значения концентраций, указанные на всем протяжении этого документа, относятся к формам свободного основания компонента(ов).
В предпочтительном варианте осуществления не содержащей животного белка среды для культивирования клеток концентрация полиамина в среде находится в диапазоне концентраций от приблизительно 0,5 мг/л до приблизительно 30 мг/л, более предпочтительно от приблизительно 0,5 мг/л до приблизительно 20 мг/л, более предпочтительно от приблизительно 0,5 мг/л до приблизительно 10 мг/л, более предпочтительно от приблизительно 2 мг/л до приблизительно 8 мг/л, наиболее предпочтительно от приблизительно 2 до приблизительно 5 мг/л.
В предпочтительном варианте осуществления общая концентрация белкового гидролизата растительного и/или животного происхождения в не содержащей животного белка среде для культивирования клеток составляет от приблизительно 0,05% до приблизительно 5% (мас./об.), более предпочтительно от приблизительно 0,05% до приблизительно 2% (мас./об.), более предпочтительно от приблизительно 0,05% до приблизительно 1% (мас./об.), более предпочтительно от приблизительно 0,05% до приблизительно 0,5% (мас./об.), наиболее предпочтительно от приблизительно 0,05% до приблизительно 0,25% (мас./об.); т.е. если среда содержит белковый гидролизат растительного и животного происхождения, то общую концентрацию вычисляют суммированием значений концентраций каждого из содержащихся в среде компонентов в виде белкового гидролизата.
Термин «не содержащая животных белков культуральная среда» в соответствии с этим изобретением относится к среде, которая не содержит белков и/или белковых компонентов из высших многоклеточных не относящихся к растениям эукариот. Типичные белки, которых избегают, представляют собой белки, находящиеся в сыворотке и в полученных из сыворотки веществах, таких как альбумин, трансферрин, инсулин и другие факторы роста. Не содержащая животных белков культуральная среда также не содержит каких-либо очищенных продуктов животного происхождения и рекомбинантных продуктов животного происхождения, а также продуктов расщепления белков и их экстрактов, или липидных экстрактов, или их очищенных компонентов. Животные белки и белковые компоненты необходимо отличать от неживотных белков, коротких пептидов и олигопептидов, получаемых из растений (как правило, длиной 10-30 аминокислот), таких как соя, и низших эукариот, таких как дрожжи, которые могут быть включены в не содержащую животных белков культуральную среду в соответствии с этим изобретением.
Основой не содержащей животных белков культуральной среды в соответствии с этим изобретением может быть любая основная питательная среда, такая как DMEM, Ham F12, среда 199, среда Мак-Коя или RPMI, как правило, известная квалифицированному специалисту. Основная питательная среда может содержать множество ингредиентов, включая аминокислоты, витамины, органические и неорганические соли и источники углеводов, где каждый ингредиент представлен в количестве, которое обеспечивает культивирование клетки, которое, как правило, известно специалисту в данной области. Среда может содержать вспомогательные вещества, такие как буферные вещества, такие как бикарбонат натрия, антиоксиданты, стабилизаторы для противодействия механическому воздействию или ингибиторы протеаз. Если необходимо, можно добавлять неионное поверхностно-активное вещество, такое как смеси полиэтиленгликолей и полипропиленгликолей (например, плюроник F68®, SERVA), в качестве противопенного вещества.
Полиамин, используемый для не содержащей животного белка культуральной среды в соответствии с этим изобретением, может быть выбран из группы, состоящей из кадаверина, путресцина, спермидина, спермина, агматина, орнитина и их сочетаний. Наиболее предпочтительно, не содержащая животных белков культуральная среда содержит орнитин, путресцин и спермин.
В предпочтительном варианте осуществления не содержащей животного белка культуральной среды полиамин регулирует синтез ДНК и РНК, пролиферацию клеток, дифференцировку клеток, стабилизацию мембран и/или антиокислительную защиту ДНК. Путресцин, спермидин, спермин и орнитин представляют собой примеры полиаминов, которые проявляют эти функции. Другим примером полиамина является кадаверин.
В другом предпочтительном варианте осуществления не содержащей животных белков среды для культивирования клеток в соответствии с этим изобретением, источником полиамина является источник, отличный от белкового гидролизата.
В дополнительном предпочтительном варианте осуществления не содержащей животных белков среды для культивирования клеток, полиамин находится в среде в концентрации, находящейся в диапазоне от приблизительно 0,5 до приблизительно 30 мг/л, более предпочтительно от приблизительно 0,5 мг/л до приблизительно 20 мг/л, более предпочтительно от приблизительно 0,5 мг/л до приблизительно 10 мг/л, более предпочтительно от приблизительно 2 мг/л до приблизительно 8 мг/л, наиболее предпочтительно от приблизительно 2 до приблизительно 5 мг/л, и белковый гидролизат растительного и/или дрожжевого происхождения находится в среде в концентрации, находящейся в диапазоне от приблизительно 0,05% до приблизительно 5% (мас./об.), более предпочтительно от приблизительно 0,05% до приблизительно 2% (мас./об.), более предпочтительно от приблизительно 0,05% до приблизительно 1% (мас./об.), более предпочтительно от приблизительно 0,05% до приблизительно 0,5% (мас./об.), наиболее предпочтительно от приблизительно 0,05% до приблизительно 0,25% (мас./об.).
Белковый гидролизат растительного происхождения, используемый для не содержащей животных белков среды для культивирования клеток в соответствии с этим изобретением, предпочтительно выбирают из группы, состоящей из гидролизата зерновых злаков и/или гидролизата сои. Гидролизат сои может представлять собой в высокой степени очищенный гидролизат сои, очищенный гидролизат сои или неочищенный гидролизат сои.
Термин «гидролизат» включает в себя любой продукт ферментативного расщепления растительного или дрожжевого экстракта. Кроме того, «гидролизат» может быть ферментативно расщеплен, например, папаином и/или может быть образован посредством аутолиза, термического расщепления и/или плазмолиза. Также гидролизаты для применения в соответствии с настоящим изобретением являются коммерчески доступными, такими как HyPep 1510®, Hy-Soy®, Hy-Yeast 412® и Hi-Yeast 444®, из источников, таких как Quest International, Norwich, NY, OrganoTechnie, S.A. France, Deutsche Hefewerke GmbH, Germany или DMV Intl. Delhi, NY. Источники дрожжевых экстрактов и гидролизаты сои также описаны в WO 98/15614, WO 00/03000, WO 01/23527 и патенте США 5741705.
Гидролизаты предпочтительно являются очищенными из неочищенной фракции, так как примеси могут препятствовать эффективному культивированию. Очистку можно проводить ультрафильтрацией или хроматографией с сефадексом, например с сефадексом 25 или сефадексом G10, или эквивалентными материалами, ионообменной хроматографией, аффинной хроматографией, гель-фильтрацией или хроматографией с обращенной фазой. Фракции могут содержать гидролизаты с определенной молекулярной массой, предпочтительно вплоть до приблизительно 1000 дальтон, более предпочтительно вплоть до приблизительно 500 дальтон, наиболее предпочтительно вплоть до приблизительно 350 дальтон. По меньшей мере приблизительно 90% гидролизата предпочтительно обладает молекулярной массой вплоть до приблизительно 1000 дальтон. Средняя молекулярная масса гидролизатов составляет предпочтительно между приблизительно 220 и приблизительно 375 дальтон. Значение pH гидролизата должно находиться в диапазоне от приблизительно 6,5 до приблизительно 7,5. Общее содержание азота предпочтительно составляет между приблизительно 5 и приблизительно 15%, и минеральный остаток предпочтительно составляет вплоть до приблизительно 20%. Содержание свободных аминокислот предпочтительно составляет между приблизительно 5% и приблизительно 30%. Содержание эндотоксина предпочтительно составляет менее чем приблизительно 500 Е/г.
Это изобретение также относится к способу применения по меньшей мере одного полиамина для добавления в не содержащую животных белков среду для культивирования клеток, содержащую белковый гидролизат растительного и/или животного происхождения, для повышения выхода экспрессируемого белка в культивируемых клетках. В соответствии с предпочтительным вариантом осуществления этого изобретения, полиамин находится в культуральной среде в общей концентрации, находящейся в диапазоне от приблизительно 0,5 до приблизительно 30 мг/л, более предпочтительно от приблизительно 0,5 мг/л до приблизительно 20 мг/л, более предпочтительно от приблизительно 0,5 мг/л до приблизительно 10 мг/л, более предпочтительно от приблизительно 2 мг/л до приблизительно 8 мг/л, наиболее предпочтительно от приблизительно 2 до приблизительно 5 мг/л в среде. Предпочтительно, полиамин выбирают из группы, состоящей из кадаверина, путресцина, спермидина, спермина, агматина, орнитина и их сочетаний. Предпочтительно, белковый гидролизат растительного и/или дрожжевого происхождения находится в среде в концентрации, находящейся в диапазоне от приблизительно 0,05% до приблизительно 5% (мас./об.), более предпочтительно от приблизительно 0,05% до приблизительно 2% (мас./об.), более предпочтительно от приблизительно 0,05% до приблизительно 1% (мас./об.), более предпочтительно от приблизительно 0,05% до приблизительно 0,5% (мас./об.), наиболее предпочтительно от приблизительно 0,05% до приблизительно 0,25% (мас./об.).
Кроме того, настоящее изобретение относится к способу культивирования клеток, включающему в себя стадии:
(a) получения не содержащей животных белков среды для культивирования клеток в соответствии с этим изобретением,
(b) размножения клеток в среде с формированием клеточной культуры.
В предпочтительном варианте осуществления не содержащая животных белков среда для культивирования клеток содержит по меньшей мере один полиамин и гидролизат растительного и/или животного происхождения. Предпочтительно, источником полиамина является источник, отличный от белкового гидролизата.
Настоящее изобретение не ограничивается каким-либо типом клеток. В предпочтительном варианте осуществления по этому изобретению используемые клетки представляют собой, например, клетки млекопитающих, клетки насекомых, клетки птиц, бактериальные клетки, клетки дрожжей. Клетки могут представлять собой, например, стволовые клетки или рекомбинантные клетки, трансформированные вектором для экспрессии рекомбинантного гена, или клетки, трансфецированные вирусом для продукции вирусных продуктов. Клетки, например, также могут представлять собой клетки, продуцирующие требуемый белок без рекомбинантной трансформации, например продуцирующие антитела B-клетки, которые могут быть трансформированы в иммортализованное состояние, например, посредством вирусной инфекции, такой как инфекция вирусом Эпштейна-Барр. Также клетки могут представлять собой, например, первичные клетки, например клетки куриного эмбриона, или первичные клеточные линии. Предпочтительными являются клетки, которые используют для продукции вируса in vitro. В предпочтительном варианте осуществления клетки могут представлять собой клетки BSC, клетки LLC-MK, клетки CV-1, клетки COS, клетки VERO, клетки MDBK, клетки MDCK, клетки CRFK, клетки RAF, клетки RK, клетки TCMK-1, клетки LLCPK, клетки PK15, клетки LLC-RK, клетки MDOK, клетки BHK-21, клетки CHO, клетки NS-1, клетки MRC-5, клетки WI-38, клетки BHK, клетки 293, клетки RK и клетки куриного эмбриона.
Клетки, используемые в соответствии с настоящим изобретением, можно культивировать способом, выбранным из группы из периодического культивирования, культивирования с подпиткой, перфузионного культивирования и культивирования в хемостате, все из которых, главным образом, известны в данной области.
Кроме того, настоящее изобретение относится к способу экспрессии белка-мишени, такого как гетерологичный, или аутологичный белок, или рекомбинантный белок, включающему в себя стадии:
a) получения культуры клеток, выращенной на не содержащей животных белков среде для культивирования клеток в соответствии с этим изобретением;
b) введения последовательности нуклеиновой кислоты, содержащей последовательность, кодирующую белок-мишень, в клетки;
c) селекции клеток, включающих последовательность нуклеиновой кислоты;
d) селективной индукции экспрессии белка-мишени в клетках.
В предпочтительном варианте осуществления не содержащая животных белков среда для культивирования клеток содержит по меньшей мере один полиамин и гидролизат растительного и/или животного происхождения. Предпочтительно, источником полиамина является источник, отличный от белкового гидролизата.
Последовательность нуклеиновой кислоты, содержащая последовательность, кодирующую белок-мишень, может представлять собой вектор. Вектор может представлять собой вирус или плазмиду. Последовательность, кодирующая белок-мишень, может представлять собой конкретный ген или биологически функциональную его часть. В предпочтительном варианте осуществления белок-мишень представляет собой по меньшей мере биологически активную часть фактора свертываемости крови, такого как фактор VIII, или по меньшей мере биологически активную часть белка, вовлеченного в продукцию эритроцитов и ангиогенез, такого как эритропоэтин, или моноклональное антитело.
Предпочтительно нуклеиновая кислота дополнительно содержит другие последовательности, пригодные для контролируемой экспрессии белка-мишени, такие как промоторные последовательности, энхансеры, TATA-боксы, участки инициации транскрипции, полилинкеры, участки рестрикции, поли-A-последовательности, последовательности для процессинга белка, маркеры селекции и т.п., которые в основном известны специалисту в данной области.
Наиболее предпочтительными являются следующие клеточные линии, трансформированные рекомбинантным вектором для экспрессии соответствующих продуктов: клетки CHO для продукции рекомбинантного фактора свертываемости VIII, клетки BHK для продукции рекомбинантного эритропоэтина, трансформированные вирусом Эпштейна-Барр, B-клетки человека для продукции антител человека.
Кроме того, настоящее изобретение относится к способу продуцирования вируса или части вируса, включающему в себя стадии:
a) получения культуры клеток, выращенной на не содержащей животных белков среде для культивирования клеток в соответствии с этим изобретением;
b) инфицирования клеток вирусом;
c) селекции инфицированных вирусом клеток;
d) инкубации клеток для размножения вируса.
В предпочтительном варианте осуществления не содержащая животных белков среда для культивирования клеток содержит по меньшей мере один полиамин и гидролизат растительного и/или животного происхождения. Более предпочтительно, источником полиамина является источник, отличный от белкового гидролизата.
Вирус, используемый в способе в соответствии с этим изобретением, может представлять собой любой патогенный вирус млекопитающего, предпочтительно вирус человека, такой как вирус осповакцины или аттенуированный вирус осповакцины, например противооспенной вакцины, коронавирус, предпочтительно вирус SARS, например, для продукции вакцины SARS, ортомиксовирус, предпочтительно вирус гриппа, например, для продукции вакцины против гриппа, парамиксовирус, ретровирус, вирус гриппа A или B, вирус реки Росс, флавивирус, предпочтительно вирус западного Нила или вирус FSME (т.е. вирус клещевого энцефалита), например, для продукции соответствующих вакцин, пикорнавирус, аренавирус, вирус герпеса, поксвирус или аденовирус.
Вирус может представлять собой вирус дикого типа, аттенуированный вирус, реассортантный вирус, рекомбинантный вирус, или их сочетание, например аттенуированный и рекомбинантный вирус. Кроме того, вместо использования обычных вирионов для инфицирования клеток вирусом, можно использовать инфекционный клон нуклеиновой кислоты. Также можно использовать расщепленные вирионы.
Способ экспрессии белка или продукции вируса можно использовать для получения иммуногенных композиций, содержащих вирус или вирусный антиген.
Клетки, используемые для способа продукции вируса, могут быть выбраны из группы, состоящей из клеток млекопитающих, клеток насекомых, клеток птиц, бактериальных клеток и клеток дрожжей. Предпочтительно, клетки культивируют способом, выбранным из группы, состоящей из серийного культивирования, культивирования с подпиткой, перфузионного культивирования и культивирования в хемостате.
Предпочтительными сочетаниями клеток с вирусами для продукции вируса или части вируса являются сочетания: клетки Vero/аттенуированная осповакцина, клетки Vero/осповакцина, клетки Vero/гепатит A, клетки Vero/вирус гриппа, клетки Vero/вирус западного Нила, клетки Vero/вирус SARS, клетки куриного эмбриона/вирус FSME.
Кроме того, настоящее изобретение относится к способу применения не содержащей животных белков среды для культивирования клеток в соответствии с этим изобретением для культивирования клеток, экспрессирующих белок-мишень.
Настоящее изобретение далее дополнительно иллюстрируется следующими примерами, не ограничиваясь ими.
ПРИМЕРЫ
Пример 1 (среда BAV)
Не содержащую животных белков среду получали на основе основной питательной среды DMEM/HAM F12 (1:1), дополненной неорганическими солями, аминокислотами, витаминами и другими компонентами (Life technologies, 32500 Powder).
Также добавляли L-глутамин (600 мг/л), аскорбиновую кислоту (20 мкМ), этаноламин (25 мкМ), Synperonic® (SERVA) (0,25 г/л), селенит натрия (50 нМ). Кроме того, в среду для культивирования клеток добавляли незаменимые аминокислоты. Кроме того, добавляли различные концентрации гидролизата сои (Quest Technologies, NY или DMV Intl., NY) в диапазоне до 1,0% и различные концентрации полиаминов в диапазоне до 10 мг/л (фиг.1-9).
Пример 2
Клеточные культуры рекомбинантных клеток млекопитающих (например, клетки СНО, стабильно экспрессирующие фактор VIII = клетки GD8/6) выращивали в 10 л биореакторах в суспензии в культуре в хемостате. Условия культивирования, представляющие собой 37°С, насыщение кислородом 20% и pH от 7,0 до 7,1 сохраняли постоянными. Культуры обеспечивали постоянным питанием в виде среды BAV, как определено в примере 1, дополнительно дополненной гидролизатами сои в диапазоне до 1,0% и/или добавлением путресцина·2HCl в диапазоне до 1 мг/л (сравнить с фиг.1-5).
Мелкомасштабные эксперименты с клетками GD8/6 в суспензионной культуре проводили во вращающихся колбах Techne с рабочим объемом 200 мл в условиях повторного питания партии при 37°С, без контроля pH и pO2. Культуры обеспечивали средой BAV, как определено в примере 1, без добавления гидролизата сои и полиаминов или с добавлением гидролизата сои в диапазоне 0,1-0,4% и/или путресцина·2HCl, орнитина·HCl, спермина·4HCl в диапазоне до 18 мг/л (эквивалентном 0-10 мг/л полиамина без HCl (сравнить с фиг.9).
Пример 3 (сравнить с фиг.1-5, 7 и 9)
Количество клеток из суспензии клеток или иммобилизованных клеток определяли либо посредством подсчета с помощью устройства для подсчета клеток CASY®, как описано Scharfe et al., (Biotechnologie in LaborPraxis 10:1096-1103 (1988)) или посредством экстракции лимонной кислотой и флуоресцентного окрашивания ядер с последующим подсчетом с помощью NucleoCounter® (Chemometec, DK). Удельную скорость роста (µ) вычисляли исходя из повышения клеточных плотностей (Xt) и/или степени разбавления (D) суспензионных клеточных культур в хемостате в устойчивой фазе на протяжении определенного интервала (t):
µ =D + ln (Xt/X0)/t
Пример 4
Активность фактора VIII (FVIII) (сравнить с фиг.1-5 и 9) измеряли с помощью хромогенного анализа (Chromogenic, Sweden). Активность эритропоэтина (сравнить с фиг.8) и титр моноклональных антител (сравнить с фиг.7) измеряли посредством тест-систем ELISA.
Объемную продуктивность вычислили исходя из количества единиц активности или титров антител, полученных на объем реактора, равный литру, в сутки (Е/л/сут или мг/л/сут), в соответствующих системах продукции.
Удельную клеточную продуктивность определяют как удельное количество продуцируемого белка (Е или мкг) на число клеток в сутки (сравнить с фиг.7 и 9) или как удельное количество продуцируемого белка (Е), продуцируемого на количество D-глюкозы, потребляемой клетками (сравнить с фиг.8).
Пример 5
Клетки GD8/6 обеспечивали средой BAV, содержащей 0,4% (мас./об.) гидролизат сои различных партий. Объемная продуктивность для FVIII варьировала от приблизительно 600 до 1800 Е/л/сут, и удельная скорость роста для различных партий варьировала от 0,35 до 0,52 µ[сут-1] (сравнить с фиг.1). Эти данные указывают на то, что партии гидролизата сои в концентрации 0,4% не обеспечивают постоянного роста клеток GD8/6, возможно, вследствие ингибирующих веществ, влияющих на удельную скорость роста (µ), которые содержатся в гидролизатах сои.
Пример 6
Клетки GD8/6 обеспечивали средой BAV, содержащей различные концентрации гидролизата сои партии M022257 (в диапазоне 0,15-1,0% мас./об.). Объемная продуктивность для FVIII варьировала от 500 до 1100 Е/л/сут и достигала оптимальной продуктивности 1100 Е/л/сут при концентрации гидролизата сои 0,4% (мас./об.) (сравнить с фиг.2).
Пример 7
Клетки GD8/6 обеспечивали средой BAV, содержащей 0,25% (мас./об.) гидролизат сои указанных выше 5 различных партий гидролизата сои, как описано в примере 5 (фиг.3A и 4A), и 0,25% (мас./об.) гидролизат сои указанных партий гидролизата сои, дополнительно дополненный 1 мг/л путресцина·2HCl (фиг.3B и 4B) соответственно. Объемная продуктивность для FVIII варьировала от 1700 Е/л/сут до 500 Е/л/сут в клетках, выращенных на среде BAV-SP, содержащей 0,25% (мас./об.) гидролизат сои различных партий гидролизата сои (фиг.3A). Удельная скорость роста варьировала от 0,58 до 0,24 µ[сут-1], указывая на то, что снижение концентрации гидролизата сои не приводит к улучшенной или более постоянной скорости роста клеток (фиг.4A).
Напротив, только незначительные отклонения объемной продуктивности для FVIII (фиг.3-B) и удельной скорости роста (фиг.4B) между указанными партиями гидролизата сои наблюдались в клетках, выращенных на среде BAV, содержащей 0,25% (мас./об.) гидролизат сои с добавлением 1 мг/л путресцина·2HCl. Добавление 1 мг/л путресцина·2HCl почти компенсирует снижение этого полиамина посредством снижения концентрации гидролизата сои от 0,4% (мас./об.) до 0.25% (мас./об.). Исходя из этого можно заключить, что к уменьшению ингибиторных веществ приводит не концентрация самого полиамина, а добавление полиамина в сочетании со снижением концентрации гидролизата сои, который снижает рост и продуктивность (см. пример 5). Более того, добавление путресцина также приводит к относительно пропорциональному повышению объемной продуктивности для FVIII вследствие повышения удельной клеточной продуктивности для FVIII (фиг.5).
Таким образом, добавление путресцина в не содержащую животных белков среду для культивирования клеток не только обеспечивает скорость экспрессии белка в культивируемых клетках, но также снижает количество растительного гидролизата, который необходимо включать в культуральную среду в целях получения такого же клеточного роста. В результате, в