Новые производные триметилциклододекатриена, их применение и содержащие их парфюмерные продукты
Иллюстрации
Показать всеИзобретение относится к смесям душистых соединений, выбранных из смеси соединений (5a-d), (6a-d), (6a'-6d'), (7a-d) и (7a'-7d'), к способу получения данных смесей, к душистой, парфюмерной и косметической композициям, а также продукту бытовой химии на их основе и к применению данных смесей или душистой композиции на их основе в качестве душистого агента, агента, маскирующего или нейтрализующего запах.
и
где R обозначает метильную группу,
и
где R обозначает этильную группу. 7 н. и 9 з.п. ф-лы.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к новым душистым соединениям, которые могут найти применение в парфюмерии. Изобретение относится также к новым макроциклическим спиртам и простым эфирам, способу их синтеза и их применению в парфюмерии благодаря их душистым свойствам.
Уровень техники
Термин «парфюмерия» используется здесь не только для обозначения парфюмерии в обычном смысле этого слова, но также и других областей, в которых важен запах продуктов. Речь может идти о парфюмерных композициях в обычном смысле этого слова, таких как душистые основы и концентраты, одеколоны, туалетная вода, духи и подобные им продукты; композициях для местного применения, в частности косметических продуктах, таких как кремы для лица и для тела, тальковые пудры, тальк, масла для волос, шампуни, капиллярные лосьоны, соли и масла для ванны, гели для душа и для ванны, туалетные мыла, антиперспиранты и дезодоранты для тела, лосьоны и кремы для бритья, мыла, кремы, зубные пасты, полоскания для рта, помады и подобные продукты; и продуктах бытовой химии, таких как мягчители, моющие средства, стиральные средства, освежители воздуха и подобные продукты.
Выражение душистое вещество используется здесь для обозначения соединения, которое распространяет запах.
Макроциклы уже находят применение в парфюмерии. В частности, тримеризация изопрена дает смесь макроциклических алкенов, которые в основном содержат два стереоизомера в разных соотношениях, в частности 1,5,10-триметилциклододека-1,5,9-триен и 1,5,9-триметилциклододека-1,5,9-триен. Эта смесь макроциклов обеспечивает парфюмерную промышленность недорогим сырьем. Некоторые производные, из которых лишь в качестве примера можно назвать такие как Cedroxyde™ (триметил-13-оксабицикло[10.1.0]тридека-4,8-диен) от Firmenich, Boisanol™ от Symrise или Trimofix™O (метил-2,5,10-триметил-2,5,9-циклодекатриен-1-илкетон) от IFF, имеют широкое применение.
С другой стороны, в патенте US 3723478 на имя Firmenich описывается окисление некоторых триметилциклододекатриенов до кетонных производных. Триметилциклододекадиеноны получают эпоксидированием с последующим раскрытием эпоксида и окислением. Однако выходы на стадиях такого направления синтеза невелики, а превращения не очень селективны.
В связи с этим существует потребность в новых душистых макроциклах и в способе синтеза с улучшенными выходом и селективностью.
Раскрытие изобретения
Авторы изобретения неожиданным образом открыли новый способ синтеза новых макроциклов, которые обладают душистыми свойствами и которые могут благодаря этому найти применение в парфюмерии.
Таким образом, целью настоящего изобретения является новое семейство циклических макромолекул, представленных следующей формулой (I):
в которой:
A)
а) каждый из R4, R5 и R7 обозначает атом водорода, а каждый из R3, R6 и R8 обозначает метильный радикал или
b) каждый из R4, R6 и R7 обозначает атом водорода, а каждый из R3, R5 и R8 обозначает метильный радикал или
c) каждый из R3, R6 и R7 обозначает атом водорода, а каждый из R4, R5 и R8 обозначает метильный радикал,
обозначенные пунктиром связи присутствуют и обозначают цис- или транс-двойные связи, a R1 обозначает атом водорода и R2 обозначает группу -ОН, -ОСН3 или -ОС2Н5, или
обозначенные пунктиром связи отсутствуют, а R1 обозначает атом водорода и R2 обозначает группу -ОСН3 или -ОС2Н5,
или
B)
каждый из R1, R4 и R6 обозначает атом водорода, а каждый из R2, R3 и R5 обозначает метильный радикал
и
обозначенные пунктиром связи присутствуют и обозначают цис- или транс-двойные связи, a R7 обозначает атом водорода и R8 группу -ОН, -ОСН3 или -OC2H5, или
обозначенные пунктиром связи отсутствуют, a R7 обозначает атом водорода и R8 обозначает группу -ОСН3 или -ОС2Н5.
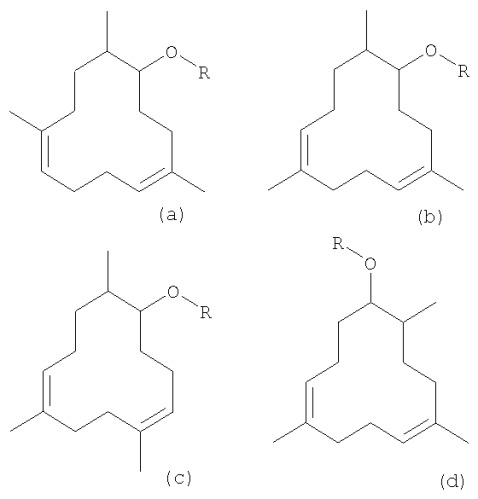
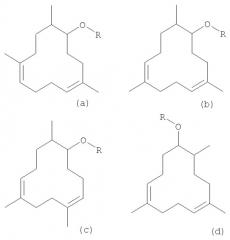
В частности, целью изобретения являются новые соединения приведенной ниже формулы (5a-d), (6a-d), (6a'-d')
в которой R обозначает атом водорода (соединения 5а, 5b, 5c, 5d), метильную группу (соединения 6а, 6b, 6с, 6d) или этильную группу (соединения 6а', 6b', 6с', 6d').
Соединения 5а, 6а, 6а' являются соединениями формулы (I), где
R1 обозначает атом водорода,
R2 обозначает группу -ОН (соединение 5а), -ОСН3 (соединение 6а) или -ОС2Н5 (соединение 6а'),
R3 обозначает метильную группу,
R4 обозначает атом водорода,
R5 обозначает атом водорода,
R6 обозначает метильную группу,
R7 обозначает атом водорода,
R8 обозначает метильную группу и
двойные связи присутствуют.
Соединения 5b, 6b, 6b' являются соединениями формулы (I), где
R1 обозначает атом водорода,
R2 обозначает группу -ОН (соединение 5b), -ОСН3 (соединение 6b) или -OC2H5 (соединение 6b'),
R3 обозначает метильную группу,
R4 обозначает атом водорода,
R5 обозначает метильную группу,
R6 обозначает атом водорода,
R7 обозначает атом водорода,
R8 обозначает метильную группу и
двойные связи присутствуют.
Соединения 5с, 6с, 6с' являются соединениями формулы (I), где
R1 обозначает атом водорода,
R2 обозначает группу -ОН (соединение 5с), -ОСН3 (соединение 6с) или -OC2H5 (соединение 6с'),
R3 обозначает атом водорода,
R4 обозначает метильную группу,
R5 обозначает метильную группу,
R6 обозначает атом водорода,
R7 обозначает атом водорода,
R8 обозначает метильную группу и
двойные связи присутствуют.
Соединения 5d, 6d, 6d' являются соединениями формулы (I), где
R1 обозначает атом водорода,
R2 обозначает метильную группу,
R3 обозначает метильную группу,
R4 обозначает атом водорода,
R5 обозначает метильную группу,
R6 обозначает атом водорода,
R7 обозначает атом водорода,
R8 обозначает группу -ОН (соединение 5d), -ОСН3 (соединение 6d) или -OC2H5 (соединение 6d') и
двойные связи присутствуют.
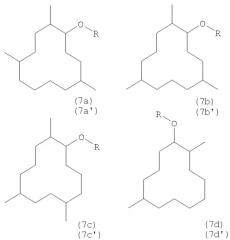
В частности, целью изобретения являются также новые соединения приведенной ниже формулы (7a-d), (7a'-d')
в которой R обозначает метильную группу (соединения 7а, 7b, 7c, 7d) или этильную группу (соединения 7а', 7b', 7c', 7d').
Соединения 7а, 7а' являются соединениями формулы (I), где
R1 обозначает атом водорода,
R2 обозначает группу -ОСН3 (соединение 7а) или -OC2H5 (соединение 7а'),
R3 обозначает метильную группу,
R4 обозначает атом водорода,
R5 обозначает атом водорода,
R6 обозначает метильную группу,
R7 обозначает атом водорода,
R8 обозначает метильную группу и
двойные связи отсутствуют.
Соединения 7b, 7b' являются соединениями формулы (I), где
R1 обозначает атом водорода,
R2 обозначает группу -ОСН3 (соединение 7b) или -ОС2Н5 (соединение 7b'),
R3 обозначает метильную группу,
R4 обозначает атом водорода,
R5 обозначает метильную группу,
R6 обозначает атом водорода,
R7 обозначает атом водорода,
R8 обозначает метильную группу и
двойные связи отсутствуют.
Соединения 7c, 7c' являются соединениями формулы (I), где
R1 обозначает атом водорода,
R2 обозначает группу -ОСН3 (соединение 7c) или -ОС2Н5 (соединение 7c'),
R3 обозначает атом водорода,
R4 обозначает метильную группу,
R5 обозначает метильную группу,
R6 обозначает атом водорода,
R7 обозначает атом водорода,
R8 обозначает метильную группу и
двойные связи отсутствуют.
Соединения 7d, 7d' являются соединениями формулы (I), где
R1 обозначает атом водорода,
R2 обозначает метильную группу,
R3 обозначает метильную группу,
R4 обозначает атом водорода,
R5 обозначает метильную группу,
R6 обозначает атом водорода,
R7 обозначает атом водорода,
R8 обозначает группу -ОСН3 (соединение 7d) или -OC2H5 (соединение 7d') и
двойные связи отсутствуют.
Соединения формулы (I) могут присутствовать в форме изомера или смеси изомеров, в частности энантиомера, или смеси энантиомеров, или рацемической смеси, или диастереоизомера, или смеси диастереоизомеров.
Все соединения формулы (I) обладают душистыми свойствами. Соединения (5a-d) имеют запах амбры, мускуса. Соединения (6a-d) и (6a'-d') имеют древесные ноты и камфарные ноты ветиверового регистра. Соединения (7a-d) имеют фруктовые и зеленые ноты. Благодаря таким душистым свойствам эти разные соединения, в особенности простые метиловые эфиры (6a-d), находят разнообразное применение, в частности в парфюмерии. Таким образом, целью изобретения является также применение этих соединений в качестве душистых агентов.
Целью настоящего изобретения является также способ синтеза соединений формулы (I).
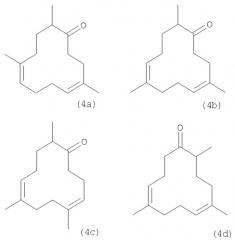
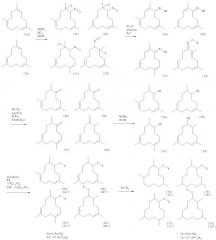
Каждое из соединений (5a-d), (6a-d), (6a'-d'), (7a-d) и (7a'-d') может быть синтезировано непосредственно или опосредованно из следующих соединений (4a-d), которые сами могут быть синтезированы из триметилциклододекатриенов. Настоящее изобретение предлагает также новый способ получения макроциклических кетонов 4a-d, который описан ниже:
Схема представляет способ синтеза соединений изобретения.
Схема 1:
В целом способ согласно изобретению включает следующие стадии:
- образование хлорнитрозо-производных 1,5,10-триметил-циклододека-1,5,9-триена (1а) и 1,5,9-триметилциклододека-1,5,9-триена (1b),
- превращение этих производных в оксимы,
- восстановительное превращение оксимов в кетоны в присутствии никеля Ренея, ацетона и борной кислоты,
- восстановление кетонов в спирты,
- этерификация с образованием простых эфиров,
- возможное гидрирование с образованием насыщенных простых эфиров.
Прежде всего, получают хлорнитрозо-производные (2a-d) 1,5,10-триметилциклододека-1,5,9-триена (1а) и 1,5,9-триметилциклододека-1,5,9-триена (1b). Для этой реакции существует большое число известных специалистам доступных реагентов, позволяющих достичь ожидаемого результата. Из этих реагентов нитрит натрия представляет интерес по экономическим причинам. Триметилциклододекатриены (1а-b) в растворителе, таком как втор-бутанол, охлаждают до температуры порядка от -10°С до -20°С, так как реакция является сильно экзотермической. После этого добавляют малыми порциями нитрит натрия (реактив, используемый в этом варианте осуществления), прибавляя одновременно по каплям хлористоводородную кислоту. Образуются белые кристаллы. По завершении добавления реагентов реакционную среду перемешивают еще 16 час, в процессе чего температура массы поднимается до комнатной. После этого раствор нейтрализуют содой или любым подходящим основанием при охлаждении так, чтобы температура в массе не превышала 25°С. Хлорнитрозо-производные (2a-d) получают в виде кристаллов, которые промывают и сушат, после чего они могут быть непосредственно задействованы на следующей стадии.
Далее хлорнитрозо-производные (2a-d) превращают в оксимы (3a-d) в подходящих условиях, которые специалист может определить на основании своего опыта. Превращение в оксимы проводят преимущественно в водной среде в присутствии какого-либо основания. Предусматривается использование нескольких оснований, однако хороший выход получают в присутствии триэтиламина. Кристаллы (2a-d) переводят в суспензию в смеси воды, толуола и триэтиламина. Суспензию кипятят в течение приблизительно от четырех до шести часов. Полное исчезновение кристаллов указывает на завершение превращения. После охлаждения фазы разделяют и промывают органическую фазу до нейтральной реакции подсоленной водой, затем серной кислотой и затем еще раз подсоленной водой. После упаривания растворителя получают оксимы (3а-d) в виде бурой массы, которая может быть непосредственно задействована в последующей реакции, так как очистка, хотя и возможна, но затруднительна с учетом молекулярной массы и сложности сырого продукта.
Существует большое разнообразие известных специалистам окислительных и восстановительных методов превращения оксима в кетон, и для получения кетонов может использоваться ряд реагентов, из которых лишь в качестве примеров можно назвать такие, как бисульфит натрия, сульфат меди, нитрит натрия, левулиновая кислота и оксон. В данном случае все попытки их использования окончились неудачей. Лишь восстановительное превращение в присутствии никеля Ренея, ацетон/этанола и борной кислоты дало возможность получить кетоны (4a-d). С этой целью оксимы (3a-d) частично растворяют в смеси этанола с ацетоном и помещают в автоклав в присутствии никеля Ренея и борной кислоты. После этого реакционную смесь перемешивают в течение примерно 14 час при температуре порядка от 25 до 60°С и давлении водорода порядка 1·104 ГПа до 5·104 ГПа, что позволяет получить кетоны (4a-d), а именно 4,9,12-триметилциклододека-4,8-диенон (4а), 4,8,12-триметилциклододека-4,8-диенон (4b), 5,8,12-триметилциклододека-4,8-диенон (4 с) и 5,9,12-триметилциклододека-4,8-диенон (4d).
Раствор после этого охлаждают до комнатной температуры, вливают в воду и экстрагируют растворителем, таким, например, как толуол. Объединенные органические фазы промывают до нейтральной реакции, высушивают, концентрируют и затем перегоняют. Смесь кетонов (4a-d) обладает мускусным, цветочным и слегка древесным запахом.
Восстановление кетонов (4a-d) в спирты (5a-d) можно проводить в подходящих условиях, которые могут быть определены специалистом. В частности, восстановление можно проводить в этаноле с использованием борогидрида натрия, который предпочтительнее других подходящих реагентов благодаря легкости его применения и разумной цене. Борогидрид натрия прибавляют к спиртовому раствору в течение периода времени примерно 6 час при температуре примерно от 5 до 15°С. Избыток гидрида разлагают ацетоном. После подкисления хлористово дородной кислотой раствор заливают водой и затем экстрагируют. Объединенные органические фазы промывают до нейтральной реакции, высушивают и концентрируют. После перегонки получают спирты (5a-d).
Эти спирты обладают запахом амбры и мускуса, который относительно слаб, но подлинен.
Спирты могут быть затем этерифицированы в подходящих, известных специалистам условиях. Обычно для этерификации спиртов используют два класса реагентов: алкилгалогениды и алкилсульфаты. Оба класса могут быть использованы для получения простых эфиров (6a-d и 6a'-d'). По экономическим соображения предпочтительны диметилсульфат и диэтилсульфат. Для облегчения образования алкоголятов к раствору триметил-циклододекадиенолов (5a-d) в тетрагидрофуране, в котором суспендированы кусочки натрия, прибавляют по каплям некоторое количество изопрена. Натрий реагирует вначале с изопреном, образуя катион, который затем быстро реагирует с присутствующими спиртами. Эта реакция проводится при температуре примерно от 10 до 20°С. Как только весь натрий прореагирует, добавляют этерифицирующий реагент (например, диметил- или диэтилсульфат). Реакционную смесь кипятят в течение приблизительно шести часов. Реакцию заканчивают, как только раствор станет бесцветным. Для разложения избытка сульфата добавляют при охлаждении (10-20°С) водно-аммиачный раствор. Водную фазу экстрагируют растворителем, таким как трет-бутилметиловый эфир. Объединенные органические фазы промывают до нейтральной реакции, высушивают, фильтруют и концентрируют. Перегонка дает метиловые эфиры (6a-d) или этиловые эфиры (6a'-d'), которые являются новыми соединениями. Метиловые эфиры (6a-d) имеют древесные и камфарные ноты ветиверового регистра, которые высоко ценятся парфюмерами. Этиловые эфиры (6a'-d') имеют почти такие же ноты, что и метиловые эфиры (6a-d), будучи при этом намного менее летучими.
Эфиры (6a-d) могут быть затем прогидрированы с целью получения соответствующих насыщенных эфиров в условиях, которые могут быть определены специалистом. В частности, гидрирование может проводиться, например, в присутствии палладия на угле при температуре порядка от 20 до 80°С под давлением водорода порядка 2·104 ГПа до 8·104 ГПа. Полученные эфиры являются новыми соединениями. Они имеют фруктовые и зеленые ноты, которые, однако, нестойки.
Описанный выше способ позволяет получить каждую группу соединений 4, 5, 6 и 7 в виде смеси a-d или a'-d'. Разделение соединений одной смеси трудно, но возможно с использованием подходящих для этого известных специалистам методов, в частности разделением на хиральной колонке или с помощью препаративной хроматографии. С учетом такого рода трудностей эти соединения разделять не обязательно, и они могут также использоваться в смеси, поскольку каждая смесь сама по себе обладает душистыми свойствами.
Целью изобретения является также применение по меньшей мере одного соединения формулы (I) согласно изобретению в качестве душистого агента, в качестве агента, маскирующего запах, или в качестве агента, нейтрализующего запах, самого по себе или в смеси с одним или несколькими другими известными специалистам душистыми соединениями, которые специалисту остается только выбрать в зависимости от желаемого эффекта. Дополнительный душистый агент или агенты могут быть соединениями формулы (I) или другими известными специалистам душистыми агентами.
Целью изобретения являются также композиции, содержащие один базовый продукт и эффективное количество одного или нескольких продуктов формулы (I) согласно изобретению.
Это может быть композиция, которая сама является душистой, или композиция, в которой душистый агент используется для того, что маскировать или нейтрализовать определенные запахи.
Базовый продукт будет легко определен специалистом в зависимости от предполагаемой композиции и, следовательно, от ее предполагаемого применения, обычные составляющие, такие как растворитель(и) и/или вспомогательные средства, для которых хорошо известны.
Эффективное количество вводимых в композицию соединений формулы (I) согласно изобретению будет варьироваться от природы композиции, желаемого эффекта душистого вещества и природы других возможно присутствующих душистых или недушистых соединений и будет легко определено специалистом, которому известно, что это количество может варьироваться в очень широком диапазоне: от 0,1 до 99 вес %, в частности от 0,1 до 50 вес % и, более конкретно, от 0,1 до 30 вес %.
Соединения формулы (I) согласно изобретению могут использоваться как таковые либо же они могут быть инкорпорированы в или на каком-либо инертном материале-носителе, который может содержать другие активные ингредиенты готовой композиции. Может быть использовано большое разнообразие материалов-носителей, включая, например, полярные растворители, масла, жиры, тонко измельченные твердые вещества, циклодекстрины, мальтодекстрины, камеди, смолы и какой-либо другой известный для таких композиций материал-носитель.
Изобретение относится, таким образом, также и к использованию соединений формулы (I) для приготовления душистой композиции или душистого изделия в описанных выше применениях, в частности в парфюмерии, косметике, например для шампуней или мыл, и для продуктов бытовой химии, таких как мягчители или стиральные средства.
Изобретение относится, в частности, к парфюмерным композициям, а именно к душистым основам или концентратам, одеколонам, туалетной воде или духам, содержащим по меньшей мере одно соединение формулы (I) или композицию, содержащую по меньшей мере одно соединение формулы (I).
Изобретение относится также, в частности, к косметическим композициям, а именно к крему для лица и тела, тальковой пудре, маслу для волос или для тела, шампуню, капиллярному лосьону, соли для ванны, маслу для ванны, гелю для душа, гелю для ванны, туалетному мылу, антиперспиранту для тела, дезодоранту для тела, лосьонам, крему для бритья, мылу для бритья, крему, зубной пасте, полосканию для рта и помаде, содержащим по меньшей мере одно соединение формулы (I) или по меньшей мере композицию, содержащую по меньшей мере одно соединение формулы (I).
Еще одной целью изобретения является способ профилактического или непрофилактического лечения или косметического ухода с использованием для этой цели по меньшей мере одного соединения формулы (I) или по меньшей мере одной композиции, содержащей по меньшей мере одно соединение формулы (I).
Изобретение, кроме того, относится к продуктам бытовой химии, а именно к мягчителям, моющим средствам, стиральным средствам, освежителям воздуха, содержащим по меньшей мере одно соединение формулы (I) или по меньшей мере одну композицию, содержащую по меньшей мере одно соединение формулы (I).
Соединения согласно изобретению могут использоваться индивидуально или в комбинации как таковые, либо же они могут быть инкорпорированы в или на каком-либо инертном материале-носителе, который может содержать другие активные ингредиенты готовой композиции. Может быть использовано большое разнообразие материалов-носителей, включая, например, полярные растворители, масла, жиры, тонкоизмельченные твердые вещества, циклодекстрины, мальтодекстрины, камеди, смолы и какой-либо другой известный для таких композиций материал-носитель.
Изобретение относится, таким образом, к использованию новых соединений для приготовления душистой композиции или душистого изделия в описанных выше применениях, в частности в парфюмерии, косметике, например для шампуней или мыл, и для продуктов бытовой химии, таких как мягчители или стиральные средства.
Изобретение относится, в частности, к парфюмерным композициям, а именно к душистым основам или концентратам, одеколонам, туалетной воде или духам, содержащим по меньшей мере одно соединение формулы (I) или композицию, содержащую по меньшей мере одно соединение формулы (I).
Изобретение относится также, в частности, к косметическим композициям, а именно к крему для лица и тела, тальковой пудре, маслу для волос или для тела, шампуню, капиллярному лосьону, соли для ванны, маслу для ванны, гелю для душа, гелю для ванны, туалетному мылу, антиперспиранту для тела, дезодоранту для тела, лосьонам, крему для бритья, мылу для бритья, крему, зубной пасте, полосканию для рта и помаде, содержащим по меньшей мере одно соединение формулы (I) или по меньшей мере композицию, содержащую по меньшей мере одно соединение формулы (I). Еще одной целью изобретения является способ профилактического или непрофилактического косметического лечения или ухода с использованием для этой цели по меньшей мере одного соединения формулы (I) или по меньшей мере одной композиции, содержащей по меньшей мере одно соединение формулы (I).
Осуществление изобретения
Приведенные ниже примеры в еще большей степени иллюстрируют различные способы получения уже известных и новых молекул согласно изобретению, а также их применение и их ценность. Эти примеры приведены лишь в целях иллюстрации и не должны рассматриваться как ограничение изобретения.
Пример 1: Синтез хлортриметилнитрозоциклододекадиенов (2a-d)
В 4-литровую колбу, снабженную боковым патрубком с воронкой для порошка, капельной воронкой и термометром, загружают 480,0 г (2,00 моль) триметилциклододекатриенов (1а и b) и 700,0 г втор-бутанола. Раствор охлаждают до температуры от -10 до -15°С и вводят по каплям одновременно в течение приблизительно шести часов 640,0 г (6,00 моль) 34%-ной соляной кислоты и порциями 160,0 г (2,32 моль) нитрита натрия. Реакция очень экзотермична. Рекомендуется эффективное охлаждение, чтобы не превышать 0°С в массе. Перемешивают реакционную среду еще шестнадцать часов, позволяя температуре в массе подняться до комнатной. Образуются белые и серые кристаллы, и реакционная среда становится пастообразной. После этого для облегчения перемешивания добавляют 1000,0 г воды, снова охлаждают и вводят по каплям 300,0 г (3,53 моль) 47%-ной соды, не превышая 25°С в массе. Кристаллы отфильтровывают, промывают 325,0 г гексана, просеивают (сито 1,25) и сушат в вакууме (вначале при 40 ГПа и затем при 0,7 ГПа), получая 419,7 г (макс. 1,56 моль) хлортриметилнитрозоциклододекадиенов (2a-d), которые содержат следы исходного вещества и которые практически нерастворимы во всех испытанных растворителях. Максимальный выход составляет 78,0%. Кристаллы непосредственно используют на следующей стадии.
Пример 2: Синтез триметилциклододекатриеноноксимов (3a-d)
В двухлитровую колбу, снабженную холодильником, капельной воронкой и термометром, вводят 270,0 г (1,00 моль) хлортриметилнитрозоциклододекадиенов (2a-d), 301,0 г толуола и 121,5 г (1,20 моль) триэтиламина, после чего доводят температуру смеси до 60°С. При этой температуре прибавляют по каплям 350,0 мл воды, затем смесь кипятят (примерно 80°С) при сильном перемешивании в течение четырех часов, охлаждают реакционную среду до 60°С и отделяют водную фазу. Органическую фазу промывают после этого дважды 200 мл подсоленной воды, один раз 250 мл 10%-ной серной кислоты и еще один раз 200 мл подсоленной воды. Упаривают при пониженном давлении (около 40 ГПа) растворитель, не превышая 50°С в массе, и получают 228,00 г бурой пастообразной массы, которую непосредственно используют на следующей стадии.
Пример 3: Синтез триметилциклододекадиенонов (4a-d)
В автоклав объемом 800 мл загружают 78,0 г этанола, 158,0 г (2,72 моль) ацетона, 2,3 г (0,04 моль) борной кислоты, 30,0 г (1,67 моль) воды, 4,0 г никеля Ренея и 228,0 г неочищенных триметилциклододекатриеноноксимов (3а-d). Трижды продувают устройство водородом, перемешивают 24 часа при 50°С и давлении водорода 3·104 ГПа. Охлаждают устройство до комнатной температуры, извлекают реакционную среду, добавляют 500 мл толуола и затем 300 мл подсоленной воды. Фазы разделяют и экстрагируют водную фазу один раз 100 мл толуола. Объединенные органические фазы промывают шесть раз 100 мл 10%-ной соляной кислотой до нейтрального рН, затем промывают еще один раз 100 мл подсоленной воды, высушивают, фильтруют и упаривают в вакууме (40 гПа), не превышая 50°С в массе. После перегонки получают 124,8 г (0,57 моль) триметилциклододекатриенонов (4a-d), т.кип. 94-97°С/0,3 ГПа. Выход по двум стадиям составляет 57%. Анализ ИК, ЯМР и масс-спектров соответствует структурам ожидаемых соединений.
Пример 4: Синтез триметилциклододекадиенолов (5a-d)
В двухлитровую колбу, снабженную термометром, помещают 124,8 г (0,57 моль) триметилциклододекадиенонов (4a-d) и 390,0 г этанола, охлаждают до 5°С и прибавляют малыми порциями 10,7 г борогидрида натрия, не превышая 10°С в массе. Перемешивают смесь при этой температуре в течение 42 часов, добавляя в течение этого времени дополнительные количества борогидрида натрия (5,3 г после 6 час, 10,1 г после 24 час и 5,3 г после 36 час при общем количестве добавленного борогидрида натрия 31,4 г (0,863 моль)). Для разложения избытка восстановителя прибавляют по каплям 79,0 г (1,36 моль) ацетона, не превышая 10°С в массе. Подкисляют реакционную среду 500,0 г 10%-ной соляной кислоты, не превышая 10°С в массе, добавляют еще 800 г воды и затем при сильном перемешивании 344 г толуола. Фазы разделяют и органическую фазу промывают три раза 200 г воды и один раз 200 г подсоленной воды, высушивают, фильтруют и упаривают толуол при пониженном давлении (40 гПа), не превышая 50 С в массе. Получают после перегонки 69,6 г (0,31 моль) триметилциклододекадиенолов (5a-d), т.кип. 98-100°С/0,2 ГПа. Выход 55,3%. Анализ ИК, ЯМР и масс-спектров соответствует структурам ожидаемых соединений.
Пример 5: Синтез метокситриметилциклододекадиенов (6a-d)
В двухлитровую колбу, снабженную холодильником, термометром и капельной воронкой, загружают под азотом 360,0 г тетрагидрофурана, 69,6 г (0,31 моль) триметилциклододекадиенолов (5a-d) и 8,2 г (0,36 моль) натрия, порубленного на маленькие кусочки. Реакционную среду охлаждают до 15°С и прибавляют по каплям 41,6 мл (28,3 г, 0,42 моль) изопрена, не превышая 15°С в массе. Продолжают перемешивание до полного растворения натрия, после чего охлаждают до 10°С и прибавляют при этой температуре по каплям 33,8 мл (45,0 г, 0,357 моль) диметилсульфата. Затем реакционную среду кипятят 6 час до полного обесцвечивания раствора, охлаждают до 10°С и прибавляют по каплям 300 мл 10%-ного водного раствора аммиака, не превышая 15°С в массе. Фазы разделяют и водную фазу экстрагируют два раза 150 мл трет-бутилметилового эфира. Объединенные органические фазы промывают один раз 150 г 10%-ной соляной кислотой, два раза 150 г воды и затем один раз 150 г подсоленной воды, высушивают, фильтруют и упаривают растворители в вакууме (40 ГПа), не превышая 50°С в массе. Получают после перегонки 33,5 г (0,14 моль) метокси-триметилциклододекадиенов (6а-d), т.кип. 68-72°С/0,2 ГПа. Выход 45,7%. Анализ ИК, ЯМР и масс-спектров соответствует структурам ожидаемых соединений.
Пример 6: Синтез этокситриметилциклододекадиенов (6а'-d')
Этокситриметилциклододекадиены (6a'-d') синтезируют, как описано в примере 4, используя 28,9 г (0,12 моль) триметилциклододекадиенов (5a-d) и 20,4 г (0,36 моль) диэтилсульфата. Получают 18,2 г (0,07 моль) этокситриметилциклододекадиенов (6a'-d'), т.кип. 105-108°С/0,2 ГПа. Выход 62,7%. Анализ ИК, ЯМР и масс-спектров соответствует структурам ожидаемых соединений.
Пример 7: Синтез метокситриметилциклододеканов (7a-d)
Помещают в автоклав 7,6 г (32 ммоль) метокситриметилциклодекадиенов (6а-d), 100 мл этанола и 0,5 г палладия на угле. Устройство закрывают и трижды продувают водородом. Перемешивают в течение шести часов при 40°С и 4·104 ГПа водорода, после чего охлаждают до комнатной температуры и извлекают реакционную среду. Катализатор отфильтровывают и упаривают растворитель при пониженном давлении (40 ГПа), не превышая 50°С в массе. После микродистилляции получают 5,0 г (20,8 ммоль) метокситриметилциклододеканов (7a-d) (71-78°С/0,3 ГПа). Выход 65,0%. Анализ ИК, ЯМР и масс-спектров соответствует структурам ожидаемых соединений Пример 8: Оценка запахов
В первую очередь комиссией были оценены душистые характеристики чистых метокситриметилциклододекадиенов (6a-d) одновременно с душистыми характеристиками известных имеющихся в продаже соединений. Оценивающая группа состояла из нескольких профессионалов, качественно и количественно оценивающих каждое соединение. Смесь соединений была описана как древесная, камфорная, в ветиверовом регистре с очень сильным запахом. Были обнаружены аналогии с несколькими продажными продуктами, такими как Spirambrene™ (2,2,3',7',7'-пентаметилспиро-1,3-диоксан-5,2'-норкаран) от Givaudan, Karanal™ (5-втор-бутил-2-(2,4-диметилциклогекс-3-енил)-5-метил[1,3]диоксан) от Quest International, Cedramber™ (6-метокси-3,6,8,8-тетраметилоктагидро-3а,7-метаноазулен) от International Flavours and Fragrances или Boisambrene™, (этокси-метокси-циклододекан) от Henkel.
После этого были приготовлены две спиртовые композиции, в которых смесь метокситриметилциклододекадиенов (6а-d) сравнивали с продажными продуктами. В каждом случае оценивание обонятельного эффекта производилось в моменты времени t0, t+48 час t+168 час для того, чтобы оценить начальные ноты, ноты сердца и базовые ноты в сравнении с известными соединениями.
| Композиция №1 | |||
| Испытание 1 | Испытание 2 | Испытание 3 | |
| Соединение | вес % | вес % | вес % |
| Кристаллизованный цедрилацетат 1) | 0,80 | 0,80 | 0,80 |
| Линалилацетат | 1,00 | 1,00 | 1,00 |
| Ацетат Vetyveryl Haiti | 4,50 | 4,50 | 4,50 |
| транс-Анетол | 0,30 | 0,30 | 0,30 |
| Orcanox 2) | 0,40 | 0,40 | 0,40 |
| Бергамотовое масло | 0,60 | 0,60 | 0,60 |
| Масло сладкого апельсина | 0,30 | 0,30 | 0,30 |
| Cashmeran 3) | 0,70 | 0,70 | 0,70 |
| Galaxolide 4) | 20,00 | 20,00 | 20,00 |
| Метиловый эфир дигидрожасмоновой кислоты 5) | 6,00 | 6,00 | 6,00 |
| Iso E Super6) | 52,00 | 52,00 | 52,00 |
| Линалол | 0,50 | 0,50 | 0,50 |
| Orange Terpenes Bresil | 0,10 | 0,10 | 0,10 |
| Ветиверовое масло Гаити | 1,00 | 1,00 | 1,00 |
| Ветиверол Гаити1) | 1,00 | 1,00 | 1,00 |
| 10%-ный изоэвгенилацетат в DPG 7) | 0,10 | 0,10 | 0,10 |
| Кардамоновое масло | 0,40 | 0,40 | 0,40 |
| 10%-ный чистый цитраль Litsea Cubeba в DPG 7) | 0,30 | 0,30 | 0,30 |
| Cedramber8) | 10,00 | / | / |
| Boisambrene9) | / | / | 10,00 |
| Метокситриметилциклододекадиен (6a-d) | / | 10,00 | / |
| В сумме | 100,00 | 100,00 | 100,00 |
1. От V.Mane Fils, Франция.
2. 3а,6,6,9а-Тетраметилдодекагидронафто[2,1-b]фуран от V.Mane Fils, Франция.
3. 1,1,2,3,3-Пентаметил-1,2,3,5,6,7-гексагидроинден-4-он от International Flavours and Fragrances, США.
4. 1,1,2,3,3,8-Гексаметил-1,2,3,5,7,8-гексагидро-6-оксациклопента[b]нафталин от International Flavours and Fragrances, США.
5. Метиловый эфир [3-оксо-2-((Е)-пентил)циклопентил]уксусной кислоты от Firmenich, Швейцария.
6. 1-(2,3,8,8-Тетраметил-1,2,3,4,5,6,7,8-октагидронафт-2-ил)этанон от International Flavours and Fragrances, США.
7. Дипропиленгликоль.
8. 6-Метокси-3,6,8,8-тетраметилоктагидро-3а,7-метаноазулен от International Flavours and Fragrances, США.
9. Этоксиметоксициклододекан от Henkel, Германия.
| Композиция №2 | |||
| Испытание 1 | Испытание 2 | Испытание 3 | |
| Используемое вещество | вес. частей | вес. частей | вес. частей |
| Violettyne 1) | 5 | 5 | 5 |
| Огсапох 2) | 20 | 20 | 20 |
| Calon 1951 Cal 3) | 5 | 5 | 5 |
| Veramoss 4) | 2 | 2 | 2 |
| Этиллиналол 5) | 50 | 50 | 50 |
| Florol 6) | 10 | 10 | 10 |
| Метиловый эфир дигидрожасмоновой кислоты 7) | 287 | 287 | 287 |
| Helional 8) | 30 | 30 | 30 |
| Iso E Super 9) | 20 | 20 | 20 |
| Lilial l0) | 10 | 10 | 10 |
| Melonal 11) | 1 | 1 | 1 |
| Methylionantheme 12) | 5 | 5 | 5 |
| Бензилсалицилат | 10 | 10 | 10 |
| Цис-3-гексенилацетат 13)14) | 2 | 2 | 2 |
| Стираллилацетат 14) | 5 | 5 | 5 |
| Аллиламилгликолят 14) | 1 | 1 | 1 |
| Galbex 15) | 2 | 2 | 2 |
| Цис-3-гексенол 14) | 2 | 2 | 2 |
| Liffarome 16} | 2 | 2 | 2 |
| Tripal 14)17) | 1 | 1 | 1 |
| Meтoкcитpимeтилциклoдoдeкaдиeн(6a-d) | / | 30 | / |
| Boisambrene forte 18) | / | / | 30 |
| В сумме | 470 | 500 | 500 |
1. (Е)-Ундека-1,3-диен-5-ин от Firmenich, Швейцария.
2. 3а,6,6,9а-Тетраметилдодекагидронафто[2,1-b]фуран от V.Mane Fils, Франция.
3. 7-Метил-бензо[и][1,4]диоксепин-3-он от Symrise, Германия.
4. Метиловый эфир 2,4-дигидрокси-3,6-диметилбензойной кислоты, International Flavours and Fragrances, США.
5. От Givodan, Швейцария.
6. 2-Изобутил-4-метилтетрагидропиран-4-ол от Firmenich, Швейцария.
7. Метиловый эфир [3-оксо-2-((Е)-пентил)циклопентил]уксусной кислоты от Firmenich, Швейцария.
8. 3-Бензо[1,3]диоксол-5-ил-2-метилпропионовый альдегид, International Flavours and Fragrances, США.
9. 1-(2,3,8,8-Тетраметил-1,2,3,4,5,6,7,8-октагидронафт-2-ил)этанон от International Flavours and Fragrances, США.
10. 3-(4-трет-Бутилфенил)-2-метилпропионовый альдегид от Givodan, Швейцария.
11. 2,6-Диметилгепт-5-енал от Givodan, Швейцария.
12. (Е)-3-Метил-4-(2,6,6-триметилциклогекс-2-енил)бут-3-ен-2-он от Firmenich, Швейцария.
13. От V.Mane Fils, Франция.
14. 10%-ный в Дипропиленгликоле.
15. От Firmenich, Швейцария.
16. Метиловый эфир (Е)-гекс-3-енилового эфира угольной кислоты от International Flavours and Fragrances, США.
17. 2,4-Диметилциклогекс-3-енкарбальдегид от International Flavours and Fragrances, США.
18. Этоксиметоксициклододекан от Henkel, Германия.
Испытания композиции №1 показали, что метокситриметилциклододекадиены (6а-d) не имеют амбровых нот Boisambrene™, но зато имеют более сильные, чем у Boisambrene™, древесные ноты и по этой причине обладает таким же действием, как Cedramber™.
Испытания композиции №2 подтвердили, что метокситриметилциклододекадиены (6a-d) являются менее амбровыми и обладают менее приятным запахом, чем Boisambrene™, но в то же время они имеют более темные базовые ноты и привносят оттенки кедрового леса, напоенные медом и воском.
Кроме того, во всех