Таксаны, ковалентно связанные с гиалуроновой кислотой или производными гиалуроновой кислоты
Иллюстрации
Показать всеИзобретение относится к таксану, особенно к паклитакселу и доцетакселу, ковалентно связанному с гиалуроновой кислотой или производным гиалуроновой кислоты, используемому в качестве активного вещества в фармацевтических композициях, которые применяют в области онкологии, при лечении опухолей, аутоиммунных заболеваний и рестеноза, а также в качестве покрытия для стентов и медицинских устройств. Ковалентная связь образуется между гидроксильными группами таксана и карбоксильными группами или гидроксильными группами гиалуроновой кислоты или производными гиалуроновой кислоты, или аминогруппами деацетилированной гиалуроновой кислоты. Связывание может происходить при помощи соединяющего соединения (спейсерного соединения), связывающего таксан с гиалуроновой кислотой или производными гиалуроновой кислоты, при условии, что соединяющее соединение отличается от гидразида. Заявленный таксан обладает повышенной терапевтической эффективностью при лечении онкологических заболеваний, аутоиммунных заболеваний и рестеноза, является водорастворимым без снижения его фармакологической активности, а также не проявляет токсичные действия, что приводит к преодолению повышенной чувствительности и анафилаксии. 14 н. и 32 з.п. ф-лы, 4 ил., 2 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к таксанам, особенно паклитакселу и доцетакселу, ковалентно связанному с гиалуроновой кислотой или производным гиалуроновой кислоты, способу их получения и их использованию в области онкологии, при лечении аутоиммунных заболеваний и рестеноза.
УРОВЕНЬ ТЕХНИКИ
Таксаны и, особенно, паклитаксел и доцетаксел, в настоящее время продаваемые на рынке под торговым названием таксол и таксотер, являются противораковыми агентами (Huizing M.T. et al., Cancer Inv., 1995, 13: 381-405), которые проявляют свое антипролиферативное действие посредством действия на организацию микротрубочек в клеточной цитоскелетной системе. Действительно, посредством ингибирования деполяризации указанных микротрубочек они предотвращают их нормальную динамическую реорганизацию, которая имеет место во время митотического деления клеток (Manfredi J.J. et al., J. Cell Biol., 1982, 94: 688-696).
Основными терапевтическими показаниями для паклитаксела являются:
- терапия для запущенного рака грудной железы;
- терапия для саркомы Капоши;
- терапия для саркомы легких (не микроцитомы);
- карцинома яичников, устойчивая к лечения стандартной химиотерапией.
Кроме того, указанную химиотерапию используют также для лечения карциномы мочевого пузыря, простаты и эндометрия.
Зная, что паклитаксел является нерастворимым в воде, его смешивают со смесью кремофор® EL (касторовое масло) - этиловый спирт в отношении 1:1 в фармацевтических композициях, используемых в настоящее время в раковой химиотерапии (Pfeifer R.W. et al., Am. J. Hosp.Pharm., 1993, 50:2520-2521). Этот препарат обычно используют для непрерывной внутривенной инфузии (в течение от 3 до 24 часов) при дозе 135-175 мг/м2.
Присутствие кремофора EL в указанном выше препарате является основной причиной побочных реакций, которые обычно имеют место во время введения паклитаксела и изменяются от простых поражений крапивницы до одышки и бронхоспазм и даже анафилактического шока (Weiss R.B. et al., J. Clin. Oncol., 1990, 8: 1263-1268).
По этой причине любой пациент, который собирается получить лечение фармацевтической композицией паклитаксел-кремофор EL, должен сначала следовать протоколу премедикации с введением дексаметазона, возможно ассоциированного с антигистамином.
Несмотря на эти предосторожности, до 40% пациентов, которые получают внутривенную инфузию паклитаксела, все же испытывают более или менее серьезные побочные реакции. Поэтому можно сказать, что клиническое применение препарата таксола в настоящее время и способы, используемые для его введения, имеют ограниченную эффективность. Это является причиной того, почему исследование теперь направлено для синтеза новых фармацевтических препаратов и/или для получения новых химических препаратов вышеуказанного противоракового лекарственного средства, которые являются водорастворимыми.
Например, исследователи пытались капсулировать паклитаксел в липосомах, нанокапсулах и микросферах, составленных полимерными стенками, образованными биоразрушаемыми сополимерами, такими как полимолочная кислота, бионеразрушаемыми сополимерами, такими как сополимер этилена и винилацетата.
Кроме того, были получены микросферы, которые загружают паклитакселом и которые образованы биоразрушаемым полимером, таким как полифосфоэфир, для создания системы для пролонгированного высвобождения лекарственного средства у места терапии при лечении карциномы легких (Nuijen В. et al., Investigation New Drugs, 2001, 19: 143-153).
Были предприняты также попытки получения мицелл указанного противоракового лекарственного средства осаждением паклитаксела в органическом растворителе системой фосфатидилхолин/соли желчных кислот (Nuijen В. et al., Investigation New Drugs, 2001, 19:143-153).
Однако при получении этих новых систем для капсулирования паклитаксела могут возникнуть трудности в отношении стабильности, получения и способности воспроизводства.
Кроме того, были сделаны различные попытки растворения лекарственного средства циклодекстрином, но новые препараты не дали желательных результатов (Nuijen В. et al., Investigation New Drugs, 2001, 19: 143-153).
Химическое исследование по новым препаратам паклитаксела, которые делают лекарственное средство более водорастворимым при сохранении его эффективности в качестве противоракового агента, привело к синтезу новых аналогов, модифицированных в положениях С2' м С7 (заявка на патент США №2001/0018531), а также к получению новых пролекарств.
Пролекарства являются терапевтически инертными производными лекарственных средств, которые активируются при введении в организм.
Здесь активный ингредиент высвобождается после самопроизвольных процессов гидролиза и/или ферментативного гидролиза.
С этой точки зрения и по указанным выше причинам были предприняты попытки синтеза новых пролекарств, которые привели, например, к получению лекарственных средств, таких как ацетилпаклитаксел (Mellado W. et al., Biochem. Biophys. Res. Commun., 1984, 124(2): 329-336) или синтеза новых сложных эфиров указанного лекарственного средства с янтарной, глутаровой и сульфоновой кислотами на атоме углерода в положении С2'. Однако доказано, что эти эфиры являются нестабильными в водной окружающей среде.
Кроме того, были синтезированы некоторые производные с группой фосфонооксифенилпропионатного эфира в положении С2' или С7, такие как паклитаксел-2'-карбонат, и ряд новых эфиров паклитаксела с аминокислотами и их производные с глутарильной группой в положении С2'.
Показано, что глутарилпаклитаксел-аспарагин и глутарилпаклитаксел-глутамин являются двумя наиболее высокорастворимыми продуктами, полученными типом описанного выше синтеза, но они являются менее эффективными, чем паклитаксел per se (Nuijen В. et al., Investigation New Drugs, 2001, 19: 143-153).
Известно также, что паклитаксел этерифицировали поли-L-глутаминовой кислотой с образованием нового водорастворимого производного указанного химиотерапевтического лекарственного средства со значительно более высоким полупериодом существования, чем неконъюгированный паклитаксел (Li С. et al., Cancer Research, 1998, 58(11): 2404-2409).
Паклитаксел был также превращен в производное с ПЭГ (полиэтиленгликоль) этерификацией лекарственного средства химиотерапии в положении С2'; однако показано, что новая молекула является очень хорошо растворимой, но не очень стабильной.
Наконец, недавно была разработана новая система доставки лекарственного средства конъюгацией паклитаксела с альбумином сыворотки крови человека (HSA). Доказано, что конъюгат паклитаксел-HSA является очень хорошо растворимым в воде и способен «нести» до 30 молекул химиотерапевтического лекарственного средства. Однако эксперименты, проведенные in vitro, показали, что он является менее эффективным против рака, чем паклитаксел per se (Nuijen В. et al., Investigation New Drugs, 2001, 19: 143-153).
В последнее время исследователи синтезировали новую систему доставки для паклитаксела, этерифицированные предварительно модифицированной гиалуроновой кислотой (далее здесь обозначаемой "НА"), которая является НА, подвергнутой взаимодействию с молекулами гидразида, связанного с карбоксильной группой НА амидной связью (Luo Y. et al., Biomacromolecules 2000, 1 (2): 208-218; патент США №5874417). Эта новая система доставки для паклитаксела позволяет лекарственному средству дойти непосредственно до поверхности мембраны являющейся мишенью раковой клетки, характеризующейся сверхэкспрессией рецептора для НА, CD44. Следовательно, доказано, что паклитаксел, связанный с НА, функционализированной гидразидом, способен связываться специфическим образом с CD44 раковой клетки и, таким образом, способен (благодаря процессу эндоцитолиза) входить в цитоплазму клетки, где он может быть ферментативным образом высвобожден и активирован, запуская свой механизм ингибирования деполяризации тубулина и, следовательно, деления клеток. Этот механизм селективного переноса лекарственного средства называют «клеточным прицеливанием».
Кроме того, известно, что НА может быть использована в качестве наполнителя для противораковых лекарственных средств в фармацевтических композициях, где НА ассоциирована (а не ковалентно связана) с химиотерапевтическими лекарственными средствами, такими как паклитаксел, для повышения их терапевтической эффективности благодаря феномену «прицеливания», описанному выше (Международная патентная заявка №WO 00/41730), и получения возможности снизить дозы, обычно указываемые в обычных химиотерапевтических протоколах (Международная патентная заявка №WO 99/02151).
И наконец, известно, что НА с низкой молекулярной массой и/или ее липидные производные используют для получения липосом, используемых для доставки лекарственных средств, включающих антираковые лекарственные средства, таких как паклитаксел (Международная патентная заявка №WO 01,39815). С точки зрения указанного выше все еще остается потребность в новых производных таксанов, которые являются стабильными и растворимыми в воде и терапевтически эффективными, по меньшей мере, такими, какими являются немодифицированные таксаны.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Автором заявки теперь обнаружено, что, ковалентно связанные с НА или производными НА таксаны, необязательно при помощи соединяющего соединения, получают стабильные и водорастворимые продукты, пригодные для получения фармацевтических композиций для лечения опухолей, аутоиммунных нарушений и рестеноза. Таким образом предметом изобретения является таксан, ковалентно привязанный к гиалуроновой кислоте или ее производному, причем указанная ковалентная связь выбрана из группы, состоящей из:
i) прямой эфирной связи, сформированной между карбоксильными группами гиалуроновой кислоты или ее производного и гидроксильными группами таксана,
ii) связи, сформированной между карбоксильными группами гиалуроновой кислоты или ее производного и гидроксильной функцией таксана посредством разделителя, причем указанный разделитель формирует эфирную связь с гиалуроновой кислотой или ее производным, и
iii) связи, сформированной между гидроксильной функцией гиалуроновой кислоты или ее производного и гидроксильной функцией таксана посредством разделителя, причем указанный разделитель формирует эфирную связь с гиалуроновой кислотой или ее производным.
Настоящее изобретение далее относится к способам получения таксанов, ковалентно связанных с НА или производными НА.
Следующим предметом изобретения являются фармацевтические композиции, содержащие в качестве активного вещества, по меньшей мере, таксан, ковалентно связанный с НА или производными НА, и их использование при лечении опухолей, аутоиммунных заболеваний и рестеноза.
Данные таксаны, ковалентно связанные с НА или производными НА, имеют много преимуществ, которые могут быть суммированы следующим образом:
1) они являются моментально растворимыми в кровотоке;
2) их не нужно смешивать с кремофором EI для получения препаратов, что позволяет преодолевать вышеуказанные проблемы, относящиеся к повышенной чувствительности и анафилаксии;
3) благодаря ферментативной активности ферментов, таких как эстеразы, обычно присутствующие в плазме, таксаны сразу высвобождаются применяемой в качестве их наполнителя НА или производным НА из настоящих композиций в кровь, где они могут свободно проявлять свою противораковую активность;
4) они дают возможность получать новое лекарственное средство, которое в случае некоторых типов рака может обладать неожиданной химиотерапевтической активностью, которая значительно выше, чем активность, которую получают, при введении неконъюгированного таксана, когда рассматривают одинаковые дозы лекарственного средства.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 показан процент выживаемости после имплантирования опухолевых клеток, как описано в примере 1, для контролей (черная гистограмма) и для мышей, которые получали паклитаксел (серая гистограмма) и паклитаксел, ковалентно связанный со сложным эфиром НА при 16% этерификации (белая гистограмма), полученным, как в примере 7.
На фигуре 2 показана фармакологическая способность, выраженная как IC50 и являющаяся результатом экспериментов в примере 2, паклитаксела, ковалентно связанного с эфирными производными НА, имеющими 16% этерификацию (серая гистограмма), 22% этерификацию (черная гистограмма) и 6,8% этерификацию (белая гистограмма) для четырех клеточных линий рака молочной железы по сравнению со ссылочным продуктом паклитакселом.
На фигуре 3 показан процент выживаемости после имплантации опухолевых клеток, как описано в примере 3, у контрольных мышей (пунктирная линия) и у мышей, которые получали гель АСР (непрерывная линия).
На фигуре 4 показан процент паклитаксела, ковалентно связанного со сложным эфиром НА, как описано в примере 7, высвобождаемого в плазму крови человека, как описано в испытании примера 13, в зависимости от времени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
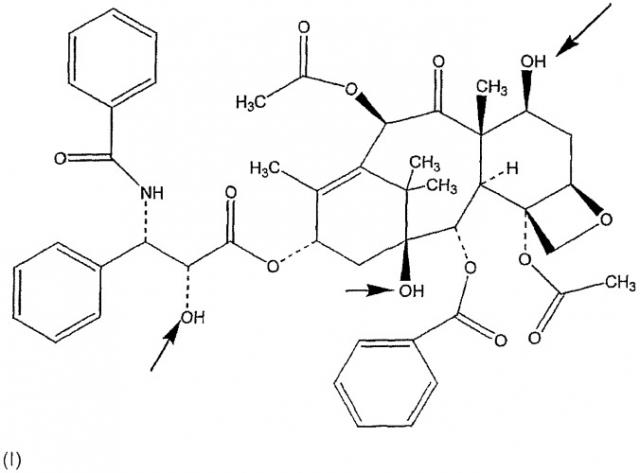
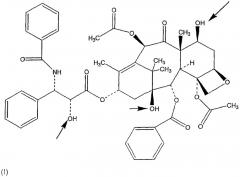
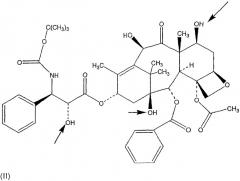
В настоящем изобретении описаны соединения, относящиеся к семейству таксана, предпочтительно, паклитакселу и доцетакселу, ниже представленных формулами (I) и (II) соответственно, ковалентно связанных с НА или производными НА, предпочтительно, при помощи соединяющей группы, как границы между таксановым компонентом и НА или производным НА, ковалентно связанным с обеими молекулами.
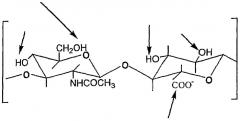
НА представляет собой гетерополисахарид, состоящий из чередующихся остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина и имеющий следующие повторяющиеся звенья:
НА представляет собой полимер с линейной цепью и молекулярной массой, которая может варьировать между 50000 и 13×106 Да в зависимости от его источника и способа, используемого для получения его. Она присутствует в природе в перицеллюлярных гелях, в основном веществе соединительной ткани позвоночных организмов (в которых она является одним из основных компонентов), в синовиальной жидкости суставов, в эндолифме и в пуповине. НА играет важную роль в биологическом организме в качестве механического носителя для клеток многих тканей, таких как кожа, сухожилия, мышцы и хрящи. Она является основным компонентом внеклеточной матрицы, но она имеет другие функции, такие как гидратация тканей, смазывание, и миграция, и дифференциация клеток.
НА, используемая в настоящем изобретении, может быть экстрагирована из любого источника, например из кондилом, или она может быть получена ферментативным путем, или технологическим способом и она может иметь молекулярную массу между 400 и 3×106 Да, особенно между 400 и 1×106 Да, и предпочтительно, между 400 и 230000 Да.
Производные НА по настоящему изобретению, предпочтительно, выбраны из группы, состоящей из следующих производных НА:
- НА в форме соли с органическими и/или неорганическими основаниями;
- Hyaff: эфиры НА со спиртами алифатического, аралифатического, циклоалифатического, ароматического, циклического и гетероциклического рядов со степенью этерификации, которая может варьировать в соответствии с типом и длиной цепи используемого спирта и в любом случае никогда не превышает 50% этерификацию и, что предпочтительно, составляет 0,1-20%, так как конечный полимер, который получают, должен всегда быть водорастворимым, тогда как оставшаяся неэтерифицированная НА может быть превращена в соли с органическими и/или неорганическими основаниями, причем такие соединения описаны в патенте США №4851521, включенном здесь в качестве ссылки;
- HyaddTM: амиды НА, образованные с аминами алифатического, аралифатического, циклоалифатического, ароматического, циклического и гетероциклического рядов с процентом амидирования между 0,1 и 10%, так как конечный полимер всегда должен быть водорастворимым, тогда как оставшаяся НА, которая не является амидированной, может быть превращена в соли с органическими и/или неорганическими основаниями, причем такие соединения описаны в заявке на Европейский патенте №1095064, включенной здесь в качестве ссылки;
- O-сульфатированные производные НА со степенью сульфатирования 4, описанные в патенте США №6027741, включенном здесь в качестве ссылки;
- АСР: внутренние эфиры НА с процентом этерификации не более чем 15%, так как полимер всегда должен быть водорастворимым, предпочтительно, между 0,05 и 10% этерификации, тогда как оставшаяся неэтерифицированная НА может быть превращена в соли с органическими и/или неорганическими основаниями, причем такие соединения описаны в Европейском патент №0341745 В1, включенном здесь в качестве ссылки;
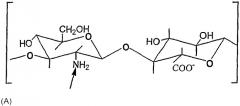
- продукты деацетилирования НА: их получают деацетилированием звена N-ацетилглюкозамина с процентом деацетилирования, предпочтительно, между 0,1 и 30%, тогда как все карбоксильные группы НА могут быть превращены в соли с органическими и/или неорганическими основаниями, как иллюстрировано в следующей структуре (А):
причем деацетилаты НА, описанные в Международной патентной заявке №WO 02/18450, авторы включают здесь в качестве ссылки;
- НуоххTM: перкарбоксилированные производные НА, полученные окислением первичного гидроксила звена N-ацетилглюкозамина со степенью перкарбоксилирования между 1 и 100%, предпочтительно, между 25 и 75%. Все карбоксильные группы НА могут быть превращены в соли с органическими и/или неорганическими основаниями, как иллюстрируется в следующей структуре (В):
Перкарбоксилированные производные НА описаны в заявке на патент США №US 2003181689.
Кроме того, настоящие соединения, в которых таксан, в частности, паклитаксел, ковалентно связан со сложным эфиром НА, могут быть получены из молекул химически немодифицированной НА и только после синтеза с химиотерапевтическим лекарственным средством модифицированием НА этерификацией ее со всеми перечисленными выше спиртами для получения продуктов Hyaff® или образованием внутренних эфиров, как в случае АСР® (см. пример 8).
Предварительно перечисленные производные НА, которые являются особенно важными в способе синтеза пролекарства НА-таксан, и, в частности, пролекарства НА-паклитаксел, являются деацетированными и сульфатированными производными, поскольку при таких же процентах паклитаксела, связанного с предварительно немодифицированной гиалуроновой кислоты, они делают конечный продукт более растворимым в кровотоке.
Известно, что при помощи рецептора СD44-мембраны НА опосредует многие различные процессы, относящиеся к клеточной физиологии и биологии, такие как пролиферация, дифференциация и локомация раковых клеток и других клеток.
В научной литературе недавно была показана эффективность НА против рака, когда НА инъецируют как таковую непосредственно в растущую раковую опухоль. Доказано, что она способна вызывать полную регрессию 30% опухолей (Herrera-Gayol A. et al., Experimental and Molecular Pathology, 2002, 72: 179-185).
Известно также, что НА может быть ассоциирована с любым химиотерапевтическим лекарственным средством для получения многих различных фармацевтических композиций, так как она способна действовать в качестве второго противоопухолевого реагента, который синергически усиливает противораковое действие лекарственного средства, ассоциированного с ней (Международная патентная заявка №WO 01/47561; в альтернативном варианте НА заявлена в качестве противоракового лекарственного средства, которое вводят как таковое в различных клинических протоколах для уменьшения/регрессии роста раковой опухоли (Международная патентная заявка №WO 97/40841).
Таксан настоящей заявки, ковалентно связанный с НА или производными НА, как указано выше, отличается от всех препаратов таксанов, в частности, ковалентная связь паклитаксела с НА или производными НА, необязательно при помощи соединяющей группы, делает паклитаксел растворимым в воде без снижения его фармакологической активности.
Действительно, эксперимент in vivo, описанный в примере 1, явно демонстрирует одинаковую противораковую эффективность данного конъюгированного паклитаксела и неконъюгированного паклитаксела, когда их вводят при одинаковых дозах.
Кроме того, НА-паклитаксел может проявлять неожиданные фармакологические свойства, которые отличаются от фармакологических свойств неконъюгированного паклитаксела, особенно в случае некоторых типов опухоли.
Действительно, в примере 2 явно показано, что настоящее эфирное производное НА, связанной с паклитакселом, обладает новой противоопухолевой фармакологической активностью: на модели цитотоксичности in vitro, описанной ниже, НА-паклитаксел настоящего изобретения неожиданного проявляет противораковую активность, которая является значительно превосходящей активность, проявляемую взятым отдельно неконъюгированным паклитакселом.
Новые противоопухолевые свойства означает, что данные таксаны, особенно, паклитаксел, конъюгированный с НА или производными НА, могут быть использованы для получения фармацевтических композиций, применимых в качестве химиотерапевтического лекарственного средства не только для лечения всех форм опухоли, для лечения которых вводят таксол®, но также для других форм опухоли, которые обычно не лечат таксолом®, таких как рак желудка и печени, рак толстой кишки, меланомы и лейкоза. Кроме того, его можно использовать при системных аутоиммунных нарушениях, таких как ревматоидный артрит, системная красная волчанка, аутоиммунный гломерулонефрит и, наконец, тиреоидит Хашимото.
Использование настоящих продуктов в новой фармакологической терапии для вышеуказанных патологий возможно, поскольку новое соединение НА-паклитаксел снижает системную токсичность таксола®, таким образом повышая терапевтическую эффективность самого лекарственного средства, так как он:
- является водорастворимым;
- не ассоциируется с кремофором® EL и, следовательно, не проявляет токсичные действия, которые проявляет кремофор;
- является одинаково эффективным при дозах, определенно более низких, чем дозы, обычно используемые в клинических протоколах, или равных этим дозам.
Известно также использование паклитаксела в качестве лекарственного средства, которое используют для ингибирования процесса рестеноза, который обычно следует после пластической операции на сосудах (предпочтительно, артериальных сосудах), коронарного шунтирования и трансплантаций органов.
Настоящие таксаны, в частности, паклитаксел, ковалентно связанные с НА или производными НА, можно также использовать для профилактики рестеноза или они могут быть использованы для образования внутреннего покрытия для стентов и устройств, имплантируемых после вышеуказанных сосудистых операций, так как было доказано, что они возможно связываются химическим образом с поверхностью указанных стендов или легко адсорбируется на ней.
В любом случае время пребывания данных продуктов на поверхности стента и, следовательно, их постепенное высвобождение в кровоток больше, чем у неконъюгированного паклитаксела, вследствие того, что химические-физические характеристики НА способствуют прогрессирующему, медленному, но непрерывному высвобождению таксола® с поверхности устройства.
Фармацевтические композиции, включающие в себя настоящие таксаны, ковалентно связанные с НА или производными НА, могут быть введены системным способом (внутривенными или артериальными, внутримышечными, внутрибрюшинными, подкожными или пероральными путями), они могут быть использованы для местного применения (чрескожной абсорбцией) или они могут быть введены непосредственно в место раковой опухоли при помощи инъекции.
НА или ее производное, ковалентно связанное с паклитакселом, может также действовать в качестве противоракового лекарственного средства per se.
В нижеследующем примере 1 автор заявки показывает, как лечение экспериментально индуцированного роста опухоли у «голых» мышей сшитым производным НА, АСР®, обнаруживает значительный регресс опухоли по сравнению с необработанными контролями.
Автор заявки поэтому описывает в первый раз новую роль НА и ее производных, которые входят в состав настоящих продуктов таксан-НА или таксан-производное НА, в качестве противоопухолевых агентов и их сравнительные использования в области онкологии. Кроме того, настоящие таксаны, ковалентно связанные с НА или производными НА, могут быть ассоциированы с различными биологически и фармакологически активными молекулами, такими, как например, стероиды, гормоны, белки, трофические факторы, витамины, нестероидные противовоспалительные лекарственные средства, химиотерапевтические лекарственные средства, антагонисты кальция, антибиотики, антивирусные агенты, интерлейкины и цитокины, такие как интерферон. Таким образом, можно получить много различных ассоциаций вышеуказанных лекарственных средств и относительно различные фармацевтические композиции, содержащие таксаны изобретения.
Настоящее изобретение относится также к способу получения настоящих таксанов, особенно, паклитаксела, ковалентно связанного с НА или производными НА; данные продукты могут быть получены следующими способами:
1) непрямым синтезом, который включает в себя введение соединяющей группы (спейсера, spacer) между таксаном и НА или производным НА, или
2) прямым синтезом между таксаном и НА или производным НА.
Функциональными группами НА или производных НА, которые могут реагировать с таксаном непосредственно или не непосредственно при помощи соединяющей группы (spacer), являются следующие группы:
1) гидроксильные группы;
2) карбоксильные группы.
Соединяющее соединение может быть, например, выбрано из группы, состоящей из алифатической или аралифатической цепи, неразветвленной или разветвленной, замещенной одной или несколькими группами, выбранными из гидроксильных, карбоксильных или карбонильных групп, эпоксидов, ацилхлоридов, меркаптанов, нитрилов, галогенов, ангидридов, изоцианатов и изотиоцианатов и аминогрупп.
Среди возможных соединяющих соединений предпочтительными являются бромпроизводные карбоновых кислот, имеющих от 2 до 18 атомов углерода, и особенно кислот, имеющих от 3 до 10 атомов углерода, более предпочтительными являются 3-бромпропионовая кислота и 4-броммасляная кислота.
Реакция синтеза между функциональными гидроксильными группами НА (или ее производных) и таксановым компонентом, таким как паклитаксел, может быть проведена способом непрямого или прямого синтеза.
Непрямой синтез может привести к образованию следующих типов ковалентной связи между соединяющей группой и НА или производными НА:
сложноэфирной группы:
- включающей в себя карбоксильную функциональную группу подходящим образом выбранной соединяющего соединения, которую активируют активирующим агентом, таким как, например, карбодиимид (схема 1, ниже);
- включающей в себя гидроксильные группы НА или производного НА, которые бромируют или замещают тозильной группой с последующим нуклеофильным замещением карбоксилом подходящим образом выбранного соединяющего соединения (схема 2, приведенная ниже); или включающей в себя ангидридную функцию подходящим образом выбранного соединяющего соединения (схема 3, приведенная ниже);
уретановой или тиоуретановой связи:
- включающей в себя аминогруппу подходящим образом выбранной соединяющей группы (схема 4, приведенная ниже), или
- включающей в себя изоцианатную или изотиоцианатную функциональую группу подходящим образом выбранной соединяющей группы (схема 5, приведенная ниже).
простой эфирной связи:
- включающей в себя функциональную эпоксигруппу (подходящим образом выбранной) соединяющей группы (схема 6, приведенная ниже);
- включающей гидроксигруппы НА или производного НА, которые бромируют или замещают тозильной группой с последующим нуклеофильным замещением гидроксильной группой подходящим образом выбранной соединяющей группы (схема 7, приведенная ниже).
ацетальной или кетальной связи:
- включающей в себя альдегидную и/или кетонную группу подходящим образом выбранной соединяющей группы (схема 8, приведенная ниже);
- включающей гидроксильную группу подходящим образом выбранной соединяющей группы и требующей присутствия простого карбонильного соединения, такого как формальдегид (схема 9, приведенная ниже).
Вышеописанные способы могут быть осуществлены с использованием агентов, активирующих гидроксильную группу НА или производных НА, например, выбранных из группы, состоящей из карбонилдиимидазола и ди-(N-сукцинимидил)карбоната.
Прямая реакция синтеза между гидроксильными группами НА или производных НА и таксаном, таким как паклитаксел, может привести к образованию следующего типа ковалентной связи:
ацетальной связи:
- включающей гидроксильную группу таксана и гидроксильные группы НА или производных НА, которые ковалентно связывают присоединение простого карбонильного соединения, такого как формальдегид (схема 10).
Реакцию между карбоксильными группами НА или производных НА и таксаном, таким как паклитаксел, можно проводить способом прямого или непрямого синтеза. Непрямой синтез может привести к образованию следующих типов ковалентной связи между соединяющим соединением и НА или производными НА:
сложноэфирная связь:
- карбоксильную группу подходящим образом выбранного соединяющего соединения, такого как 4-броммасляная кислота, активируют активирующим агентом, таким как карбодиимид, и таким образом делают ее подходящей для синтеза с гидроксильной группой таксана (предпочтительно, группой на атоме углерода у С2'), такого как паклитаксел. Затем прямым контактированием в безводном растворителе с четвертичной аммониевой солью, в частности с тетрабутиламмониевой (ТВА) солью НА или производного НА, получают нуклеофильное замещение карбоксила НА или производного НА на бромсоединяющего соединения. Таким способом получают сложноэфирную связь между НА или производным НА и соединяющей группой в свою очередь связанной с паклитакселом. В альтернативном случае нуклеофильное замещение карбоксильной группы НА или производного НА бромсоединяющего соединения можно проводить перед образованием связи между самим соединяющим соединением и таксаном (схема 11, приведенная ниже).
- посредством использования активирующих агентов карбоксильной группы НА или производного НА, таких как карбодиимид, можно образовать сложноэфирную связь между указанной группой и функциональной гидроксильной группой (подходящим образом выбранного) соединяющего соединения, предварительно или впоследствии связанного с паклитакселом (схема 12, приведенная ниже).
амидная связь:
- активация карбоксильных групп НА или производных НА активирующим агентом, способным связываться с аминогруппой подходящим образом выбранного соединяющего соединения, за исключением гидразидов, предварительно или впоследствии связанного с таксаном, таким как паклитаксел (схема 13, приведенная ниже).
Прямой синтез может привести к образованию следующих типов ковалентной связи:
сложноэфирная связь:
- активация карбоксильных групп НА или производного НА активирующим агентом, придающим возможность связыванию ее с гидроксильной группой таксана (схема 14, приведенная ниже).
- активация гидроксильной группы таксанового компонента активирующим агентом, придающим возможность связывания ее с функциональной карбоксильной группой НА или производного НА (схема 14, приведенная ниже);
- следующий тип связи требует бромидного или тозилатного производного таксана. Указанную связь получают реакцией нуклеофильного замещения бромидной или тозильной группы карбоксильной группой НА или производного НА (схема 15, приведенная ниже).
Реакцию синтеза между аминогруппами деацетилированной НА и таксановым компонентом, таким как паклитаксел, можно проводить способом непрямого или прямого синтеза.
Непрямой синтез может привести к образованию следующих типов ковалентной связи между соединяющим соединением и НА:
амидной связи:
- включающей в себя карбоксильную группу подходящим образом выбранного связывающего соединения (схема 16);
уретановой или тиоуретановой связи:
- включающей в себя гидроксильную или тиольную группу подходящим образом выбранного соединяющего соединения (схема 17).
Прямой синтез может привести к образованию следующего типа ковалентной связи:
уретановой связи:
- включающей в себя гидроксильную группу таксана и функциональную аминогруппу деацетилированной НА (схема 18).
По такому же способу связью, включающей в себя соединяющее соединение и таксан, такой как паклитаксел, может быть связь типа сложного эфира (схема 19), уретана или тиоуретана (схема 20), ацеталя или кеталя (схема 21), для ее образования может требоваться присутствие активирующего агента, особенно для сложноэфирных и уретановых связей.
Соединяющее соединение может быть связано с таксаном, таким как паклитаксел, до или после связывания с функциональными группами НА или производных НА, в зависимости от типа функциональных групп подходящим образом выбранного соединяющего соединения.
Процент прямого или непрямого связывания таксана, такого как паклитаксел, с НА или производным НА может варьировать между 0,1% и 100%, предпочтительно, между 0,1% и 35%.
Следующие примеры приведены для предоставления неограничивающих иллюстраций настоящего изобретения.
Пример 1
Влияние новых эфирных производных НА с паклитакселом на «голых» мышей после имплантации опухолевых клеток
Для данного эксперимента авторы инокулировали клетками аденокарциномы яичника человека, OVCAR-3, иммунодепрессивных голых мышей, принадлежащих к виду Athymic CD-1. Каждую мышь инокулировали внутрибрюшинным путем 5×106 раковых клеток.
Экспериментальная схема:
Испытуемые лекарственные средства:
- таксол, обрабатывали 5 животных;
- HYTAD1p20: эфирное производное НА, ковалентно связанное с паклитакселом, с 16% этерификации карбоксила (мас./мас.). Молекулярная масса НА, используемой для синтеза данного нового лекарственного средства, была 200000 Да (см. пример 7 для деталей его получения). Для этого лекарственного средства также использовали пять животных.
Обработанные животные: 10 животных сначала инокулировали клетками OVCAR-3.
Пять животных использовали для эксперимента с Таксолом® и другие пять использовали для экспериментов с HYTAD1p20:
- все десять животных затем получали внутрибрюшинной инъекцией 3 дозы фармакологического средства (на 6-й, 13-й и 20-й дни после инокуляции раковых клеток), равные 20 мг/кг массы тела Таксола® или 125 мг/кг массы тела HYTAD (соответствует 20 мг/мышь паклитаксела).
Контрольные животные: 5 животных сначала инокулировали индуцирующей раковое заболевание суспензией клеток OVCAR-3, после чего они не получали какого-либо лечения.
Определение кривой выживания
Кривую выживания вычисляли из данных лечебного вмешательства на 92-й день после инокуляции раковых клеток в брюшную полость.
Результаты: полученные результаты иллюстрируются на фигуре 1.
Трое контрольных животных имели развившуюся аденокарциному яичников и погибли между 70-м и 75-м днем после инокуляции раковых