Рекомбинантная плазмидная днк pyfi-gfp, кодирующая продукцию флюоресцентного белка gfpaav и штамм бактерий escherichia coli jm109-pyfi, продуцирующий флюоресцентный белок gfpaav в присутствии токсических агентов
Иллюстрации
Показать всеИзобретение относится к биотехнологии, белковой и генной инженерии, конкретно к получению геносенсоров. Конструируют рекомбинантную плазмидную ДНК pYfi-gfp, обеспечивающую продукцию химерного флюоресцентного белка GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA под контролем промотора гена YfiA в присутствии токсических. Плазмида имеет размер 3730 п.о. Рекомбинантный штамм Escherichia coli JM109-pYfi содержит генетическую конструкцию по данному изобретению и продуцирует флюоресцентный белок GFPaav в присутствии токсических, повреждающих клетку агентов. Изобретение позволяет регистрировать присутствие в среде токсических агентов при повышении уровня флюоресценции клеток полученного штамма. 2 н.п. ф-лы, 4 ил.
Реферат
Изобретение относится к биотехнологии, белковой и генной инженерии, конкретно к получению геносенсоров, и представляет собой рекомбинантную плазмидную ДНК pYfi-gfp, содержащую ген, кодирующий химерный флюоресцентный белок GFPaav, а также рекомбинантный штамм Escherichia coli JM109 [pYfi] - продуцент химерного флюоресцентного белка GFPaav, в присутствии токсических агентов.
Разработка и создание геносенсорных конструкций является важной задачей по ряду причин. Во-первых, они имеют большое прикладное значение как индикаторы самых разных аспектов во все более ухудшающихся условий внешней среды, а во-вторых, позволяют провести фундаментальные, экспериментальные исследования как устойчивости и адаптации биологической системы к конкретным воздействиям, так и механизмов их реализации.
Геносенсор - это искусственная генетическая система, чувствительным элементом которой является промотор гена, активируемый естественным образом в ответ на то или иное стрессовое (метаболическое) воздействие. В геносенсорных конструкциях такие промоторы связаны с геном-репортером [1, 2]. В качестве репортерных генов используют гены, кодирующие флюоресцентные или люминесцентные белки [3]. К настоящему времени разработан ряд достаточно эффективных сенсорных конструкций, способных выявлять лишь одну группу токсических факторов, в основном сенсоры окислительного стресса [4, 5], агентов, повреждающих ДНК [5, 6], белки или мембраны [5, 7], а также сенсоры, регистрирующие присутствие тяжелых металлов [8, 9].
Наиболее ближайшим к заявляемому техническому решению прототипом является плазмидная ДНК pYfi-gfp, содержащая под контролем промотора YfiA (raiA) Escherichia coli, ген, кодирующий флуоресцентный белок green fluorescent protein (GFPaav) и штамм Escherichia coli, продуцирующий белок GFPaav в присутствии перекиси водорода (Khiebodarova et al.: Database GenSensor as informational source for design of biosensors. Experimental development of biosensor based on yfiA gene. // Proceedings of the fifth international conference on bioinformatics of genome regulation and structure (BGRS'2006), v.2, pp.93-96).
Недостатками известного прототипа являются низкая чувствительность рекомбинантных клеток к токсическому агенту и активация только одним агентом, а именно перекисью водорода.
Технической задачей изобретения является получение рекомбинантной плазмидной ДНК pYfi-gfp, кодирующей химерный флюоресцентный белок GFPaav, и штамма - продуцента химерного флюоресцентного белка GFPaav, с использованием штамма Escherichia coli.
Поставленная техническая задача решается:
- конструированием на основе впервые идентифицированного потенциального промотора гена yfiA (raiA) Escherichia coli, плазмидной ДНК pYfi-gfp, содержащей под контролем промотора гена yfiA, ген, кодирующий химерный флюоресцентный белок green fluorescent protein (GFPaav), с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA (RaiA);
- получением путем трансформации, сконструированной рекомбинантной плазмидной ДНК pYfi-gfp штамма бактерий Escherichia coli, способного повышать уровень продукции химерного флюоресцентного белка GFPaav, с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA (RaiA), в присутствии токсических агентов различной природы. Регистрация повышения флюоресценции клеток полученного штамма свидетельствует о присутствии токсических агентов в среде.
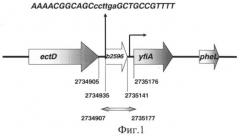
С помощью базы данных GenSensor [10] обнаружен ген yfiA (raiA) Escherichia coli, который активируется при нарушении оптимальных условий роста клеток [11] и при наличии в среде различных агентов, повреждающих ДНК, РНК и белки [1, 2, 12]. Использование промотора такого гена в сенсорных конструкциях обеспечивает создание полифункционального геносенсора, активация которого будет отражать метаболическое неблагополучие клетки. Информации о существовании независимого промотора у гена yfiA (raiA) Escherichia coli обнаружено не было, однако косвенные данные свидетельствовали о такой возможности [13, 14]. Анализ нуклеотидной последовательности между генами ectD (b2595) и yfiA (b2597) выявил наличие канонического Rho-независимого терминатора транскрипции на расстоянии 30 нуклеотидов от конца открытой рамки считывания гена ectD, структура которого (фиг.1) позволяет формирование потенциальной шпильки с энергией - 16,7 ккал/моль. Это значение достаточно хорошо соответствует энергии наиболее часто встречающихся, экспериментально идентифицированных Rho-независимых терминаторов транскрипции у E.coli [15] и в совокупности с данными [14] позволяет предположить отсутствие регуляции гена yfiA (raiA) со стороны впереди лежащего гена ectD (b2595). Таким образом, была идентифицирована потенциальная промоторная область гена yfiA (raiA), которая от конца сайта терминации транскрипции гена ectD до ATG кодона гена yfiA (raiA) составляет 223 пары нуклеодидов (фиг.1).
Клонированная последовательность потенциальной промоторной области гена yfiA (raiA) E.coli составляет 270 п.н. и включает часть Rho-независимого потенциального терминатора транскрипции впереди лежащего гена ectD и ATG кодон.
На основе впервые идентифицированного промотора гена yfiA (raiA) конструируют плазмиду pYfi-gfp, содержащую под контролем этого промотора ген gfp, кодирующий флюоресцентный белок green fluorescent protein (GFPaav) с укороченным временем полужизни [16], содержащий 5 первых кодонов гена yfiA. Для этого в полимеразной цепной реакции (ПЦР) с использованием олигонуклеотидных праймеров 5'-CCTCGGGCCCCAGAAACCTGAAACACAAAACGG и 5'-AAGGGCATGC ATAAATTTTACCTCTTGTCTTCCCGTC, а также ДНК Escherichia coli НВ101 в качестве матрицы синтезируют фрагмент, содержащий промоторный район гена yfiA (raiA). С помощью праймеров 5'-CGCGCATGCCAATGAACATTCGTAAAGGAGAAGAACTTTTCACT и 5'-CGCGAAGCTTATTAAACTGCTGCAGCG получают ДНК-фрагмент, кодирующий химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA (RaiA). Этот фрагмент ДНК объединяют в реакции лигирования с векторной плазмидой pRS2 [17], гидролизованной эндонуклеазами KpnI и HindIII. Полученный таким образом промежуточный вектор гидролизуют эндонуклеазами ApaI и SphI и объединяют в реакции лигирования с обработанным теми же эндонуклеазами ПНР-фрагментом, содержащим промотор гена yfiA (raiA). В результате получают плазмиду pYfi-gfp, правильность участков встраивания в которой подтверждают рестрикционным анализом и секвенированием. Определение нуклеотидных последовательностей проводят в обоих направлениях с использованием автоматического секвенатора CEQ™ 2000XL DNA Analysis System ("Beckman") и наборов "F" CEQ DTCS Kit.
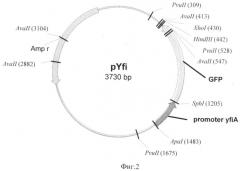
На основе результатов определения нуклеотидных последовательностей встроенных фрагментов и рестрикционного анализа плазмиды строят схему плазмиды, содержащей под контролем промотора гена yfiA (raiA) Escherichia coli ген, кодирующий химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA (фиг.2).
Полученная рекомбинантная плазмидная ДНК pYfi-gfp, структура которой представлена на фиг.2, характеризуется следующими признаками:
- имеет молекулярную массу 2,46 МДа и размер 3730 п.о.;
- содержит искусственный ген, кодирующий химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA (RaiA), под контролем промотора гена yfiA Escherichia coli, обеспечивающего продукцию химерного флюоресцентного белка GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA в присутствие токсических факторов;
состоит из следующих элементов:
- ApaI/HindIII - векторного фрагмента плазмиды pRS2 [17], размером 2688 п.о., содержащего сайт инициации репликации плазмиды pUC18, ori Е. coli, ген бета-лактамазы (bla);
- ApaI/HindIII - фрагмента размером 927 п.о., содержащего промотор гена yfiA (raiA) Escherichia coli и ген, кодирующий флюоресцентный белок GFPaav;
содержит:
- генетический маркер: ген бета-лактамазы (bla), определяющий устойчивость трансформированных pYfi-gfp клеток E.coli к ампициллину;
- уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: HindIII - 442, Ncol - 1034, Apal - 1383.
Получают рекомбинантный бактериальный штамм, способный продуцировать химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA в присутствии токсических агентов, что легко детектируется по повышению флюоресценции суспензии клеток этого штамма. Для получения такого продуцента используют штамм Escherichia coli JM109 recA1, endA1, gyrA96, thi, hsdR17, supE44, relA1, Δ(lac-proAB)/F' [traD36, proAB+, lacIq, lacZΔM15].
Компетентные клетки Eschercihia coli JM109 трансформируют ДНК плазмиды pYfi-gfp, выделенной из отобранного клона методом щелочного лизиса [18]. Полученный таким образом рекомбинантный штамм Escherichia coli JM109 [pYfi] характеризуется следующими признаками:
Морфологические признаки. Клетки мелкие утолщенной палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаре "Difco" колонии круглые, гладкие, прижатые, мутные, блестящие, серые, край ровный. При росте на жидких средах (на минимальной среде или бульоне Луриа) образуют интенсивную ровную муть. Клетки растут при температуре 37°С при оптимуме рН от 6.8 до 7.0.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (100 мкг/мл), обусловленную наличием плазмиды.
Рекомбинантный штамм Escherichia coli JM109 [pYfi] обеспечивает индуцируемый токсическими агентами (например, перекисью водорода, митомицином С) синтез химерного флюоресцентного белка GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA, что легко детектируется по повышению флюоресценции суспензии клеток этого штамма.
Полученный штамм депонирован в Коллекции культур микроорганизмов ФГУН ГНЦ ВБ «Вектор» под номером В-1146.
Для оценки чувствительности полученных клеток Escherichia coli JM109 [pYfi] ночную культуру этих клеток разводят в свежем бульоне Луриа с 50 мкг/мл ампициллина и растят при 37°С до среднелогарифмической фазы. Затем клетки промывают в минимальной среде М9 и вносят в лунки 96-луночного планшета, содержащего соответствующие разведения токсических агентов. В качестве токсических агентов используют 3.2 мМ, 1.6 мМ, 0.8 мМ и 0.4 мМ перекись водорода (окислительный агент) и 1.2 µМ, 0.6 µМ и 0.3 µM митомицин С (повреждение ДНК). Чувствительность клеток Escherichia coli JM109 [pYfi] к присутствию токсических агентов оценивают по увеличению флюоресценции (облучение - 485 нм, 0,1 с; эмиссия - 535 нм) при температуре культивирования 26°С и 32°С. Флюоресценцию измеряют с помощью флюориметра Perkin Elmer VICTOR3 в единицах флюоресценции, уровень индукции представляет собой отношение максимальной флюоресценции в опыте к флюоресценции в контрольной точке, измеренной за тот же период времени. Флюоресценцию клеток Escherichia coli JM109 [pYfi], не подвергшихся воздействию токсических агентов, рассматривают в качестве отрицательного контроля (примеры 3, 4).
Определяющими отличиями предлагаемого изобретения являются:
- на основе гена yfiA (raiA) E.coli, отобранного с помощью специально созданной базы данных GenSensor, конструируют рекомбинантную плазмидную ДНК pYfi-gfp, содержащую под контролем впервые идентифицированного независимого промотора гена yfiA (raiA) E.coli, ген, кодирующий химерный флюоресцентный белок green fluorescent protein (GFPaav) с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA;
- путем трансформации клеток Escherihia coli JM109 рекомбинантной плазмидной ДНК pYfi-gfp получают штамм Escherichia coli JM109 [pYfi], способный продуцировать химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA в присутствии токсических агентов, в частности митомицина С или перекиси водорода, что легко детектируется по повышению флюоресценции суспензии клеток этого штамма.
Таким образом, полученная конструкция является геносенсором, регистрирующим присутствие в среде токсических агентов, в частности митомицина С и перекиси водорода.
Изобретение иллюстрируется следующими фигурами:
Фиг.1 Структура потенциальной регуляторной области гена yfiA (raiA). Указано положение открытых рамок считывания генов ectD, b2596, yfiA и pheL, потенциального старта транскрипции гена yfiA [13], потенциального Rho-независимого терминатора транскрипции гена ectD и позиции потенциального промотора гена yfiA в координатах полного генома E.coli (GenBank: U00096).
Фиг.2 Физическая карта плазмиды pYfi-gfp, содержащей под контролем промотора гена yfiA Escherihia coli ген, кодирующий химерный флюоресцентный белок green fluorescent protein (GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA. Указаны сайты для эндонуклеаз рестрикции HindIII, SfhI, ApaI, AvaII и PvuII; промотор гена yfiA; ген, кодирующий химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA (RaiA); ген ампициллиновой устойчивости к ампициллину Ampr.
Фиг.3 Влияние различных концентраций H2O2 на флюоресценцию клеток линии E.coli, трансформированных плазмидой pYfi-gfp, в сравнении с контрольными клетками при температуре 26°С (А) и 32°С (Б).
Фиг.4 Влияние различных концентраций митомицина С на флюоресценцию клеток линии E.coli, трансформированных плазмидой pYfi-gfp, в сравнении с контрольными клетками при температуре 26°С (А) и 32°С (Б).
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Конструирование рекомбинантной плазмиды pYfi-gfp, содержащей под контролем промотора гена yfiA (raiA) ген gfp, кодирующий химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA
ДНК-фрагмент, содержащий промоторный район гена yfiA (raiA), получают в полимеразной цепной реакции (ПЦР) с использованием олигонуклеотидных праймеров 5'-CCTCGGGCCCCAGAAACCTGAAACACAAAACGG и 5'-AAGGGCATGCATAAATTTTACCTCTTGTCTTCCCGTC, а также ДНК Escherichia coli HB101 в качестве матрицы синтезируют фрагмент, содержащий промоторный район гена yfiA (raiA). Затем в полимеразной цепной реакции (ПЦР) с использованием олигонуклеотидных праймеров 5'-CGCGCATGCCAATGAACATTCGTAAAGGAGAAGAACTTTTCACT и 5'-CGCGAAGCTTATTAAACTGCTGCAGCG получают ДНК-фрагмент, кодирующий химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA (RaiA). Этот фрагмент ДНК объединяют в реакции лигирования с векторной плазмидой pRS2 [17], гидролизованной эндонуклеазами KpnI и HindIII. Полученный таким образом промежуточный вектор гидролизуют эндонуклеазами ApaI и SphI и объединяют в реакции лигирования с обработанным теми же эндонуклеазами ПЦР-фрагментом, содержащим промотор гена yfiA (raiA). В результате получают геносенсорную плазмиду pYfi-gfp, правильность участков встраивания в которой подтверждают рестрикционным анализом и секвенированием. Определение нуклеотидных последовательностей проводят в обоих направлениях с использованием автоматического секвенатора CEQ™ 2000XL DNA Analysis System ("Beckman") и наборов "F" CEQ DTCS Kit.
Пример 2. Создание рекомбинантного штамма Escherichia coli JM109 [pYfi], продуцирующего химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA в присутствии токсических агентов для клетки
Клетки штамма Eschercihia coli Escherichia coli JM109 recA1, endA1, gyrA96, thi, hsdR17, supE44, relAl, Δ(lac-proAB)/F' [traD36, proAB+, lacIq, lacZΔM15] культивируют при 37°С до среднелогарифмической стадии роста и трансформируют кальциевым методом ДНК рекомбинантной плазмиды pYfi-gfp, очищенной методом щелочного лизиса [18]. Трансформанты высевают на агаризованную среду LB, содержащую 50 мкг/мл ампициллина. Выросшие на утро клоны культивируют в бульоне Луриа с 50 мкг/мл ампициллина и из них выделяют плазмидную ДНК методом щелочного лизиса [18]. Соответствие выделенных плазмидных ДНК требуемой ДНК подтверждают рестрикционным анализом и секвенированием участка встройки. Клон, содержащий плазмиду pYfi-gfp, рассевают до отдельных колоний на агаризованной среде LB, содержащей 50 мкг/мл ампициллина. ДНК плазмид из отдельных клонов выделяют методом щелочного лизиса [16] и все процедуры повторяют еще 2 раза соответственно. В итоге получают штамм Escherichia coli JM109 [pYfi], содержащий рекомбинантную геносенсорную плазмиду pYfi-gfp.
Пример 3. Тестирование чувствительности созданного рекомбинантного штамма Escherichia coli JM109 [pYfi] к воздействию перекиси водорода (окислительный агент)
Чувствительность полученных клеток Escherichia coli JM109 [pYfi] оценивают в модельных экспериментах по увеличению флюоресценции при температуре культивирования 26°С и 32°С. Для этого ночную культуру клеток подращивают в свежей среде LB с 50 мкг/мл ампициллина до среднелогарифмической стадии. Затем клетки промывают в среде М9 и аликвоты, по 50 мкл вносят в лунки планшета, содержащие 6.4, 3.2, 1.6 и 0.8 мМ перекиси водорода в 50 мкл М9 соответственно. Эксперимент проводят в повторах и повторяют не менее трех раз. Флюоресценцию клеток измеряют на флюориметре Perkin Elmer VICTOR3: время облучения - 0,1 с, длина волны облучения - 485 нм, длина волны эмиссии - 535 нм. Флюоресценцию клеток Escherichia coli JM109 [pYfi], не подвергшихся воздействию перекиси водорода, рассматривают в качестве отрицательного контроля. Значения флюоресценции приведены на графике (фиг.3). Клетки Escherichia coli JM109 [pYfi] реагируют на присутствие перекиси водорода в концентрации 0.4-3.2 мМ с максимальным уровнем индукции через 60-70 мин при температуре 26°С (фиг.3А) и в концентрации 0.4-0.8 мМ с максимальным уровнем индукции через 60-80 мин при температуре 32°С (фиг.3Б).
Пример 4. Тестирование чувствительности созданного рекомбинантного штамма Escherichia coli JM109 [pYfi] к воздействию митомицина С (токсический агент, повреждающий ДНК клетки)
Ночную культуру клеток Escherichia coli JM109 [pYfi] подращивают в свежей среде LB с 50 мкг/мл ампициллина до среднелогарифмической стадии. Затем клетки промывают в среде М9 и аликвоты, по 50 мкл вносят в лунки планшета, содержащие 2.4 µM, 1.2 µМ и 0.6 µМ митомицина С в 50 мкл М9. Эксперимент проводят в повторах и повторяют не менее трех раз. Флюоресценцию клеток измеряют на флюориметре Perkin Elmer VICTOR3: (0,1 с/485 нм/535 нм). Флюоресценцию клеток Escherichia coli JM109 [pYfi], не подвергшихся воздействию митомицина С, рассматривают в качестве отрицательного контроля. Значения флюоресценции приведены на графике (фиг.4). Реакция клеток Escherichia coli JM109 [pYfi] на присутствие митомицина С достигает максимума через 90-100 мин, при этом уровень максимальной индукции развивается при концентрации митомицина С, равной 0.3 µМ, при температуре 26°С (фиг.4А) и практически не зависит от таковой при температуре 32°С.
Таким образом, впервые идентифицирован и клонирован промотор гена yfiA (raiA) Escherichia coli, сконструирована рекомбинантная плазмида pYfi-gfp, содержащая под контролем этого промотора ген, кодирующий химерный флюоресцентный белок green fluorescent protein GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA (RaiA), продукция которого увеличивается в присутствии в среде токсических агентов различной природы, приводящих к активации промотора гена yfiA {raiA}, в частности митомицина С и перекиси водорода; трансформация клеток Escherichia coli JM109 обуславливает получение рекомбинантного штамма Escherichia coli JM109 [pYfi], способного к продукции химерного флюоресцентного белка GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA в присутствии токсических агентов, в частности митомицина С и перекиси водорода. Увеличение флюоресценции клеток полученного штамма свидетельствует об активации геносенсорной конструкции и, следовательно, о присутствии токсических агентов в среде.
1. Рекомбинантная плазмидная ДНК pYfi-gfp, кодирующая продукцию химерного флюоресцентного белка GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA под контролем промотора гена YfiA в присутствии токсических агентов, имеющая размер 3730 п.о. и мол. вес 2,46 МДа, содержащая:ApaI/HindIII - векторный фрагмент плазмиды pRS2, размером 2688 п.о., содержащий сайт инициации репликации плазмиды pUC18, ori E.coli, ген бета-лактамазы (bla);Apal/HindIII - фрагмент размером 927 п.о., содержащий промотор гена YfiA (raiA) Escherichia coli, и ген, кодирующий химерный флуоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA;генетический маркер: ген бета-лактамазы (bla), определяющий устойчивость трансформированных плазмидой pYfi-gfp клеток E.coli к ампициллину;уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: HindIII - 442, Ncol - 1034, Apal - 1383.
2. Штамм бактерий Escherichia coli JM109 [pYfi], депонирован в Коллекции культур микроорганизмов ФГУН ГНЦ ВБ «Вектор», регистрационный номер В-1147, продуцирующий химерный флюоресцентный белок GFPaav с пятью измененными аминокислотами, соответствующими первым пяти аминокислотам белка YfiA в присутствии токсических агентов.