Растения с повышенной урожайностью и способ их получения
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ увеличения урожайности обеспечивающих урожай частей растений относительно соответствующих растений дикого типа, включающий введение в растение нуклеиновой кислоты, кодирующей циклин-зависимую киназу D-типа (CDKD), содержащую NXTALRE звено, где Х означает любую аминокислоту. Раскрыт способ производства трансгенного растения с повышенной урожайностью, включающий введение в растение или растительную клетку кодирующей CDKD нуклеиновой кислоты, содержащую NXTALRE звено, где Х означает любую аминокислоту, и культивирование растительной клетки в условиях, промотирующих регенерацию и рост зрелого растения. Изобретение позволяет повышать урожайность растений. 2 н. и 12 з.п. ф-лы, 3 ил., 5 табл.
Реферат
Настоящее изобретение относится, в общем, к молекулярной биологии и касается способа повышения урожайности растений. Более конкретно, настоящее изобретение касается способа повышения урожайности растений, особенно урожайности семян, путем введения в растение нуклеиновой кислоты, кодирующей циклин-зависимую киназу D-типа (CDKD - D-type Cyclin-Dependent Kinase). Настоящее изобретение также касается растений, полученных способами по изобретению, при этом растения имеют повышенную урожайность по сравнению с соответствующими растениями дикого типа. Изобретение также касается конструкций, используемых в способах по изобретению.
Постоянно растущее народонаселение в мире и уменьшение пахотных земель, пригодных для сельскохозяйственных культур, стимулирует исследования, направленные на улучшение эффективности сельского хозяйства. Обычными средствами улучшения сельскохозяйственных и садовых культур является использование методик селекционного разведения для идентификации растений, имеющих желаемые свойства. Однако такие методики селекционного разведения имеют различные недостатки, а именно, эти методики обычно трудоемкие, и полученные в результате растения часто содержат гетерогенные генетические компоненты, которые не всегда дают в результате желаемые черты при переходе из родительских растений. Успехи в молекулярной биологии позволили человечеству модифицировать гермаплазму животных и растений. Генная инженерия растений включает выделение и манипуляции с генетическим материалом (обычно в форме ДНК или РНК) и последующее введение этого генетического материала в растение. Такая технология привела к разработке растений, имеющих различные улучшенные экономические, агрономические или садоводческие признаки. Признаком, особенно экономически интересным, является урожайность. Урожайность обычно определяют как измеримое получение экономического объема из культуры. Она может быть определена в терминах количества и/или качества. Урожайность прямо зависит от различных факторов, например числа и размера органов, строения растения (например, числа веток), выработки семян и т.д. Развитие корней, поглощение питательных веществ и устойчивость к стрессам также являются важными факторами, определяющими урожайность. Урожайность сельскохозяйственных культур может быть путем оптимизации одного из вышеперечисленных факторов, что может быть сделано путем модификации врожденных механизмов роста растений.
Врожденные механизмы роста растений неотъемлемы от высокоупорядоченной последовательности событий, вместе известных как «клеточный цикл». Продвижение через клеточный цикл является фундаментальным для роста и развития всех многоклеточных организмов и является ключевым в пролиферации клетки. Главные компоненты клеточного цикла хорошо сохраняются в дрожжах, млекопитающих и растениях. Клеточный цикл обычно делится на следующие последовательные фазы: G0 - G1 - S - G2 - М. Репликация ДНК или синтез обычно протекают во время S фазы («S» - для синтеза ДНК), а митотическая сегрегация хромосом имеет место во время М фазы («М» - для митоза), с промежуточными гэп фазами, G1 (во время которого клетки растут перед репликацией ДНК) и G2 (период после репликации ДНК, во время которого клетка готовится к делению). Деление клетки завершается после цитокинеза, последнего этапа М фазы. Клетки, которые вышли из клеточного цикла и которые становятся покоящимися, находятся в вышеуказанной G0 фазе. Клетки в этой фазе могут быть стимулированы, чтобы начать клеточный цикл на G1 фазе. "G" в G1, G2 и G0 положения для "гэп". Завершение процесса клеточного цикла позволяет каждой дочерней клетке во время деления клетки получить полную копию родительского генома.
Деление клетки контролируют два основных события клеточного цикла, а именно инициация синтеза ДНК и инициация митоза. Каждый переход к каждому из этих ключевых событий контролируется с помощью контрольных точек (реперов), представленных специфическими белковыми комплексами (вовлеченными в репликацию ДНК и деление). Экспрессия генов, необходимая для синтеза ДНК на границе G1/ S, регулируется с помощью E2F семейства транскрипционных факторов в клетках млекопитающих и растительных клетках (La Thangue, 1994; Muller et al., 2001; De Veylder et al., 2002). Вступление в клеточный цикл регулируется/инициируется с помощью E2F/Rb комплекса, который объединяет сигналы и разрешает активацию транскрипции генов клеточного цикла. Переход между различными фазами клеточного цикла и, следовательно, продвижение через клеточный цикл стимулируется путем формирования и активации различных гетеродимерных серин/треонин белковых киназ, главным образом, относящихся к циклин-зависимым киназам (CDKs). Предварительным условием активности этих киназ является физическая ассоциация со специфическим циклином, выбор времени активации сильно зависит от экспрессии циклина. Связывание циклина вызывает конформационные изменения в N-концевой доле привязки CDK и способствует локализации и субстратной специфичности комплекса. Мономерные CDKs активируются, когда они ассоциированы с циклинами, и тогда обладают киназной активностью. Уровни циклинового белка колеблются в клеточном цикле и поэтому являются главным фактором при определении выбора времени активации CDK. Периодическая активация этих комплексов, содержащих циклины и CDK, во время клеточного цикла опосредует временную регуляцию переходов клеточного цикла (контрольные точки). Другие факторы, регулирующие активность CDK, включают CDK ингибиторы (CKIs или ICKs, KIPs, CIPs, INKs), CDK активирующие киназы (CAK), CDK фосфатазу (Cdc25) и CDK субъединицы (CKS) (Mironov et al. 1999; Reed 1996).
До настоящего времени в растениях были изучены два главных класса CDK, известные как А-тип и В-тип CDKs. А-тип CDKs регулирует и G1-to-S и G2-to-M переходы, в то время как В-тип CDKs контролирует только G2-to-M контрольную точку (Hemerly et al., 1995; Magyar et al., 1997; Porceddu et al., 2001). Кроме того, сообщалось о наличии С-типа CDKs и CDK-активирующих киназ (CAKs) (Magyar et al., 1997; Umeda et al., 1998; Joubes et al., 2001). Vandepoele et al., 2002, идентифицировали четыре CAKs с помощью основанного на гомологии анотационного метода. Этими CAKs были три D типа CAKs (Arath; CDKD; 1, Arath; CDKD; 2 и Arath;CDKD;3); и один F-тип CAK (Arath; CDKF; 1).
Yamaguchi et al. (PNAS Vol.100 (13) 8019-8023, 2003) описывает переэкспрессию рисовой R2 кДНК (которая кодирует CAK) в эксплантаты табачных листьев. Они сообщили, что временная экспрессия R2 в течение первых 7 дней выращивания стимулирует формирование каллуса в отсутствии цитокинина. Yamaguchi et al. также провели контроль in vitro органогенеза с помощью CDK.
Fabian-Marwedel et al. (The Plant Cell, Vol.14, 197-210, 2002) сообщают, что рисовая CAK, R2, регулирует S-фазовое продвижение и общий темп роста в суспензионных клетках.
Способность влиять на клеточный цикл растения и тем самым модифицировать различные характеристики роста растений может быть применена в различных областях, таких как повышение урожайности, размножение растений, в производстве декоративных культур, местных культур, садовых культур, лесоводстве, производстве водорослей для использования в биореакторах (для биотехнологического получения таких веществ, как фармацевтические вещества, антитела или вакцины, или для биоконсервирования органических отходов) и в других таких областях.
Было найдено, что введение в растение нуклеиновой кислоты, кодирующей CDKD, дает растения с повышенной урожайностью по сравнению с соответствующими растениями дикого типа. Поэтому согласно одному из вариантов настоящего изобретения предлагается способ повышения урожайности растений, включающий введение в растение нуклеиновой кислоты, кодирующей CDKD.
Термин «повышенная урожайность», как он определен здесь, означает одну или более из следующих характеристик, каждая относительно соответствующего растения дикого типа: (i) повышенная биомасса (масса) одной или более частей растения, в частности, надземных (обеспечивающих урожай) частей, повышенная биомасса корней или повышенная биомасса любой другой обеспечивающей урожай части; (ii) повышенный выход семян, который может быть результатом увеличения биомассы семени (массы семени) и который может быть за счет увеличения массы семян на растении или за счет увеличения отдельных семян, и при этом увеличение массы семян может быть обусловлено изменением размеров семени, таких как длина семени и/или ширина семени и/или площадь семени; (iii) увеличенное число (наполненных) семян; (iv) увеличенный размер семян, который может также влиять на состав семян; (v) увеличенный объем семян, который может также влиять на состав семян; (vi) увеличенный индекс урожайности, который выражается как отношение выхода обеспечивающих урожай частей, таких как семена, к общей биомассе; и (vii) увеличенная масса тысячи зерен (TKW), которая экстраполируется из подсчитанного числа наполненных зерен и их общей массы. Повышенная TKW может быть результатом увеличенного размера семян и/или удельного веса семян.
Согласно предпочтительному варианту осуществления изобретения повышение урожайности охватывает повышение урожайности на уровне семени, как определено в любом одном или более вышеуказанных (ii)-(vii).
Взяв в качестве примера кукурузу, повышенную урожайность можно представить как одну или более из следующих характеристик: увеличение числа растений на гектар или акр, увеличение числа початков на растение, увеличение числа рядов, увеличение числа зерен в ряду, массы зерна, массы тысячи зерен, длина/диаметр початка и др. Взяв рис в качестве примера, увеличение выхода можно выразить путем увеличения одной или более из следующих характеристик: число растений на гектар или акр, число метелок на растение, число колосков в метелке, число цветков на метелку, увеличение скорости наполнения семян, повышение массы тысячи зерен и др. Повышение урожайности также может дать в результате изменение строения или может быть результатом измененного строения.
Согласно предпочтительному варианту осуществление способов по изобретению приводит в результате к растениям с повышенной урожайностью, которая выражается с помощью, по меньшей мере, одного из признаков: увеличенная площадь надземной части, увеличенная TKW, увеличенное число наполненных семян, повышенная масса семени и повышенный индекс урожайности, каждый относительно контроля или соответствующих растений дикого типа.
Осуществление способов по изобретению преимущественно ведет к повышенной урожайности в любых растениях.
Используемый здесь термин «растение» охватывает целые растения, предки и потомство растений и части растений, включая семена, побеги, стебли, листья, корни (включая клубни), и растительные клетки, ткани и органы, где каждый из вышеупомянутых содержит интересующий ген. Термин «растение» также охватывает зародыши, меристематические области, гаметофиты, спорофиты, пыльцу и микроспоры, где снова каждый из вышеупомянутых содержит интересующий ген. Используемый здесь термин «растение» не включает суспензионные культуры и ткани каллуса.
Способы по изобретению могут быть осуществлены на любом растении, предпочтительны все растения, принадлежащие к суперсемейству Viridiplantae, в особенности однодольные и двудольные растения, включая кормовые или фуражные бобы, декоративные растения, продовольственные культуры, деревья или кустарники, выбранные из списка, включающего Acacia spp., Acer spp., Actinidia spp., Aesculus spp., Agathis australis, Albizia amara, Alsophila tricolor, Andropogon spp., Arachis spp., Areca catechu, Astelia fragrans, Astragalus cicer, Baikiaea plurijuga, Betula spp., Brassica spp., Bruguiera gymnorrhiza, Burkea africana, Butea frondosa, Cadaba farinosa, Calliandra spp., Camellia sinensis, Canna indica, Capsicum spp., Cassia spp., Centroema pubescens, Chaenomeles spp., Cinnamomum cassia, Co/Tea arabica, Colophospermum mopane, Cotonillia varia, Cotoneaster serotina, Crataegus spp., Cucumis spp., Cupressus spp., Cyathea dealbata, Cydonia oblonga, Cryptomeria japonica, Cymbopogon spp., Cynthea dealbata, Cydonia oblonga, Dalbergia monetaria, Davallia divaricata, Desmodium spp., Dicksonia squarosa, Diheteropogon amplectens, Dioclea spp., Dolichos spp., Dorycnium rectum, Echinochloa pyramidalis, Ehrartia spp., Eleusine coracana, Eragrestis spp., Erythrina spp., Eucalyptus spp., Euclea schimperi, Eulalia villosa, Fagopyrum spp., Feijoa sellowiana, Fragaria spp., Flemingia spp., Freycinetia banksii, Geranium thunbergii, Ginkgo biloba, Glycine javanica, Gliricid/a spp., Gossypium hirsutum, Grew/tea spp., Guibourtia coleosperma, Hedysarum spp., Hemarthia altissima, Heteropogon contortus, Hordeum vulgare, Hyparrhenia rufa, Hypericum erectum, Hyperthelia dissoluta, Indigo incamata, Iris spp., Leptarrhena pyrolifolia, Lespediza spp., Lettuca spp., Leucaena leucocephala, Loudetia simplex, Lotonus bainesii, Lotus spp., Macrotyloma axillare, Malus spp., Manihot esculenta, Medicago sativa, Metasequoia glyptostroboides, Musa sapientum, Nicotianum spp., Onobrychis spp., Omithopus spp., Oryza spp., Peltophorum africanum, Pennisetum spp., Persea gratissima, Petunia spp., Phaseolus spp., Phoenix canariensis, Phormium cookianum, Photinia spp., Picea glauca, Pinus spp., Pisum sativum, Podocarpus totara, Pogonarthria fleckii, Pogonarthria squarmsa, Populus spp., Prosopis cineraria, Pseudotsuga menziesii, Pterolobium stellatum, Pynis communis, Quercus spp., Rhaphiolepsis umbellata, Rhopalostylis sapida, Rhus natalensis, Ribes grossularia, Ribes spp., Robinia pseudoacacia, Rosa spp., Rubus spp., Salix spp., Schyzachyrium sanguineum, Sciadopitys verticillata, Sequoia sempervirens, Sequoiadendron giganteum, Sorghum bicolor, Spinacia spp., Sporobolus fimbriatus, Stiburus alopecuroides, Stylosanthos humilis, Tadehagi spp., Taxodium distichum, Themeda triandra, Trifolium spp., Triticum spp., Tsuga heterophylla, Vaccinium spp., Vicia spp., Vitis vinifera, Watsonia pyramidata, Zantedeschia aethiopica, Zea mays, амарант, артишок, аспарагус, брокколи, брюссельскую капусту, качанную капусту, канолу, морковь, цветную капусту, сельдерей, листовую капусту, лен, капусту кормовую, чечевицу, семена масличного рапса, окру, лук, картофель, рис, сою, землянику, сахарную свеклу, сахарный тростник, подсолнечник, томат, тыкву, чай, водоросли и др. Согласно предпочтительному варианту настоящего изобретения растение является сельскохозяйственным растением, таким как соя, подсолнечник, канола, люцерна, семена рапса, хлопок, томат, картофель или табак. Более предпочтительно растение является однодольным растением, таким как сахарный тростник. Наиболее предпочтительно растение является зерновой культурой, такой как рис, кукуруза, пшеница, просо, ячмень, рожь, сорго или овес.
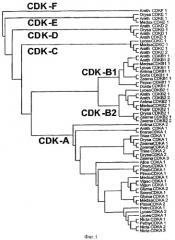
Термины " CDK D-типа" или "CDKD" используются взаимозаменяемо и относятся к любой аминокислотной последовательности, которая, когда используется в конструкции CDK филогенетического дерева, такого как указано на Фиг.1, скапливается вокруг или в группу, которая включает CDKs D-типа, но не другие типы CDK, такие как А-, В-, С-, Е- или F-тип CDKs. Упоминаемая здесь нуклеиновая кислота, кодирующая CDKD, является нуклеиновой кислотой, кодирующей CDKD аминокислоту, как определено выше.
Специалист в данной области может легко определить, любая ли из рассматриваемых последовательностей аминокислот попадает под вышеуказанное определение, используя известные для изготовления такого филогенетического дерева методики и компьютерные программы, такие как GCG, EBI или CLUSTAL пакет, используя параметры по умолчанию. В конструкции такого филогенетического дерева последовательности, скапливающиеся вокруг или в группе CDK D-типа будут рассматриваться, как попадающие под определение «CDK D-типа». Нуклеиновые кислоты, кодирующие такие последовательности, будут использоваться в выполняемых способах по изобретению.
CDKs D-типа обычно обладают способностью фосфорилировать и активировать CDKs, и также могут фосфорилировать и активировать РНК полимеразу II. CDKs D-типа могут также проявлять одну или более, а предпочтительно все, из следующих черт: (i) NXTALRE звено, где Х - любая аминокислота; (ii) каталитический киназный домен; и (iii) способность связывать циклин Н.
CDKD можно легко отличить от любой другой CDK, т.к. звено NXTALRE является специфичным для этого типа CDK (согласно теперешним знаниям). В отличие от него, согласно теперешним знаниям, CDK А-типа будет иметь PSTAIRE звено; CDK В-типа - P(P/S)T(A/T)(L/M)RE звено; а CDK С-типа - PITAIRE звено; CDK Е-типа будет иметь SPTARE звено; и CDK F-типа будет иметь XSAXRE звено.
Специалист в данной области может легко оценить активность киназы, например, на очищенных субстратах, таких как человеческая CAK2 или Arabidopsis thaliana РНК полимераза II карбокси-концевая. Способность CDKD связывать циклин Н может быть легко определена путем соосаждения комплекса CDKD-циклин Н из очищенной CDKD и циклина Н, или путем использования двух гибридных оценок.
В Arabidopsis thaliana CDKDs кодируются 3 различными генами: CDKD; 1, CDKD; 2 и CDKD; 3, каждый ген кодирует белок, который содержит звено NXTALRE, где Х - любая аминокислота.
Преимущественно способы по изобретению могут быть осуществлены с использованием любой нуклеиновой кислоты, кодирующей CDKD, как определено выше. Введение в растение кодирующей CDKD нуклеиновой кислоты дает измененную экспрессию (предпочтительно повышенную экспрессию) в растение такой нуклеиновой кислоты и/или измененные (предпочтительно повышенные) активность и/или уровни в растении CDKD полипептида. Активность CDKD может быть увеличена путем повышения уровней полипептида. Альтернативно, активность может быть повышенной, когда уровни CDKD полипептида не изменяются, или даже когда уровни CDKD полипептида снижены. Это может произойти, когда существенные свойства полипептида изменяются, например, путем изготовления мутантной версии, которая является более активной, чем полипептид дикого типа.
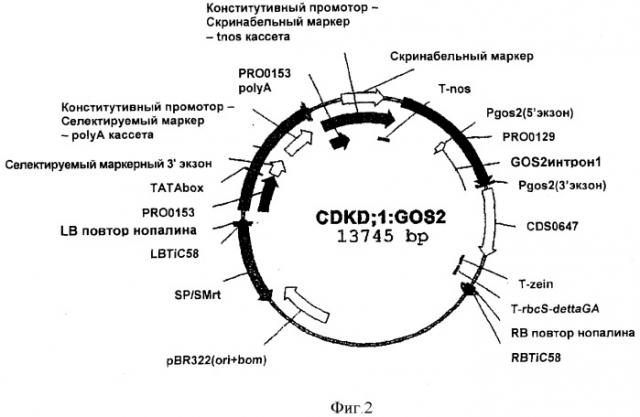
Нуклеиновая кислота, кодирующая CDKD, предпочтительно операбельно связана с конститутивным промотором для сверхэкспрессии в растении. Конститутивный промотор предпочтительно является GOS2 промотором, более предпочтительно GOS2 промотором из риса. Важно, что применимость настоящего изобретения не ограничивается использованием CDKD из Arabidopsis thaliana, ни CDKD, представленной в виде SEQ ID NO: 1, также применимость настоящего изобретения не ограничивается экспрессией CDKD-кодирующей нуклеиновой кислоты, когда побуждается с помощью GOS2 промотора.
Согласно предпочтительному варианту настоящего изобретения, рассматривается усиленная или повышенная экспрессия CDKD нуклеиновой кислоты. Способы достижения усиленной или повышенной экспрессии генов или генных продуктов хорошо описаны в уровне техники и включают, например, сверхэкспрессию, побуждаемую с помощью сильного промотора, использование транскрипционных энхансеров или трансляционных энхансеров.
Нуклеиновая кислота, кодирующая CDKD, может быть произведена из любого источника. Нуклеиновая кислота/ген, кодирующая CDKD, может быть выделена из микробного источника, такого как бактерия, дрожжи или грибы, или из растения, водоросли или животного (включая человека) источника. Эта кислота может быть модифицирована из ее природной формы в композиции или геномной среде путем преднамеренных манипуляций человека. Нуклеиновая кислота является предпочтительно гомологичной нуклеиновой кислотой, т.е. кислота получена либо из растения, либо из растения того же вида, в которое она вводится, либо из различных видов растений. Нуклеиновая кислота может быть выделена из двудольных видов, предпочтительно семейства Brassicaceae, более предпочтительно из Arabidopsis thaliana. Более предпочтительно кодирующая CDKD нуклеиновая кислота, выделенная из Arabidopsis thaliana, представляет собой CDKD; 1, CDKD; 2 или CDKD; 3. Наиболее предпочтительно CDKD является CDKD; 1 из Arabidopsis thaliana, в частности последовательностью нуклеиновой кислоты, как представленная в SEQ ID NO: 1 и соответствующей аминокислотной последовательностью, представленной в виде SEQ ID NO: 2.
Преимущественно осуществление настоящего изобретения не ограничивается использованием CDKD; 1 из Arabidopsis, как представленная в SEQ ID NO: 1. Способы по настоящему изобретению могут быть осуществлены с использованием функциональных вариантов CDKD, как описанные выше, или с использованием функциональных вариантов кодирующих CDKD нуклеиновых кислот. Предпочтительными функциональными вариантами являются варианты последовательности нуклеиновой кислоты, представленной в виде SEQ ID NO: 1 или функциональные варианты аминокислотной последовательности, представленной в виде SEQ ID NO: 2.
Используемый здесь термин «функциональный вариант» означает вариант, который попадает под приведенное ранее определение CDKD. Предпочтительно функциональный вариант также обладает способностью фосфорилировать и активировать CDKs, и фосфорилировать и активировать РНК полимеразу II. Предпочтительно функциональный вариант CDKs D-типа проявляет одну или более, а предпочтительно все, из следующих черт: (i) NXTALRE звено, где Х - любая аминокислота; (ii) каталитический киназный домен; и (iii) способность связывать циклин Н. Специалист в данной области легко определит, является ли частный вариант функциональным (в смысле способен ли он повышать выход растения) путем простой замены последовательности, описанной ниже в разделе Примеры, вариантом, тестируемым на функцию.
Подходящий вариант нуклеиновой кислоты и аминокислотных последовательностей, используемый при осуществлении способа по настоящему изобретению, включает:
(i) функциональную часть кодирующей CDKD нуклеиновой кислоты;
(ii) последовательности, способные к гибридизации кодирующей CDKD нуклеиновой кислоты;
(iii) альтернативные сплайс-варианты кодирующей CDKD нуклеиновой кислоты;
(iv) аллельные варианты кодирующей CDKD нуклеиновой кислоты;
(v) гомологи, производные и активные фрагменты CDKD аминокислоты.
Каждый из вышеупомянутых вариантов является функциональным вариантом, как он определен ранее.
Специалисту в данной области очевидно, что использование кодирующей CDKD последовательности ДНК полной длины не является необходимым условием для выполнения способов по изобретению. Способы по изобретению преимущественно могут быть осуществлены с использованием функциональной части кодирующей CDKD ДНК/нуклеиновой кислоты, предпочтительно функциональной части последовательности нуклеиновой кислоты, как представленная в SEQ ID NO: 1. Функциональная часть является кодирующей CDKD нуклеиновой кислотой, попадающей под определение функциональных вариантов, приведенное выше. Часть может быть получена, например, путем проведения одной или более делеций кодирующей CDKD нуклеиновой кислоты, такой как последовательность нуклеиновой кислоты, представленная в SEQ ID NO: 1, с использованием методик, хорошо известных из уровня техники.
Поэтому согласно изобретению предлагается способ повышения урожайности растения, особенно выхода семян, включающий введение в растение части кодирующей CDKD нуклеиновой кислоты.
Другим вариантом является последовательность, способная к гибридизации кодирующей CDKD нуклеиновой кислоты. Такими гибридизирующими последовательностями являются последовательности, попадающие под определение функциональных вариантов, приведенное выше. Особенно предпочтительными являются последовательности, способные к гибридизации кодирующей CDKD нуклеиновой кислоты при жестких условиях, особенно кодирующая CDKD нуклеиновая кислота, представленная в виде SEQ ID NO: 1.
Термин «гибридизация», как он определен здесь, означает процесс, где по существу гомологичные комплементарные нуклеотидные последовательности аннелируют друг друга. Процесс гибридизации может быть осуществлен полностью в растворе, т.е. обе комплементарные нуклеиновые кислоты находятся в растворе. Методы молекулярной биологии, на которых основан такой процесс, включают полимеразную цепную реакцию (PCR; и все основанные на ней методы), субстрактивную гибридизацию, случайное (рандомное) праймерное расширение, нуклеаза S1 картирование, праймерное расширение, обратную транскрипцию, синтезы кДНК, различные развертки РНК, и определение последовательности ДНК. Процесс гибридизации также может быть осуществлен с одной из комплементарных нуклеиновых кислот, иммобилизованной в матрице, такой как магнитные гранулы, гранулы Сефарозы или любой другой смолы.
Методы молекулярной биологии, на которых основан такой процесс, включают выделение поли (А*) мРНК. Процесс гибридизации, кроме того, может быть осуществлен с одной из комплементарных нуклеиновых кислот, иммобилизованной в твердой подложке, такой как нитроцеллюлоза или нейлоновая мембрана, или иммобилизованной, например, путем фотолитографии, например, на кремнийсодержащей стеклянной подложке (последние известны как нуклеиновокислотные матрицы или микроматрицы или как нуклеиновокислотные чипы). Методы молекулярной биологии, на которых основан такой процесс, включают РНК и ДНК гелевые блот-анализы, гибридизацию колоний микроорганизмов, гибридизацию тромбоцитов, in situ гибридизацию и микроматричную гибридизацию. Для того чтобы осуществить возможную гибридизацию, молекулы нуклеиновой кислоты обычно термически или химически денатурируют, чтобы перевести двойную цепь в две единичные цепи и/или удалить «шпильки» или другие вторичные структуры из единичных цепных нуклеиновых кислот. На строгость гибридизации влияют условия, такие как температура, концентрация соли и состав буфера гибридизации. Гибридизацию предпочтительно осуществляют при жестких условиях. Жесткими условиями являются те, при которых (1) используют низкую ионную концентрацию и высокую температуру промывки, например, 0,5М натрийфосфатный буфер с рН 7.2, 1 мМ ЭДТА рН 8.0 в 7% SDS при температуре или 65°С или 55°С, или (2) используют во время гибридизации денатурирующий агент, такой как формамид, например, 50% (об/об) формамид с 0.1% бычьим сывороточным альбумином, 0.1% Ficoll, 0.1% поливиниполипирролидон, 0.05 М натрийфосфатный буфер с рН 6.5 с 0.75 М NaCl, 0.075 М натрий цитрат при 42°С. Специфические примеры включают использование 50% формамида, 5XSSC (0.75 M NaCl, 0.075 М натрий цитрата), 50 мМ натрий фосфата (рН 6.8), 0.1% натрий пирофосфата, 5Х Denhard's раствора, обработанной ультразвуком ДНК из молок лососевых (50 nm/мл), 0.1% SDS и 10% декстран сульфата при 55°С, с промывками при 55°С в 0.2XSSC и 0.1% SDS. Специалист может легко определить и изменить жесткость условий, подходящих для получения ясного и обнаруживаемого сигнала гибридизации.
Поэтому согласно изобретению предлагается способ повышения урожайности растения, включающий введение в растение последовательности способной к гибридизации, предпочтительно при жестких условиях, кодирующей CDKD нуклеиновой кислоты.
Другим вариантом, используемым в способах по изобретению, является альтернативный сплайс-вариант кодирующей CDKD нуклеиновой кислоты. Подходящими сплайс-вариантами являются варианты, попадающие под определение функциональных вариантов, приведенное выше. Используемый здесь термин «альтернативный сплайс-вариант» охватывает варианты нуклеиновой кислоты, в которой выбранные интроны и/или экзоны исключены, замещены или добавлены. Такими вариантами будут те, в которых биологическая активность белка сохраняется нетронутой, что может быть достигнуто путем селективного сохранения функциональных сегментов белка. Такие сплайс-варианты могут быть найдены в природе или могут быть изготовлены человеком. Способы изготовления таких сплайс-вариантов хорошо известны из уровня техники. Сплайс-варианты SEQ ID NO: 1 являются особенно предпочтительными для использования в способах по изобретению.
Поэтому изобретение также предлагает способ повышения урожайности растения, включающий введение в растение альтернативного сплайс-варианта кодирующей CDKD нуклеиновой кислоты.
Другим вариантом, используемым в способах по изобретению, является аллельный вариант кодирующей CDKD нуклеиновой кислоты. Подходящими аллельными вариантами являются варианты, попадающие под определение функциональных вариантов, приведенное выше. Аллельные варианты существуют в природе, и использование в способах по настоящему изобретению является использованием этих природных аллелей. Аллельные варианты охватывают единичные нуклеотидные полиморфизмы (SNPs), а также малые инсерция/делеция полиморфизмы (INDELs). Размер INDELs обычно меньше чем 100 bp.SNPs и INDELs формируют наибольший набор вариантов последовательностей существующих в природе полиморфных цепей большинства организмов. Аллельные варианты SEQ ID NO: 1 являются особенно предпочтительными для использования в способах по изобретению.
Поэтому изобретение также предлагает способ повышения урожайности растения, включающий введение в растение аллельного варианта кодирующей CDKD нуклеиновой кислоты.
Кроме того, преимущественно способы по настоящему изобретению могут быть осуществлены с использованием гомологов, производных или активных фрагментов CDKD. Нуклеиновые кислоты, кодирующие гомологи, производные или активные фрагменты аминокислоты, такой как представленная в виде SEQ ID NO: 2, могут быть легко определены с использованием обычных методик, хорошо известных специалистам в данной области. Какие нуклеиновые кислоты подходят для использования в способах по изобретению можно легко определить, как описано выше.
«Гомологи» белка охватывают пептиды, олигопептиды, полипептиды, белки и энзимы, имеющие аминокислотные замещения, делеции и/или инсерции относительно данного не модифицированного белка и имеющие схожую биологическую и функциональную активность с не модифицированным белком, из которого они произведены. Для получения таких гомологов аминокислоты белка могут быть замещены другими аминокислотами, имеющими схожие свойства (такими как схожие гидрофобность, гидрофильность, антигенность, склонность к образованию или разрыву α-спиральных структур или β-пластинчатых структур). Таблицы консервационного замещения хорошо известны из уровня техники (см., например, Creighton (1984) Proteins. W.H.Freeman and Company).
Гомологи, используемые в способах по настоящему изобретению, имеют преимущественно, по меньшей мере, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% идентичности последовательности с аминокислотной последовательностью, представленной в виде SEQ ID NO: 2. CDKDs проявляют около 65% идентичности друг другу и проявляют менее 40% идентичности с другими CDKs. Поэтому гомолог, имеющий, по меньшей мере, 50% идентичности с CDK, как представленная SEQ ID NO: 2, не будет охватывать любую другую CDK, кроме CDK D-типа.
Термином «гомологи» также охватываются две специальные формы гомологии, которые включают ортологические последовательности и паралогические последовательности, которые охватывают эволюционные концепции, используемые для описания наследственных соотношений генов. Термин «паралогический» относится к ген-дупликациям внутри генома вида, ведущего к паралогическим генам. Термин «ортологический» относится к гомологичным генам в различных организмах, обусловленным наследственными взаимоотношениями.
Ортологи, например, в видах однодольных растений, могут быть легко найдены с помощью так называемого реципрокного бласт-поиска. Это может быть сделано с помощью первого бласта, включающего бластирование данной последовательности (например, SEQ ID NO: 1 или SEQ ID NO: 2) по отношению к любой последовательности из базы данных, такой как открыто доступной базе данных NCBI, которую можно найти на: http://www.ncbi.nlm.nih.gov. Если бы разыскивались ортологи в рисе, данная последовательность была бы бластирована, например, по отношению к клонам кДНК полной длины 28469 из Oryza sativa Nipponbare, доступных из NCBI. Может быть использован BLASTn, когда исходят из нуклеотидов, или TBLASTX, когда исходят из белка, при стандартных значениях по умолчанию (ожидание 10, выравнивание 50). Бласт-результаты могут быть отфильтрованы. Полные последовательности либо из отфильтрованных результатов, либо из не фильтрованных результатов затем повторно бластируют (второй бласт) по отношению к данной последовательности (SEQ ID NO: 1 или 2). Результаты первого и второго бластов затем сравнивают. В случае больших семейств используют ClustalW с последующей визуализацией в виде дерева ближайших соединений.
Гомолог может быть в форме «замещенного варианта» белка, т.е. когда, по меньшей мере, один остаток в аминокислотной последовательности удален и на его место вставлен другой остаток. Аминокислотные замещения обычно бывают из единичных остатков, но могут быть кластерными, в зависимости от функциональных ограничений, накладываемых на полипептид; инсерции обычно бывают порядка от 1 до 10 аминокислотных остатков, а делеции будут в интервале от 1 до 20 остатков. Предпочтительно аминокислотные замещения содержат консервативные аминокислотные замещения.
Гомолог может быть в форме «инсерционного варианта» белка, т.е. когда один или более аминокислотных остатков введены в предопределенный сайт в белке. Инсерции могут содержать амино-концевые и/или карбокси-концевые слияния, а также инсерции внутрь последовательности единичной или множества аминокислот. В общем, инсерции внутри аминокислотной последовательности должны быть меньшими, чем амино- или карбокси-концевые слияния, порядка от 1 до 10 остатков. Примеры амино- или карбокси-терминально слитых белков или пептидов включают связывающий домен или активирующий домен транскрипционного активатора, как используемые в дрожжевой двухгибридной системе, белки оболочки фагов, (гистидин)6-метка, глутатион-S-трансфераза-метка, белок А, мальтоза-связывающий белок, дигидрофолат редуктаза, эпитоп Tag·100, c-myc эпитоп, FLAG® - эпитоп, lacZ, CMP (калмодулин-связывающий белок), эпитоп НА, эпитоп белка С и эпитоп VSV.
Гомологи в форме «делеционных вариантов» белка характеризуются удалением одной или более аминокислот из белка.
Аминокислотные варианты белка могут быть легко изготовлены с использованием методик синтеза пептидов, хорошо известных из уровня техники, таких как твердофазный пептидный синтез и аналогичные, или путем манипуляций рекомбинантных ДНК. Способы манипулирования ДНК последовательностями для получения замещенных, инсерционных или делеционных вариантов белков хорошо известны из уровня техники. Например, методики изготовления замещенных мутаций при предопределенных сайтах в ДНК хорошо известны специалистам в данной области и включают М13 мутагенез, T7-Gen in vitro мутагенез (USB, Cleveland, ОН), быстро обменный сайт-специфический мутагенез (Stratagene, San Diego, CA), PCR-опосредованный сайт-специфический мутагенез или другие протоколы сайт-специфического мутагенеза.
«Производные» включают пептиды, олигопептиды, полипептиды, белки и энзимы, которые могут содержать замещения, делеции или добавления природных или не имеющихся в природе аминокислотных остатков, по сравнению с аминокислотными последовательностями имеющихся в природе форм белка, например, как представленные в SEQ ID NO: 2. «Производные» белка охватывают пептиды, олигопептиды, полипептиды, белки и энзимы, которые могут содержать природно-существующие измененные, гликозилированные, ацилированные, или не существующие в природе аминокислотные остатки, по сравнению с аминокислотными последовательностями имеющихся в природе форм полипептида. Производное может также содержать один или более не аминокислотный заместитель, по сравнению с аминокислотной последовательностью, из которой оно произведено, например молекула репортер или другой лиганд, ковалентно или не ковалентно связанный с аминокислотной последовательностью, такой как молекула репортер, которая связана для облегчения ее обнаружения, и не существующие в природе аминокислотные остатки, родственные аминокислотным последовательностям природно-существующего белка.
«Активные фрагменты» CDKD белка охватывают аминокислотные остатки, подходящие для группирования вокруг или в группе CDK D-типа на конструкции филогенетического дерева, такого как показано на Фиг.1. Когда используемые фрагменты в филогенетическом дереве похожи с теми, с которыми должны быть сравнены, это значит, что должны быть использованы соответствующие фрагменты других CDK для изготовления дерева.
Способы поиска и идентификации гомологов CDKD должны быть хорошо известны специалистам в данной области техники. Методы выборки последовательностей для сравнения хорошо известны специалистам в данной области, такие методы включают GAP, BESTFIT, BLAST, FASTA и TFASTA. GAP использует алгоритм Needleman and Wunsch (J. Mol. Biol. 48: 443-453, 1970) для выборки из двух полных последовательностей последовательности с максимальным числом пар и минимальным числом пробелов. Алгоритм BLAST рассчитывает процент идентичности последовательности и выполняет статистический анализ схожести между двумя последовательностями.
Программное обеспечение для выполнения BLAST анализов доступно через Национальный центр биотехнологической информации. Гомологи, подходящие для использования в способе по изобретению, т.е. имеющие, по меньшей мере, 50% идентичности последовательности с аминокислотной последовательностью, представленной в виде SEQ ID NO: 2, могут быть идентифицированы с помощью последовательностей белка CDK полной длины путем их сравнения с использованием программного обеспечения ClustalX1.81, используя параметры по умолчанию. Матрица расстояний может быть затем рассчитана из этого сравнения с использованием программного обеспечения BOXSHADE, также используя параметры по умолчанию. Оба программных обеспечения общедоступны.
Таким образом, изобретение также предлагает способ повышения урожайности растения, включающий введение в растение нуклеиновой кислоты, к