Способ получения образца для детектирования микроорганизма, способ детектирования микроорганизма и набор для детектирования микроорганизма
Иллюстрации
Показать всеСогласно следующим стадиям детектируют при помощи проточной цитометрии живые клетки, поврежденные клетки, VNC клетки и мертвые клетки микроорганизма в тестируемом образце: а) стадия обработки тестируемого образца ферментом, выбираемым из липолитических ферментов и протеаз, обладающим активностью по разрушению клеток, отличающихся от клеток микроорганизма, коллоидных частиц белков или липидов, присутствующих в исследуемом образце; b) стадия обработки тестируемого образца ингибитором топоизомеразы и/или ингибитором ДНК-гиразы; с) стадия обработки тестируемого образца, обработанного на стадиях а) и b), агентом, окрашивающим ядра, и d) стадия детектирования микроорганизмов в тестируемом образце, обработанном агентом, окрашивающим ядра, проточной цитометрией. Это обеспечивает удобное и быстрое детектирование живых микроорганизмов и распознавание поврежденных и мертвых клеток в пищевых продуктах и клинических образцах. 3 н. и 17 з.п. ф-лы, 19 ил., 8 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу детектирования микроорганизма, содержащегося в продуктах питания или клинических образцах, способу получения образца, используемого для способа, и к набору для детектирования микроорганизма. Более конкретно настоящее изобретение относится к способу и набору для детектирования микроорганизма, который позволяет равномерно различать живые клетки, поврежденные клетки и мертвые клетки микроорганизма, содержащегося в пищевых продуктах и клинических образцах.
Уровень техники
Метод культивирования на чашках традиционно использовали для измерения общего количества живых бактерий в пищевых продуктах, клинических образцах или окружающей среде. Однако метод культивирования на чашках требует для получения результатов примерно два дня времени. Более того, при бактериологическом тесте, основанном на культуре, при использовании обычно используемой среды трудно детектировать поврежденные бактерии в окружающей среде, бактерии, поврежденные искусственным воздействием (первое может относиться к живым, но не культивируемым (VNC) клеткам, и последнее может относиться к поврежденным клеткам, в особенности в узком смысле этого слова), и т.д. и было желательным разработать быстрый и надежный способ для подсчета живых бактерий.
Проточная цитометрия (FCM) представляет собой способ пропускания потока образца в проточной кювете при постоянной скорости потока, проходящего через лазерный луч, и измерения рассеяния света клетками или другими микрочастицами или флуоресценции, испускаемой клетками или другими микрочастицами. Поскольку это позволяет детектировать микроорганизмы на уровне одной клетки, в последние годы этот способ используют для детектирования микроорганизмов не только в области молекулярной биологии и клеточной биологии, но также для детектирования микроорганизмов в окружающей среде, молочных продуктах, напитках, клинических образцах и т.д. (например, патентные документы 1 и 2, непатентные документы с 1 по 5).
Однако аппараты для FCM (проточные цитометры), используемые в целях указанного способа, являются чрезвычайно дорогостоящими и имеют большие размеры, и они также требуют наличия навыка для их использования. Более того, для указанных аппаратов до настоящего момента существуют требующие улучшения или решения проблемы, связанные с экономией, безопасностью, простотой, надежностью и достоверностью различения живых клеток и мертвых клеток микроорганизмов для действительных применений в области пищевой промышленности, где существует большое разнообразие бактериальных контаминантов, как неповрежденными бактериями, поврежденными бактериями, так и мертвыми бактериями.
Например, патентный документ 1 описывает способ детектирования общего содержания бактерий в жидком образце при использовании хелатирующего иона, протеазы, поверхностно-активного вещества и бактериологически-специфического флуоресцентного красителя. Хелатирующий ион, типичным примером которого является ЭДТА, необходимо использовать в концентрации от 1 до 5 мМ, и если концентрация превышает данный уровень, то клеточные стенки и клеточные мембраны живых бактерий, клеточные стенки которых не повреждены, могут быть также разрушены. Предпочтительная концентрация хелатирующего иона, используемого в способе патентного документа 1, составляет от примерно 6 до 17 мМ, и, исходя из этого, существует проблема, состоящая в том, что подвергаются лизису как мертвые бактерии, так и живые бактерии. Более того, предел детектирования указанного способа составляет примерно 104 КОЕ/мл, и, исходя из этого, если число живых бактерий низкое (103 КОЕ/мл или меньше) в жидком образце, при условии что только одна живая бактерия существует в жидком образце, бактерии должны пролиферировать до уровня указанного выше предела детектирования. Исходя из этого, указанный способ нельзя безусловно рассматривать как быстрый способ.
Патентный документ 2 описывает способ обработки образцов жидкостей организма протеазой, липазой и нуклеазой, лизис лейкоцитов, тромбоцитов и эритроцитов при использовании окрашивания этидий бромидом в буфере, включающем борат натрия, ЭДТА, формальдегид и неионное поверхностно-активное вещество (Triton X-100 и т.д.), для окрашивания этидий бромидом только бактерий, детектирование и количественные оценки бактерий на основе флуоресцентной микроскопии, проточной цитометрии или т.п. Однако предполагается, что лейкоциты и тромбоциты не подвергаются лизису, оставаясь в теле жидкого образца даже после обработки протеазой, липазой и нуклеазой, и на них адсорбируются живые бактерии с образованием комплексов, и что окрашиваются как живые бактерии, так и мертвые бактерии, и, таким образом, оказывается трудным определить, является бактерия живой или мертвой. Более того, хотя патентный документ 2 описывает, что способ представляет собой способ детектирования бактерий при такой низкой плотности, как 10 клеток/мл (образец) в течение времени примерно 2 часа или быстрее, часто 45 минут или быстрее, патентный документ в действительности описывает пример, в котором детектирование оказалось невозможным, пока в жидком образце не присутствовало бы по крайней мере 104 КОЕ/мл или более бактерий, и, таким образом, способ не применим для детектирования небольшого количества микроорганизмов, такого как в коровьем молоке.
Непатентный документ 1 описывает способ использования свойства SYTO63, состоящего в том, что он проникает сквозь клеточные стенки и клеточные мембраны живых клеток и мертвых клеток, и свойство TO-PRO3, состоящее в том, что он проникает сквозь клеточные стенки и клеточные мембраны мертвых клеток, в попытке распознавания живых бактерий и мертвых бактерий на основе проточной цитометрии. Дополнительно, документ описывает пример, в котором живые клетки и мертвые клетки суспендировали в стерилизованной воде и проводили попытку распознавания живых клеток и мертвых клеток в указанной среде. Однако мертвые клетки представляли собой клетки, которые кипятили в течение 15 минут, и их клеточные стенки и клеточные мембраны были в значительной степени повреждены по сравнению с мертвыми клетками в реальных пищевых продуктах. Исходя из этого, указанный способ представляет собой способ, пригодный исключительно для мертвых бактерий в ограниченном диапазоне пищевых продуктов, таких как термически обработанные блюда, при этом не оценивались условия для ультравысокотемпературной пастеризации, используемой для коровьего молока и т.д. и в современных продуктах, и уничтожающей бактерии без денатурации белков в пищевых продуктах.
Непатентный документ 2 описывает способ, позволяющий протеиназе К действовать на UHT (пастеризованное при ультравысокой температуре) коровье молоко для переваривания мицеллярного казеина, с удалением липидов путем центрифугирования при охлаждении для детектирования бактерий в коровьем молоке и измерения в нем общего числа бактерий (включая живые бактерии и мертвые бактерии), и способ добавления 0,1% Triton X-100 в качестве неионогенного поверхностно-активного вещества к сырому молоку дополнительно к указанной выше протеиназе К для детектирования бактерий в сыром молоке и измерения общего бактериального числа (числа живых бактерий и мертвых бактерий). Однако в способах непатентного документа 2 даже если предоставляли протеазе К воздействовать на UHT коровье молоко, мицеллярный казеин полностью не переваривается и присутствует большое число не полностью переваренных продуктов, имеющих размер, сопоставимый с размером бактерий. Если флуоресцентный ядерный краситель, такой как SYTO BC или SYTO9, действует на такие продукты, наблюдается сильное неспецифическое поглощение, затрудняющее их различение от живых бактерий. Более того, существует проблема, состоящая в том, что клеточные мембраны соматических клеток, такие как коровьи лейкоциты и клетки эпителия молочной железы, рассматриваемые как часть компонентов, контаминирующих молоко, повреждаются только в незначительной степени, и если их подвергают окрашиванию SYTO BC, SYTO9 или пропидий йодидом в том виде, в котором они присутствуют, то пропидий йодид не проникает в них, и в результате хромосомная ДНК испускает зеленую флуоресценцию, что затрудняет различение соматических клеток и живых бактерий.
Непатентный документ 3 описывает способ, сходный со способом патентного документа 1, за тем исключением, что не используют обработку протеазой в качестве способа измерения числа живых бактерий молочнокислых бактерий в йогурте или закваске йогурта, и способ описан в качестве способа использования неионогенного поверхностно-активного вещества в сочетании с хелатирующим агентом. В качестве отличительного признака изобретения описано, что способ позволяет разрушать соматические клетки, выступающие в качестве контаминантов, и эффективно разделять глобулы жира. Однако образцы, подвергаемые указанной выше обработке, содержат множество контаминантов, происходящих из молока, и предел обнаружения живых кисломолочных бактерий уменьшается до настолько малого содержания, как примерно 105 КОЕ/мл для йогурта или закваски йогурта из-за наличия контаминантов. Исходя из этого, способ требует в особенности деликатного определения условий для разрушения исключительно соматических клеток и отсутствия повреждения клеточных стенок и клеточных мембран живых бактерий путем регулирования концентрации неионогенного поверхностно-активного вещества и хелатирующего агента. Таким образом, способ не пригоден в качестве удобного и высокочувствительного способа детектирования для различения живых бактерий и мертвых бактерий.
Хотя этидий моноазид (EMA, 8-азид-3-амин-6-фенил-5-этилфенантрадиний хлорид) в общем известен как обладающий противораковым действием, он представляет собой яд в отношении топоизомеразы II (тип II топоизомеразы), существующей в клетках млекопитающих (например, непатентный документ 5). ЕМА беспорядочно интеркалирует в хромосомную ДНК, и затем только интеркалированный ЕМА превращается в нитрен под действием облучения видимым светом и связывается с хромосомной ДНК при помощи ковалентного связывания. Например, под действием топоизомеразы раковые клетки регулируют степень спиральности цепей ДНК или разматывают цепи ДНК, для того чтобы осуществить репликацию цепей ДНК и экспрессию генов (транскрипция ДНК), и расплетание достигается путем расщепления соответствующих участков хромосомной ДНК и повторного лигирования продуктов расщепления. В этом случае, как и для функции ЕМА, повторное лигирование ДНК топоизомеразой II ингибируется в результате ковалентного присоединения нитрена, полученного из ЕМА, в момент повторного лигирования, и в результате усиливается фрагментация ДНК. ЕМА, не интеркалированная в цепи ДНК и существующая в свободной форме, превращается под действием видимого света в гидроксиламин, но гидроксиламин не ингибирует активности топоизомеразы II.
В качестве соединений, ингибирующих такую активность топоизомеразы II, помимо этидий моноазида, упомянутого выше, известны амсакрин, доксорубицин, эллиптицин, этопсид, митоксантрон, саинтопин и т.д. В качестве соединений, ингибирующих активность топоизомеразы I, которая обладает активностью, сходной с топоизомеразой II, известны камптотецин, топотекан и т.д. (например, непатентный документ 6). Дополнительно, в области бактерий в качестве соединений, ингибирующих активность бактериальной ДНК-гиразы, имеющей активность, сходную с упомянутыми выше ферментами, известны ципрофлоксацин, офлоксацин, эноксацин, пефлоксацин, флероксацин, норфлоксацин, налидиксовая кислота, оксолиновая кислота, пиромидиновая кислота и т.д. (например, непатентный документ 7).
Однако до настоящего времени не сообщалось об использовании указанных ядов топоизомеразы I, ядов топоизомеразы II и ядов бактериальной ДНК-гиразы для предварительной обработки образцов, таких как пищевые продукты и клинические образцы, содержащие микроорганизмы, в способах исследования для различения живых клеток и мертвых клеток микроорганизмов в целях реализации быстрого и высокочувствительного детектирования.
В качестве другого способа детектирования живых бактерий предлагалась автоматическая система для удобного и быстрого детектирования респираторной активности и эстеразной активности (патентный документ 3). Однако детектирование при использовании указанного способа ограничивается случаями, при которых может быть точно измерена респираторная активность и эстеразная активность исследуемой бактерии.
В качестве состояний, отличных от живых бактерий, существуют поврежденные клетки, VNC (живые, но некультивируемые клетки) и мертвые клетки. Описан способ определения их проточной цитометрией при использовании cFDA (диацетат карбоксифлуоресцеина), который испускает зеленую флуоресценцию в присутствии эстеразы и пропидий йодида (PI) (непатентный документ 8). Однако данный способ также представляет собой способ, при помощи которого можно легко различать живые клетки, поврежденные клетки и мертвые клетки, только в том случае, если повреждение клеточных стенок в поврежденных клетках выражено в значительной степени.
Таким образом, если поврежденные клетки представляют собой поврежденные клетки с низкой степенью повреждения, вызванной длительным временем пастеризации при низкой температуре (LTLT) или коротким временем пастеризации при высокой температуре (HTST), или поврежденные клетки с низкой степенью повреждения, вызванной воздействием окружающей среды, живые клетки и поврежденные клетки не могут быть различены при использовании данного способа.
Патентный документ 1: Международная патентная заявка, нерассмотренная публикация в Японии № 9-510105.
Патентный документ 2: Японская патентная публикация (Kokoku) № 6-55157.
Патентный документ 3: Японский опубликованный патент № 2002-281998.
Непатентный документ 1: Bokin Bobai, vol. 31, No.7, 2003, pp. 357-363.
Непатентный документ 2: Applied and Environmental Microbiology, vol. 66, No. 3, 2000, pp. 1228-1232.
Непатентный документ 3: Applied and Environmental Microbiology, vol. 68, No. 6, 2002, pp. 2934-2942.
Непатентный документ 4: Applied and Environmental Microbiology, vol. 60, No. 12, 1994, pp. 4255-4262.
Непатентный документ 5: Biochemistry, vol. 36, No. 50, 1997, pp. 15884-15891.
Непатентный документ 6: The Journal of Biological Chemistry, vol. 270, No. 37, 1995, pp. 21429-21432.
Непатентный документ 7: The New England Journal of Medicine, vol. 324, No. 6, 1991, pp. 384-394.
Непатентный документ 8: Applied and Environmental Microbiology, vol. 68, 2002, pp. 5209-5216.
Описание изобретения
Проблемы, которые решает настоящее изобретение
Одна из целей настоящего изобретения состоит в обеспечении способа детектирования микроорганизма, который позволяет удобное и быстрое детектирование живых микроорганизмов в пищевых продуктах и клинических образцах при использовании экономически выгодной проточной цитометрии, и может применяться при выборочных инспекциях на пищевых предприятиях или в клинической области, и способа получения образца, используемого в последующем способе. Более того, другая цель настоящего изобретения состоит в обеспечении набора, делающего возможным распознавание живых клеток, поврежденных клеток и мертвых клеток.
Средства решения проблемы
С точки зрения указанного выше уровня техники, заявители настоящего изобретения тщательно исследовали удобный способ теста с достоверностью и точностью и в приложении к детектированию живых клеток микроорганизма, содержащихся в пищевых продуктах и клинических образцах, в особенности для различения живых клеток, поврежденных клеток и мертвых клеток. В результате, заявители обнаружили, что даже если количество микроорганизма, содержащегося в образце, бесконечно мало, то возможно различить живые клетки и мертвые клетки с высокой степенью чувствительности, путем идентификации различных контаминантов, включающих мертвые клетки, содержащиеся в пищевых продуктах и клинических образцах, путем предварительной обработки пищевого продукта или клинического образца липазой, протеазой, этидий моноазидом, в качестве ДНК-интеркалирующего агента и т.д., для того чтобы эффективно удалять контаминанты на стадии предварительной обработки образца, флуоресцентного окрашивания образца и подвергания измерению при использовании проточного цитометра. Таким образом, заявители осуществили настоящее изобретение.
Таким образом, настоящее изобретение обеспечивает способ получения измеряемого образца для детектирования живых клеток микроорганизма в тестируемом образце при помощи проточной цитометрии, который включает следующие стадии:
а) стадия обработки тестируемого образца ферментом, обладающим активностью с точки зрения разрушения клеток, отличающихся от клеток микроорганизма, коллоидных частиц белков или липидов, присутствующих в исследуемом образце, и
b) стадия обработки тестируемого образца ядом топоизомеразы и/или ядом ДНК-гиразы.
Настоящее изобретение также обеспечивает способ детектирования живых клеток микроорганизма в тестируемом образце при помощи проточной цитометрии, который включает следующие стадии:
а) стадия обработки тестируемого образца ферментом, обладающим активностью с точки зрения разрушения клеток, отличающихся от клеток микроорганизма, коллоидных частиц белков или липидов, присутствующих в исследуемом образце,
b) стадия обработки тестируемого образца ядом топоизомеразы и/или ядом ДНК-гиразы,
с) стадия обработки тестируемого образца, обработанного на стадиях а) и b) агентом, окрашивающим ядра, и
d) стадия детектирования микроорганизмов в тестируемом образце, обработанном агентом, окрашивающим ядра, проточной цитометрией.
В предпочтительном варианте осуществления способа для получения измеряемого образца для детектирования живых клеток микроорганизма в тестируемом образце при помощи проточной цитометрии и способа детектирования живых клеток микроорганизма в тестируемом образце при помощи проточной цитометрии, стадию b) проводят после стадии а).
В предпочтительных вариантах осуществления указанных выше способов тестируемый образец представляет собой тестируемый образец молока, молочного продукта, пищевого продукта, полученного при использовании молока или молочного продукта в качестве исходного материала, образец крови, образец мочи, образец спинно-мозговой жидкости, образец синовинальной жидкости и образец плевральной жидкости.
В предпочтительных вариантах осуществления упомянутых выше способов микроорганизм представляет собой бактерию.
В предпочтительных вариантах осуществления упомянутых выше способов фермент выбирают из липолитических ферментов и протеаз.
В предпочтительных вариантах осуществления упомянутых выше способов яд топоизомеразы выбирают из амсакрина, камптотецина, доксорубицина, эллиптицина, этопозида, митоксантрона, саинтопина, топотекана и СР-115953.
В предпочтительных вариантах осуществления упомянутых выше способов яд ДНК-гиразы выбирают из ципрофлоксацина, офлоксацина, эноксацина, пефлоксацина, флероксацина, норфлоксацина, налидиксовой кислоты, оксолиновой кислоты и пиромидиновой кислоты.
В предпочтительных вариантах осуществления упомянутых выше способов яд топоизомеразы представляет собой этидий моноазид, и способ включает стадию подвергания тестируемого образца, к которому добавляют этидий моноазид, облучению видимым светом.
В предпочтительных вариантах осуществления упомянутых выше способов способы дополнительно включают стадию с) обработки тестируемого образца, обработанного в стадиях а) и b), агентом, окрашивающим ядра.
В предпочтительных вариантах осуществления упомянутых выше способов агент, окрашивающий ядра, включает первый окрашивающий агент, который может проникать через клеточные стенки живых клеток и мертвых клеток, и второй окрашивающий агент, который более легко проникает через клеточные стенки мертвых клеток, по сравнению с клеточными стенками живых клеток, по сравнению с первым окрашивающим агентом.
В предпочтительных вариантах осуществления упомянутых выше способов агент, окрашивающий ядра, представляет собой пропидий йодид и SYTO9.
Настоящее изобретение также обеспечивает набор для получения измеряемого образца для детектирования живых клеток микроорганизма в тестируемом образце при использовании проточной цитометрии, который включает следующие элементы: фермент, выбранный из липолитических ферментов и протеаз, яд топоизомеразы и/или яд ДНК-гиразы и агенты, окрашивающие ядра.
В предпочтительном варианте осуществления упомянутого выше набора яд топоизомеразы выбирают из амсакрина, камптотецина, доксорубицина, эллиптицина, этопозида, митоксантрона, саинтопина, топотекана и СР-115953.
В предпочтительном варианте осуществления упомянутого выше набора яд ДНК-гиразы выбирают из ципрофлоксацина, офлоксацина, эноксацина, пефлоксацина, флероксацина, норфлоксацина, налидиксовой кислоты, оксолиновой кислоты и пиромидиновой кислоты.
В предпочтительном варианте осуществления упомянутого выше набора яд топоизомеразы представляет собой этидий моноазид.
Эффективное действие изобретения
Настоящее изобретение позволяет удобно и быстро различать живые клетки, поврежденные клетки и мертвые клетки в пищевых продуктах и клинических образцах при использовании проточной цитометрии. Способы и набор по настоящему изобретению можно применять при стихийных инспекциях, а также он является выгодным с экономической точки зрения.
Краткое описание чертежей
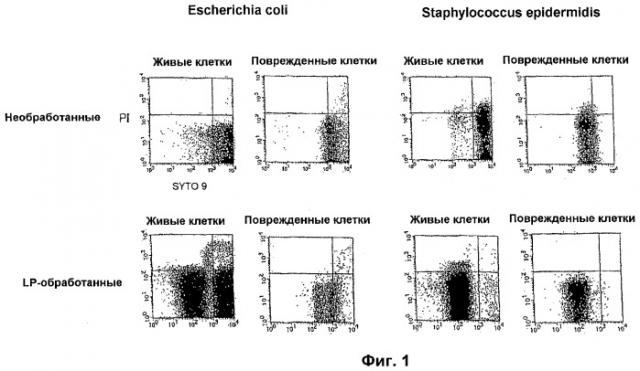
Фиг. 1. Графики, показывающие результаты FCM измерений после SYTO9/PI окрашивания LP-обработанной группы суспензий Escherichia coli (живые бактерии и поврежденные бактерии) и LP-обработанной группы суспензий Staphylococcus epidermidis (живые бактерии и поврежденные бактерии), а также необработанной группы суспензий Escherichia coli (живые бактерии и поврежденные бактерии) и необработанной группы суспензий Staphylococcus epidermidis (живые бактерии и поврежденные бактерии).
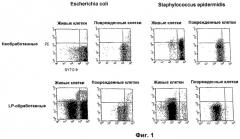
Фиг. 2. Графики, показывающие результаты FCM измерений после SYTO9/PI окрашивания LP-обработанного UHT гомогенизированного молока, инокулированного Escherichia coli (живые бактерии), и LP-обработанного UHT гомогенизированного молока, не инокулированного бактериями.
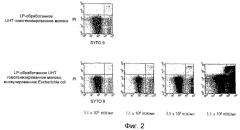
Фиг. 3. Графики, показывающие результаты FCM измерений после SYTO9/PI окрашивания LP-обработанного LTLT негомогенизированного молока, инокулированного Escherichia coli (живые бактерии и поврежденные бактерии), LP-обработанного LTLT негомогенизированного молока, инокулированного Staphylococcus epidermidis (живые бактерии и поврежденные бактерии), а также LP-обработанного LTLT негомогенизированного молока, не инокулированного бактериями.
Фиг. 4. Графики, показывающие результаты FCM измерений после SYTO9/PI окрашивания для LP-обработанных и ЕМА-обработанных суспензий Escherichia coli (живые бактерии и поврежденные бактерии) и суспензий Staphylococcus epidermidis (живые бактерии и поврежденные бактерии).
Фиг. 5. Графики, показывающие результаты FCM измерений после SYTO9/PI окрашивания для LP-обработанного и ЕМА-обработанного UHT гомогенизированного молока, инокулированного Escherichia coli (живые бактерии), и UHT гомогенизированного молока, инокулированного Staphylococcus epidermidis (живые бактерии), и UHT гомогенизированного молока, не инокулированного бактериями.
Фиг. 6. Графики, показывающие результаты FCM измерений после SYTO9/PI окрашивания для LP-обработанного и ЕМА-обработанного негомогенизированного молока, инокулированного Escherichia coli (живые бактерии и поврежденные бактерии).
Фиг. 7. Графики, показывающие результаты FCM измерений после SYTO9/PI окрашивания для LP-обработанного и ЕМА-обработанного LTLT негомогенизированного молока, инокулированного Staphylococcus epidermidis (живые бактерии и поврежденные бактерии).
Фиг. 8. Графики, показывающие результаты FCM измерений после SYTO9/PI окрашивания для UHT гомогенизированного молока, инокулированного Escherichia coli (живые бактерии) и Staphylococcus epidermidis (живые бактерии) после LP-обработки и обработки а) амсакрином, b) эллиптицином, с) камптотецином или d) ципрофлоксацином.
Фиг. 9. Графики, показывающие зависимость между временем погружения в кипящую воду микропробирки, содержащей физиологический солевой раствор, и температурой жидкости в микропробирке.
Фиг. 10. Фотографии электрофореза хромосомных ДНК Escherichia coli, Klebsiella, Citrobacter и Salmonella (живые бактерии и поврежденные бактерии), экстрагированных и очищенных до (N) или после (E) ЕМА-обработки.
Фиг. 11. Фотографии электрофореза хромосомных ДНК Escherichia coli (поврежденные бактерии и мертвые бактерии), экстрагированных и очищенных до (N) или после (E) ЕМА-обработки.
Фиг. 12. Фотографии электрофореза хромосомных ДНК Staphylococcus epidermidis (живые бактерии, поврежденные бактерии и мертвые бактерии), экстрагированных и очищенных до (N) или после (E) ЕМА-обработки.
Фиг. 13. Графики, показывающие результаты FCM измерений для живых бактерий, поврежденных бактерий и мертвых бактерий Escherichia coli до и после ЕМА-обработки.
Фиг. 14. Графики, показывающие результаты FCM измерений для живых бактерий, поврежденных бактерий и мертвых бактерий Staphylococcus epidermidis до и после ЕМА-обработки.
Фиг. 15. Графики, показывающие результаты FCM измерений для живых бактерий Mycobacterium tuberculosis, а также поврежденных бактерий и мертвых бактерий Mycobacterium tuberculosis, обработанных гидразидом изоникотиновой кислоты и рифампицином до и после ЕМА-обработки.
Фиг. 16. Графики, показывающие результаты FCM измерений для живых бактерий, а также поврежденных бактерий и мертвых бактерий Listeria, обработанных ампициллином и гентамицином до и после ЕМА-обработки.
Фиг. 17. Графики, показывающие соответствие классификаций живых бактерий, поврежденных бактерий и мертвых бактерий Escherichia coli, Staphylococcus epidermidis, Mycobacterium tuberculosis и Listeria согласно АТФ способу и их различение согласно способу настоящего изобретения.
Фиг. 18. Графики, показывающие соответствие классификаций живых бактерий, поврежденных бактерий и мертвых бактерий Escherichia coli, Staphylococcus epidermidis, Mycobacterium tuberculosis и Listeria согласно эстеразному способу и их различение согласно способу настоящего изобретения.
Фиг. 19. Графики, показывающие результаты FCM измерений для Listeria в крови человека до и после ЕМА-обработки
Лучший вариант осуществления изобретения
Далее здесь будут детально объяснены предпочтительные варианты осуществления изобретения. Однако настоящее изобретение не ограничивается следующими предпочтительными вариантами осуществления и может быть свободно модифицировано в пределах области применения настоящего изобретения.
Способ получения измеряемого образца для проточной цитометрии (в дальнейшем также обозначаемой аббревиатурой «FCM») согласно настоящему изобретению представляет собой способ для получения измеряемого образца для детектирования живых клеток микроорганизма в тестируемом образце при помощи проточной цитометрии и представляет собой способ, включающий следующие стадии:
а) стадия обработки тестируемого образца ферментом, обладающим активностью с точки зрения разрушения клеток, отличающихся от клеток микроорганизма, коллоидных частиц белков или липидов, присутствующих в исследуемом образце, и
b) стадия обработки тестируемого образца ядом топоизомеразы и/или ядом ДНК-гиразы.
Способ детектирования живых клеток микроорганизма в тестируемом образце представляет собой способ детектирования живых клеток при использовании образца, полученного указанным выше способом для получения измеряемого образца для FCM, и дополнительно включает следующие стадии дополнительно к указанным выше стадиям а) и b):
с) стадия обработки тестируемого образца, обработанного на стадиях а) и b) агентом, окрашивающим ядра, и
d) стадия детектирования микроорганизмов в тестируемом образце, обработанном агентом, окрашивающим ядра, проточной цитометрией.
В указанной спецификации «тестируемый образец» обозначает объект, для которого детектируются присутствующие в нем живые клетки микроорганизма, и он не является ограничивающим до той степени, пока микроорганизм может быть детектирован FCM.
Примеры включают молоко, молочные продукты и пищевые продукты, полученные при использовании молока или молочного продукта в качестве исходного материала, образцы крови, образцы мочи, образцы спинно-мозговой жидкости, образцы синовинальной жидкости и образцы плевральной жидкости и т.п. В особенности предпочтительны молоко, молочные продукты, пищевые продукты, полученные при использовании молока или молочного продукта в качестве исходного материала. В настоящем изобретении тестируемый образец может представлять собой любой из указанных выше продуктов и биологических образцов самих по себе и может представлять собой образец, получаемый разбавлением или концентрированием любого из указанных выше продуктов и биологических образцов, или путем подвергания любого из указанных выше продуктов или биологических образцов предварительной обработке, отличающейся от обработки согласно способу настоящего изобретения. Примеры предварительной обработки включают термическую обработку, фильтрацию, обработку антибиотиком и т.д.
«Микроорганизм» представляет собой объект, детектируемый при использовании способа настоящего изобретения, и он не является ограничивающим до той степени, пока микроорганизм может быть детектирован FCM, и яд топоизомеразы, яд ДНК-гиразы или этидий моноазид по-разному действуют на живые клетки, поврежденные клетки и мертвые клетки микроорганизма. Предпочтительные примеры включают бактерии, гифомицеты, дрожжи и т.д. Бактерии включают как грамположительные бактерии, так и грамотрицательные бактерии. Примеры грамположительных бактерий включают бактерии Staphylococcus, такие как Staphylococcus epidermidis, бактерии Streptococcus, бактерии Listeria, бактерии Bacillus, бактерии Mycobacterium и т.д. Примеры грамотрицательных бактерий включают бактерии Escherichia, такие как Escherichia coli, кишечные бактерии, типичным представителем которых являются бактерии Enterobacter, бактерии Salmonella, бактерии Vibrio, бактерии Pseudomonas и т.п.
В настоящем изобретении «живые бактерии (живая клетка)» относится к клетке, которая может пролиферировать при ее культивировании при, в общем, предпочтительных условиях культивирования, и могут пролиферировать в состоянии, таком, что клетка проявляет метаболическую клеточную активность (состояние живые и культивируемые) в предпочтительных условиях, и клетки в значительной степени не имеют повреждений клеточной стенки. В качестве примеров указанной выше метаболической клеточной активности могут быть указаны АТФ активность, эстеразная активность и т.д.
«Поврежденные бактерии» (поврежденная клетка или живая, но не культивируемая клетка) представляют собой клетку в состоянии, в котором она практически не может пролиферировать даже при культивировании в оптимальных условиях культивирования, поскольку клетка повреждена в связи с искусственным стрессом или природным стрессом и проявляет метаболическую активность на низком уровне по сравнению с живой клеткой, но на значительном уровне по сравнению с мертвой клеткой (поврежденное или живое, но не культивируемое [VNC] состояние). Хотя VNC клетки и поврежденные клетки можно различать в узком смысле на основе типа воздействия, являющегося причиной повреждения, VNC клетки и поврежденные клетки в узком смысле могут быть объединены под названием поврежденные клетки по настоящему изобретению по сравнению с живыми клетками или мертвыми клетками.
Детектирование бактерий, проявляющих состояние поврежденной клетки при использовании термической обработки в мягких условиях или введении антибиотиков, привлекает внимание в особенности в области санитарной инспекции пищевых продуктов и клинических тестов, и настоящее изобретение обеспечивает способ детектирования микроорганизма, который позволяет различать все состояния клеток, включая не только детектирование живых клеток, но и различение живых клеток и мертвых клеток и различение живых клеток и поврежденных клеток.
«Мертвая клетка» представляет собой клетку в состоянии, в котором она не может пролиферировать, не проявляет метаболическую активность (мертвое состояние), даже если ее культивируют при оптимальных условиях культивирования. Более того, она находится в состоянии, в котором хотя структура клеточной стенки поддерживается, но сама клеточная стенка в значительной степени повреждена, и агент, окрашивающий ядра, обладающий слабой проницаемостью, такой как пропидий йодид, может проходить через клеточную стенку.
Единицей числа клеток живых клеток, поврежденных клеток и мертвых клеток обычно является число клеток (клетки)/мл. Число живых клеток может быть аппроксимировано числом колоний (КОЕ/мл (образующие колонии единицы/мл)), образованных при культивировании клеток при оптимальных условиях на подходящей среде на чашках Петри. Стандартный образец мертвых клеток может быть получен путем подвергания суспензии живых клеток термообработке, например термообработке в кипящей воде. В указанном случае число мертвых клеток в таком образце может быть примерно описано как КОЕ/мл суспензии живых клеток перед термообработкой. Хотя время термообработки в кипящей воде для получения мертвых клеток изменяется в зависимости от типа микроорганизма, мертвые клетки бактерий, описанные в примерах, могут быть получены, например, термообработкой в течение примерно 12 минут. Поврежденные клетки могут быть получены при помощи термообработки в кипящей воде в течение более короткого времени по сравнению с временем, используемым для получения мертвых клеток. Например, поврежденные клетки бактерий, описанные в примерах, могут быть получены термообработкой в течение примерно 50 секунд. В указанном случае число поврежденных клеток может быть примерно описано как КОЕ/мл суспензии живых клеток перед термообработкой. Дополнительно, стандартный образец поврежденных клеток может быть также получен при помощи обработки антибиотиком. В таком случае число поврежденных клеток может быть примерно оценено по числу колоний (КОЕ/мл), образованных при культивировании клеток при оптимальных условиях на подходящей среде для чашек Петри, путем удаления антибиотика после обработки суспензии живых клеток антибиотиком, измерением коэффициента пропускания видимого света (длина волны: 600 нм), что представляет собой оптическую мутность, и сравнение оптической мутности с оптической мутностью суспензии живых клеток, для которой известна плотность живых клеток.
«Коллоидные частицы белков» представляют коллоидные частицы, содержащиеся в тестируемом образце, включающие белки в качестве составных частей, и неспецифически окрашиваемые агентом, окрашивающим ядра, и пример которых включает мицеллярный казеин.
Здесь и далее способ настоящего изобретения будет объяснен для каждой стадии.
(1) Стадия а)
В этой стадии тестируемый образец обрабатывают ферментом, имеющим активность с точки зрения разрушения клеток, отличающихся от клеток микроорганизма, коллоидных частиц белков или липидов, присутствующих в исследуемом образце.
В общем указано, что для того, чтобы детектировать бактерии FCM, бактерии необходимо подвергать пропусканию через детектор в количестве по крайней мере примерно 100 КОЕ. Однако если живые клетки в тестируемом образце, таком как молоко, детектируют при помощи FCM, большое число контаминантов, таких как соматические клетки, глобулы жира и мицеллярный казеин, не только бактерии, попадают в целевую область (бактериальный целевая область) FSC (прямой рассеянный свет) - SSC (боковой рассеянный свет), и поэтому бактерии могут не детектироваться, даже если через детектор проходит примерно 100 КОЕ бактерий. Исходя из сказанного, предпочтительно удалять или уменьшать число клеток, отличающихся от клеток микроорганизмов, коллоидальные частицы белков, липиды и т.д., существующие в тестируемом образце, путем обработки ферментом.
В том случае, если тестируемый образец представляет собой молоко, молочный продукт или пищевой продукт, полученный при использовании молока или моло