Физически устойчивая рентгеноаморфная форма ранитидина гидрохлорида с повышенной противоязвенной активностью и способ ее получения
Иллюстрации
Показать всеИзобретение относится к медицине и касается новой, ранее неизвестной формы ранитидина гидрохлорида, обладающего свойствами H2-блокатора. Изобретение заключается в том, что форма ранитидина является рентгеноаморфной. Рентгеноаморфная форма физически устойчива, описан также способ получения рентгеноаморфной формы из ранее известных кристаллических модификаций. Изобретение обеспечивает получение с новой рентгеноаморфной формы ранитидина гидрохлорида, обладающей повышенной специфической противоязвенной активностью. 2 с. и 10 з.п. ф-лы, 1 табл., 2 ил.
Реферат
Изобретение относится к медицине, конкретно к фармацевтической химии. Описана новая стабильная рентгеноаморфная форма ранитидина гидрохлорида, обладающего свойствами Н2-блокатора. Новая форма физически устойчива и обладает более выраженным противоязвенным эффектом по сравнению с ранее известными кристаллическими формами.
Ранитидин: N-[2-[[[5-(диметиламино)метил]-2-фуранил]метил]тио]этил-N'-метил-2-нитро-1,1-этендиамин) и его физиологически приемлемые соли впервые описаны в патенте США №4128658. Ранитидин обнаружил способность блокировать Н2-гистаминную активность, что обусловило перспективу для его применения в лечении заболеваний, сопровождающихся расстройствами функционального состояния желудочно-кишечного тракта: язва желудка, пептическая язва, послеоперационные осложнения, а также аллергические и воспалительные состояния, в которых известно участие гистамина как медиатора.
Соль, образованная ранитидином основанием и соляной кислотой (далее упоминающаяся как ранитидина гидрохлорид), является наиболее важной, так как применяется в большинстве производимых лекарственных формах, например таблетках для орального введения. Это служит причиной поиска путей производства ранитидина гидрохлорида в таком физическом состоянии, которое обеспечило бы преимущества не только при технологическом процессе получения, но и при хранении конечного продукта, а также при применении готовой лекарственной формы больными.
Так, была описана и запатентована форма 2 ранитидина гидрохлорида - патенты США №4521431 и №4672133. Указывается, что в соответствии со способом, предложенным для получения первоначальной формы 1 ранитидина гидрохлорида (патент США №4128658), в промышленном процессе производства продукта наблюдаются недостатки - продукт имеет непригодные для фильтрации и высушивания характеристики. В вышеуказанных источниках отмечается невозможность производства кристаллической формы 1 ранитидина гидрохлорида в коммерческом масштабе и, более того, форма 1 является нестабильной и самопроизвольно переходит в стабильную форму 2, причем очень быстро. В отличие от формы 1, форма 2 имеет более крупные кристаллы, менее гигроскопична и проявляет другие технологические преимущества. Тем не менее, были предприняты многократные попытки создать форму 1, которая была бы лишена указанных недостатков. Например, заявка РСТ WO 96/33185, патенты США №5523423, №5338871 и №5621120.
Первоначальный патент США №4128658 описывает различные производные аминоалкилфурана, в том числе ранитидин. Пример 32 описания к патенту США №4128658 излагает способ получения формы 1 ранитидина гидрохлорида путем растворения ранитидина в промышленном спирте (растворитель, основную часть которого составляет этанол), содержащем хлористый водород. Кристаллизация проводится добавлением этилацетата. Эта процедура является неудовлетворительной по своим характеристикам - из вышеуказанных растворителей (этилацетат и этанол) форма 1 ранитидина гидрохлорида выходит нестабильной. Это делает процесс неприменимым для использования в коммерческом масштабе.
В патентах США №4521431 и №4672133 описывается кристаллическая форма ранитидина гидрохлорида, обозначенная как форма 2 и имеющая более выгодные характеристики для фильтрации и высушивания, чем форма 1 ранитидина гидрохлорида, полученная с применением хлористого водорода, промышленного спирта и этилацетата. Форма 2 ранитидина гидрохлорида может быть получена обработкой раствора ранитидина, например, низшим спиртом и хлористым водородом с последующей кристаллизацией при повышенной температуре и при добавлении дополнительного количества растворителя. Кроме этого, форма 2 ранитидина гидрохлорида может быть получена с предварительным изолированием формы 1 и растворением соли, например, нагреванием органического растворителя, такого как метанол, этанол с последующим охлаждением и кристаллизацией соли формы 2, возможно добавление антирастворителя или добавление зародышевых кристаллов формы 2 для индуцирования кристаллизации.
Различия между формой 2, описанной в патентах США №4521431 и №4672133, и формой 1 - продуктом, полученным в примере 32 описания к патенту США №4128658, характеризуются ИК-спектром и характеристиками порошковых рентгенограмм.
Патент США №5338871 описывает приготовление чистой формы 1 ранитидина гидрохлорида путем растворения ранитидина гидрохлорида в смеси растворителей, содержащей не менее одного низшего алифатического спирта, ароматический углеводород и инициатор кристаллизации в виде зародышевых кристаллов чистой формы 1 ранитидина гидрохлорида.
В патенте США №5621120 описаны три модификации, различающиеся по характеристикам порошковых рентгенограмм, - форма 1, форма 2 и стандартный образец, соответствующий фармакопее США.
Как следует из вышеуказанных патентов, температура плавления нестабильной формы 1 ранитидина гидрохлорида составляет 133-134°С (патент США №4128658), стабильной формы 1 ранитидина гидрохлорида - 136-137°С (патент США №5621120), а формы 2 ранитидина гидрохлорида - 139-141°С (патент США №4521431).
О терапевтической неэквивалентности указанных полиморфных модификаций не сообщается. Наоборот, в описании к патенту США №5621120, сообщается о том, что форма 1 и форма 2 проявляют практически неотличимую биодоступность.
Известно, что растворимость лекарственного вещества представляет собой один из факторов, обуславливающих его терапевтическую эффективность. Известно, что терапевтическая эффективность зависит от биодоступности медикамента, которая является функцией хорошей и/или полной абсорбции. Абсорбция зависит от растворимости ранитидина гидрохлорида. Хорошее растворение ранитидина гидрохлорида тем более желательно в связи с тем, что существует относительно небольшая область желудочно-кишечного тракта, где осуществляется его абсорбция. Слабое или неполное растворение в момент контакта с зоной всасывания вызывает слабую абсорбцию и, таким образом, терапевтическое действие может значительно уменьшаться.
В течение долгого времени пытались приготовить лекарственную форму, содержащую ранитидин в аморфной форме, поскольку известно, что у аморфных форм растворимость, как правило, выше, чем таковая у кристаллических форм (см. обзор J. Haleblain, J. Phann. Sci, 64, 1269, 1975). Однако создание и применение аморфных форм представляют сложную проблему, главным образом потому, что они физически неустойчивы, термодинамически нестабильны и в течение короткого промежутка времени могут переходить в кристаллические формы. Подавляющее большинство веществ трудно получить в аморфном состоянии (Китайгородский А.И. Рентгеноструктурный анализ мелкокристаллических и аморфных тел. М., 1952). В заявке РСТ WO 96/39126 указывается, что обнаружение физически устойчивой аморфной формы ранитидина, не переходящей быстро в кристаллическую форму, было бы значительным шагом вперед. В этой заявке для решения проблемы был получен адсорбционный комплекс ранитидина гидрохлорида на носителе. Задача получения чистой аморфной формы не была решена. Аналогичное решение было предпринято в заявке РСТ WO 94/20091. В этой заявке описан инклюзионный комплекс ранитидина гидрохлорида и циклодекстрина. В указанных заявках приведены рентгенографические характеристики комплексов и спектры ДСК.
Естественно, что рентгенографические, термические и другие характеристики ранитидина гидрохлорида, адсорбированного в виде монослоя на носителе или заключенного внутрь молекулы циклодекстрина существенно отличаются от таковых характеристик, присущих его аморфной или кристаллическим формам. Кроме того, молекулярные и конформационные изменения, вызванные влиянием адсорбционных или других стабилизирующих комплексы сил, не гарантируют того факта, что ранитидина гидрохлорид присутствует в комплексе в конформации, характерной для индивидуальной аморфной формы.
Кроме того, введение дополнительного компонента в лекарственный препарат является нежелательным фактом. Например, при получении адсорбционного комплекса ранитидин-носитель (по вышеуказанной заявке РСТ WO 96/39126) имеют место значительные недостатки: существенные потери активного компонента, высокие требования к удельной поверхности носителя, трудности при последующей стандартизации комплексной субстанции и некоторые другие. Следует также отметить, что применение большого количества носителя может неблагоприятно сказаться на состоянии желудочно-кишечного тракта больного, использующего конечный продукт - противоязвенное средство.
Таким образом, можно сделать заключение, что в настоящее время проблема получения стабильного ранитидина гидрохлорида, имеющего терапевтические преимущества по сравнению с известными полиморфными модификациями, не решена.
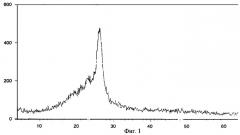
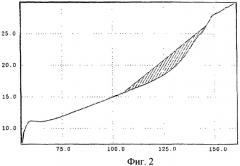
Задачей изобретения является создание физически устойчивой формы ранитидина гидрохлорида, обладающей повышенной терапевтической активностью. В результате экспериментов было неожиданно обнаружено, что повышенной специфической активностью наряду со стабильностью в течение длительного промежутка времени, достаточного для коммерческого использования, обладает рентгеноаморфная форма ранитидина гидрохлорида. Рентгеноаморфная форма ранитидина гидрохлорида представляет собой очень легкий, "воздушный" белый со слабым желтоватым оттенком аморфный порошок, характеризующийся на порошковой рентгенограмме диффузным рассеянием (аморфным гало) в области 15-30 2θ° и на кривой ДСК (дифференциальной сканирующей калориметрии) одним широким эндотермическим эффектом в интервале от 107,1±2,5 до 146,2±2,0°С. Порошок быстрее и больше, чем кристаллические формы, растворяется в воде.
Изобретением также является способ получения новой ренгеноаморфной формы. Способ заключается в том, что кристаллический ранитидина гидрохлорид растворяют в органическом растворителе или в воде, или в их смеси при температуре 50-80°С, раствор охлаждают до замораживания, замороженную массу измельчают и высушивают до получения ренгеноаморфного порошка ранитидина гидрохлорида, имеющего остаточную влажность не более 2,5%. Высушивание замороженной массы проводят при пониженном давлении. В качестве органического растворителя предпочтительно использовать низшие алифатические спирты, в частности этиловый спирт.
Новая ренгеноаморфная форма ранитидина гидрохлорида по сравнению с ранее известными полиморфными формами и различными комплексами указанного соединения обладает повышенной специфической противоязвенной активностью.
Полученная ренгеноаморфная форма ранитидина гидрохлорида может найти широкое применение в медицине, особенно для лечения язвенной болезни желудка.
Краткое описание чертежей
Фиг.1 - порошковая рентгенограмма заявленной рентгеноаморфной формы ранитидина гидрохлорида.
Фиг.2 - кривая ДСК заявленной рентгеноаморфной формы ранитидина гидрохлорида.
Лучший вариант осуществления изобретения
30 г ранитидина гидрохлорида (USP XXIII Specification) растворяют в 470 г дистиллированной воды при температуре 75°С и охлаждают до замораживания раствора. Замороженную массу механически измельчают при температуре замороженного продукта до получения частиц размером не более 5 мм, а затем высушивают при давлении 10-1 мм рт.ст. Процесс сушки проводят при температуре +32°C до получения аморфного порошка ранитидина гидрохлорида, остаточная влажность которого составляет 2,4%. Выход целевого продукта 28,1 г.
Рентгеноаморфная форма ранитидина гидрохлорида представляет собой пушистый, "воздушный", легкий аморфный порошок белого со слабым желтоватым оттенком цвета. Продукт характеризуется аморфным гало в области 15-30 2θ° на порошковой рентгенограмме (фиг.1) и одним эндотермическим эффектом на кривой дифференциальной сканирующей калориметрии в интервале от 104,9 до 146,3°С (фиг.2).
Ретгенофазовый анализ проводили на автоматизированном порошковом дифрактометре. Условия съемки: излучение CuKα, графитовый монохроматор на вторичном пуске, интервалы углов от 4 до 64 2θ°, шаг 0,1°, скорость сканирования 2°/мин. Исследуемый образец помещали в кварцевую кювету, съемку проводили под тонкой полимерной (майларовой) пленкой. На дифрактограмме заявленного вещества проявляется характерное для аморфных веществ диффузное рассеяние (аморфное гало) (Whittaker E.J.W. Crystallography. Pergamon Press. Oxford. 1981) в области 15-30 2θ° и накладывающийся на него широкий рефлекс полимера пленки с центром около 26 2θ°. Дифференциальный сканирующий калориметрический анализ (ДСК) полученного продукта проводили в атмосфере азота с начальной температурой нагрева от 50 до 250°С со скоростью нагревания 8°С/мин. Максимальная величина теплового потока - 60 мВт. Масса образца 3,5 мг. На кривой ДСК заявленной рентгеноаморфной формы ранитидина гидрохлорида проявляется характерный для аморфной фазы один широкий эндотермический эффект с начальной температурой эндотермического эффекта 104,9°С и конечной температурой эндотермического эффекта 146,3°С. Энтальпия (ΔН) эффекта равна 81,49 Дж/г.
Определение растворимости и скорости растворения ранитидина гидрохлорида, соответствующего требованиям USP ХХIII и заявленного образца - рентгеноаморфного ранитидина гидрохлорида.
Определение растворимости проводили в соответствии с требованиями статьи "Solubility", USP XXIII изд. (1995 г, р.2071).
Растворитель - дистиллированная вода, температура растворителя 20°С.
Обнаружено, что в 1 г растворителя растворяется 1,25 г ранитидина гидрохлорида фармакопейного (среднее из 10 определений), т.е. 0,80 г растворителя на 1 г растворяемого вещества; в 1 г растворителя растворяется 1,79 г заявленного рентгеноаморфного ранитидина гидрохлорида (среднее из 10 определений), т.е. 0,55 г растворителя на 1 г растворяемого вещества.
Таким образом, оба образца согласно USP XXIII относятся к легкорастворимым веществам. Однако растворимость заявленного образца по сравнению с ранитидина гидрохлоридом фармакопейным увеличена на 43%.
Скорость растворения сравниваемых образцов определяли, растворяя по 5,0 г каждого образца в 10 мл дистиллированной воды при 20°С, и определяли время растворения образца.
Образец ранитидина гидрохлорида фармакопейного растворяется в течение 47 с (среднее из 10 определений), образец заявленного рентгеноаморфного ранитидина гидрохлорида растворяется в течение 8 с (среднее из 10 определений).
Таким образом, скорость растворения заявленного образца в 5,8 раза выше, чем у образца фармакопейного.
Определение стабильности при хранении
Полученный аморфный порошок ранитидина гидрохлорида хранился в обычных условиях в течение 14 мес и после хранения был подвергнут повторному исследованию. Порошок по-прежнему представляет собой пушистый, "воздушный", легкий аморфный порошок белого со слабым желтоватым оттенком цвета. Продукт характеризуется аморфным гало в области 15-30 2θ° на порошковой рентгенограмме (график аналогичен приведенному на фиг.1) и одним эндотермическим эффектом на кривой дифференциальной сканирующей колориметрии в интервале от 104,9 до 146,3°С (график аналогичен приведенному на фиг.2). Растворимость и скорость растворения в процессе хранения также не изменились (см. выше).
Промышленная применимость
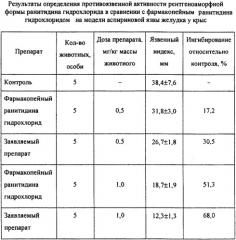
Была изучена противоязвенная активность заявленной рентгеноаморфной формы ранитидина гидрохлорида в сравнении с его известной модификацией (широко применяемого в лечении язвенной болезни ранитидина гидрохлорида по USP XXIII).
Определение противоязвенной активности изучаемых образцов проводили на модели аспириновой язвы желудка у крыс-самцов линии Вистар массой тела 258-337 г (Brittain R.T., Daly M.J., Scand. J. GastroenteroL-1981. Vol.16, Suppl. №69 - p. 1-8). Животные содержались в индивидуальных стандартных клетках площадью 806 см2 с решетчатыми полами из нержавеющей проволоки. За 18 ч до эксперимента животные лишались пищи при свободном доступе к питьевой воде.
За 15 мин до индукции язвы животным внутрижелудочно вводили раствор заявленного препарата в физиологическом растворе в концентрации 0,1 или 0,2 мг/мл из расчета 5 мл/кг массы тела животного. Животным контрольной группы вводили физиологический раствор. Язвенные повреждения слизистой оболочки желудка вызывали путем внутрижелудочного введения 6% суспензии ацетилсалициловой кислоты в 1% крахмале из расчета 5 мл/кг. Забой животных осуществляли через 5 ч после введения суспензии ацетилсалициловой кислоты путем передозировки медицинского эфира. В изолированные желудки с наложенными на пищевод и привратник лигатурами через 10-миллиметровый шприц вводили 8 мл 2%-ного раствора формалина, после чего препараты помещали на 10 мин в 2%-ный раствор формалина для фиксации стенки желудка, желудки препарировали по большой кривизне. Суммарную длину язвенных повреждений слизистой оболочки желудка у каждой из крыс измеряли при 8-кратном увеличении с использованием биологического микроскопа, оснащенного встроенной в окуляр измерительной линейкой с ценой деления 0,1 мм. Язвенный индекс рассчитывали как сумму длины язвенных повреждений слизистой оболочки желудка крысы.
Результаты изучения влияния предварительного внутрижелудочного введения заявленной рентгеноаморфной формы ранитидина гидрохлорида в сравнении с известным ранитидином гидрохлоридом, широко применяемым как противоязвенное средство, приведены в таблице.
Как видно из данных таблицы, достоверное уменьшение язвенного индекса у заявленного препарата по сравнению с известным - фармакопейным ранитидина гидрохлоридом в дозе 0,5 мг/кг составляет 1,2 раза, а в дозе 1 мг/кг - 1,5 раза.
Изобретение иллюстрируется следующими примерами.
Пример 1
30 г ранитидина гидрохлорида (USP XXIII Specification) растворяют в 470 г дистиллированной воды при температуре 70°С и охлаждают до замораживания раствора. Замороженную массу механически измельчают при температуре замороженного продукта до получения частиц размером менее 5 мм, а затем высушивают при давлении 10 мм рт.ст. Процесс сушки ведут при температуре +30°С до получения аморфного порошка ранитидина гидрохлорида. Остаточная влажность продукта составляет 1,6%. Выход целевого продукта 27,8 г.
Полученный продукт представляет собой очень легкий белый со слабым желтоватым оттенком аморфный порошок ранитидина гидрохлорида с температурой начала эндотермического эффекта на кривой ДСК 107,1°С и окончания эндотермического эффекта на кривой ДСК 144,8°С. Продукт характеризуется на порошковой рентгенограмме аморфным гало в области 15-30 2θ°.
Пример 2
5 г ранитидина гидрохлорида (USP XXIII Specification) растворяют в 495 г спиртоводной смеси (этанол-вода в соотношении 1:1) при температуре 50°С и охлаждают до замораживания раствора. Замороженную массу измельчают при температуре замороженного продукта до получения частиц размером менее 5 мм, а затем высушивают при давлении 10-1 мм рт.ст. Процесс сушки ведут при температуре +35°С до получения аморфного порошка ранитидина гидрохлорида, остаточная влажность продукта составляет 2,25%. Выход целевого продукта 4,6 г.
Полученный продукт представляет собой очень легкий белый со слабым желтоватым оттенком аморфный порошок ранитидина гидрохлорида с температурой начала эндотермического эффекта на кривой ДСК 105,9°С и окончания эндотермического эффекта на кривой ДСК 147,4°С. Продукт характеризуется на порошковой рентгенограмме аморфным гало в области 15-30 2θ°.
Пример 3
30 г ранитидина гидрохлорида (соответствующего форме 1 по параметрам рентгеновской дифрактограммы) растворяют в 470 г дистиллированной воды при температуре 80°С и охлаждают до замораживания раствора. Замороженную массу механически измельчают при температуре замороженного продукта до получения частиц размером менее 5 мм, а затем высушивают при давлении 10-1 мм рт. ст. Процесс сушки ведут до получения аморфного порошка ранитидина гидрохлорида, остаточная влажность продукта составляет 1,5%. Выход целевого продукта 27,6 г.
Полученный продукт представляет собой очень легкий белый со слабым желтоватым оттенком аморфный порошок ранитидина гидрохлорида с температурой начала эндотермического эффекта на кривой ДСК 106,1°С и окончания эндотермического эффекта на кривой ДСК 146,5°С. Продукт характеризуется на порошковой рентгенограмме аморфным гало в области 15-30 2θ°.
Пример 4
5 г ранитидина гидрохлорида (соответствующего форме 1 по параметрам рентгеновской дифрактограммы) растворяют в 495 г спиртоводной смеси (этанол-вода в соотношении 1:1) при температуре 50°С и охлаждают до замораживания раствора. Замороженную массу механически измельчают при температуре замороженного продукта до получения частиц размером менее 5 мм, а затем высушивают при давлении 10-1 мм рт.ст. Процесс сушки ведут до получения аморфного порошка ранитидина гидрохлорида, остаточная влажность продукта составляет 1,3%. Выход целевого продукта 4,8 г.
Полученный продукт представляет собой очень легкий белый со слабым желтоватым оттенком аморфный порошок ранитидина гидрохлорида с температурой начала эндотермического эффекта на кривой ДСК 104,6°С и окончания эндотермического эффекта на кривой ДСК 148,2°С. Продукт характеризуется на порошковой рентгенограмме аморфным гало в области 15-30 2θ°.
Пример 5
30 г ранитидина гидрохлорида (соответствующего форме 2 по параметрам рентгеновской дифрактограммы) растворяют в 470 г дистиллированной воды при температуре 70°С и охлаждают до замораживания раствора. Замороженную массу механически измельчают при температуре замороженного продукта до получения частиц размером менее 5 мм, а затем высушивают при давлении 10-1 мм рт. ст. Процесс сушки ведут до получения аморфного порошка ранитидина гидрохлорида, остаточная влажность продукта составляет 2,4%. Выход целевого продукта 27,9 г.
Полученный продукт представляет собой очень легкий белый со слабым желтоватым оттенком аморфный порошок ранитидина гидрохлорида с температурой начала эндотермического эффекта на кривой ДСК 104,8°С и окончания эндотермического эффекта на кривой ДСК 145,0°С. Продукт характеризуется на порошковой рентгенограмме аморфным гало в области 15-30 2θ°.
Пример 6
5 г ранитидина гидрохлорида (соответствующего форме 2 по параметром кристаллической решетки) растворяют в 495 г спиртоводной смеси (этанол-вода в соотношении 1:1) при температуре 50°C и охлаждают до замораживания раствора. Замороженную массу измельчают при температуре замороженного продукта до получения частиц размером менее 5 мм, а затем высушивают при давлении 10-1 мм рт.ст. Процесс сушки ведут до получения аморфного порошка ранитидина гидрохлорида, остаточная влажность продукта составляет 2,3%. Выход целевого продукта 4,7 г.
Полученный продукт представляет собой очень легкий белый со слабым желтоватым оттенком аморфный порошок ранитидина гидрохлорида с температурой начала эндотермического эффекта на кривой ДСК 104,9°С и окончания эндотермического эффекта на кривой ДСК 147,1°С. Продукт характеризуется на порошковой рентгенограмме аморфным гало в области 15-30 2θ°.
Пример 7
60 г ранитидина гидрохлорида (USP XXIII Specification) растворяют в 940 г дистиллированной воды при температуре 80°С и охлаждают до замораживания раствора. Замороженную массу механически измельчают при температуре замороженного продукта до получения частиц размером менее 5 мм, а затем высушивают при давлении 10-1 мм рт.ст. Процесс сушки ведут до получения аморфного порошка ранитидина гидрохлорида, остаточная влажность продукта составляет 2,5%. Выход целевого продукта 56,82 г.
Полученный продукт представляет собой очень легкий белый со слабым желтоватым оттенком аморфный порошок ранитидина гидрохлорида с температурой начала эндотермического эффекта на кривой ДСК 106,5°С и окончания эндотермического эффекта на кривой ДСК 144,2°С. Продукт характеризуется на порошковой рентгенограмме аморфным гало в области 15-30 2θ°
Пример 8
2 г ранитидина гидрохлорида (USP XXIII Specification) растворяют в 398 г этилового спирта при температуре 50°С и охлаждают до замораживания раствора. Замороженную массу механически измельчают при температуре замороженного продукта до получения частиц размером менее 5 мм, а затем высушивают при давлении 10-1 мм рт.ст. Процесс сушки ведут до получения аморфного порошка ранитидина гидрохлорида, остаточная влажность продукта составляет 1,1%. Выход целевого продукта 1,8 г.
Полученный продукт представляет собой очень легкий белый со слабым желтоватым оттенком аморфный порошок ранитидина гидрохлорида с температурой начала эндотермического эффекта на кривой ДСК 109,6°С и окончания эндотермического эффекта на кривой ДСК 147,3°С. Продукт характеризуется на порошковой рентгенограмме аморфным гало в области 15-30 2θ°.
Пример 9
5 г ранитидина гидрохлорида (USP XXIII Specification) растворяют в 495 г спиртоводной смеси (этанол-вода в соотношении 1:1) 50°С и охлаждают до замораживания раствора. Замороженную массу механически измельчают при температуре замороженного продукта до получения частиц размером менее 5 мм, а затем высушивают при давлении 10-1 мм рт.ст. Процесс сушки ведут до получения аморфного порошка ранитидина гидрохлорида, остаточная влажность продукта составляет 1,4%. Выход целевого продукта 4,6 г.
Полученный продукт представляет собой очень легкий белый со слабым желтоватым оттенком аморфный порошок ранитидина гидрохлорида с температурой начала эндотермического эффекта на кривой ДСК 105,6°С и окончания эндотермического эффекта на кривой ДСК 146,3°С. Продукт характеризуется на порошковой рентгенограмме аморфным гало в области 15-30 2θ°.
1. Физически устойчивая рентгеноаморфная форма ранитидинагидрохлорида с повышенной противоязвенной активностью, характеризующаяся порошковой рентгенограммой с невыраженными рефлексами, идентифицирующими кристаллические формы, с аморфным гало в области 15-30 2θ° и одним эндометрическим эффектом на кривой дифференциальной сканирующей калориметрии в интервале 104,6-148,2°С.
2. Физически устойчивая рентгеноаморфная форма ранитидина гидрохлорида с повышенной противоязвенной активностью по п.1, характеризующаяся температурой начала эндотермического эффекта на кривой дифференциальной сканирующей калориметрии 107,0±2,5°С и температурой окончания эндотермического эффекта на кривой ДСК 146,2 ±2,0°С.
3. Физически устойчивая рентгеноаморфная форма ранитидина гидрохлорида с повышенной противоязвенной активностью по пп.1 и 2, характеризующаяся повышенной растворимостью в воде.
4. Физически устойчивая рентгеноаморфная форма ранитидина гидрохлорида с повышенной противоязвенной активностью по п.3, характеризующаяся растворимостью в воде при температуре 20°С не менее 1,79:1.
5. Способ получения физически устойчивой рентгеноаморфной формы ранитидина гидрохлорида с повышенной противоязвенной активностью, характеризующийся тем, что кристаллическую форму растворяют в воде, или в органическом растворителе, или в их смеси при температуре 50-80°С, раствор охлаждают до замораживания, замороженную массу измельчают на холоде до размера частиц не более 5 мм и высушивают до получения аморфного порошка ранитидина гидрохлорида.
6. Способ получения физически устойчивой рентгеноаморфной формы ранитидина гидрохлорида с повышенной противоязвенной активностью по п.5, характеризующийся тем, что высушивание измельченной замороженной массы проводят при пониженном давлении до остаточной влажности конечного продукта не более 2,5%.
7. Способ получения физически устойчивой рентгеноаморфной формы ранитидина гидрохлорида с повышенной противоязвенной активностью по п.6, характеризующийся тем, что высушивание измельченной замороженной массы проводят при температуре окружающей среды 30-35°С.
8. Способ получения физически устойчивой рентгеноаморфной формы ранитидина гидрохлорида с повышенной противоязвенной активностью по п.5, характеризующийся тем, что органический растворитель представляет собой этиловый спирт.
9. Способ получения физически устойчивой рентгеноаморфной формы ранитидина гидрохлорида с повышенной противоязвенной активностью по п.5, характеризующийся тем, что водно-органический растворитель представляет собой смесь вода-этанол в соотношении 1:1 (по массе).
10. Способ получения физически устойчивой рентгеноаморфной формы ранитидина гидрохлорида с повышенной противоязвенной активностью по п.5, характеризующийся тем, что концентрация исходного раствора ранитидина гидрохлорида в воде составляет 5,5-6,5 мас.%.
11. Способ получения физически устойчивой рентгеноаморфной формы ранитидина гидрохлорида с повышенной противоязвенной активностью по п.5, характеризующийся тем, что концентрация исходного раствора ранитидина гидрохлорида в водно-органической смеси составляет 0,8-1,2 мас.%.
12. Способ получения физически устойчивой рентгеноаморфной формы ранитидина гидрохлорида с повышенной противоязвенной активностью по п.5, характеризующийся тем, что концентрация исходного раствора ранитидина гидрохлорида в органическом растворителе составляет 0,4-1,0 мас.%.