Замещенные в бета-положении тетрагидропираны (тетрагидропираноны), способ их синтеза и их применение в парфюмерии
Иллюстрации
Показать всеИзобретение относится к применению тетрагидропирана (тетрагидропиранона), замещенного в бета-положении по отношению к атому кислорода в цикле, в качестве душистого вещества, при этом данное соединение соответствует следующей формуле:
где заместитель R означает линейный алкильный радикал СН3-(СН2)n-, в котором n=2-10 включительно, (СН3)2СН- или С6Н5-(СН2)m-, где m=0 или 1;
или
,
где А означает -CH2- или -СО-, способу их получения и композициям, таким, как парфюмерные, топические, в частности косметические композиции, и бытовые средства ухода. 4 н. и 8 з.п. ф-лы, 5 табл.
Реферат
Уровень техники, к которой относится изобретение
Настоящее изобретение относится в целом к области душистых веществ и их применению в парфюмерии, в частности, для приготовления топических композиций и бытовых средств ухода. В частности, настоящее изобретение касается применения в качестве душистых веществ тетрагидропиранов (татрагидропиранонов), замещенных в бета-положении по отношению к атому кислорода в цикле, благодаря их способности обладать оттенками запаха цитрусовых, вербены, фруктов или нитрилов, а также касается способа их синтеза.
Уровень техники
Термин «парфюмерия» употреблен здесь не только в его обычном значении, но и для обозначения других областей, в которых важную роль играет аромат изделий. Речь может идти о парфюмерных композициях в обычном смысле этого слова, например, ароматизирующие основания и концентраты, одеколоны, душистые воды, духи и схожие продукты, о топических композициях, в частности косметических, таких, как кремы для лица и тела, пудры из талька, масла для волос, шампуни, лосьоны для укрепления волос, соли и масла для ванны, гели для душа и ванны, туалетного мыла, средства против потения и дезодоранты для тела, лосьоны и кремы для бритья, мыла, кремы, зубные пасты, средства для полоскания рта, мази и схожие продукты, бытовые средства ухода, такие, как смягчители, ПАВ, моющие средства, освежители воздуха и схожие продукты.
Выражение «душистое вещество» используется здесь для обозначения соединения, издающего аромат.
Некоторые лактоны (т.е. тетрагидропираноны) и некоторые пираны уже используются в парфюмерии. Большая часть применяемых в парфюмерии лактонов представляет собой производные жирных кислот и, следовательно, являются замещенными в положении 6, ими являются γ-декалактон или γ-додекалактон, придающие фруктовый, бальзамический оттенок аромата душистым соединениям. Так же обстоит дело и в отношении пиранов в парфюмерии, которые также являются замещенными в альфа-положении по отношению к атому кислорода, содержащемуся в цикле. Следует упомянуть только два из них: розовый оксид и Doremox® фирмы Firmenich, которые придают типичные оттенки запаха композициям из розы.
Существует потребность и в других душистых веществах для расширения гаммы оттенков запаха, придаваемых композиции, и существующих способов их внесения.
При этом известные способы синтеза могут быть усовершенствованы. Часто тетрагидропираноны синтезировали путем ферментативного окисления соответствующего кетона, как описали Margaret M. Kayser и др., Journal of Organic Chemistry, 1998 г., 63 (20), стр.7103-7106, и Stephanie C. Lemoult и др., Journal of the Chemical Society, Perkin Transaction 1: Organic and Bio-Organic Chemistry, 1995 г., 2, стр.89-91. Химически их синтезировали из оксетанов (Masahiko Yamaguchi и др., Tetrahedron Letters, 1984 г., 25 (11), стр.1159-1162) или реакцией Mukalyama-Michael между силилсетен-ацеталами и алкилиденмалонатами (David A. Evens и др., J. Am. Chem. Soc., 1999 г., 121 (9), стр.1994-1995).
Для синтеза тетрагидропиранов было разработано четыре основных способа: реакция Принса (Prins), описанная Paul R. Straps в J. Org. Chem., 1969 г., 34 (3), стр.479-485, добавка радикалов ацетилированных производных в тетрагидропиран (Montaudon E. и др., Bull. Soc. Chim. Fr., 1974 г., 11, ч.2, стр.2635-2638) или циклизация диола, синтезированного на основе диасида, как описано E. Montaudon и др. (J. Heterocycl. Chem., 1979 г., 16 (11), стр.113-121) и Paul R. Strapp в приведенной выше публикации.
Указанные способы являются однако трудно осуществляемыми в промышленном масштабе. Следовательно, возникает необходимость в создании способа промышленного синтеза, обеспечивающего доступ к большому количеству разных соединений.
Раскрытие изобретения
Целью изобретения является душистое вещество, содержащее тетрагидропиран (тетрагидропиранон), замещенный в бета-положении по отношению к атому кислорода в цикле формулы (I):
где заместитель R представляет собой линейный алкильный радикал СН3-(СН2)n, в котором n=2-10 включительно, (СН3)2- или С6Н5-(СН2)m-, где m=0 или 1;
или
где А означает -СН2- или -СО-.
В частности, объектом изобретения является душистое вещество, содержащее соединение тетрагидро-2Н-пиран-2-он или тетрагидропиран, замещенный в бета-положении по отношению к атому кислорода в цикле формулы (Ia) или (Ib):
где R имеет то же значение, что и в формуле (I).
Формула (Ia) соответствует формуле (I), в которой А означает -СО-. Формула (Ib) соответствует формуле (I), в которой А означает -СН2-.
Следовательно, объектом изобретения является применение соединения формул (I), (Ia) или (Ib) в качестве душистого вещества.
В некоторых вариантах выполнения R в формулах (I), (Ia) или (Ib) означает линейный алкильный радикал СН3-(СН2)n, где n=4-10 включительно. В некоторых вариантах выполнения R в приведенных формулах означает линейный алкильный радикал СН3-(СН2)n-, где n=4-8 включительно, или же линейный алкильный радикал СН3-(СР2)n-, где n=6-10 включительно.
В частности, объектом изобретения является душистое вещество, выбранное из следующих душистых веществ, или, иначе говоря, применение в качестве душистого вещества одного из следующих соединений:
5-пентил-тетрагидропиран-2-он,
3-гептил-тетрагидропиран,
5-гептил-тетрагидропиран-2-он,
3-бензил-тетрагидропиран,
заместители, соответствующие R в формуле (I), являющиеся линейными.
Среди душистых веществ (соединений), приведенных в формуле (I), некоторые являются, по мнению авторов изобретения, новыми соединениями, которые заявляются в этом качестве, имеются в виду:
5-пентил-тетрагидропиран-2-он,
5-нонил-тетрагидропиран-2-он,
5-бензил-тетрагидропиран-2-он,
5-(2,2,3-триметил-циклопент-3-енил)-тетрагидропиран-2-он,
3-гептил-тетрагидропиран,
3-октил-тетрагидропиран,
3-нонил-тетрагидропиран,
3-децил-тетрагидропитран,
3-ундецил-тетрагидропиран,
3-(2,2,3-триметил-циклопент-3-енил)-тетрагидропиран,
заместители, соответствующие R в формуле (I), являющиеся линейными.
Следовательно, объектом изобретения являются соединения формулы (I):
где заместитель R представляет собой линейный алкильный радикал СН3-(СН2)n-, где n=6-10 включительно,
или
в том случае, когда А означает -СН2-, и
заместитель R означает линейный алкильный радикал СН3-(СН2)n-, где n=4, 6 или 8, или С6Н5-,
или
в том случае, когда А означает -СО-.
По сведениям авторов изобретения, ни одно из приведенных в формуле I соединений не было описано до настоящего времени в качестве соединения со свойствами душистого вещества и не применялось в парфюмерии.
Также объектом настоящего изобретения является композиция, содержащая базовый продукт и эффективное количество соединения формулы (I), такого, как охарактеризованное выше.
Речь может идти об ароматизирующей композиции, в которой душистое вещество используется для маскировки или нейтрализации некоторых запахов или же для значительного улучшения обонятельного восприятия оттенка запаха этой композиции. Действительно душистое вещество формулы (I) придает ароматизирующей композиции, в которой оно содержится, воспринимаемый обонянием оттенок запаха, являющийся более выраженным, более динамичным, более интенсивным и с более широкой гаммой, чем ароматизирующая композиция без ее присутствия. Упомянутая композиция может выбираться из парфюмерных композиций, в обычном смысле этого слова, таких, как ароматизирующие основания и концентраты, одеколоны, душистые воды, духи и схожие продукты, топических композиций, в частности косметических, таких, как кремы для лица и тела, пудры из талька, масла для волос, шампуни, лосьоны для укрепления волос, соли и масла для ванны, гели для душа и ванны, туалетные мыла, средства против потения и дезодоранты для тела, лосьоны и кремы для бритья, мыла, кремы, зубные пасты, средства для полоскания рта, мази и схожие продукты, бытовых средств ухода, таких, как смягчители, ПАВ, стиральные средства, освежители воздуха и схожие продукты.
Базовый продукт может быть легко определен специалистом с учетом требуемой композиции и ее назначения, для которой хорошо известны обычные компоненты, такие, как - в качестве не ограничивающего примера - растворитель (растворители) и/или добавка(добавки).
Эффективное количество соединения формулы (I), вводимого в композицию, колеблется в зависимости от соединения, типа композиции, требуемого ароматизирующего эффекта и типа других вероятно присутствующих ароматизирующих или неароматизирующих соединений и может быть легко определено специалистом, которому известно, что это количество может колебаться в очень широком диапазоне, составляющем от 0,1 до 99 вес.%, в частности от 0,1 до 50 вес.%, а именно от 0,1 до 30 вес.%.
Соединение формулы (I) может содержаться в виде изомера или смеси изомеров, в частности энантиомера или смеси энантиомеров или рацемической смеси.
Указанное соединение может использоваться в качестве отдельного душистого вещества или, как принято в парфюмерии, в смеси с одним или несколькими душистыми соединениями, которые специалист в состоянии определить с учетом требуемого эффекта. Дополнительным или дополнительными душистыми веществами могут служить соединения формулы (I) или другие, известные специалисту душистые вещества.
Упомянутое соединение может применяться в том виде, в каком оно есть, или оно может вводиться в инертный наполнитель, или может содержать другие активные ингредиенты целевой композиции. Может применяться большое разнообразие наполнителей, включая, например, полярные растворители, масла, жиры, мелко измельченные твердые вещества, циклодекстрины, мальтодекстрины, смолоподобные вещества, смолы и любой другой известный для таких композиций наполнитель.
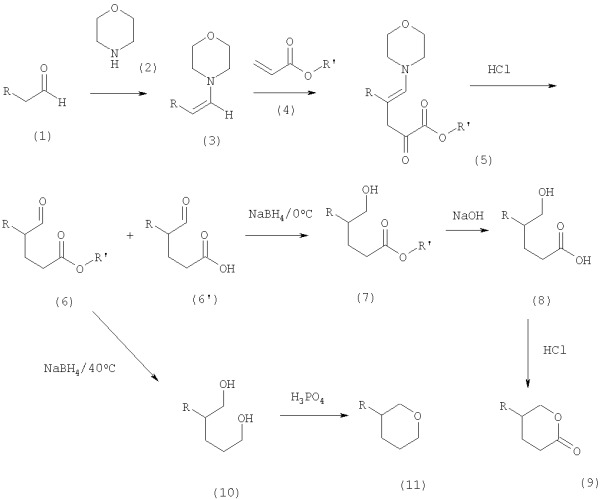
Также объектом изобретения является способ синтеза соединений формулы (I). Ниже приводится схема синтеза согласно одному из вариантов выполнения изобретения.
где R имеет то же значение, что и в формулах (I), (Ia) или (Ib), R' означает СН3 или С2Н5 или сложный эфир высшего спирта, предпочтительно из числа имеющихся в продаже, такой, как СН3 или С2Н5, для исключения удорожания синтеза. В приведенной схеме соединение (9) соответствует соединению формулы (Ia), в то время как соединение (11) соответствует соединению формулы (Ib).
Все соединения формулы (I) могут быть синтезированы восстановлением на основе единственного соединения: сложного оксоэфира формулы (6):
где R имеет то же значение, что и в формуле (I), R' означает СН3 или С2Н5- или сложный эфир высшего спирта.
Следовательно, объектом изобретения является способ синтеза соединения формулы (I), включающий в себя восстановление сложного оксоэфира формулы (6).
В зависимости от условий проведения реакции восстановления получают соединение формулы (Ia) или формулы (Ib).
Сложный оксоэфир (6) может быть синтезирован способом, включающим в себя конденсацию вторичного амина альдегидом для образования енамина с последующей конденсацией последнего акрилатом для образования сложного енаминового эфира, гидролизуемого в сложный оксоэфир. Такой способ синтеза имеет то преимущество, что ограничивается количество реакций для самоконденсации альдегида.
Согласно предпочтительному варианту выполнения изобретения сложный оксоэфир синтезируют следующим образом.
На первом этапе енамин (3) образуют из альдегида (1) и вторичного амина. Эта реакция проводится преимущественно с помощью цикличного амина, такого, как пиперидин или морфолин (2), однако могут применяться и другие амины, такие, как ациклические амины. Морфолин представляет интерес по экономическим соображениям (низкая стоимость). Для этой реакции не требуется применения катализатора, однако обычные катализаторы для образования енаминов могут применяться. Их применение не повышает ни кпд, ни глубины переработки, напротив они способны увеличивать скорость протекания реакции. Вторичный амин (2) нагревают в растворителе, например циклогексане, до температуры начала перегонки азеотропа растворителя и воды. При этой температуре добавляют альдегид (1), предпочтительно медленно для уменьшения до минимума его самоконденсации. По окончании реакции растворитель и избыток вторичного амина (2) выпаривают при пониженном давлении. Енамин (3) (который представляет собой альценил-морфолин в том случае, когда вторичный амин является морфолином) непосредственно используется в последующей реакции. Очистка дистилляцией не требуется, она не повышает кпд реакции Михаэля, которая затем начинается. В енамин (3) добавляют соответствующее основание, например гидроксид калия в метаноле (около 1 мол.%), и смесь доводят преимущественно до температуры около 50°С. Медленно добавляют акрилат (4) и реакционную смесь перемешивают предпочтительно при высокой температуре в конце введения добавки. Таким образом получают сложный енаминовый эфир (5). В том случае, когда реакцию проводят при более низкой температуре, обработка протекает медленно, при этом повышенная температура (порядка 50°С) способствует полимеризации акрилата (4) и, следовательно, является предпочтительной.
После этого сложный енаминовый эфир (5) гидролизуют соответствующей кислотой для получения сложного оксоэфира (6). Гидролиз проводят при температуре от около 20 до 80°С, предпочтительно при около 60°С. Кислота, применяемая при гидролизе сложного енаминового эфира (5), может быть минеральной, например соляной или серной, или же раствором уксусной кислоты с добавкой буфера в виде ацетата натрия. Обработка уксусной кислотой обеспечивает преимущество, которое состоит в том, что она является более щадящей и что возможно увеличение выхода сложного оксоэфира (6) по сравнению с обработкой, например, соляной кислотой. При указанных выше условиях не удается полностью исключить частичного омыления сложного оксоэфира (6) с образованием соответствующей оксокислоты (6'). Следовательно, необходимо тщательно определять длительность гидролиза с тем, чтобы можно было ограничить образование соответствующей оксокислоты (6'). В частности, эта продолжительность составляет от 2 до 8 часов, предпочтительно от 3 до 6 часов. Выход достигает порядка 60-70%.
Объектом изобретения является способ синтеза соединения формулы (I), при этом способ включает в себя восстановление сложного оксоэфира формулы (6):
где R имеет то же значение, что и в формуле (I), R' означает СН3 или С2Н5- или сложный эфир высшего спирта.
В зависимости от условий восстановления сложного оксоэфира (6) получают либо сложный гидроксиэфир (7), являющийся предшественником лактонового производного (9) формулы (Ia), либо диол (10), обеспечивающий при кислотной обработке получение пирана (11) формулы (1b).
Сложный гидроксиэфир (7) не выделяют, он превращается в лактон при выходе 60-70%, как правило, 67%.
Диолы выделяют и превращают в соответствующие тетрагидропираны при выходе порядка 60-70%.
Общий кпд синтеза согласно изобретению достигает порядка 35-45% как при получении продуктов формулы (Ia), так и продуктов формулы (Ib).
Объектом изобретения является также способ синтеза соединения формулы (I), включающий в себя восстановление сложного оксоэфира (6) соответствующим восстановителем:
а) при низкой температуре для образования сложного гидроксиэфира (7) с последующим омылением соответствующим основанием, затем гидролиз соответствующей кислотой и последующую циклизацию для образования соединения формулы (Ia) или
b) при высокой температуре для образования диола (10) с последующей циклизацией для получения соединения формулы (Ib).
Под низкой температурой подразумевается температура от около -10 до 10°С, предпочтительно от около -5 до 5°С, еще более предпочтительно около 0°С. Под высокой температурой подразумевается температура от около 30 до 50°С, предпочтительно от около 30 до 40°С, еще более предпочтительно около 35°С.
Само собой разумеется, что специалисту известно, что необходимое количество восстановителя зависит от того, восстанавливается ли только альдегид или же обе функциональные группы, при этом он будет в состоянии определить необходимое количество в зависимости от стоящей цели. Для сведения можно сообщить, что для восстановления альдегида следует добавить около 0,25 эквивалента (моль) и около 0,75 эквивалента (моль) для восстановления обеих функциональных групп.
Восстановителем для выборочного восстановления группы альдегида может служить боргидрид натрия или полиметилгидросилоксаны или бораны. Сильные восстановители требуются при образовании диола, например боргидрид натрия, гидрид лития и алюминия, триизопропилоксид алюминия или натрия.
В варианте выполнении способа согласно изобретению восстановление сложного оксоэфира (6) с помощью восстановителя, например боргидрида натрия или полиметилгидросилоксана, может проводиться при низкой температуре, т.е. при около -10-10°С, предпочтительно -5-5°С, более предпочтительно около 0°С, в соответствующем растворителе, например этаноле или метаноле, с помощью соответствующего восстановителя в количестве от около 0,2 до 0,3 молярного эквивалента, предпочтительно несколько более около 0,25 молярного эквивалента (при необходимости количество, необходимое для нейтрализации оксокислоты (6'), содержащейся в реакционной среде, увеличивают в случае синтеза сложного оксоэфира описанным выше способом). При этом получают сложный гидроксиэфир (7). Сложный гидроксиэфир может быть омылен непосредственно, без извлечения, соответствующим основанием, например гидроксидом натрия в водной среде. При этом водную фазу извлекают соответствующим растворителем, например толуолом, для удаления спирта, образующегося из альдегида в результате самоконденсации исходного альдегида. После этого реакционную среду подкисляют соответствующей кислотой, например соляной, в результате чего возможно проводить одновременный гидролиз солей бора и солей натрия гидроксикислоты (8). Гидроксикислота (8) не может быть выделена, так как она непроизвольно циклизуется в кислой среде с образованием δ-лактона (9), соответствующего соединению формулы (Ia). Лактон выделяют и очищают дистилляцией.
В другом варианте выполнения способа согласно изобретению восстановление сложного оксоэфира с помощью восстановителя, например боргидрида натрия или гидрида лития и алюминия, проводится при температуре около 30-50°С, предпочтительно около 30-40°С, более предпочтительно около 35°С, в соответствующем растворителе, например этаноле или изопропаноле, восстановителем в количестве около 0,6-1,2 молярного эквивалента, предпочтительно при несколько большем молярном эквиваленте (при необходимости добавляемом в количестве, необходимом для нейтрализации оксокислоты (6'), присутствующей в реакционной среде в том случае, когда сложный оксоэфир был синтезирован описанным выше способом). Восстанавливают эфирную группу и получают диол (10). После этого реакционную среду подкисляют соответствующей кислотой, например соляной, извлекают водную среду соответствующим растворителем, таким, как толуол, для отделения диола. В частности, диол при небольшой молекулярной массе хорошо растворяется в воде. При этом необходимо следить за тем, чтобы отделение диола (10) было количественным. Затем диол (10) очищают дистилляцией, проводят циклизацию, например, обработкой его соответствующей кислотой, например фосфорной при концентрации 85%, и при соответствующей температуре, в частности от 120 до 140°С, для образования пирана (11), соответствующего соединению формулы (Ib). Пиран (11) отделяют и очищают дистилляцией.
Способы синтеза соединения формулы (I), предусматривающие восстановление сложного оксоэфира формулы (6), могут также содержать этапы синтеза сложного оксоэфира формулы (6), описанные выше в связи со способами синтеза указанного сложного оксоэфира.
Приводимые ниже примеры дополнительно поясняют душистые вещества согласно изобретению, их применение, синтез и эффективность. Эти примеры приводятся только с целью пояснения и не могут рассматриваться в качестве ограничительных в отношении объема изобретения.
Пример 1. Синтез сложного 4-формил-нонанметилового эфира (6)
В колбу емкостью 4 л, снабженную магнитной мешалкой, холодильником, термометром и загрузочной воронкой, помещают 418,0 г (4,80 моля) морфолина и 344,0 г циклогексана. Смесь нагревают до температуры 65-70°С, в течение пяти часов добавляют 444,2 г (3,89 моля) гептаналя, затем быстро доводят до температуры кипения (80-84°С в начале внесения добавки и 87°С в конце операции). Образовавшуюся при реакции воду отделяют. После этого реакционную смесь охлаждают и проводят дистилляцию циклогексана и избытка морфолина при пониженном давлении (около 4400 Па), не превышая температуру 80°С внутри массы. Охлаждают до 40°С, доводят давление до давления окружающей среды и добавляют 4,0 г гидроксида калия в 40 мл метанола с 4-гепт-1(Е/Z)-енил-морфолином. Смесь нагревают до 60°С и в течение четырех часов добавляют 237,5 г (2,76 моля) метилакрилата. Перемешивают в течение двенадцати часов при 60°С, затем дополнительно добавляют 165,3 г (1,92 моля) метилакрилата в течение 2 часов 30 минут. По окончании внесения добавки температуру реакционной среды увеличивают до 80°С и продолжают перемешивание в течение двенадцати часов. В течение двух часов по каплям вводят при указанной температуре буферный водный раствор уксусной кислоты с рН 4 (587,3 г уксусной кислоты, 215,3 г ацетата тригидрата натрия и 697,5 г воды). Продолжают перемешивание еще в течение четырех часов. Дают отстояться и разделяют на фазы. Водную фазу дважды отделяют циклогексаном в количестве 200 мл. Органические фазы объединяют и промывают один раз 100 мл воды, один раз 100 мл раствора, насыщенного бикарбонатом натрия, и один раз 150 мл насыщенного солевого раствора. Сушат на сульфате магния. После выпаривания растворителя при пониженном давлении (3990 Па) без превышения температуры 50°С внутри массы получают 890,0 г сложного сырого оксоэфира, который отбеливают в глубоком вакууме (80-95°С при 80 Па) и получают 663,0 г сложного 4-формил-нонанметилового эфира при 82,7% (выход 2,74 моля; 70%).
Пример 2. Синтез 5-пентил-тетрагидропиран-2-она (9)
В колбу объемом четыре литра, снабженную механическим смесителем и термометром, помещают 1560,0 г этанола и 663,0 г (не более 2,74 моля) сложного 4-формил-нонанметилового эфира при концентрации 82,7%, полученного в примере 1, и охлаждают до 0°С. Затем в течение четырех часов добавляют 41,6 г (1,10 моля) боргидрида натрия небольшими порциями, не превышая температуру 5°С внутри массы. По окончании введения продолжают размешивание в течение еще 24 часов при 0°С. Затем добавляют отдельными каплями 1900,0 г водного раствора гидроксида натрия 10% в течение двух часов, не превышая температуру 10°С внутри массы. Образуется осадок белого цвета. Размешивание продолжают до полного растворения осадка (в течение около двух часов). Колбу помещают в вакуум с давлением около 3990 Па и проводят дистилляцию этанола. Образовавшуюся водную фазу экстрагируют дважды с помощью 200 мл смеси из толуола и гексана (50:50) для удаления нейтральных продуктов. Затем водную фазу охлаждают до 0°С. После этого водную фазу подкисляют с помощью 1900,0 г соляной кислоты при 10% в течение трех часов, не превышая температуру 10°С внутри массы. По окончании введения продолжают размешивание в течение четырех часов, доведя при этом температуру реакционной смеси до температуры окружающей среды (20°С). Дают отстояться и отделяют органическую фазу. Водную фазу экстрагируют дважды 200 мл толуола. Органические фазы объединяют и дважды промывают 100 мл воды и один раз 200 мл воды, затем упаривают при пониженном давлении (3990 Па). Получают 696,0 г сырого продукта, который отбеливают при 133 Па и получают 468,0 г 5-пентил-тетрагидропиран-2-она при 86,1%. После дистилляции в колонке Вигрё получают сердцевинную фракцию в количестве 289,0 г (1,70 моля) 5-пентил-тетрагидропиран-2-она при концентрации 98,3% (90-2°С / 27 Па), выход составил 61%.
Пример 3. Синтез сложного 4-формил-ундеканметилового эфира (6)
В колбу емкостью 1 л, снабженную магнитной мешалкой, холодильником, термометром и загрузочной воронкой, помещают 104,4 г (1,20 моля) морфолина и 210,0 г циклогексана. Смесь нагревают до температуры 65-70°С. Добавляют в нее в течение четырех часов 142,0 г (0,99 моля) нонанала. При этом быстро доводят до температуры кипения (80-84°С в начале введения добавки и 87°С в конце операции). Образовавшуюся при реакции воду отводят с помощью холодильника. Затем реакционную среду охлаждают, циклогексан и избыток морфолина подвергают дистилляции при пониженном давлении (около 4400 Па), не превышая при этом температуру 60°С в массе. Охлаждают до 40°С, доводят до давления окружающей среды и добавляют 1,5 г гидроксида калия в 20 мл метанола с 4-нон-1(Е/Z)-енил-морфолином. Смесь нагревают до 50°С и в течение одного часа добавляют 85,5 г (0,99 моля) метилакрилата. Перемешивают в течение пятнадцати часов при 50°С, затем дополнительно добавляют в течение 1,5 часа 43,0 г (0,50 моля) метилакрилата. По окончании введения добавки продолжают перемешивание в течение двенадцати часов при 60°С. Температуру реакционной смеси увеличивают до 80°С. В течение двух часов при указанной температуре отдельными каплями вводят водный раствор буферной уксусной кислоты с рН 4 (195,7 г уксусной кислоты, 71,7 г тригидрата ацетата натрия и 232,6 г воды). Перемешивание проводят еще в течение четырех часов. Дают отстояться и разделяют на фазы. Водную фазу экстрагируют дважды с помощью 150 мл толуола. Органические фазы объединяют и трижды промывают 100 мл воды и один раз 100 мл насыщенного солевого раствора. Сушат сульфатом магния. После выпаривания растворителя при пониженном давлении (3990 Па) без превышения температуры 50°С внутри массы получают 237,0 г сырого сложного оксоэфира, который отбеливают в глубоком вакууме (70-120°С при 93 Па), получили 152,1 г сложного 4-формил-ундеканметилового эфира при 91,0% (выход 0,61 моля; 61%).
Пример 4. Синтез 2-гептил-пентан-1,5-диола (10)
В колбу емкостью 1 л, снабженную магнитной мешалкой, термометром и загрузочной воронкой, помещают 390,0 г изопропанола и 22,4 г (0,59 моля) боргидрида натрия. Отдельными каплями добавляют в течение часа 148,4 г (0,59 моля) сложного 4-формил-ундеканметилового эфира (6) при концентрации 91%. Температура внутри массы во время добавки возрастает до 35°С. Перемешивание продолжали в течение 29 часов при понижении температуры внутри массы до комнатной (около 20°С). После охлаждения реакционной среды до 5°С добавляют 8,6 г ацетона без превышения температуры 10°С внутри массы. Реакционную смесь снова охлаждают до 5°С и добавляют 240,0 г соляной кислоты в течение часа без превышения температуры 10°С внутри массы. Добавляют 250,0 г воды для упрощения разделения на фазы. Водную фазу экстрагируют дважды 200 мл толуола. Объединяют органические фазы и промывают их один раз 100 мл воды и один раз 100 мл насыщенного солевого раствора. Сушат на сульфате магния и фильтруют. Растворитель удаляют при пониженном давлении (3990 Па), не превышая температуру 50°С внутри массы. Получают 118,0 г (0,42 моля) 2-гептил-пентан-1,5-диола (10) при концентрации 72%, который был непосредственно направлен на этап циклизации.
Пример 5. Синтез 3-гептил-тетрагидропирана (11)
В колбу емкостью 500 мл, снабженную магнитной мешалкой, холодильником, термометром и загрузочной воронкой, помещают 60,6 г (0,21 моля) 2-гептил-пентан-1,5-диола и быстро добавляют 52,6 г фосфорной кислоты при концентрации 85%. При введении добавки температура реакционной смеси возрастает до 60°С. Реакционную смесь нагревают до состояния флегмы (127°С) и перемешивают в течение четырех часов. Затем охлаждают до комнатной температуры (около 20°С) и добавляют 150 мл воды. Увеличивают скорость перемешивания и продолжают перемешивание в течение 30 минут. Фазы разделяют и экстрагируют водную фазу один раз 100 мл метил-трет-бутилового эфира. Органические фазы объединяют и промывают дважды 50 мл насыщенного бикарбонатом натрия раствора и один раз 50 мл насыщенного солевого раствора. Сушат, фильтруют и упаривают растворитель при пониженном давлении (3990 Па), не превышая температуру 50°С внутри массы. Затем сырой продукт дистиллируют в колонке Вигрё. Сердцевинная фракция содержала 28,1 г (0,18 моля) 3-гептил-тетрагидропирана при концентрации 96% (температура кипения 100°С при 930 Па). Выход составил 73%.
Инфракрасные спектральные анализы, ЯМР и анализ массы полученных соединений показали, что эти соединения соответствовали структуре целевых соединений.
Пример 6. Оценка воздействия на обоняние
На первом этапе ароматизирующие свойства нескольких чистых соединений оценивали посредством панели. Оценочная панель была составлена несколькими специалистами, она позволила качественно оценить каждое соединение. Соединения были описаны в качестве фруктовых и лактоновых соединений с оттенками запаха листьев фигового дерева или кориандра. Результаты оценки приведены ниже:
- 5-пропил-тетрагидро-2Н-пиран-2-он: оттенки запаха лактонитов, кокосового ореха, листьев фигового дерева, реестр октагидрокумарина,
- 5-пентил-тетрагидро-2Н-пиран-2-он: оттенки запаха лактонитов, лимона, зелени, вербены,
- 3-гептил-тетрагидропиран: оттенки запаха лактонитов, зелени, альдегида, листьев кориандра, мандарина, банана,
- 3-бензил-тетрагидропиран: оттенки запаха герани, леса, фенола, лактонитов.
После этого тестировали 5-пентил-тетрагидро-2Н-пиран-2-он и 5-гептил-тетрагидро-2Н-пиран-2-он в качестве основы перламутровой шампуни (соответственно композиции 1, 2 и 3). Их благоухающий эффект оценивали сравнением ароматизирующих композиций с содержанием и отсутствием каждого соединения. 3-Бензил-тетрагидропиран тестировали в качестве основы перламутровой шампуни и в качестве концентрированной смягчающей основы (композиции 4, 5). Благоухающий эффект сравнивали с ароматом стираллилацетата.
Композиция №1
Тиаре (малазийское растение)
(применение в качестве основы перламутровой шампуни в количестве 0,5 вес.%)
| Компонент | Опыт 1, г | Опыт 2, г |
| Бензилацетат | 60,0 | 60,0 |
| Коричный спирт, синтетический, Prime(1) | 6,0 | 6,0 |
| Фенилэтиловый спирт | 80,0 | 80,0 |
| Метилантранилат | 20,0 | 20,0 |
| Метилбензоат | 2,0 | 2,0 |
| Цитронеллол,98% | 60,0 | 60,0 |
| Кумарин | 4,0 | 4,0 |
| Гераниол, чистый | 56,0 | 56,0 |
| Дигидро-метилжасмонат | 200,0 | 200,0 |
| Гелиотропин, кристаллический | 8,0 | 8,0 |
| Изоэвгенол | 3,0 | 3,0 |
| Линалол | 100,0 | 100,0 |
| Лирал(2) | 130,0 | 130,0 |
| Метилионантем | 40,0 | 40,0 |
| Бензилсалицилат | 200,0 | 200,0 |
| Фолион(3) | 5,0 | 5,0 |
| Индол, 10%, в DPG (дипропиленгликоле) | 6,0 | 6,0 |
| Метилпаракрезол, 10%, в | 6,0 | 6,0 |
| DPG | ||
| Дипропиленгликоль | 10,0 | 0,0 |
| 5-Пентил-тетрагидро-2Н-пиран-2-он | 0,0 | 10,0 |
| Всего | 1000,0 | 1000,0 |
| (1) Происхождение: фирма «Givaudan», Швейцария; | ||
| (2) 4-(4-гидрокси-4-метилпентил)-3-циклогексен-1-карбальдегид; происхождение: фирм «International Flavors & Fragrances Inc., США; | ||
| (3) метил-2-октиноат; происхождение: фирма «Givaudan», Швейцария. |
Композиция №2
Ландыш
(применение в качестве основы перламутровой шампуни в количестве 0,5 вес.%)
| Компонент | Опыт 1, г | Опыт 2, г |
| Бензилацетат | 56,0 | 56,0 |
| Фенилэтиловый спирт | 445,0 | 445,0 |
| α-гексилкоричный альдегид | 100,0 | 100,0 |
| Цитронеллол,98% | 80,0 | 80,0 |
| Дигидро-метилжасмонат | 100,0 | 100,0 |
| Лилиал(1) | 85,0 | 85,0 |
| Линалол | 110,0 | 110,0 |
| Триплал(2) | 1,0 | 1,0 |
| цис-3-Гексенол, 10%, в DPG (дипропиленгликоле) | 6,0 | 6,0 |
| Индол, 10%, в DPG | 6,0 | 6,0 |
| Ванилин, 10%, в DPG | 6,0 | 6,0 |
| Дипропиленгликоль | 10,0 | 0,0 |
| 5-Гептил-тетрагидро-2Н-пиран-2-он | 0,0 | 10,0 |
| Всего | 1000,0 | 1000,0 |
| (l) 2-Метил-3-(4-трет-бутилфенил)пропанол, происхождение: Швейцария; | ||
| (2) 2,4-диметил-3-циклогексен-1-карбальдегид, происхождение: фирма «International Flavors & Fragrances Inc.», США. |
Композиция №3
Персик
(применение в качестве основы перламутровой шампуни в количестве 0,5 вес.%)
| Компонент | Опыт 1, г | Опыт 2, г |
| Изоамилацетат | 10,0 | 10,0 |
| Бензилацетат | 65,0 | 65,0 |
| Фенилэтиловый спирт | 40,0 | 40,0 |
| Аллилкапроат | 5,0 | 5,0 |
| Живескон(1) | 5,0 | 5,0 |
| Дигидро-метилжасмонат | 145,0 | 145,0 |
| цис-3-Гексенол | 4,0 | 4,0 |
| α-ионон | 15,0 | 15,0 |
| цис-Жасмон(2) | 2,0 | 2,0 |
| Линалол | 175,0 | 175,0 |
| Неофолион(3) | 1,0 | 1,0 |
| Фрамбинон | 3,0 | 3,0 |
| γ-Ноналактон | 10,0 | 10,0 |
| Тетрагидролиналол | 260,0 | 260,0 |
| Гексилсалицилат | 155,0 | 155,0 |
| Вещество МО20(4) | 80,0 | 80,0 |
| Этилбутират, 10%, в DPG (дипропиленгликоле) | 5,0 | 5,0 |
| Дипропиленгликоль | 20,0 | 0,0 |
| 5-Гептил-терагидро-2Н-пран-2-он | 0,0 | 20,0 |
| Всего | 1000,0 | 1000,0 |
| (1) Этил-2-этил-6,6-диметил-2-циклогексен-карбоксилат и этил-2,3,6,6-тераметил-2-циклогексен-карбоксилат; происхождение: фирма «Givaudan», Швейцария; | ||
| (2) происхождение: фирма «Givaudan», Швейцария; | ||
| (3) метил-2-ноненоат; происхождение: фирма «Givaudan», Швейцария; | ||
| (4) патентованное средство фирмы «V. Mane Fils». |
Композиция №4
Спелая черника
(применение в качестве смягчающей основы в количестве 0,5 вес.%)
| Компонент | Опыт 1, г | Опыт 2, г |
| Cassis MGO(1) | 30,0 | 30,0 |
| Изоамилацетат | 6,0 | 6,0 |
| Бензилацетат | 20,0 | 20,0 |
| Этилацетилацетат | 25,0 | 25,0 |
| α-Гексилкоричный альдегид | 55,0 | 55,0 |
| Лауриновый альдегид | 2,0 | 2,0 |
| γ-Ундекалактон | 30,0 | 30,0 |
| 2-Этил-4-(2,3,3-триметил-3-циклопентил-1-ил)-2-бутен-1-он)(2) | 45,0 | 45,0 |
| Бакданол (2) | 10,0 | 10,0 |
| Бенжоин сиамский, 50%, в ЕМК | 2,0 | 2,0 |
| Бутилбутират | 3,0 | 3,0 |
| Этилциннамат | 4,0 | 4,0 |
| Лимон итальянский | 60,0 | 60,0 |
| Дипропиленгликоль | 186,0 | 186,0 |
| цис-3-Гексенол | 5,0 | 5,0 |
| α-Ионон | 12,0 | 12,0 |
| β-Ионон | 18,0 | 18,0 |
| Лилиал(3) | 30,0 | 30,0 |
| Лимон сладкий, дистиллированный, Гаити | 20,0 | 20,0 |
| Линалол | 20,0 | 20,0 |
| Метилионатем Super(4) | 35,0 | 35,0 |
| Мюск T-этиленбрассилат(5) | 200,0 | 200,0 |
| Апельсин, Бразилия | 30,0 | 30,0 |
| Фламбинон(6) | 10,0 | 10,0 |
| Бензилсалицилат | 25,0 | 25.0 |
| Ундекавертол(7) | 4,0 | 4,0 |
| Этилмалтол-Велтол Плюс(8) | 2,0 | 2,0 |
| Вердокс(9) | 35,0 | 35,0 |
| Бензольный альдегид без толуола, 10%, в DPG (дипропиленгликоле) | 5,0 | 5,0 |
| Cumin Ess. | 2,0 | 2,0 |
| Дамасенон, 10%, в DPG(10) | 7,0 | 7,0 |
| Фолион, 10%, в DPG(11) | 4,0 | 4,0 |
| Гальбан | 4,0 | 4,0 |
| Гвоздика | 4,0 | 4,0 |
| Мелонал, 10%, в DPG(12) | 2,0 | 2,0 |
| 6-цис-Ноненол, 1%, в DPG | 5,0 | 5,0 |
| Оксан, 10%, в DPG(13) | 15,0 | 15,0 |
| Диметилсульфид, 1%, в DPG | 15,0 | 15,0 |
| Стираллилацетат | 25,0 | 0,0 |
| 3-Бензил-тетрагидропиран | 0,0 | 25,0 |
| Всего | 1000,0 | 1000,0 |
| (1) Патентованное средство фирмы V. Mane Fils; |