Применение антагонистов окситоцина при вспомогательной репродукции
Иллюстрации
Показать всеИзобретение относится к медицине и касается применения антагонистов окситоцина или их фармацевтически приемлемых солей для изготовления лекарственного средства для улучшения рецептивности матки при вспомогательной репродукции. Изобретение обеспечивает уменьшение количества неудачных попыток у женщин, подвергающихся процедурам вспомогательной репродукции, и улучшение общего качества жизни пациенток. 2 н. и 18 з.п. ф-лы, 6 ил.
Реферат
Настоящее изобретение относится к применению антагонистов окситоцина, или антагонистов окситоцина и вазопрессина, или антагонистов вазопрессина, или их фармацевтически приемлемых солей, например атозибана, барузибана или релковаптана, или их комбинаций с другими веществами для изготовления лекарственного средства, основным профилем действия которого является ингибирование рецепторов окситоцина и/или вазопрессина в небеременной матке млекопитающих, приводящее к улучшению рецептивности матки при переносе эмбрионов. Изобретение также относится к применению вышеупомянутых веществ для изготовления лекарственного средства для регуляции сократимости матки у субъектов, подвергающихся процедуре искусственной инсеминации.
Технологии вспомогательной репродукции применяют у людей для лечения бесплодия и у животных для продуцирования беременности. Бесплодие, поражающее примерно 10% пар людей по всему миру, можно лечить экстракорпоральным оплодотворением и переносом эмбрионов в полость матки (ЭКО-ПЭ) или, в менее сложных случаях, искусственной инсеминацией. Процент успешных попыток ЭКО-ПЭ у людей обычно составляет от 10 до 40% беременностей на цикл лечения, при инсеминации возможно достижение уровня 20%. Как правило, успех переноса эмбрионов зависит от рецептивности матки, которую определяют как способность матки обеспечить оптимальные условия для надлежащей имплантации и развития эмбриона. Основными компонентами рецептивности матки являются сократительная активность матки и состояние эндометрия. Чрезмерная сократимость матки, возникающая во время переноса эмбрионов, может выталкивать эмбрионы из матки во влагалище или маточные трубы, и это может служить причиной безуспешного лечения или, во втором случае, причиной внематочной беременности - серьезного, потенциально опасного для жизни осложнения. Кроме того, помимо качества спермы успех искусственной инсеминации зависит от интенсивности и направления волн сокращений матки, а также от состояния эндометрия. Когда сокращения матки направлены от дна матки к шейке, сперма, введенная в матку во время процедуры, выдавливается из матки, что сказывается на эффективности процедуры.
У людей циклы, во время которых происходит внутриматочная имплантация, могут характеризоваться пониженной сократительной активностью матки. Маточные сокращения также влияют на имплантацию эмбрионов у разводимых животных. Известно, что процент успешных попыток имплантации негативно коррелирует с частотой маточных сокращений. Различие в процентах успешных попыток имплантации у женщин с высокой и низкой сократительной активностью матки может превышать 50%. К тому же, простагландины маточного происхождения снижают перфузию эндометрия, ухудшая рецептивность матки. Применение лекарственных средств, которые снижают сократимость матки, таких как бета-агонисты, часто сопровождается неблагоприятными реакциями и не влияет на процент успешных попыток имплантации.
Задача изобретения заключается в том, чтобы предоставить лекарственные средства, которые увеличивают процент успешных процедур вспомогательной репродукции, и идентифицировать вещества, которые могут быть использованы для изготовления таких лекарственных средств, причем эти лекарственные средства не должны вызывать побочных эффектов, характерных для современных лекарственных средств, и должны иметь улучшенную клиническую эффективность при вспомогательной репродукции.
Объектом изобретения является применение и лекарственное средство, которые определены в прилагаемой формуле изобретения. В частности, изобретение относится к применению антагонистов окситоцина, антагонистов окситоцина и вазопрессина или антагонистов вазопрессина для изготовления лекарственного средства для улучшения рецептивности матки при переносе эмбрионов или при искусственных инсеминациях.
Подробно, изобретение относится к применению эффективного количества антагонистов окситоцина, антагонистов окситоцина и вазопрессина или антагонистов вазопрессина или их фармацевтически приемлемых солей для изготовления лекарственных средств, используемых в процедурах вспомогательной репродукции, которые можно применять до, во время и после переноса эмбрионов и которые действуют, улучшая рецептивность матки. Согласно изобретению антагонисты окситоцина, антагонисты окситоцина и вазопрессина или антагонисты вазопрессина или их фармацевтически приемлемые соли вводят энтерально или парентерально в 24-часовой дозе в пределах от примерно 0,01 мг до примерно 10 г.
Антагонисты окситоцина, антагонисты окситоцина и вазопрессина или антагонисты вазопрессина или их фармацевтически приемлемые соли могут быть пептидными или непептидными веществами. В частности, антагонист окситоцина, антагонист окситоцина и вазопрессина или антагонист вазопрессина представляет собой вещество, выбранное из следующей группы веществ: атозибан, барузибан, релковаптан, ТТ-235 (ANTAG III, 1-PMP(S)-2-Trp-6-Pen-8-Arg-окситоцин), L-365,209 [цикло(L-изолейцил-D-2,3,4,5-тетрагидро-3-пиридазинкарбонил-L-2,3,4,5-тетрагидро-3-пиридазинкарбонил-N-метил-D-фенилаланил-L-пролил-
D-фенилаланил], L-366,509 [2-гидрокси-7,7-диметил-1-((спиро(1Н-инден-1,4'-пиперидин)-1'-илсульфонил)метил)бицикло(2.2.1)гептан-2-уксусная кислота], L-371,257 [1-(1-(4-((N-ацетил-4-пиперидинил)окси)-2-метоксибензоил)пиперидин-4-ил)-4Н-3,1-бензоксазин-2(1Н)-он], L-372,662 [1-(1-4-(1-(2-метил-1-оксидопиридин-3-илметил)
пиперидин-4-илоксил-2-метоксибензоил)пиперидин-4-ил)-1,4-дигидробензо(d)(1,3)оксазин-2-он], L-368,899 [1-(((7,7-диметил-2-(2-амино-4-(метилсульфонил)бутирамидо)бицикло(2.2.1)гептан-1-ил)метил)сульфонил)-4-(2-метилфенил)пиперазин], desGly(NH2)9d(CH2)5{Tyr(Me)2Thr4]OVT, соединение РА1-6 кислота, ANTAG II (1-РМР-2-Trp-8-Arg-окситоцин), ANTAG I (1-РМР-2-Trp-3-Phe-4-IIe-8-Arg-окситоцин), L-366,948 (цикло(3-(2-нафталинил)-D-аланил-L-изолейцил-D-2-пиперидинкарбонил-L-2-пиперидинкарбонил-D-гистидил-L-пролил), L-366,682 (цикло(D-гистидил-L-пролил-D-триптофил-L-изолейцил-D-2-пиперидинкарбонил-L-2-пиперидинкарбонил), ОТА (d(CH2)5[Tyr(Me)2Thr4, Tyr-NH2(9)]орнитин вазотоцин), SSR126768A (4-хлор-3-[(3R)-(+)-5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксо-2,3-дигидро-1Н-индол-3-ил]-N-этил-N-(3-пиридилметил)бензамида гидрохлорид), вещество, имеющее код GW405212X, и вещество, имеющее код ОРС-21268 [1-(1-(4-(3-ацетиламинопропокси)бензоил)-4-пиперидил)-3,4-дигидро-2(1Н)-хинолин].
В частности, применение по изобретению относится к лечению бесплодия у людей, конкретно к процедуре переноса эмбрионов, особенно к переносу свежих или замороженных/оттаявших эмбрионов. Предпочтительное применение по изобретению относится к процедуре экстракорпорального оплодотворения-переноса эмбрионов (ЭКО-ПЭ) или относится к переносу эмбрионов, когда компоненты эмбриона ооцит или сперматозоид взяты у донора(ов). Изобретение конкретно относится к использованию у разводимых животных, а именно коров, свиней, лошадей, овец, при выполнении процедуры переноса эмбрионов. В одном из воплощений изобретение дополнительно относится к применению других лекарственных средств, которые можно использовать при вспомогательной репродукции, в частности доноров оксида азота, субстратов синтазы оксида азота, прогестагенов, антагонистов простагландинов, метилоксантинов, бета-агонистов, агонистов простациклина.
В частности, лекарственные средства, изготовленные согласно охарактеризованному изобретению, могут быть использованы в ходе процедур вспомогательной репродукции конкретно для регуляции сократительной активности матки, улучшающей транспорт спермы в женских половых путях после искусственной инсеминации. В конкретном воплощении изобретение относится к лечению, которое проводят у людей, или к использованию у разводимых животных, а именно коров, свиней, лошадей, овец, когда осуществляют искусственную инсеминацию. Наконец, дополнительный объект изобретения составляют лекарственные средства, изготовленные согласно охарактеризованному выше применению.
Объектом изобретения является применение эффективного количества антагонистов окситоцина, антагонистов окситоцина и вазопрессина или антагонистов вазопрессина или их фармацевтически приемлемых солей, например атозибана, барузибана или релковаптана, для изготовления лекарственных средств, используемых в процедурах вспомогательной репродукции, в частности в процедурах переноса эмбрионов или искусственной инсеминации. Лекарственные средства, охарактеризованные в изобретении, применяют в форме пептида (например, атозибан) или непептида (например, релковаптан) до, и/или во время, и/или после переноса эмбрионов, а также до, и/или во время, и/или после искусственной инсеминации. Эти лекарственные средства вводят энтерально или парентерально в 24-часовой дозе от примерно 0,01 мг до примерно 10 г. Применение этих лекарственных средств относится к лечению бесплодия у людей, в частности к экстракорпоральному оплодотворению и переносу свежих эмбрионов или переносу замороженных/оттаявших эмбрионов в ситуации, когда обе гаметы (ооцит и сперматозоид) взяты у партнеров или когда одна или обе гаметы взяты у донора(ов). Лечение антагонистами окситоцина, антагонистами окситоцина и вазопрессина или антагонистами вазопрессина или их фармацевтически приемлемыми солями, например атозибаном, барузибаном или релковаптаном, проводят также у разводимых животных, а именно коров, свиней, лошадей, овец, и оно включает перенос эмбрионов, причем эффективное применение предполагается в суточной дозе от примерно 0,01 мг до примерно 10 г.
Лечение антагонистами окситоцина, антагонистами окситоцина и вазопрессина или антагонистами вазопрессина или их фармацевтически приемлемыми солями в форме пептидных или непептидных веществ относится к процедуре искусственной инсеминации у людей и у разводимых животных, а именно коров, свиней, лошадей, овец, при которой их применяют до, и/или во время, и/или после процедуры. При таком лечении лекарственные средства по изобретению используют для регуляции сократимости матки, улучшая транспорт спермы в женских половых путях, при этом предусматривается 24-часовая доза от примерно 0,01 мг до примерно 10 г.
Применение антагонистов окситоцина, антагонистов окситоцина и вазопрессина или антагонистов вазопрессина или их фармацевтически приемлемых солей, например, атозибана, барузибана или релковаптана, для изготовления лекарственных средств, используемых в процедурах вспомогательной репродукции, осуществляют в комбинации с применением одного или более из следующих веществ: доноры оксида азота, субстраты синтазы оксида азота, прогестагены, антагонисты простагландинов, метилоксантины, бета-агонисты, агонисты простациклина.
Хороший профиль безопасности является одним из преимущественных качеств лекарственных средств, содержащих антагонисты окситоцина, антагонисты окситоцина и вазопрессина или антагонисты вазопрессина или их фармацевтически приемлемые соли, например, атозибан, барузибан или релковаптан, в частности в силу высокой специфичности и избирательности этих веществ, обычно ограничивающих действие этих лекарств на матку.
Ингибирование рецепторов окситоцина и/или вазопрессина в матке приводит к улучшению рецептивности матки несколькими путями: во-первых, путем снижения сократимости матки и, во-вторых, благодаря благотворному влиянию на эндометрий, что достигается путем ингибирования локального высвобождения простагландинов (это высвобождение уменьшает эндометриальную перфузию). В случае сокращений матки в направлении от дна матки к шейке ингибирование рецепторов окситоцина и/или вазопрессина, достигаемое до, во время или после искусственной инсеминации, предотвращает выталкивание введенной спермы наружу из матки во влагалище.
Комбинация антагонистов окситоцина, антагонистов окситоцина и вазопрессина или антагонистов вазопрессина или их фармацевтически приемлемых солей с другими веществами, ингибирующими сократимость матки, например бета-агонистами, оказывает сверхаддитивный эффект. Такой эффект может быть использован для уменьшения доз активных веществ в комбинированных лекарственных средствах, и это связано с усилением действия веществ, используемых в композиции. Следовательно, такой эффект также снижает вероятность неблагоприятных реакций на лекарственные вещества. Доноры оксида азота, субстраты синтазы оксида азота, ингибиторы простагландинов, метилоксантины, миметики простациклина или прогестагены являются примерами веществ, которые можно комбинировать с антагонистами окситоцина, антагонистами окситоцина и вазопрессина или антагонистами вазопрессина или их фармацевтически приемлемыми солями для улучшения рецептивности матки и регуляции сократимости матки и для снижения вероятности неблагоприятных реакций на лекарственные вещества.
Изобретение обеспечивает повышение процента наступления беременности после переноса эмбрионов и искусственной инсеминации. Что касается людей, то это дает прямое социальное преимущество для населения, дополнительно давая эффект в снижении стоимости лечения бесплодия. Использование изобретения у разводимых животных позволит снизить затраты на разведение.
В отличие от альтернативного применения антагонистов окситоцина, раскрытых в WO 9609824, которое, как заявлено, увеличивает фертильность и выживаемость эмбрионов у разводимых животных за счет пролонгирования функционирования желтого тела, которое служит источником прогестерона, и сохраняет беременность, настоящее изобретение относится к методам вспомогательной репродукции, а не к самостоятельным родам. Кроме того, настоящее изобретение не относится к формированию или поддержанию желтого тела, так как в циклах с переносами эмбрионов желтое тело не присутствует. Следовательно, увеличение процента наступления беременности согласно изобретению достигается по другому механизму улучшения рецептивности матки, как в случае переноса эмбрионов, так и в случае искусственных инсеминаций.
Для лучшей иллюстрации изобретения прилагаются следующие графические материалы.
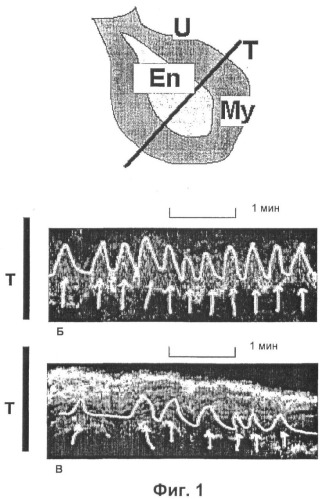
На Фиг.1 представлен график сократительной активности матки, оцененной трансвагинальным ультразвуковым исследованием у пациентки, случай которой описан в примере 1. Сокращения матки на графиках Б и В отмечены светлым цветом для лучшей наглядности. В методе анализа цифрового изображения из-за требования высокого качества изображения для анализа выбран период 4 минуты из общих 5 минут.
А) Схематическое представление принципа неинвазивной оценки сократимости матки (выполненной подобно Fanchin et al. [Hum. Reprod. 1998; 13 (7): 1968-74]). Обозначения: U - матка, En - эндометрий (внутренний слой матки) - отмечаются изменения в структуре и контуре эндометрия во время сокращений матки, My - миометрий (средний слой матки, образованный гладкой мышечной тканью), Т - тестируемый сегмент, где оцениваются движения контура эндометрия, отражающие сократительную активность матки.
Б) График, демонстрирующий сократительную активность матки до применения антагониста окситоцина атозибана. Видна сократительная гиперактивность. Обозначения: ↑ - сокращение матки, 1 мин - сегмент, представляющий цифровую запись в течение 1 мин, Т - тестируемый сегмент, где оцениваются движения контура эндометрия, отражающие сократительную активность матки.
В) График, демонстрирующий сократительную активность матки в момент максимального эффекта антагониста окситоцина атозибана. Сократительная активность матки заметно снижена. Обозначения: ↑ -сокращение матки, 1 мин - сегмент, представляющий цифровую запись в течение 1 мин, Т - тестируемый сегмент, где оцениваются движения контура эндометрия, отражающие сократительную активность матки.
На Фиг.2, построенной на основе примера 2, представлено сравнение параметров подвижности спермы человека в контрольных образцах и в образцах, подвергнутых воздействию атозибана в 3 концентрациях (300 нМ, 1000 нМ и 3000 нМ). Фиг.2 включает в себя 3 диаграммы: А - диаграмма, демонстрирующая проценты активно подвижных сперматозоидов в зависимости от воздействия атозибана (0 нМ, 300 нМ, 1000 нМ и 3000 нМ) и времени воздействия; Б - диаграмма, демонстрирующая проценты подвижных сперматозоидов в зависимости от воздействия атозибана (0 нМ, 300 нМ, 1000 нМ и 3000 нМ) и времени воздействия; В - диаграмма, демонстрирующая проценты гиперактивно подвижных сперматозоидов в зависимости от воздействия атозибана (0 нМ, 300 нМ, 1000 нМ и 3000 нМ) и времени воздействия. Значительных различий между контрольной (0 нМ) и экспериментальными (атозибан 300 нМ, 1000 нМ и 3000 нМ) группами не наблюдалось. Снижение подвижности сперматозоидов со временем (на 8-й и 24-й час эксперимента) зависело от постепенного снижения энергетического запаса спермия и было сравнимо во всех оцененных группах. Статистический анализ (дисперсионный анализ, ANOVA) не выявил каких-либо значительных различий в параметрах подвижности сперматозоидов. Обозначения: Активные, % - процент активно подвижных сперматозоидов; Подвижность, % - процент подвижных сперматозоидов; Гиперактивные, % - процент гиперактивно подвижных сперматозоидов.
На Фиг.3, построенной на основе примера 2, представлено сравнение параметров движения (скорости) сперматозоидов в контрольных образцах и образцах экспериментальных групп (подвергнутых воздействию атозибана в 3 концентрациях: 300 нМ, 1000 нМ и 3000 нМ). Фиг.3 включает в себя 3 диаграммы: А - диаграмма, демонстрирующая изменения скорости движения сперматозоидов по реальной траектории в зависимости от воздействия атозибана (0 нМ, 300 нМ, 1000 нМ и 3000 нМ) и времени воздействия; Б - диаграмма, демонстрирующая изменения скорости прямолинейного движения сперматозоидов в зависимости от воздействия атозибана (0 нМ, 300 нМ, 1000 нМ и 3000 нМ) и времени воздействия; В - диаграмма, демонстрирующая изменения амплитуды латерального смещения головок сперматозоидов от усредненной траектории их движения в зависимости от воздействия атозибана (0 нМ, 300 нМ, 1000 нМ и 3000 нМ) и времени воздействия. Обозначения: VSL - скорость прямолинейного движения, VLC - скорость движения по реальной траектории, ALH - амплитуда латерального смещения головки сперматозоида от усредненной траектории его движения. Статистический анализ (дисперсионный анализ, ANOVA) не выявил каких-либо значительных различий между контрольным (0 нМ) и экспериментальными образцами (атозибан 300 нМ, 1000 нМ, 3000 нМ).
Результаты биотеста на подвижность спермы человека, представленные на Фиг.2 и Фиг.3, рассмотренные далее в примере 2, подтверждают, что антагонист окситоцина и вазопрессина атозибан не ингибирует подвижность сперматозоидов человека in vitro, что подтверждает, что у него нет эмбриотоксического потенциала и, следовательно, его можно использовать при вспомогательной репродукции.
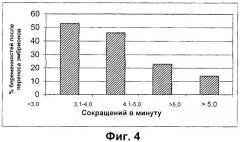
Фиг.4 иллюстрирует соотношение между сократительной активностью матки и процентом успешных попыток переноса эмбрионов. В случае высокой сократительной активности (>5,0 сокращений/минуту) клинический процент наступления беременности достигал 14%, а в случае пациентов с низкой сократительной активностью матки он повысился более чем в 3 раза, достигая 53% (фигура согласно публикации Fanchin et al. [Hum. Reprod. 1998; 13(7): 1968-74]).
На Фиг.5 представлена диаграмма сократительной активности матки небеременных людей (которую оценивали с использованием параметра площадь под кривой внутриматочного давления) во время стимуляции вазопрессином в случаях отсутствия и присутствия в организме антагониста окситоцина и вазопрессина релковаптана.
Обозначения столбцов:
плацебо - базовая сократительная активность матки (у пациенток, получающих плацебо);
VAS-1, VAS-2, VAS-3 - относительная (по отношению к плацебо) сократительная активность матки у пациенток, которым вводили релковаптан: их номера соответствуют введениям вазопрессина.
Данные, представленные на этой фигуре, демонстрируют эффект ингибирования рецепторов окситоцина и вазопрессина (и вазопрессин, и релковаптан действуют и на рецепторы окситоцина), снижая сократимость матки. Принимая во внимание рецепторный профиль релковаптана, т.е. более высокая аффинность к рецепторам вазопрессина Via по сравнению с рецепторами окситоцина в добавление к тому, что экспрессия Via сильнее в небеременной матке по сравнению с беременной, релковаптан является многообещающим кандидатом для применения до переноса эмбрионов и искусственной инсеминации (фигура согласно публикации Bossmar et al. [BJOG 1997,104:471-477]).
Фиг.6 (согласно Pierzynski P et al. [JSGE 2004, 11(6): 384-387]) иллюстрирует сократительную активность миометрия у беременных людей до и после введения антагониста окситоцина барузибана.
Обозначения: Р - базовое сокращение, вызванное хлоридом калия (KCI); W - промывание; ОТ - серия кумулятивных инъекций окситоцина для стимуляции сократимости матки (которые повторяли до и после введения антагониста окситоцина), W - промывание, BSB - введение антагониста окситоцина барузибана.
В этом исследовании in vitro оценивали эффект барузибана на сократимость гладкой мышцы матки, стимулированную окситоцином. Сократительная активность гладкой мышцы матки (миометрия) значительно снизилась после введения барузибана, и общее ингибирование сократительной активности наблюдалось в диапазоне концентраций окситоцина, которые имеются у людей. В этом исследовании было показано, что барузибан является более сильным ингибитором сокращений матки по сравнению с атозибаном. Несмотря на физиологические различия между беременной маткой и небеременной маткой, барузибан является многообещающим кандидатом для применения в технологиях вспомогательной репродукции с учетом его пролонгированной модели действия (установленный период полувыведения разовой дозы составляет 7 часов).
Изобретение относится к применению антагонистов окситоцина, антагонистов окситоцина и вазопрессина или антагонистов вазопрессина, например атозибана, барузибана или релковаптана или их фармацевтически приемлемых солей, для изготовления лекарственных средств, содержащих активные вещества в 24-часовой дозе от примерно 0,1 мг до примерно 10 г. Применение этих лекарственных средств улучшает рецептивность матки, что достигается за счет ослабления влияния окситоцина и/или вазопрессина на миометрий и эндометрий (гладкую мышцу и самый внутренний слой матки, где происходит имплантация). Такой эффект вызывает состояние покоя матки (с точки зрения сократимости) и дополнительно прекращает стимуляцию синтеза простагландинов в матке (простагландины в норме повышают сократимость матки и снижают эндометриальную перфузию). Следовательно, внутриматочная среда становится более "дружественной к эмбриону", что, в свою очередь, повышает процент успешных попыток переноса эмбрионов. Лекарственные средства, описанные в изобретении, при введении в случаях сокращений матки, направленных от дна матки к шейке матки, если они обнаружены перед искусственной инсеминацией, дают возможность повысить эффективность этой процедуры, предотвращая выталкивание спермы из матки в шейку.
Данное изобретение полезно для лечения, улучшающего рецептивность матки при переносе эмбрионов у людей и разводимых животных. В лечении антагонистами окситоцина, антагонистами окситоцина и вазопрессина или антагонистами вазопрессина или их фармацевтически приемлемыми солями можно использовать пептидные лекарственные средства, которые соответствуют структуре окситоцина и вазопрессина, такие как атозибан или барузибан, а также непептидные лекарственные средства, такие как релковаптан. Пептидные лекарственные средства нельзя вводить перорально из-за их переваривания, однако такое введение возможно, если использовать специальные системы для высвобождения лекарственных средств. Пептидные антагонисты окситоцина, антагонисты окситоцина и вазопрессина или антагонисты вазопрессина, например атозибан или барузибан, или их фармацевтически приемлемые соли можно вводить внутривенно, внутримышечно, подкожно или интраназально. Непептидные антагонисты окситоцина, окситоцина и вазопрессина или антагонисты вазопрессина, например релковаптан, или их фармацевтически приемлемые соли можно вводить также энтерально. Лекарственные средства, описанные в изобретении, содержащие пептидные или непептидные лекарственные вещества, вводят в дозе от примерно 0,1 мг до примерно 10 г за 24 часа разовой дозой, повторной дозой или в виде непрерывной/периодической инфузии. Введение лекарственного средства начинают максимум за одну неделю до переноса эмбрионов и заканчивают максимум через одну неделю после переноса. Это дает возможность аннулировать рефлекторную реакцию сокращения матки на введение катетера для переноса, а также снизить сократимость матки и улучшить рецептивность матки до момента имплантации эмбриона, что имеет место у людей примерно через одну неделю после переноса.
Другой аспект изобретения относится к изготовлению лекарственных средств, применяемых для регуляции сократимости матки до, во время и после искусственной инсеминации. Антагонисты окситоцина, антагонисты окситоцина и вазопрессина или антагонисты вазопрессина или их фармацевтически приемлемые соли вводят в случаях сократимости матки, направленной от дна матки к шейке, которая может выталкивать сперму из матки в шейку. Применение лекарственных средств по изобретению начинают максимум за неделю до инсеминации и продолжают максимум одну неделю после этой процедуры. В случае серии инсеминаций лечение можно продолжать максимум неделю после последней инсеминации. Антагонисты окситоцина, антагонисты окситоцина и вазопрессина или антагонисты вазопрессина или их фармацевтически приемлемые соли, такие как атозибан, барузибан или релковаптан, вводят в дозе от приблизительно 0,01 мг до приблизительно 10 г за 24 часа энтерально или назально, внутривенно, внутримышечно или подкожно. Примерами форм для введения этих лекарственных средств являются таблетки, драже, капсулы, пилюли, суспензии, сиропы, гранулы и растворы. Каждая стандартная доза, например таблетка или ложка раствора, может содержать, например, 0,1-1000 мг каждого из активных компонентов.
Лекарственные средства, содержащие антагонисты окситоцина, антагонисты окситоцина и вазопрессина или антагонисты вазопрессина или их фармацевтически приемлемые соли, можно применять в комбинации с другими лекарственными средствами, которые могут снижать сократимость матки, например с донорами оксида азота, субстратами синтазы оксида азота, прогестагенами, антагонистами простагландинов, метилоксантинами, бета-агонистами, агонистами простациклина или прогестагенами.
Комбинации антагонистов окситоцина, окситоцина и вазопрессина или антагонистов вазопрессина или их фармацевтически приемлемых солей с другими упомянутыми выше веществами можно вводить энтерально или парентерально в дозах, обеспечивающих соответствующую эффективность в снижении сократимости матки, с возможным дополнительным эффектом снижения неблагоприятных реакций на лекарственные вещества.
Пример 1. Клиническое применение лекарственного средства, содержащего атозибан, являющийся антагонистом окситоцина и вазопрессина, для повышения рецептивности матки при переносе эмбрионов в ходе процедуры вспомогательной репродукции ЭКО-ПЭ (экстракорпоральное оплодотворение-перенос эмбрионов)
Клиническое описание: женщина в возрасте 42 года с 15-летней историей бесплодия, беременностей никогда не было, с негативной акушерско-гинекологической историей болезни, относящейся к клинической картине бесплодия. Исходные результаты лабораторных анализов на гормоны, сделанных во время менструации: фолликулостимулирующий гормон (FSH) - 5,1 МЕ/мл (нормальный диапазон 3,2-10,0), лютеинизирующий гормон (LH) - 1,8 мМЕ/мл (нормальный диапазон 1,2-12,5), пролактин (PRL) - 23,4 нг/мл (нормальный диапазон 3,3-24,5), Е2 - 95,7 нг/мл (нормальный диапазон 12,0-48,0), Т - 0,43 (нормальный диапазон 0,1-0,96 нг/мл). При физиологическом и ультразвуковом исследовании была выявлена миоматозная матка и киста левого яичника. Через месяц после первого визита пациентка была подвергнута хирургическому лечению путем лапаротомии и энуклеации миомы матки и энуклеации кисты левого яичника без осложнений.
Через 7 месяцев после операции было начато специфическое лечение бесплодия, и пациентка была включена в программу ЭКО-ПЭ. Первая программа лечения была проведена в сентябре 2003 по длительному протоколу стимуляции овуляции. В ходе этого лечения пациентка получила в сумме 144 ампулы рекомбинантного FSH (Gonal 75 ME) и 8 ампул менопаузального гонадотропина человека HMG (Menogen 75 ME), что вызвало рост 3 граафовых фолликулов. После трансвагинальной аспирации фолликулов был отобран 1 ооцит в фазе MII. Из-за азооспермии, обнаруженной у мужа пациентки, подтвержденной также путем тестикулярной биопсии, для экстракорпорального оплодотворения использовали сперму анонимного донора. На третий день после отбора ооцита один 4-бластомерный эмбрион был перенесен в матку с отрицательным результатом.
Следующая (2-я) программа ЭКО была предпринята через 3 месяца. В ходе контролируемой стимуляции яичников было введено в сумме 74 ампулы рекомбинантного FSH (Gonal 75 ME) и 8 ампул менопаузального гонадотропина человека HMG (Menogen 75 ME). В этом цикле лечения был подтвержден рост 3 фолликулов. После трансвагинальной аспирации фолликулов было отобрано 3 ооцита в фазе MII, которые были затем оплодотворены спермой анонимного донора. На третий день после отбора ооцитов два 2-бластомерных эмбриона были перенесены в полость матки с отрицательным результатом.
В третьей программе ЭКО, проведенной через 6 месяцев, использовали длительный протокол стимуляции яичников. В ходе этого цикла лечения было введено 58 ампул рекомбинантного FSH (Gonal 75 ME) и 2 ампулы менопаузального гонадотропина человека HMG (Menogen 75 ME). В результате наблюдался рост 8 фолликулов. После трансвагинальной аспирации фолликулов были отобраны ооциты в фазе MII, которые затем были оплодотворены спермой анонимного донора. Два 4-бластомерных эмбриона были перенесены в полость матки с отрицательным результатом. Спустя один месяц была выполнена гистероскопия, обеспечивающая получение данных по возможной патологии полости матки, с отрицательным результатом.
Ввиду высокой вероятности низкого потенциала развития ооцитов у пациентки еще через 2 месяца было принято решение сменить этот метод лечения на использование ооцитов донора. Ооциты были анонимно предоставлены другой, здоровой пациенткой, лечившейся по программе ЭКО из-за бесплодия мужчины. После экстракорпорального оплодотворения 2 донорских ооцитов спермой анонимного донора был осуществлен перенос эмбрионов с отрицательным результатом. После этого в течение последующих 7 месяцев были осуществлены 3 последовательных цикла получения эмбрионов из донорских ооцитов и донорской спермы с отрицательным результатом.
В 8-м цикле лечения было принято решение о применении лекарственного средства, содержащего атозибан (антагонист окситоцина и вазопрессина), с целью улучшения рецептивности матки. Это лекарственное средство вводили внутривенной инфузией, которую начали за 60 мин до переноса и продолжали на протяжении 2 часов после переноса. За 10 минут до начала введения (70 минут до переноса) было проведено трансвагинальное ультразвуковое исследование с 5-минутной цифровой регистрацией сокращений матки. За 60 минут до переноса внутривенно была введена болюсная доза атозибана 6,75 мг без неблагоприятных реакций. Сразу же после этого начали непрерывную инфузию 18 мг/час атозибана с использованием инфузионного насоса, и ее продолжали на протяжении следующих 60 минут. Через 45 минут после начала инфузии повторили трансвагинальное ультразвуковое исследование с цифровой регистрацией изображения. Между 55- и 60-й минутами инфузии был осуществлен сопровождаемый ультразвуком перенос 2 эмбрионов. После переноса дозировку атозибана изменили на 6 мг/час. Введение закончили через 2 часа после переноса, общая введенная доза составила 37,5 мг.
Вышеописанная модель применения атозибана обеспечила максимальный эффект во время переноса эмбрионов (было доказано, что стабильные концентрации атозибана достигаются примерно через час после начала инфузии). Пациентка оставалась в горизонтальном положении в течение часа после окончания инфузии и в этот день ограничила свою активность. При контрольном визите через 2 недели после переноса эмбрионов был проведен тест на беременность с положительным результатом. При следующем визите (4 недели после переноса) нормальная внутриматочная двойная беременность была подтверждена трансвагинальным ультразвуковым исследованием, биение сердца плодов было визуализировано в обоих гестационных мешках.
Положительный результат лечения бесплодия у этой пациентки подтверждает благоприятное воздействие антагонистов окситоцина и вазопрессина на усиление рецептивности матки при переносе эмбрионов. Поскольку невозможно подтвердить другие аспекты действия атозибана (его воздействие на эндометриальную перфузию или на продуцирование местных простагландинов) во время переноса, доказательство действия было основано на его эффекте снижения сократительной активности матки, которое было продемонстрировано неинвазивно в момент максимального эффекта атозибана. Анализ сократимости матки выполняли двумя способами, используя последовательности ультразвукового изображения: путем инспекции и мануальной регистрации сокращений при ускоренной последовательности снимков (способ I) и путем цифрового анализа смещений контура эндометрия (способ II, выполненный подобно способу, представленному R. Fanchin et al. [Fanchin R i wsp. Hum Reprod 1998; 13(7): 1968-74]). Анализ сократительной активности матки, выполненный в ситуации отсутствия воздействия и в ситуации стабильных уровней атозибана в крови, продемонстрировал ее значительное снижение (способ I: 15 сокращений/5 мин до введения атозибана против 5 сокращений/5 мин после введения; способ II: 11 сокращений/4 мин до введения атозибана против 7 сокращений/4 мин после введения). Способ II иллюстрируется на Фиг.1. Применение лекарственного средства, содержащего атозибан, улучшает рецептивность матки несколькими путями: прямо, т.е. путем снижения сократительной активности матки, а также опосредованно, т.е. путем снижения стимуляции сократимости матки и ослабления эффекта снижения эндометриальной перфузии в результате ингибирования продуцирования/экскреции простагландинов в полости матки.
В целом, данный случай подтверждает рациональность применения лекарственных средств, содержащих антагонисты окситоцина, антагонисты окситоцина и вазопрессина или антагонисты вазопрессина или их фармацевтически приемлемые соли в лечении, улучшающем рецептивность матки при вспомогательной репродукции, особенно во время процедуры переноса эмбрионов. Дополнительно, беременность была достигнута у второй пациентки со сходными клиническими признаками.
Пример 2. Безопасность антагонистов окситоцина при вспомогательной репродукции
Лекарственное средство, содержащее атозибан, является на сегодняшний день единственным антагонистом окситоцина и вазопрессина, который зарегистрирован для применения у людей. Он является пептидным веществом, разрешенным для внутривенного применения в ситуации, диаметрально отличающейся от вспомогательной репродукции, а именно при преждевременных родах, где его используют для сохранения беременности. Клиническая безопасность атозибана была тщательно проверена в исследованиях, предшествующих его регистрации. Атозибан считается уникально безопасным, вызывающим минимальные побочные эффекты. Тем не менее, применение при вспомогательной репродукции не предполагалось, поскольку не проводилось никаких эмбриотоксических исследований атозибана.
Для того чтобы проверить эмбриотоксичность атозибана было проведено исследование по влиянию атозибана на параметры подвижности спермы человека (биотест на подвижность сперматозоидов человека). Методика, использованная в данном исследовании, является стандартной методикой для контроля качества и оценки эмбриотоксичности в лабораториях ЭКО. Было показано, что эта методика аналогична биотестам мышиных или кроличьих эмбрионов, которые являются животными моделями эмбриотоксичности [Miller, JW et al. Fertil Steril 2001: 76(3), SuppI I; S104]. Специ