Композиции, содержащие липазу, протеазу и амилазу, предназначенные для лечения недостаточности поджелудочной железы
Иллюстрации
Показать всеИзобретение относится к гастроэнтерологии и представляет собой композицию для лечения недостаточности поджелудочной железы, включающую микробную липазу, микробную протеазу и микробную амилазу, причем соотношение липазы, протеазы и амилазы в указанной композиции составляет примерно 1:1:0,15 единиц USP. Изобретение обеспечивает получение стабильных композиций с ферментами поджелудочной железы, проявляющих максимальную эффективность при наименьших дозировках и отличающихся хорошо известным профилем безопасности. 2 н. и 29 з.п. ф-лы, 10 табл., 7 ил.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка согласно 35 USC § 119(e) претендует на приоритет предварительной заявки на патент Соединенных Штатов №60/618764, поданной 14 октября 2004, содержание которой включено в настоящую заявку с помощью ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям, которые предназначены для лечения состояний, включающих недостаточность поджелудочной железы. Композиции по настоящему изобретению содержат липазу, протеазу и амилазу в определенных соотношениях, что обеспечивает благоприятные результаты у пациентов, как, например, у пациентов, которые страдают недостаточностью поджелудочной железы. Кроме того, настоящее изобретение относится к способам применения таких композиций для лечения недостаточности поджелудочной железы.
УРОВЕНЬ ТЕХНИКИ
Пищеварение представляет собой физиологический процесс, с помощью которого поступившая в организм пища расщепляется на легко всасываемые питательные компоненты. После проглатывания пища проходит через различные сегменты желудочно-кишечного тракта, и при этом осуществляется пищеварение, в первую очередь, под действием пищеварительных ферментов. Три группы пищеварительных ферментов, которые важны для этого процесса, включают липазы (для переваривания жира), протеазы (для переваривания белков) и амилазы (для переваривания углеводов).
Переваривание пищи и поглощение питательных компонентов осуществляется в тонком кишечнике. Там проглоченная пища расщепляется под действием пищеварительных ферментов для легкого всасывания. Большая часть пищеварительных ферментов секретируется поджелудочной железой и попадает в тонкую кишку через проток поджелудочной железы.
Поджелудочная железа вырабатывает большое количество экзокринных и эндокринных действующих веществ, требуемых для надлежащего пищеварения, питания и метаболизма. Экзокринная деятельность поджелудочной железы включает секрецию белков, которые действуют в качестве ферментов в тонкой кишке, катализируя гидролиз жира до глицерина и жирных кислот, белков до пептидов и аминокислот, и углеводов до декстринов, дисахаридов и моносахаридов, таких как глюкоза. Экзокринная недостаточность поджелудочной железы (называемая далее по тексту «недостаточностью поджелудочной железы») является результатом снижения функции поджелудочной железы и может быть вызвана целым рядом клинических расстройств. Например, недостаточность поджелудочной железы связана с кистозным фиброзом, хроническим панкреатитом, острым панкреатитом, раком поджелудочной железы и синдромом Швахмана-Даймонда [E.P.DiMagno et al., in The Pancreas: Biology, Pathobiology and Disease, 2d Ed., V.Liang et al., eds., pp. 665-701 (1993)].
У пациентов, страдающих недостаточностью поджелудочной железы, поджелудочной железе не удается выработать и/или секретировать достаточные количества пищеварительных ферментов для поддержания нормального процесса пищеварения, включая переваривание жиров, белков и углеводов. В результате эти пациенты страдают от нарушения поглощения питательных веществ. Клинические проявления недостаточности поджелудочной железы включают спастические боли в животе, вздутие живота, диарею, стеаторею, тошноту и потерю веса.
Недостаточность поджелудочной железы имеется у 89% пациентов, страдающих кистозным фиброзом [D.Borowitz et al., “Use of Fecal Elastase-1 to Identify Misclassification of Functional Pancreatic Status in Patients with Cystic Fibrosis”, J.Pediatr., 145, pp.322-326 (2004)]. Кистозный фиброз является аутосомным рецессивным генетическим расстройством, которое в первую очередь поражает желудочно-кишечную и дыхательную системы [S.M. Rowe et al., “Mechanisms of Disease: Cystic Fibrosis”, N. Engl. J. Med., 352, pp. 1992-2001 (1995)]. Аномальные количества и вязкость слизи, вырабатываемой у пациентов с кистозным фиброзом, препятствуют секреции достаточных количеств ферментов поджелудочной железы. Уменьшенный объем секреции поджелудочной железы ведет к сгущению в протоке поджелудочной железы, препятствуя выходу ферментов и бикарбоната в двенадцатиперстную кишку. В результате пациенты с кистозным фиброзом, у которых имеется недостаточность поджелудочной железы, страдают от ухудшения пищеварения и сталкиваются со значительным нарушением всасывания жиров и белков. Например, у таких пациентов, как правило, всасывается менее 60% поступающего с пищей жира [M. Kraisinger et al., “Clinical Pharmacology of Pancreatic Enzymes in Patients with Cystic Fibrosis and in vitro Performance of Microencapsulated Formulations”, J. Clin. Pharmacol., 34, pp. 158-166 (1994)]. Если не осуществлять лечение заболевания, нарушение пищеварения и всасывания у пациентов с кистозным фиброзом ведет к недостаточности питания, неспособности набирать или сохранять массу тела и уменьшению роста, а также к ухудшению течения хронических гнойных легочных заболеваний. [K. Gaskin et al., "Improved Respiratory Prognosis in CF Patients with Normal Fat Absorption", J. Pediatr., 100, pp. 857-862 (1982); J.M. Littlewood et al., "Control of Malabsorption in Cystic Fibrosis", Paediatr. Drugs, 2, pp. 205-222 (2000)].
В настоящее время стандартная терапия недостаточности поджелудочной железы основана прежде всего на пероральном введении свиной панкрелипазы, содержащей смесь липаз, трипсина, химотрипсина, эластазы и амилаз. Хотя добавки свиных панкреатических ферментов содержат значительные количества амилазы, сообщалось, что пациенты с кистозным фиброзом имеют нормальные уровни амилазы [P.L. Townes et al., “Amylase Polymorphism: Studies of Sera and Duodenal Aspirates in Normal Individuals and in Cystic Fibrosis”, Am. J. Hum. Genet., 28, pp. 378-389 (1976)]. Соответственно считается, что амилаза не играет роли в увеличении переваривания полисахаридов [E. Lebenthal et al., “Enzyme Therapy for Pancreatic Insufficiency: Present Status and Future Needs”, Pancreas, 9, pp. 1-12 (1994)]. Липазный, протеазный и амилазный компоненты добавок свиной поджелудочной железы, как правило, присутствуют в соотношении 1:3,5:3,5.
Добавки ферментов поджелудочной железы, как правило, вводят перорально с пищей. Поскольку эти добавки проходят через среду желудка с низким значением pH, их ферментная активность быстро уменьшается. В результате требуются значительные количества концентрата ферментов (иногда не менее 15 капсул или таблеток за один прием пищи), чтобы гарантировать наличие в проксимальной части кишечника достаточно активных ферментов для помощи при недостаточности поджелудочной железы.
Поскольку протеаза и липаза могут обратимо инактивироваться в кислой среде желудка, к продуктам панкрелипазы были применены технологии растворимых в кишечнике покрытий, с целью поместить ферменты в микрокапсулы или другим способом обработать их защитным кишечным покрытием. Хотя такие кишечные покрытия улучшали комплекс свойств продукта, для достижения благоприятного терапевтического результата по-прежнему требовались большие количества добавок [J.H. Meyer, in Pancreatic Enzymes in Health and Disease, P.G. Lankisch, ed., pp. 71-88 (1991)]. Была внедрена линия продуктов с высоким содержанием панкрелипазы (Ultrase®) с целью уменьшения количества таблеток или капсул, необходимых для лечения недостаточности поджелудочной железы. Однако в 1991 году Cystic Fibrosis Foundation Соединенных Штатов совместно с FDA сообщили о многочисленных случаях фиброзирующей колонопатии у детей с кистозным фиброзом, принимавших такие продукты с высоким содержанием действующих веществ [S.C. Fitzsimmons et al., “High-Dose Pancreatic-Enzyme Supplements and Fibrosing Colonopathy in Children with Cystic Fibrosis”, N. Engl. J. Med., 336, pp.1283-1289 (1997)]. У этих пациентов структуры, вызванные фиброзом ободочной кишки, часто требовали хирургического вмешательства и в некоторых случаях колэктомии.
В качестве средства против уменьшения дневных доз ферментов поджелудочной железы, FDA удалила с рынка продукты с высоким содержанием действующего вещества (определенные как более чем 2500 USP единиц на 1 кг массы тела) [D.S. Borowitz et al., “Use of Pancreatic Enzyme Supplements for Patients with Cystic Fibrosis in the Context of Fibrosing Colonopathy”, J. Pediatr., 127, pp. 681-684 (1995)]. Кроме того, Cystic Fibrosis Foundation Соединенных Штатов совместно с FDA рекомендовали подробное исследование комплексной природы экстрактов свиных ферментов [см. там же]. Группа экспертов по согласованию также рекомендовала исследование альтернативных, устойчивых к действию кислот липаз.
Независимо от того, покрыта ли данная добавка, содержащая ферменты поджелудочной железы, кишечным покрытием или нет, биодоступность таких добавок меняется в широких пределах из-за различий в кислотности кишечника пациентов. В результате для улучшения клинической эффективности ферментных добавок многие пациенты употребляют изменяющие pH лекарственные средства, такие как блокаторы гистаминового-2 рецептора (H2) и ингибиторы протонного насоса (PPI) [P.G. Lankish, "Enzyme Treatment of Exocrine Pancreatic Insufficiency in Chronic Pancreatitis', Digestion, 54 (Supp. 2), pp. 21-29 (1993); D.Y. Graham, "Pancreatic Enzyme Replacement: the Effect of Antacids or Cimetidine", Dig. Dis. Sci., 27, pp. 485-490 (1982); J.H. Saunders et al., "Inhibition of Gastric Secretion in Treatment of Pancreatic Insufficiency", Br. Med. J., 1, pp. 418-419 (1977); H.G. Heijerman et al., "Omeprazole Enhances the Efficacy of Pancreatin (Pancrease) in Cystic Fibrosis", Ann. Inter. Med., 114, pp. 200-201 (1991); M.J. Bruno et al., "Comparative Effects of Adjuvant Cimetidine and Omprazole during Pancreatic Enzyme Replacement Therapy", Dig. Dis. Sci., 39, pp. 988-992 (1994)].
Нестабильность с точки зрения эффективности и фармацевтических свойств, а также недостаточная устойчивость были выявлены в качестве важных факторов, вносящих вклад в слабую реакцию некоторых пациентов на традиционные добавки, содержащие ферменты поджелудочной железы [C.L. Chase et al., "Enzyme Content and Acid Stability of Enteric-Coated Pancreatic Enzyme Products in vitro", Pancreas, 30, pp. 180-183 (2005); D.S. Borowitz et al., J. Pediatr., 127, supra; C.J. Powell et al., "Colonic Toxicity from Pancreatins: a Contemporary Safety Issue", Lancet, 353, pp. 911-915 (1999); E. Lebenthal et al., "Enzyme Therapy for Pancreatic Insufficiency: Present Status and Future Needs", Pancreas, 9, pp. 1-12 (1994); P. Regan et al., "Comparative Effects of Antacids, Cimetidine and Enteric Coating on the Therapeutic Response to Oral Enzymes in Severe Pancreatic Insufficiency", N. Eng. J. Med., 297, pp. 854-858 (1977)]. Эти факторы включают изменения активности ферментов от партии к партии, чувствительность к потере активности через некоторое время при действии солнечного света, тепла или влаги, а также недостаточно определенный профиль нежелательных реакций [D.S. Borowitz et al., J.Pediatr., 127, выше]. Другие факторы, которые усугубляют неэффективность терапии поджелудочной железы, включают разрушение замещающих ферментов желудочным соком и/или имеющимися в просвете кишечника протеазами, асинхронное удаление из желудка ферментных добавок и мясной пищи, а также задержка высвобождения ферментов из препаратов с кишечным покрытием [P.G.Lankish, Digestion, 54 см. выше; P.Regan et al., N. Eng. J. Med., 297, см. выше].
Из-за проблем с эффективностью, стабильностью и биодоступностью, которыми характеризуются стандартные добавки, содержащие панкреатические ферменты, в качестве альтернатив ферментам, полученным из свиней, было предложено применение ферментов, вырабатываемых микроорганизмами. Например, в патенте США № 6051220 описаны композиции, включающие одну или несколько устойчивых к кислотам липаз и одну или несколько устойчивых к кислотам амилаз, причем оба типа ферментов предпочтительно грибкового происхождения. В заявке на патент США 2004/0057944 описаны композиции, включающие липазу Rhizopus delemar, протеазу Aspergillus melleus и амилазу Aspergillus oryzae. В заявке на патент США 2001/0046493 описаны композиции, включающие сшитые кристаллические бактериальные липазы, совместно с грибковыми или растительными протеазами и грибковыми или бактериальными амилазами.
Несмотря на такие разработки, по-прежнему сохраняется потребность в оптимизации лекарственных составов для дальнейшего улучшения как эффективности добавок с ферментами поджелудочной железы, так и соответствия препаратов различным пациентам. Цель получения добавок с ферментами поджелудочной железы, проявляющих максимальную эффективность при наименьших дозировках и отличающихся хорошо известным профилем безопасности, остается очень важной для всех пациентов, страдающих недостаточностью поджелудочной железы, включая пациентов, которые входят в сообщество людей с кистозным фиброзом.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на композиции и способы, предназначенные для лечения состояний, включающих недостаточность поджелудочной железы. В соответствии с предпочтительным вариантом осуществления, композиции по настоящему изобретению характеризуются кристаллами сшитой микробной липазы, микробной протеазой и микробной амилазой в соотношении примерно 1,0:1,0:0,15 единиц ферментной активности USP. Преимущественно эти композиции характеризуются стабильными ферментными компонентами, что, в свою очередь, гарантирует in vivo высвобождение действующего фермента в желудочно-кишечный тракт и тем самым допускает эффективные режимы лечения недостаточности поджелудочной железы с низкими дозировками.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
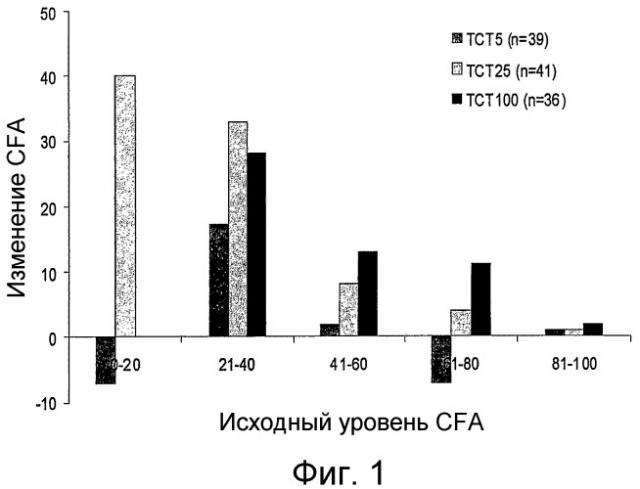
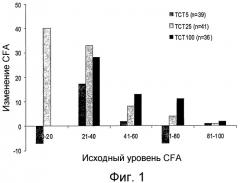
На фиг.1 показано изменение среднего коэффициента поглощения жира (“CFA”) по сравнению с исходным уровнем у пациентов, которым вводят композиции по настоящему изобретению во время фазы 2 исследования.
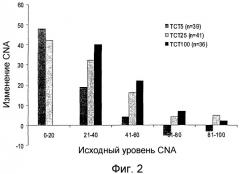
На фиг.2 показано изменение среднего коэффициента поглощения азота (“CNA”) по сравнению с исходным уровнем у пациентов, которым вводят различные композиции по настоящему изобретению во время фазы 2 исследования.
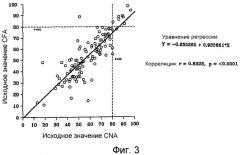
На фиг.3 показана корреляция между коэффициентом поглощения жира (“CFA”) и коэффициентом поглощения азота (“CNA”) в начальный период у пациентов, которым вводят композиции по настоящему изобретению во время фазы 2 исследования.
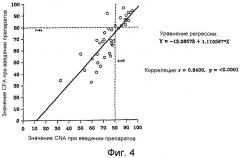
На фиг.4 показана корреляция между коэффициентом поглощения жиров (“CFA”) и коэффициентом поглощения азота (“CNA”) в период введения препаратов у пациентов, которым вводят композиции по настоящему изобретению во время фазы 2 исследования.
На фиг.5 показана корреляция между разностями коэффициента поглощения жиров (“CFA”) и коэффициента поглощения азота (“CNA”) во время введения препаратов и во время начального периода у пациентов, которым вводят композиции по настоящему изобретению во время фазы 2 исследования.
На фиг.6 показано изменение среднего коэффициента поглощения жиров (“CFA”) по сравнению с исходным уровнем у пациентов с кистозным фиброзом, которым вводят различные дозы композиций по настоящему изобретению во время фазы 1 исследования.
На фиг.7 показано изменение среднего коэффициента поглощения азота (“CNA”) по сравнению с исходным уровнем у пациентов, которым вводят различные дозы композиций по настоящему изобретению во время фазы 1 исследования.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к открытию, согласно которому композиции, включающие липазу, протеазу и амилазу в соотношении примерно 1,0:1,0:0,15 единиц ферментной активности USP, являются эффективными для лечения состояний, включающих недостаточность поджелудочной железы. Это уникальное соотношение между липазой, протеазой и амилазой делает возможным лечение таких состояний при терапевтических режимах с низкими дозировками, которые невозможны при применении стандартных добавок со свиными панкреатическими ферментами. Кроме того, данное соотношение между липазой, протеазой и амилазой позволяет избежать высокой концентрации протеазы, которая, как полагают, несет ответственность за фиброзирующую колонопатию при применении стандартных ферментных добавок [D.S. Borowitz et al., J. Pediatr., 127, см. выше].
Согласно предпочтительному варианту осуществления композиции по настоящему изобретению включают кристаллы сшитой микробной липазы, микробную протеазу и микробную амилазу в соотношении примерно 1,0:1,0:0,15 единиц ферментной активности USP.
Определения
Следует понимать, что определенные ниже термины имеют следующие значения, если не указано иное:
Термин «аморфный» относится к любому состоянию, отличному от кристаллического или полукристаллического состояния. Аморфные вещества включают аморфные твердые вещества и жидкости.
Термин «кристалл» или «кристаллический» относится к одной из форм вещества в твердом состоянии, которая содержит атомы, расположенные в виде периодически повторяющейся в трех измерениях структуры [см., например, Barrett, Structure of Methals, 2nd ed., (1952)]. Кристаллы или кристаллическая форма фермента отличаются от его аморфных или полукристаллических форм. Кристаллы демонстрируют характерные черты, включая структуру пространственной решетки, характерные формы и оптические свойства, такие как, например, показатель преломления.
Термин «полукристаллический» относится к веществу в твердом состоянии, имеющему как кристаллические, так и аморфные области.
Термин «субъект», «пациент» или «индивидуум» относится к любому млекопитающему, включая любое классифицированное животное само по себе, в т.ч. людей и других приматов.
Термин «нарушение пищеварения» относится к ухудшению расщепления компонентов пищи (таких как жиры, белки и углеводы) до их составных частей, которые могут всасываться в пищеварительном тракте (моно-, ди- или олигосахаридов, аминокислот, олигопептидов, жирных кислот и моноглицеридов). Нарушение пищеварения может быть следствием нескольких состояний, включая недостаточность поджелудочной железы.
Термин «нарушение всасывания» относится к ухудшению всасывания переваренных компонентов пищи, в том числе витаминов и микроэлементов из тонкого кишечника или толстой кишки. Нарушение всасывания может являться следствием нарушения поглощения в слизистых оболочках выстилающих кишечник тканей или отдельных аномалий пищеварения. Нарушение всасывания в кишечнике может наблюдаться для многих компонентов пищи или для конкретных макрокомпонентов, а именно жиров, белков или углеводов, а также для микрокомпонентов, таких как кальций, магний, железо и витамины. Нарушение всасывания может являться следствием нескольких состояний, включая недостаточность поджелудочной железы. Нарушение всасывания белков называют «азотореей». Нарушение всасывания жиров называют «стеатореей».
Термин «липаза» относится к ферменту, который катализирует гидролиз (т.е. разделение гидроксильных групп и атомов водорода соединений на фрагменты за счет присоединения воды) липидов до глицерина и простых жирных кислот. Катализируемая ферментом реакция, как правило, требует присутствия ионов кальция (Ca2+). Секретируемые поджелудочной железой липазы исключительно важны для переваривания жиров (триглицеридов) в верхней петле тонкого кишечника. Согласно предпочтительному варианту осуществления липазы, применимые в композициях и способах по настоящему изобретению, не являются липазами, вырабатываемыми поджелудочной железой, т.е. они не выделены из ткани поджелудочной железы человека или животных. Согласно более предпочтительному варианту осуществления настоящего изобретения применяемые липазы являются микробными липазами. Согласно еще более предпочтительному варианту осуществления настоящего изобретения применяемые липазы являются бактериальными липазами. Бактериальные липазы включают, например, липазу Pseudomonas и/или липазу Burkholderia.
Микробные липазы могут быть выделены из природных микробиологических источников или они могут представлять собой рекомбинантные микробные липазы, получаемые по технологии рекомбинантной ДНК с применением подходящей клетки-хозяина, выбранной из клеток-хозяев любых бактерий, дрожжей, грибков, растений, насекомых или млекопитающих, предпочтительно бактерий в культуре. Рекомбинантные липазы охватывают или закодированы нуклеиновыми кислотами из природной последовательности липаз. Далее, рекомбинантные липазы включают аминокислотную последовательность, которая гомологична или в основном идентична природной последовательности, а также липазы, закодированные нуклеиновыми кислотами, которые гомологичны или в основном идентичны природным нуклеиновым кислотам, кодирующим липазы. С другой стороны, липазы, применимые в композициях и способах по настоящему изобретению, могут быть синтезированы по стандартным методикам синтеза пептидов.
Термин «протеаза» относится к протеиназе, протеолитическому ферменту или пептидазе, которая представляет собой фермент, катализирующий расщепление внутренних амидных пептидных связей в белке. Конкретно, протеазы катализируют превращение белков в составляющие их аминокислоты путем расщепления амидных связей между карбоксильной группой одной аминокислоты и аминогруппой другой. Протеазы, как правило, идентифицируют по их каталитическому типу, например пептидазы аспарагиновой кислоты, цистеин (тиол) пептидазы, металлопептидазы, серин пептидазы, треонин пептидазы, щелочные или полущелочные протеазы, нейтральные, а также пептидазы с неизвестным механизмом катализа (см. http://merops.sanger.ac.uk). Согласно предпочтительному варианту осуществления протеазы, применяемые в композициях и способах по настоящему изобретению, не являются протеазами, вырабатываемыми поджелудочной железой, т.е. их не выделяют из ткани поджелудочной железы человека или млекопитающих. Согласно более предпочтительному варианту осуществления настоящего изобретения протеазы представляют собой микробные протеазы. Согласно еще более предпочтительному варианту осуществления настоящего изобретения протеазы представляют собой грибковые протеазы. Согласно еще одному варианту осуществления настоящего изобретения протеаза представляет собой протеазу Aspergillus melleus.
Микробные протеазы могут быть выделены из природных микробиологических источников, или они могут представлять собой рекомбинантные микробные протеазы, получаемые по технологии рекомбинантной ДНК с применением подходящей клетки-хозяина, выбранной из любых клеток-хозяев бактерий, дрожжей, грибков, растений, насекомых или млекопитающих, предпочтительно грибков, в культуре. Рекомбинантные протеазы охватывают или закодированы нуклеиновыми кислотами из природной последовательности протеаз. Далее, рекомбинантные протеазы включают аминокислотную последовательность, которая гомологична или в основном идентична природной последовательности, а также протеазы, закодированные нуклеиновыми кислотами, которые гомологичны или в основном идентичны природным нуклеиновым кислотам, кодирующим протеазы. С другой стороны, протеазы, применимые в композициях и способах по настоящему изобретению, могут быть синтезированы по стандартным методикам синтеза пептидов.
Термин «амилаза» относится к ферменту, который вырабатывается в поджелудочной железе, а также в слюнных железах у людей, но не у всех млекопитающих. Амилаза человеческой слюны известна как птиалин. Амилаза является основным пищеварительным ферментом, ответственным за переваривание углеводов, например полисахаридов, в тонком кишечнике, путем превращения двух компонентов крахмала (амилозы и амилопектина) в простые сахара. Более конкретно, амилаза гидролизует крахмал, гликоген и декстрин с образованием глюкозы, мальтозы и предельных декстринов. Клинически уровни амилазы в крови часто повышены при состоянии острого и иногда хронического панкреатита. Термин «амилазы, не вырабатываемые поджелудочной железой» относится к амилазам, которые не выделены из ткани поджелудочной железы человека или животных. Согласно более предпочтительному варианту осуществления настоящего изобретения, амилазы являются микробными амилазами. Согласно еще более предпочтительному варианту осуществления настоящего изобретения амилаза представляет собой грибковую амилазу. Согласно еще одному варианту осуществления настоящего изобретения амилаза представляет собой амилазу Aspergillus и предпочтительно амилазу Aspergillus oryzae.
Микробные амилазы могут быть выделены из природных микробиологических источников или они могут представлять собой рекомбинантные микробные амилазы, получаемые по технологии рекомбинантной ДНК с применением подходящей клетки-хозяина, выбранной из любых клеток-хозяев бактерий, дрожжей, грибков, растений, насекомых или млекопитающих, предпочтительно грибков, в культуре. Рекомбинантные амилазы охватывают или закодированы нуклеиновыми кислотами из природной последовательности амилаз. Далее, рекомбинантные амилазы включают аминокислотную последовательность, которая гомологична или в основном идентична природной последовательности, а также амилазы, закодированные нуклеиновыми кислотами, которые гомологичны или в основном идентичны природным нуклеиновым кислотам, кодирующим амилазы. С другой стороны, амилазы, применимые в композициях и способах по настоящему изобретению, могут быть синтезированы по стандартным методикам синтеза пептидов.
Термины «терапевтически эффективная доза» или «терапевтически эффективное количество» относятся к такому количеству композиции, которое приводит к предотвращению, отсрочке появления симптомов или облегчению тяжести симптомов состояния, которое будет подвергаться лечению. Терапевтически эффективное количество является таким количеством, которого достаточно для лечения, профилактики, уменьшения тяжести, отсрочки наступления или уменьшения частоты проявления одного или нескольких симптомов состояния, которое будет подвергаться лечению. Состояния, которые могут подвергаться лечению с применением композиций по настоящему изобретению, включают, например, недостаточность поджелудочной железы, нарушение всасывания и нарушение пищеварения.
Термин «единица USP» относится к единице ферментной активности фармакопеи Соединенных Штатов, имеющейся в средстве или композиции. Одна единица USP липазы, протеазы или амилазы определена в Pancrelipase, USP, U.S. Pharmacopeia National Formulary, USP 24, pp. 1254-1255 (2000). В этом источнике раскрыты способы анализа липазы, протеазы и амилазы, причем они включены в настоящую заявку с помощью ссылки.
Характеристики композиций настоящего изобретения
Преимущественно, композиции согласно настоящему изобретению улучшают всасывание жира, белка и крахмала у пациентов, страдающих такими состояниями, как, например, недостаточность поджелудочной железы, что ведет к улучшению снабжения питательными веществами и роста. Композиции сохраняют высокие уровни специфической активности в кислотно-пепсиновой среде. Это происходит потому, что их ферментные компоненты противостоят кислой среде верхней части желудочно-кишечного тракта, в т.ч. низким значениям pH желудка и высоким уровням протеазы в желудочно-кишечном тракте, что дает ферментам возможность достичь кишечника в активной форме. В результате композиции можно вводить в меньших количествах за одну дозировку и с помощью меньшего количества приемов по сравнению с добавками, содержащими свиные панкреатические ферменты. Это, в свою очередь, обеспечивает лучшее согласие пациентов с условиями лечения.
Кроме того, композиции по настоящему изобретению можно вводить субъектам без необходимости применения кишечного покрытия или добавления средств, подавляющих действие кислоты. Это происходит потому, что полученные из микроорганизмов ферментные компоненты, применяемые в различных вариантах осуществления композиций по настоящему изобретению, более устойчивы к действию кислоты в желудке, чем свиные панкреатические ферменты.
Липазный компонент
Липазный компонент композиций по настоящему изобретению предпочтительно представляет собой микробную липазу. Более предпочтительно, применяется бактериальная липаза, а не липаза грибкового или растительного происхождения.
Предпочтительно липаза является такой липазой, которая стабильна в среде с кислотным значением pH и/или которая устойчива к протеолитическому разрушению. Кроме того, липаза может применяться в форме, которая увеличивает устойчивость к кислотному pH и/или устойчивость к протеолитическому разрушению. В этом случае липаза предпочтительно применяется в форме сшитых кристаллов. Любая из описанных выше липаз может применяться для образования сшитого кристаллического липазного компонента композиций по настоящему изобретению.
Кристаллизация липазы
Кристаллы липазы, применимые в композициях по настоящему изобретению, могут быть выращены с применением стандартных способов, таких как кристаллизация в замкнутом объеме. См., например, патент США 6541606. С другой стороны, кристаллы липазы могут быть выращены регулируемым осаждением белка из водного раствора или водного раствора, содержащего органические растворители. См., например, патент США 5618710 и заявку на патент США 2003/0017144. Специалист в данной области техники поймет, что условия, которыми необходимо управлять во время кристаллизации, включают, например, скорость испарения растворителя, присутствие подходящих дополнительных растворителей и буферных растворов, pH и температуру.
Кристаллы липазы могут быть получены за счет выбора сочетания липазного фермента, подлежащего кристаллизации, с подходящим растворителем или водным растворителем, содержащим подходящие осаждающие средства, такие как соли или органические реагенты. Растворитель смешивают с липазой и необязательно подвергают перемешиванию при температуре, которая, как определено экспериментально, подходит для стимулирования кристаллизации и приемлема для сохранения стабильности и активности белка. Растворитель может необязательно включать дополнительные растворенные вещества, такие как двухвалентные катионы, кофакторы или хаотропы, а также буферные компоненты для регулирования pH. Необходимость в дополнительных растворенных веществах для содействия кристаллизации, а также их концентрации могут быть определены экспериментально. Для способа в промышленном масштабе регулируемое осаждение, приводящее к кристаллизации, может быть наилучшим образом проведено при применении простой комбинации белка, осадителя, дополнительных растворенных веществ, и, необязательно, буферов в периодическом процессе. С другой стороны, также могут применяться лабораторные способы кристаллизации, такие как диализ или диффузия паров. McPherson et al., Methods Enzymol., 114, pp. 112-120 (1985) и Gilliland, J. Crystal Growth, 90, pp. 51-59 (1988) включают обширный перечень подходящих условий, описанных в литературе по кристаллизации. Иногда несовместимость между средой кристаллизации и средством для сшивания может потребовать замены буфера или растворителя перед началом сшивания.
Липаза кристаллизуется при соблюдении ряда условий, включая pH в диапазоне приблизительно 4-9. Осадители, применимые для получения липазного компонента композиций по настоящему изобретению, включают изопропанол, трет-бутанол, 2-метил-2,4-пентандиол (MPD), сульфат аммония, хлорид натрия, хлорид магния и другие соединения, известные специалистам в данной области техники. Применимые соли включают двухвалентные и одновалентные катионы и их соли.
Кристаллы липазы, применимые в композициях по настоящему изобретению, могут иметь наибольший размер от примерно 0,01 мкм до примерно 500 мкм, или от примерно 0,1 мкм до примерно 50 мкм, или от примерно 0,1 мкм до примерно 10 мкм. Они могут иметь форму, выбранную из группы, состоящей из сфер, игл, стержней, пластин, как, например, шестиугольных и квадратных, ромбоидов, кубов, бипирамид и призм.
Сшивание кристаллов липазы
Если кристаллы липазы были выращены в подходящей среде, их можно подвергнуть сшиванию. Сшивание приводит к стабилизации кристаллической решетки за счет введения ковалентных связей между молекулами белка, из которых состоит кристалл. Это делает возможным перенесение фермента в несвойственную ему среду, что, в ином случае, для данного фермента могло бы быть несовместимо с существованием кристаллической решетки или интактного фермента.
В результате сшивания кристаллов липазы могут быть изменены устойчивость фермента (например, в отношении pH, температуры, механическая и/или химическая устойчивость), профиль активности липазы в зависимости от pH, растворимость, однородность размера и объема кристаллов, скорость высвобождения липазы из кристалла и/или размер и форма промежутков между отдельными молекулами фермента, из которых состоит кристаллическая решетка.
Сшивание преимущественно осуществляют таким образом, чтобы образующиеся сшитые кристаллы содержали липазу, которая проявляет не менее примерно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,7% или 99,9% или более ферментной активности по сравнению с немодифицированной липазой. Устойчивость может быть увеличена не менее чем на примерно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 250%, 300% или более по сравнению с немодифицированной липазой. Устойчивость может быть измерена в условиях хранения, как, например, устойчивость к pH, устойчивость к действию температур, устойчивость к действию протеаз, в т.ч. желудочно-кишечных протеаз и Pronase™, устойчивость к растворению, или же, например, биологическая устойчивость in vivo.
В некоторых случаях сшивание кристаллов липазы замедляет переход липазы в раствор, эффективно иммобилизуя молекулы фермента в микрокристаллических частицах. При действии пускового механизма в среде, окружающей сшитые кристаллы липазы, например, при условиях применения, а не хранения, кристаллы липазы растворяются, высвобождая полипептиды липазы и/или увеличивая активность липазы. Скорость растворения может управляться, например, одним или несколькими из следующих факторов: степень сшивания, продолжительность времени действия реагента для сшивания на кристаллы липазы, скорость добавления реагента для сшивания к кристаллам липазы, природа сшивающего агента, длина сшивающего агента, pH, температура, присутствие сульфгидрильных реагентов, таких как цистеин или глутатион, площадь поверхности кристаллов сшитой липазы, размер кристаллов сшитой липазы или форма кристаллов сшитой липазы.
Сшивание кристаллов липазы может быть осуществлено с применением одного реагента для сшивания или их комбинации, включая полифункциональные реагенты, в т.ч. бифункциональные реагенты, одновременно (параллельно) или последовательно. В различных вариантах осуществления под действием пускового механизма окружающей среды или через определенный промежуток времени происходит уменьшение количества или ослабление сшивающих агентов между молекулами в кристаллах липазы, что ведет к растворению липазы или высвобождению активного вещества. С другой стороны, сшивающие агенты могут разрываться в месте прикрепления к молекулам, что ведет к растворению белка или высвобождению активного вещества. См., например, патенты США №№ 5976529 и 6140475. Сшивание может быть проведено в соответствии с любой стандартной методикой сшивания.
Итоговая концентрация сшивающих агентов в сшитых кристаллах липазы должна находиться в пределах от примерно 0,001 нМ до примерно 300 нМ, предпочтительно от примерно 1,0 нМ до примерно 50 нМ, наиболее предпочтительно от примерно 2,0 нМ до примерно 5,0 нМ.
Согласно предпочтительному варианту осуществления настоящего изобретения, сшивающий реагент представляет собой бис(сульфосукцинимидил)суберат (“BS3”). Другие применимые сшивающие реагенты включают глутаровый альдегид, янтарный альдегид, октандиальдегид и глиоксаль. Дополнительные полифункциональные сшивающие реагенты включают галогентриазины, например цианурхлорид; галогенпиримидины, например 2,4,6-трихлор/бромпиримидины; ангидриды или галогенангидриды алифатических или ароматических моно- или дикарбоновых кислот, например малеиновый ангидрид, (мет)акрилоилхлорид, хлорацетилхлорид; N-метилольные соединения, например N-метилолхлорацетамид; диизоцианаты или диизотиоцианаты, например фенилен-1,4-диизоцианат и азиридины. Другие сшивающие реагенты включают эпоксиды, как, например, диэпоксиды, триэпоксиды и тетраэпоксиды. Для ознакомления с представительным перечнем других доступных сшивающих реагентов см., например, каталог Pierce Chemical Company, издание 2003-2004 гг. Другие примеры реагентов для сшивания включают: диметил-3,3'-дитиобиспропионимидат·HCl (DTBP); дитиобис(сукцинимидилпропионат) (DSP); бисмалеимидогексан (BMH); 1,5-дифтор-2,4-динитробензол (DFDNB); диметилсуберимидат·2HCl (DMS); дисукцинимидилглутарат (DSG); дисульфосукцинимидилтартрат (сульфо-DST); 1-этил-3-[3-диметиламинопропил]карбодиимидгидрохлорид (EDC); этиленгликольбис[сульфосукцинимидилсукцинат] (сульфо-EGS); сложный эфир N-[γ-малеимидобутирилокси]сукцинимида (GMBS); N-гидроксисульфосукцинимидил-4-азидобензоат (сульфо-HSAB); сульфосукцинимидил-6-[α-метил-α-(2-пиридилдитио)толуамидо]гексаноат (сульфо-LC-SMPT); бис-[β-(4-азидосалициламидо)этил]дисульфид (BASED); и NHS-PEG-винилсульфон (NHS-PEG-VS).
Кроме этого, могут применяться реагенты, осуществляющие обратимое сшивание. Некоторые обратимо сшивающие реагенты являются полифункциональными сшивающими реагентами, которые включают пусковой механизм в виде отдельной группы. Реакционноспособная функциональная группа вовлечена в связыв