Способ лечения глубоких ран
Иллюстрации
Показать всеИзобретение относится к медицине, а именно - к комбустиологии и хирургии. Способ включает предварительную очистку раны и нанесение на раневую поверхность фибробластов. Фибробласты распределены в гелеобразной массе. При этом гелеобразная масса содержит бессывороточную питательную среду и метилцеллюлозу в количестве 1,0-3,0 мас.%. Способ повышает длительность сохранения жизнеспособности нанесенных на рану клеток, позволяет избежать возникновение аллергической реакции. 4 з.п. ф-лы, 5 ил., 1 табл.
Реферат
Предлагаемое изобретение относится к медицине, в частности к комбустиологии и хирургии, и может быть использовано для лечения глубоких ран различного происхождения, в том числе ожоговых.
Известен способ лечения ран с применением культур клеток (Патент RU2023424, опубл. 30 ноября 1994 г.), заключающийся в том, что после хирургической обработки рану покрывают культурой клеток фибробластов человека, а после приживления фибробластов производят аутодермопластику, для которой используют расщепленный сетчатый лоскут. Недостаток этого способа состоит в том, что клетки культуры фибробластов, внесенные в рану, быстро (в течение суток) разрушаются и гибнут под действием отделяемого раны.
Известен также способ, включающий в себя применение фибробластов в коллагеновом геле (Bell 1983, Journal Inv.Dermatology, v.81, p.2-10), заключающийся в том, что фибробласты вносят в коллагеновый гель, а затем помещают на рану. Недостаток этого способа состоит в том, что такая система также быстро (в течение суток) разрушается ферментами раны.
Ряд других способов предполагает использование культуры клеток фибробластов или эпидермоцитов, выращенных на различного вида подложках синтетического или природного происхождения (Давыдова и др., 2007, Клеточные технологии в биологии и медицине, №4).
Проведенные нами исследования по изучению судьбы клеток на ранах показали, что клетки, выращенные на подложках биологического и синтетического происхождения, при наложении их на раневую поверхность часто гибнут уже в течение первых часов после наложения их на рану, что объясняется незащищенностью вносимых клеток от воздействия ферментов и цитотоксических веществ раны.
Задача, которая возникла в связи с этим обстоятельством, состояла в разработке способа, позволяющего сохранить жизнеспособность нанесенных на рану клеток в течение, по крайней мере, 2-3 суток, а также в создании трехмерного субстрата для ран в виде геля, простого в изготовлении и пригодного для использования в качестве среды для переноса клеток на рану.
Поставленная задача решена тем, что предложен способ лечения глубоких ран, включающий нанесение клеток фибробластов или эпидермоцитов на раневую поверхность, отличающийся тем, что, согласно изобретению, клетки наносят распределенными в гелеобразной массе, состоящей из, по меньшей мере, питательной среды для культивирования животных клеток и метилцеллюлозы в количестве 1,0-3,0 мас.%.
В качестве питательной среды можно брать любую питательную среду, подходящую для культивирования животных клеток, в том числе и минимальную, например минимальную среду Дальбекко, ИГЛА, F-12, 199.
В случае проведения аутодермопластики, включающей наложение расщепленного сетчатого лоскута кожи, клетки, распределенные в вышеупомянутой гелеобразной массе, наносят поверх сетчатого лоскута кожи.
При необходимости поверх нанесенной гелеобразной массы с распределенными в ней клетками дополнительно накладывают неадгезионное к раневой поверхности, перфорированное раневое покрытие на основе полисахаридов растительного происхождения, например типа "Биокол", или синтетических материалов, например типа «Парапран».
В гелеобразную массу с клетками можно дополнительно вносить сыворотку в концентрации до 5 мас.%, или коллаген в концентрации 0,01-0,05 мас.%, или пектин в концентрации 0,1-0,2 мас.%, или желатин в концентрации 0,1-0,2 мас.%, или смесь этих компонентов в любом сочетании и соотношении в суммарной концентрации 0,1-0,2 мас.%,
Сущность предложенного способа основана на следующем.
Поскольку в гелях из коллагена и других животных субстратов при внесении в рану наблюдается их разрушение ферментами раны с последующей быстрой гибелью клеток, и возможны аллергические реакции, была изучена возможность применения для защиты клеток в ране небелковых субстратов - различных полисахаридов растительного происхождения: альгината, метилцеллюлозы, пектина и каррагинана. Кроме того, в качестве контроля в опытах использовали гель поливинилового спирта.
Для проведения экспериментов были взяты растительные препараты, образующие гелеподобную массу (далее гель) в водных растворах. В процессе исследования выяснялось влияние этих веществ на клетки фибробласты в культуре.
Для проведения этого эксперимента в качестве основы брали минимальную среду Дальбекко (ДМЕМ) производства компании «Sigma», в которую вносили исследуемые вещества и фибробласты в количестве 40 тыс. кл/мл, которые культивировали на чашках Петри в течение 48 часов.
Результаты исследований приведены в таблице.
| Таблица | |||||
| Вещество | Альгинат натрия 2% | Метилцеллюлоза 2% | Пектин 2% | Каррагинан 1% | Поливиниловый спирт |
| Морфология клеток в культуре через 48 часов после посева | Клетки округлой формы без адгезии ко дну культурального пластика | Клетки распластаны, обычной формы, без видимых изменений | Клетки округлой формы, рост слабый | Рост клеток в виде гроздьев | Роста клеток не наблюдается, множество разрушенных, гибнущих клеток |
При этом было показано, что фибробласты в питательной среде DMEM без содержания эмбриональной телячьей сыворотки (Fetal Bovine Serum characterized, HyClone), которую обычно добавляют в обязательном порядке в питательную среду, не обладают ростовой активностью. Однако если добавить в ростовую среду водный раствор метилцеллюлозы, то фибробласты растут и размножаются также как при добавлении ростовой сыворотки.
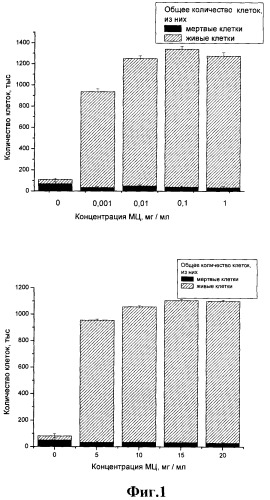
Для изучения зависимости ростовой и пролиферативной активности фибробластов в бессывороточной питательной среде DMEM с добавлением метилцеллюлозы в различных концентрациях был проведен эксперимент. Тестируемые концентрации метилцеллюлозы составляли: 0,001%; 0,01%; 0,1%; 0%; 0,5%; 1%; 1,5%; 2%. Посев клеток проводили в чашки Петри площадью 9,9 см2. Посевная плотность клеток составляла 50 тыс/см2. Подсчет клеток проводили через 48 часов культивирования с помощью камеры Горяева, после окраски клеток трипановым синим.
Полученные результаты зависимости количества клеток фибробластов от концентрации метилцеллюлозы в среде DMEM, не содержащей сыворотки, представлены в виде диаграмм на фиг.1.
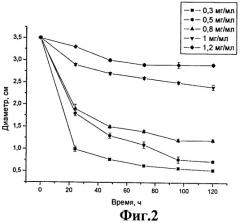
На фиг.2 представлен график зависимости диаметра контракционного коллагенового диска от концентрации метилцеллюлозы в присутствии фибробластов.
В качестве контракционного (сжимаемого) диска использовали коллагеновый гель в концентрации 0,5 мг/мл, приготовленный на среде ДМЕМ, в который вносили метилцеллюлозу в концентрации 0,3 мг/мл; 0,5 мг/мл; 0,8 мг/мл; 1 мг/мл и 1,2 мг/мл и культуру клеток фибробластов человека, которые добавляли в готовый гель в концентрации из расчета 50 тыс/см2 чашки Петри. Коллагеновый гель с клетками помещали в чашки Петри диаметром 3,5 см. Диаметр контракционного диска измеряли в сантиметрах. Показания снимались каждые 24 часа. График зависимости контракции коллагенового диска представлен на фиг.2.
Как видно из представленных на фиг.2 данных, степень контракции диска зависит от количества метилцеллюлозы.
Таким образом, был установлен факт размножения клеток фибробластов в бессывороточной среде ДМЕМ в присутствии метилцеллюлозы и факт предотвращения контракции коллагенового геля in vitro.
Для изучения выживаемости в ране вносимых в нее клеток были проведены эксперименты на мышах-самцах (16 особей) линии SHK, массой ~35 г, у которых после обработки операционного поля под общей анестезией (внутрибрюшинное введение 1% эмульсии пропофола, средняя доза 0,5 мл на 35 гр. веса животного), на спине наносили 2 раны размером 1×1 см симметрично друг другу. На одну рану накладывали выращенные на подложке из фторкаучука (80%) и метилцеллюлозы (20%) фибробласты (180-200 тыс/см2) (вместе с этой подложкой), на другую рану накладывали гель, приготовленный на среде ДМЕМ, содержащий фибробласты эмбрионов мышей, несущих ген зеленого флюоресцентного белка (GFP), в количестве 180-200 тыс/мл и имеющий следующий состав:
а) метилцеллюлоза в концентрации 15 мг/мл;
или б) коллаген в конечной концентрации 0,05 мг/мл, смешанный с метилцеллюлозой в концентрации 15 мг/мл.
Для предотвращения испарения рану покрывали пленочным покрытием типа "Биокол" (ТУ 939370=001-23431671). Наблюдение проводили 3-5 дней.
За судьбой фибробластов, помещенных в рану, наблюдали визуально с помощью микроскопа «Axiovert-200», т.к. синтезируемый ими зеленый белок дает яркую зеленую флюоресценцию при использовании ультрафиолетового освещения.
Эксперимент показал длительное (до 3 суток) сохранение интенсивности свечения зеленого флюоресцирующего белка, продуцируемого фибробластами, помещенными в рану в геле как содержащем только метилцеллюлозу, так и содержащем коллаген и метилцеллюлозу, что подтверждает длительное сохранение жизнеспособности фибробластов. В то же время в ране, покрытой подложкой с фибробластами, напротив, обнаружены только следы клеток без сохранения свечения, что подтверждает их гибель под действием содержимого раны уже в течение первых часов.
Это подтверждается фотографиями (при увеличении ×400) отпечатков на стекле содержимого раны через 24 часа после наложения на рану геля с фибробластами на основе метилцеллюлозы и пленки «Биокол» поверх геля (фиг.3).
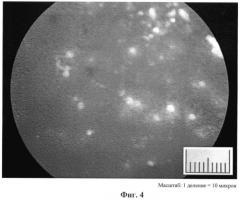
В качестве контроля представлена фотография (фиг.4) (при увеличении ×400) отпечатков на стекле содержимого раны через 24 часа после наложения на рану подложки из фторкаучука (80%) и метилцеллюлозы (20%) с фибробластами (180-200 тыс/см2).
Как видно из фиг.3, отмечается свечение множества клеток, что подтверждает сохранение их жизнеспособности, в то время как на фиг.4 светятся только единичные клетки.
На фиг.5 представлена фотография (при увеличении ×400) фибробластов, помещенных в рану в геле, содержащем коллаген и метилцеллюлозу, которая также подтверждает сохранение жизнеспособности клеток через сутки после их помещения в рану.
В ограниченных клинических наблюдениях на больных с ожоговыми и травматическими ранами также установлено преимущество применения фибробластов, помещенных в гель из питательной среды и метилцеллюлозы, перед применением клеток, размещенных на подложке из латекса фторкаучука (80%) и метилцеллюлозы (20%) или коллагена (0,1%). Это выразилось, прежде всего, в экономии времени и возможности применения процедур по нанесению фибробластов на рану в любых условиях, а также в улучшении регенеративных процессов в ране, что связано с большей длительностью существования клеток фибробластов в гелеобразной массе и их длительным стимулирующим влиянием на репаративные процессы.
Применение геля, содержащего метилцеллюлозу, позволяет включать в него различные вещества, влияющие на заживление (полисахариды, антисептики, ростовые факторы).
Способ апробирован в клинических условиях на кафедре термических поражений, ран и раневых инфекций Российской медицинской Академии последипломного образования (РМАПО) на базе ожогового центра 36-ой Городской клинической больницы г.Москвы на больных с глубокими ожоговыми ранами, требующими хирургического лечения для восстановления целостности кожных покровов. Практически лечение осуществляют следующим образом.
Перед наложением гелеобразной массы с клетками (фибробластами или эпидермоцитами) проводят хирургическую обработку раны в объеме некрэктомии и проводится аутодермопластика сетчатым кожным лоскутом.
После чего наносят гелеобразную массу с фибробластами, содержащую метилцеллюлозу, которую, при необходимости, покрывают пленкой типа «Парапран» (ТУ 9393-011=52708501) или «Биокол» (ТУ 939370=001-23431671).
ПРИМЕР 1.
Больной Трушков К.В. 28 лет. Диагноз: Термический (пламенем) ожог обеих верхних конечностей, задней поверхности туловища II-III АБ степени 32% поверхности тела (IIIБ 16%). Травма от 08.06.08 г.Поступил в отделение 08.06.08 г. На 9 сутки с целью уменьшения интоксикации выполнена хирургическая некрэктомия в области ожоговых ран на площади 16% поверхности тела. Через 7 дней произведено тангенциальное иссечение ран на этой же площади с одномоментной аутодермопластикой перфорированным аутолоскутом с коэффициентом увеличения 1:4 и с нанесением поверх аутолоскута геля, содержащего минимальную среду Дальбекко и метилцеллюлозу в количестве 1,0%, в котором распределены культивированные фибробласты, и поверх геля - раневого покрытия «Парапран».
На перевязке через трое суток после операции отмечена начавшаяся активная эпителизация ячеек трансплантатов, которая завершилась на 10 сутки.
ПРИМЕР 2.
Больной Паутов К.Г. 49 лет. Диагноз: Термический (пламенем) ожог головы, шеи, туловища верхних и нижних конечностей I-II-III АБ степени 41% поверхности тела, IIIБ - до 2% поверхности тела. Травма от 22.06.08 г. Поступил в отделение 23.06.08 г. На 2 день после поступления произведен туалет (дебризинг) ожоговых ран с удалением обрывков эпидермиса на всей раневой поверхности. На рану IIIАБ степени на площади 25% поверхности тела нанесен гель, содержащий минимальную среду ИГЛА и метилцеллюлозу в количестве 1,5%, в котором были распределены культивированные фибробласты, и поверх геля - раневое покрытие «Биокол». Через 3 дня во время первой перевязки после удаления раневого покрытия на раневой поверхности отмечены признаки начавшейся эпителизации ран. Раны была вновь укрыта раневым покрытием «Биокол» для предотвращения инфицирования и травматизации, и создания условий влажной среды.
Во время последующих перевязок признаков нагноения ран не отмечено. Полная эпителизация ран завершилась на 18 сутки после травмы.
ПРИМЕР 3.
Больная Новикова Т.А. 54 года. Диагноз: Термический (кипятком) ожог левого бедра и голени II-III АБ степени 10% поверхности тела (IIIБ - 5% п.т.). Травма от 30.09.07 г. Поступила в отделение 06.10.07 г. На 5 сутки после поступления выполнено тангенциальное иссечение гранулирующих ран с одномоментной аутодермопластикой на площади 5% поверхности тела (перфорированным аутолоскутом с коэффициентом увеличения 1:4).
Поверх помещенного на рану кожного лоскута нанесен гель, содержащий минимальную среду ДМЕМ и метилцеллюлозу в количестве 2,5%, в котором были распределены культивированные фибробласты, и поверх геля - раневое покрытие «Биокол».
Послеоперационное течение гладкое. Начало эпителизации в ячейках отмечено на 3 сутки. Полная эпителизация ячеек на 10 сутки. Выписана на 18 сутки после поступления в удовлетворительном состоянии.
Приведенные примеры конкретного выполнения подтверждают, что предлагаемый способ является осуществимым. С его помощью пролечено 23 пациента с глубокими, преимущественно ожоговыми ранами различной локализации, требующими хирургического лечения для восстановления целостности кожного покрова.
1. Способ лечения глубоких ран, включающий предварительную очистку раны и нанесение на раневую поверхность фибробластов, распределенных в гелеобразной массе, содержащей питательную среду, отличающийся тем, что гелеобразная масса содержит бессывороточную питательную среду и метилцеллюлозу в количестве 1,0-3,0 мас.%.
2. Способ по п.1, отличающийся тем, что в качестве бессывороточной питательной среды используют минимальную среду, например Дальбекко, или ИГЛА, или F-12, или 199.
3. Способ по п.1, отличающийся тем, что в случае использования аутодермопласта гелеобразную массу с клетками наносят на раневую поверхность через сетчатый лоскут аутодермопласта.
4. Способ по п.1, отличающийся тем, что дополнительно поверх гелеобразной массы наносят неадгезивное раневое покрытие на основе полисахаридов растительного происхождения, например «Биокол», или на основе синтетических материалов, например «Парапран».
5. Способ по п.1, отличающийся тем, что гелеобразная масса дополнительно включает коллаген в количестве 0,01-0,005 мас.%.