Пептид, обладающий ростостимулирующей активностью гранулоцитарного колониестимулирующего фактора человека
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению биологически активных веществ пептидной природы, обладающих ростостимулирующей активностью гранулоцитарного колониестимулирующего фактора человека, и может быть использовано в медицине. Путем in silico конструирования получают олигопептид общей формулы I: , где где А представляет собой Boc - трет-бутилоксикарбонил или Ас - ацетил; X1 представляет собой Е, или D, или L, или Р, или S; Х2 представляет собой N, или Q, или А, или G; Х3 представляет собой G, или N, или V, или (β-А) - β-аланин; Х4 представляет собой К или отсутствует и В представляет собой ОМе - метил. Изобретение позволяет получить олигопептид, обладающий ростостимулирующей активностью гранулоцитарного колониестимулирующего фактора роста и способностью к стимулированию дифференцировки стволовых клеток in vitro в направлении эпителиальных прогениторов, и расширить арсенал эффективных терапевтических средств для лечения заболеваний, сопровождающихся миелосупрессией и инфекционными осложнениями. 4 ил., 1 табл.
Реферат
Настоящее изобретение относится к области биоорганической химии, биохимии и медицины, а именно к биологически активным веществам пептидной природы, обладающим ростостимулирующей активностью гранулоцитарного колониестимулирующего фактора человека, и могут найти применение в медицине, ветеринарии, а также в экспериментальной биохимии.
Гранулоцитарный колониестимулирующий фактор (Г-КСФ) является основным гемопоэтическим фактором роста, который обеспечивает пролиферацию, дифференцировку и терминальное созревание миелоидных предшественников нейтрофильных гранулоцитов, а также стимулирует разнообразные функции зрелых нейтрофилов и увеличивает продолжительность их жизни. Г-КСФ играет важную роль в регуляции гранулоцитопоэза как в равновесном состоянии, так и в условиях его экстренной активации, например, при инфекции [1, 2].
Природный Г-КСФ человека является кислым гликопротеидом и содержит два дисульфидных мостика (Cys37-Cys43 и Cys65-Cys75) [3]. Он существует в двух формах: белок типа А состоит из 177 аминокислотных остатков, белок типа В, более активный и представляющий собой основную форму, - из 174 аминокислотных остатков. Молекулярная масса последнего составляет 19.6 кДа [4]. Рекомбинантный Г-КСФ человека из E.coli имеет ту же первичную структуру, что и природный Г-КСФ типа В, но не гликозилирован и содержит дополнительный остаток метионина на N-конце.
Получение рекомбинантного Г-КСФ человека привело к созданию на его основе новых терапевтических средств, таких как Ленограстим®, Филграстрим®. В настоящее время рекомбинантный Г-КСФ человека широко применяется при целом ряде заболеваний, сопровождающихся миелосупрессией и инфекционными осложнениями, как, например, при химио- и радиотерапии рака, СПИДе, тяжелой хронической нейтропении, остром миелолейкозе, апластической анемии, миелодиспластическом синдроме, при трансплантации костного мозга и мобилизации клеток периферической крови для трансплантации, а также при повреждении кожи и мягких тканей с тяжелыми морфофункциональными и косметическими последствиями [5]. Результаты исследований, например [6, 7], показывают, что локальное применение рекомбинантного Г-КСФ, в частности, при поверхностной травме кожи, стимулирует процесс эпителизации, компенсаторные механизмы и обеспечивает скорейшее заживление раневого дефекта.
Однако получение рекомбинантного Г-КСФ человека является весьма сложной и дорогостоящей технологией. Стоимость препаратов на основе рекомбинантного Г-КСФ человека достаточно высока, что ограничивает возможность его применения в терапевтических целях. Олигопептиды, способные заменить по своему действию Г-КСФ, на данный момент отсутствуют.
Задачей настоящего изобретения является расширение арсенала эффективных и доступных терапевтических средств для лечения заболеваний, сопровождающихся миелосупрессией и инфекционными осложнениями.
Основной технический результат, который может быть получен при осуществлении настоящего изобретения, заключается в реализации данного назначения: создании новых олигопептидов, обладающих ростостимулирующей активностью гранулоцитарного колониестимулирующего фактора роста и отличающихся высокой способностью к стимулированию дифференцировки эпителиальных клеток.
В отличие от производства рекомбинантного Г-КСФ человека синтез заявляемых пептидов осуществляется по упрощенной и недорогостоящей технологии, так как включает небольшое количество стадий, что снижает стоимость препарата, сказывается на его доступности и, следовательно, расширяет возможности его применения. В этом состоит дополнительный технический результат изобретения.
Основной технический результат достигается за счет создания пептидов (ряд пептидов, близких по виду активности, различающихся только величиной активности), общей формулы
А-Х1-Х2-Х3-Х4-В,
где А представляет собой Воc или Ас;
Х1 представляет собой Glu, Asp, Leu, Pro или Ser;
X2 представляет собой Asn, Gln, Ala или Gly;
ХЗ представляет собой Gly, Asn, Val или p-Ala;
X4 представляет собой Lys или отсутствует и
В представляет собой ОМе,
обладающих ростостимулирующей активностью гранулоцитарного колониестимулирующего фактора человека и проявляющих высокую стимулирующую активность в отношении дифференцировки стволовых клеток in vitro в направлении эпителиальных прогениторов. В формуле: Boc - трет-бутилоксикарбонил, Ас - ацетил, Glu - глутаминовая кислота, Asp - аспарагиновая кислота, Leu - лейцин, Pro - пролин, Ser - серии, Asn - аспарагин, Gln - глутамин, Ala - аланин, Gly - глицин, Val - валин, p-Ala - β-аланин, Lys - лизин, ОМе - метил.
Для подтверждения ростостимулирующей активности заявляемых пептидов и их способности к стимулированию дифференцировки эпителиальных клеток проводили оценку их влияния на рост и дифференцировку линейных эмбриональных стволовых клеток in vitro (Пример 1). Активность оценивали методами морфометрического анализа при микроскопии культур клеток с использованием флюоресцентных меток в различные сроки культивирования.
Пример 1
In vitro оценка влияния, например, одного из олигопептидов - Boc-Glu-Gln-Val-Lys-OMe на рост и дифференцировку линейных эмбриональных стволовых клеток (ЭСК)
После удаления надосадочной жидкости культуру в лунках 24-луночного планшета покрывали 20 мкл рабочего раствора моноклональных антител, меченых с помощью FITS, и инкубировали в течение 30 минут в темноте при 4°С. Затем надосадочную жидкость удаляли и промывали с гепес-буфером дважды.
Анализ культуры осуществлялся с помощью инвертированного флюоресцентного микроскопа с оптимумом регистрации 500 мс. В анализ брали 1000 событий. Регистрацию сигнала осуществляли с использованием фильтра 530/30 нм.
Формирование множественных очагов эпителиоподобных клеток отмечалось уже к 8 дню эксперимента в сериях, где разведение пептида не превышало 1:100. К 10 дню происходила кластеризация эпителиоподобных клеток в скопления по 8-20 элементов (Таблица). Соседние эпителиоподобные клетки и их кластеры в ходе роста имели тенденцию к слиянию и образовывали в ряде случаев эпителиоподобные пласты и скопления толщиной до 3 уровней с количеством клеточных элементов не менее 1000. При этом о дифференцировке клеточных элементов в направлении эпителиальных прогениторов свидетельствовала избирательная экспрессия рецепторных маркеров pan-СК (общий маркер эпителиальных клеток), характерная в период с 14 по 24 день не менее чем для 87% (FITC-staining). При этом в остальной популяции ЭСК не более чем 11% клеточных элементов связывало антитела к цитокератину.
Особенностью роста эпителиоподобных клеток в культуре явилось также отсутствие склонности к слиянию с другими производными стволовых клеток - даже при достижении полного монослоя в большинстве случаев крупные эпителиоподобные конгломераты были отделены практически по всему периметру тонкой демаркационной линией от 5 до 20 мкм.
| Оценка дифференцировки клеточных элементов в направлении эпителиальных прогениторов | |||
| Сутки культивирования | % эпителиоподобных клеточных элементов, экспрессирующих pan-CK (FITC), (n=8) | ||
| ЭСК контроль | ЭСК + пептид в разведении 1:500 | ЭСК + пептид в разведении 1:50 | |
| 3 | 0,1 | 0.1 | 0.1 |
| 5 | 0,1 | 0.1 | 0.1 |
| 8 | 0,7±0,1 | 0.9±0.2 | 2.5±0.9 |
| 10 | 1.1±0.4 | 1.2±0.3 | 6.3±1.0 |
| 14 | 1.1±0.4 | 2.1±0.7 | 5.3±0.6 |
| 16 | 1.5±1.0 | 2.3±0.9 | 11.7±2.4 |
| 20 | 2.6±0.5 | 2.5±0.2 | 13.2±2.0 |
| 24 | 4.1±0.9 | 2.0±0.8 | 13.7±3.1 |
| 30 | 4.0±1.6 | 3.8±0.8 | >14* |
| * - нет возможности точного подсчета из-за многоярусной локализации клеток. |
Из представленных в таблице данных можно сделать вывод, что заявляемый пептид проявляет высокую активность по отношению к дифференцировке клеточных элементов в направлении эпителиальных прогениторов. Данное соединение может найти применение в медицине и ветеринарии в качестве средства с ранозаживляющим действием, стимулирующего процесс эпителизации.
Нижеследующие чертежи составляют часть описания настоящего изобретения и включены для дополнительной демонстрации некоторых аспектов настоящего изобретения. Настоящее изобретение можно лучше понять путем обращения к одному или нескольким из этих чертежей в сочетании с подробным описанием представленных здесь конкретных вариантов осуществления настоящего изобретения.
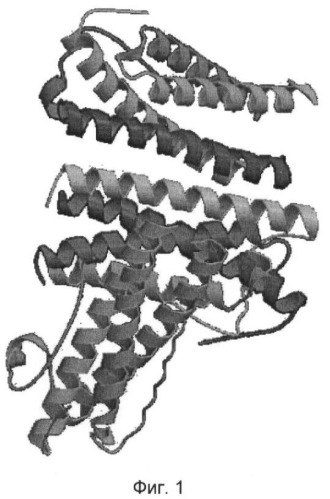
На фиг.1 представлена пространственная структура Г-КСФ [9].
На фиг.2 представлена пространственная структура белка Г-КСФ с идентифицированным функциональным сайтом (функциональный сайт выделен).
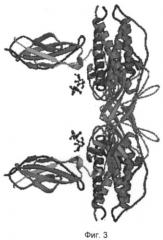
На фиг.3 представлена пространственная структура комплекса Г-КСФ/рецептор [10].
На фиг.4 представлена пространственная структура комплекса Г-КСФ/рецептор с идентифицированным функциональным сайтом белка Г-КСФ (функциональный сайт выделен).
Формулы заявляемых пептидов были выявлены по результатам компьютерного конструирования участков связывания гранулоцитарного колониестимулирующего фактора роста с рецепторами поверхности стволовых клеток. Компьютерное конструирование участков связывания Г-КСФ с его рецептором проводили с помощью программного комплекса, осуществляющего компьютерное моделирование пространственной структуры белковых молекул и дизайн низкомолекулярных соединений, ответственных за биологическую функцию белка. Далее использована оригинальная система прогноза, которая и позволила сгенерировать искомые последовательности
Пример 2
In silico конструирование функционального сайта Г-КСФ на основе пространственной структуры белка Г-КСФ
Для осуществления конструирования функционального сайта Г-КСФ использовалась компьютерная программа.
Исходными данными для работы послужили первичные и пространственные структуры белков, импортированные из банка данных Protein Data Bank [8]. В базе данных банка проводили поиск пространственной структуры Г-КСФ. В результате для компьютерного конструирования отобрали пространственную структуру Г-КСФ [9] (фиг.1).
Далее проводили компьютерное моделирование, которое позволило идентифицировать аминокислотные остатки белка Г-КСФ, принимающие участие во взаимодействии Г-КСФ с его рецептором и определяющим искомую биологическую активность (фиг.2). На основе полученных данных спрогнозировали формулы заявляемых пептидов.
Пример 3
In silico конструирование функционального сайта Г-КСФ на основе пространственной структуры комплекса Г-КСФ/рецептор
Для осуществления конструирования функционального сайта Г-КСФ использовалась компьютерная программа.
Исходными данными для работы послужили первичные и пространственные структуры белков, импортированные из банка данных Protein Data Bank [8]. В базе данных банка проводили поиск пространственной структуры комплекса Г-КСФ/рецептор. В результате для компьютерного конструирования отобрали пространственную структуру комплекса Г-КСФ/рецептор [10] (фиг.3).
Далее проводили компьютерное моделирование, которое позволило идентифицировать аминокислотные остатки белка Г-КСФ, принимающие участие во взаимодействии Г-КСФ с его рецептором (фиг.4).
Полученные результаты совпадают с результатами Примера 2, что доказывает правильность конструирования функционального сайта Г-КСФ in silico.
Источники информации
1. Avalos B.R. // Blood. 1996. V.88. P.761.
2. Welte K., Gabrilove J., Bronchud M.H., Platzer E., Morstyn G. // Blood. 1996. V.88. P.1907.
3. Lu H.S., Boone T.C., Souza L.M., Lai P.H. // Arch. Biochem. Biophys. 1989. V.268. P.81.
4. Asano S. // Am. J. Pediafr. Hematol. Oncol. 1991. V.13. P.400.
5. Welte K., Gabrilove J., Bronchud M.H., Platzer E., Morstyn G. // Blood. 1996. V.88. P.1907.
6. Давыдовский А.Г., Климкович B.A. // «Актуальные проблемы гематологии и трансфузиологии». 2007. С.214.
7. Давыдовский А.Г., Климкович В.А., Москва В.В., Дмитриев В.В. // «Актуальные проблемы гематологии и трансфузиологии». 2007. С.76.
8. http://www.rcsb.org/pdb/home/home.do
9. http://www.rcsb.org/pdb/explore/explore.do?structureld=1RHG
10. http://www.rcsb.org/pdb/explore/explore.do?structureld=2D9Q
Пептид, обладающий ростостимулирующей активностью гранулоцитарного колониестимулирующего фактора человека, общей формулы I где А представляет собой Воc или Ас;X1 представляет собой Е, или D, или L, или Р, или S;Х2 представляет собой N, или Q, или А, или G;Х3 представляет собой G, или N, или V, или (β-А);Х4 представляет собой К или отсутствует иВ представляет собой ОМе,где Boc - трет-бутилоксикарбонил, Ас - ацетил, Е - глутаминовая кислота, D - аспарагиновая кислота, L - лейцин, Р - пролин, S - серии, N - аспарагин, Q - глутамин, А - аланин, G - глицин, V - валин, (β-А) - β-аланин, К - лизин, ОМе - метил.