Способ конъюгации пептидов, опосредованной трансглутаминазой
Иллюстрации
Показать всеПредложены конъюгаты человеческого гормона роста, полученные путем удаления атома водорода из -NH2 в боковой цепи Gln, который образован от человеческого гормона роста или соединения человеческого гормона роста. 3 н. и 3 з.п. ф-лы.
Реферат
Область техники
Настоящее изобретение относится к новому способу посттрансляционной конъюгации пептидов, где трансглутаминазу используют для включения в пептид места присоединения, к которому может быть избирательно присоединена другая группа. Указанные конъюгированные пептиды обладают измененными характеристиками и могут, следовательно, иметь применение в терапевтических целях либо они могут облегчить анализ или выделение и очистку указанных пептидов.
Предшествующий уровень техники
Хорошо известно, что свойства и характеристики пептидов можно модифицировать путем присоединения к этим пептидам групп, которые должным образом изменяют свойства пептида. Для такой конъюгации обычно необходимо, чтобы некоторая функциональная группа в пептиде взаимодействовала с другой функциональной группой с образованием конъюгирующей группы. Как правило, аминогруппы, такие как N-концевая аминогруппа или ε-аминогруппа в лизинах, использовали в сочетании с подходящим ацилирующим реагентом. Часто желательно или даже необходимо уметь регулировать реакцию конъюгации, то есть контролировать, где присоединяются конъюгирующие соединения и сколько конъюгирующих групп присоединяется. Это часто называют специфичностью.
Задачей настоящего изобретения является разработка способа, с помощью которого пептиды можно конъюгировать с высокой степенью специфичности. В общих чертах в этом способе используют фермент, например трансглутаминазу, способный к включению соединения, содержащего подходящую функциональную группу, в пептид, где указанную функциональную группу затем используют в качестве места присоединения, где происходит конъюгация.
Конъюгация пептидов известна на протяжении длительного времени, и более 20 лет назад в US 4179337 раскрыты пептиды, конъюгированные с полиэтилен- или полипропиленгликолями.
Раскрыты различные типы химических реакций, которые эффективны для образования связи между пептидом и фрагментом, который конъюгируют с этим пептидом. В ЕР 605963 раскрыта графт-полимеризация водных полимеров, которые образуют оксимную связь с альдегидной группой на белке. Ни одна из природных аминокислот не содержит альдегидную группу, поэтому в процессе конъюгации сначала нужно окислить гидроксильную группу. В WO 96/41813 раскрыты полимеры, которые содержат группу, образующую оксим амино-окси, полезный в реакциях конъюгации. В WO 98/05363 раскрыто соединение, содержащее пептид и растворимый в воде полимер, где эти два соединения ковалентно связаны посредством оксимной связи при N-концевом аминокислотном остатке.
Кроме того, известно использование ферментов для обеспечения более специфичной конъюгации пептидов. В ЕР 243929 раскрыто использование протеолитических ферментов, таких как карбоксипептидаза, для включения соединения с функциональной группой в С-конец пептида, где указанную функциональную группу можно затем использовать в качестве места, к которому присоединяют цитотоксические группы, другие пептиды или репортерные группы, используемые для облегчения анализа пептида, такие как, например, флуоресцентные группы. Эта методика, однако, ограничивает выбор места присоединения С-концевым аминокислотным остатком, что является жестким ограничением, если этот С-концевой остаток является существенным для активности пептида.
Трансглутаминазу ранее использовали для изменения свойств пептидов. В пищевой промышленности и, в частности, в молочной промышленности, существует много методик, например, для структурированных пептидов, с использованием трансглутаминаз. В других документах раскрыто использование трансглутаминазы для изменения свойств физиологически активных пептидов. В ЕР 950665, ЕР 785276 и Sato, Adv. Drug Delivery Rev., 54, 487-504, 2002, раскрыта прямая реакция между пептидами, содержащими по меньшей мере один Gln, и аминированным ПЭГ или подобными лигандами в присутствии трансглутаминазы, и авторами Wada в Biotech. Lett., 23, 1367-1372, 2001, раскрыта прямая конъюгация β-лактоглобулина с жирными кислотами с помощью трансглутаминазы.
Краткое изложение сущности изобретения
Авторы настоящего изобретения неожиданно обнаружили, что ферменты, такие как, например, трансглутаминаза, можно использовать для включения в пептид одной или более чем одной функциональной группы, не доступные в данном пептиде, с образованием функционализированного пептида, и что этот функционализированный пептид можно затем подвергать взаимодействию с другим соединением, содержащим конъюгирующую группу и одну или более чем одну функциональную группу, способную взаимодействовать с функциональной группой или группами, включенными, таким образом, в пептид, но не взаимодействовать с другими функциональными группами, присутствующими в этом пептиде.
Такой способ обеспечивает высокую степень специфичности в связи с тем, что трансглутаминаза может катализировать включение соединений только при аминокислотных остатках, которые являются субстратами для трансглутаминазы, и в связи с тем, что функциональные группы выбраны таким образом, что они могут взаимодействовать друг с другом, но не взаимодействовать с другими функциональными группами, содержащимися в этом пептиде. Таким образом, конъюгирующая группа присоединяется только в контролируемом локусе или локусах, и путем выбора функциональных групп можно регулировать число конъюгированных групп.
Соответственно, в одном варианте изобретения предложен способ конъюгации пептидов, включающий
i) взаимодействие в одну или более чем одну стадию пептида с первым соединением, содержащим одну или более чем одну функциональную группу или скрытую функциональную группу, которая не доступна ни в одном из аминокислотных остатков, составляющих указанный пептид, в присутствии трансглутаминазы, способной катализировать включение указанного первого соединения в пептид с образованием функционализированного пептида,
ii) возможную активацию указанной скрытой функциональной группы и
iii) взаимодействие в одну или более чем одну стадию функционализированного пептида со вторым соединением, содержащим одну или более чем одну функциональную группу, где указанная функциональная группа или группы не взаимодействуют с функциональными группами, доступными в аминокислотных остатках, составляющих указанный пептид, причем функциональная группа или группы во втором соединении способны взаимодействовать с функциональной группой или группами в первом соединении с образованием ковалентной связи между функционализированным пептидом и вторым соединением.
Задачей настоящего изобретения также является разработка пептидов, конъюгированных способом согласно настоящему изобретению.
Следующей задачей настоящего изобретения также является разработка пептидов, которые модифицированы таким образом, чтобы сделать их более пригодными для способа согласно настоящему изобретению.
Следующей задачей настоящего изобретения является разработка реагентов и ферментов, пригодных для использования в способах согласно настоящему изобретению.
Следующей задачей настоящего изобретения является разработка композиций, например фармацевтических композиций, содержащих пептиды, конъюгированные способом согласно настоящему изобретению.
Следующей задачей настоящего изобретения является разработка пептидов, конъюгированных способами согласно настоящему изобретению, для применения в терапии.
Следующей задачей настоящего изобретения является разработка терапевтических способов для лечения заболеваний, при которых вводят конъюгированные пептиды, полученные способами согласно настоящему изобретению.
Следующей задачей настоящего изобретения является разработка применения конъюгированных пептидов, полученных способами согласно настоящему изобретению, в для изготовления лекарственных средств.
Следующей задачей настоящего изобретения является разработка способа улучшения фармакологических свойств пептида путем конъюгации указанного пептида способами согласно настоящему изобретению.
Определения
В настоящем контексте "трансаминирование" или подобный термин предназначен для обозначения реакции, где атом азота в боковой цепи глутамина обменивается с атомом азота от другого соединения, в частности с атомом азота от другого азотсодержащего нуклеофила.
В настоящем контексте термин "не доступный" означает, что что-либо отсутствует или отсутствует de facto в том смысле, что что-либо не достижимо. Когда указано, что функциональные группы не доступны в пептиде, который конъюгируют, это должно означать, что указанная функциональная группа отсутствует в пептиде или, если присутствует, то каким-либо образом предотвращено ее участие в реакциях. Например, указанная функциональная группа может быть углублена в структуру пептида таким образом, что она защищена от участия в реакции, либо она может быть расположена в таком участке пептида, где ограниченная гибкость пептидной цепи предотвращает участие этой функциональной группы в реакциях. Понятно, что доступность или недоступность функциональной группы зависит от условий реакции. Можно рассматривать, что в присутствии денатурирующих агентов или при повышенных температурах пептид может развертываться с обнажением не доступных в других условиях функциональных групп. Должно быть понятно, что "не доступный" означает "не доступный при условиях реакции, выбранных для конкретной интересующей реакции".
В настоящем контексте термин "оксимная связь" означает группу формулы -С=N-O-.
В настоящем контексте термин "гидразонная связь" означает группу формулы -C=N-N-.
В настоящем контексте термин "фенилгидразонная связь" означает группу формулы
В настоящем контексте термин "семикарбазонная связь" означает группу формулы -C=N-N-C(O)-N-.
Термин "алкан" означает насыщенный, нормальный, разветвленный и/или циклический углеводород. Если при нем не указано иное число атомов, этим термин означает углеводороды с числом атомов углерода от 1 до 30 (оба включительно), как, например, от 1 до 20 (оба включительно), как, например, от 1 до 10 (оба включительно), например, от 1 до 5 (оба включительно) или от 15 до 30 атомов углерода (оба включительно).
Термин "алкен" означает насыщенный, нормальный, разветвленный и/или циклический углеводород, содержащий по меньшей мере одну двойную связь углерод-углерод. Если при нем не указано иное число атомов, этим термин означает углеводороды с числом атомов углерода от 2 до 30 (оба включительно), как, например, от 2 до 20 (оба включительно), как, например, от 2 до 10 (оба включительно), например, от 2 до 5 (оба включительно) или от 15 до 30 атомов углерода (оба включительно).
Термин "алкин" означает насыщенный, нормальный, разветвленный и/или циклический углеводород, содержащий по меньшей мере одну тройную связь углерод-углерод. Если при нем не указано иное число атомов, этим термин означает углеводороды с числом атомов углерода от 2 до 30 (оба включительно), как, например, от 2 до 20 (оба включительно), как, например, от 2 до 10 (оба включительно), например, от 2 до 5 (оба включительно) или от 15 до 30 атомов углерода (оба включительно).
Термин "гомоциклическое ароматическое соединение" означает ароматические углеводороды, такие как бензол и нафталин.
Термин "гетероциклическое соединение" означает циклическое соединение, содержащее 5, 6 или 7 кольцевых атомов, из которых 1, 2, 3 или 4 представляют собой гетероатомы, выбранные из N, О и/или S. Примеры гетероциклических ароматических соединений включает тиофен, фуран, пиран, пиррол, имидазол, пиразол, изотиазол, изоксазол, пиридин, пиразин, пиримидин, пиридазин, а также их частично или полностью гидрогенизированные эквиваленты, такие как пиперидин, пиразолидин, пирролидин, пирролин, имидазолидин, имидазолин, пиперазин и морфолин.
Термины "гетероалкан", "гетероалкен" и "гетероалкин" обозначают алканы, алкены и алкины, как определено выше, в котором один или более чем один гетероатом или группа включена в структуру указанных групп. Примеры гетерогрупп и гетероатомов включают -О-, -S-, -S(O)-, -S(O)2-, -C(O)- -C(S)- и -N(R*)-, где R* представляет собой водород или C1-C6-алкил. Примеры гетероалканов включают:
, , ,
, и
Термин "радикал" или "бирадикал" означает соединение, из которого один или два, соответственно, атома водорода удалены. Когда конкретно указано, радикал может также означать группу, образованную путем удаления из соединения большей группы атомов, например, гидроксила.
Термин "галоген" означает члены седьмой группы главной подгруппы периодической таблицы, например. F, Cl, Br и I.
Термин "ПЭГ означает полиэтиленгликоль молекулярной массы между примерно 100 и примерно 1000000 Да, включая его аналоги, где, например, концевая ОН-группа замещена группой алкокси, такой как, например, группа метокси, группа этокси или группа пропокси. В частности, ПЭГ, где концевая группа -ОН замещена метокси, называют мПЭГ.
Термин "мПЭГ" (или более правильно "мПЭГил") означает полидисперсный или монодисперсный радикал структуры
где m представляет собой целое число больше 1. Таким образом, мПЭГ, где m равно 90, имеет молекулярную массу 3991 Да, то есть примерно 4 кДа. Подобным образом, мПЭГ со средней молекулярной массой 20 кДа имеет среднее m 454. В результате способа получения мПЭГ эти молекулы часто имеют распределение молекулярных масс. Это распределение описывают индексом полидисперсности.
Термин "индекс полидисперсности" означает отношение между средней молекулярной массой и среднечисловой молекулярной массой, как известно в области химии полимеров (см., например, "Polymer Synthesis and Characterization", J.A. Nairn, University of Utah, 2003). Индекс полидисперсности представляет собой число, которое выше или равно единице, и его можно оценить на основании данных гель-проникающей хроматографии. Когда индекс полидисперсности равен 1, продукт является монодисперсным и, таким образом, состоит из соединений с единой молекулярной массой. Когда индекс полидисперсности выше 1, он является мерой полидисперсности этого полимера, то есть того, насколько широким является распределение полимеров с различными молекулярными массами.
Использование, например, выражения "мПЭГ20000" в формулах, названиях соединений или в молекулярных структурах означает остаток мПЭГ, где мПЭГ является полидисперсным и имеет молекулярную массу примерно 20 кДа.
Индекс полидисперсности, как правило, повышается с повышением молекулярной массы ПЭГ или мПЭГ. Когда делают ссылку на 20 кДа ПЭГ и, в частности, 20 кДа мПЭГ, она предназначена для указания соединения (или в действительности смеси соединений) с индексом полидисперсности ниже 1,06, таким как ниже 1,05, таким как ниже 1,04, таким как ниже 1,03, таким как между 1,02 и 1,03. Когда делают ссылку на 30 кДа ПЭГ и, в частности, 30 кДа мПЭГ, она предназначена для указания соединения (или в действительности смеси соединений) с индексом полидисперсности ниже 1,06, таким как ниже 1,05, таким как ниже 1,04, таким как ниже 1,03, таким как между 1,02 и 1,03. Когда делают ссылку на 40 кДа ПЭГ и, в частности, 40 кДа мПЭГ, она предназначена для указания соединения (или в действительности смеси соединений) с индексом полидисперсности ниже 1,06, таким как ниже 1,05, таким как ниже 1,04, таким как ниже 1,03, таким как между 1,02 и 1,03.
В настоящем контексте слова "пептид" и "белок" используют взаимозаменяемо, и они должны обозначать одно и то же. Термин "пептид" означает соединение с двумя или более чем двумя аминокислотными остатками, связанными пептидной связью. Аминокислоты могут быть природными или неприродными. В этот термин также следует включать указанные соединения, замещенные другими пептидами, сахаридами, липидами или другим органическим соединением, а также соединения, где один или более чем один аминокислотный остаток химически модифицирован. В этот термин также следует включать пептиды, к которым присоединены простетические группы. В частности, пептид проявляет физиологическую активность, такую как, например, терапевтическая активность.
В настоящем контексте термин "арил" означает гомоциклический ароматический кольцевой радикал или радикал, представляющий собой конденсированную гомоциклическую кольцевую систему, где по меньшей мере одно из колец является ароматическим. Типичные арильные группы включают фенил, дифенил, нафтил, тетралинил и тому подобное.
Термин "гетероарил", как его используют здесь, один или в комбинации, относится к ароматическому кольцевому радикалу с числом кольцевых атомов, например, от 5 до 7, или к радикалу, представляющему собой конденсированную ароматическую кольцевую систему с числом кольцевых атомов, например, от 7 до 18, где по меньшей мере одно из колец является ароматическим и содержит один или более чем один гетероатом в виде кольцевых атомов, выбранный из гетероатомов азота, кислорода или серы, где N-оксиды, а также монооксиды серы и диоксиды серы являются допустимыми гетероароматическими замещениями. Примеры включают фуранил, тиенил, тиофенил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, тиазолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил, изотиазолил, пиридинил, пиридазинил, пиразинил, пиримидинил, хинолинил, изохинолинил, бензофуранил, бензотиофенил, индолил и индазолил и тому подобное.
Термин "конъюгат" в виде существительного означает модифицированный пептид, то есть пептид с группой, связанной с ним для модификации свойств указанного пептида. В виде глагола термин "конъюгировать" означает процесс связывания группы с пептидом для модификации свойств указанного пептида.
Термин "пролекарство", как его используют здесь, означает соединение, которое не обладает или не обязательно обладает терапевтической активностью, но которое после введения превращается в терапевтически активное соединение посредством реакции, происходящей в организме. Как правило, такие реакции представляют собой гидролиз, например, посредством эстераз или окисления. Примеры пролекарств включают биологически гидролизуемые амиды и биологически гидролизуемые эфиры, а также охватывают а) соединения, в которых биологически гидролизуемая функциональная группа в таком пролекарстве включена в соединение согласно настоящему изобретению, и б) соединения, которые могут окисляться или восстанавливаться биологически при данной функциональной группе с образованием лекарственных веществ согласно настоящему изобретению. Примеры этих функциональных групп включают 1,4-дигидропиридин, N-алкилкарбонил-1,4-дигидропиридин, 1,4-циклогексадиен, трет-бутил и тому подобное.
В данном описании термин "биологически гидролизуемый эфир" означает эфир лекарственного вещества (в данном случае соединение по изобретению), который либо а) не препятствует биологической активности исходного вещества, но придает этому веществу преимущественные свойства in vivo, такие как продолжительность действия, начало действия и тому подобное, либо б) является биологически неактивным, но легко превращается in vivo субъектом в биологически активное действующее вещество. Преимущество состоит, например, в повышенной растворимости или в том, что биологически гидролизуемый эфир после перорального введения всасывается из пищеварительного тракта и превращается в соединение согласно настоящему изобретению в плазме. Множество таких примеров известно в данной области техники и включает, например, низшие алкиловые эфиры (например, C1-C4), низшие ацилоксиалкиловые эфиры, низшие алкоксиацилоксиалкиловые эфиры, алкоксиацилоксиэфиры, алкилациламиноалкиловые эфиры и холиновые эфиры.
В данном описании термин "биологически гидролизуемый амид" означает амид лекарственного вещества (в данном случае соединение по изобретению), который либо а) не препятствует биологической активности исходного вещества, но придает этому веществу преимущественные свойства in vivo, такие как продолжительность действия, начало действия и тому подобное, либо б) является биологически неактивным, но легко превращается in vivo субъектом в биологически активное действующее вещество. Преимущество состоит, например, в повышенной растворимости или в том, что биологически гидролизуемый амид после перорального введения всасывается из пищеварительного тракта и превращается в соединение согласно настоящему изобретению в плазме. Множество таких примеров известно в данной области техники и включает, например, низшие алкиламиды, амиды α-аминокислот, алкоксиациламиды и алкиламиноалкилкарбониламиды.
В настоящем контексте термин "фармацевтически приемлемая соль" означает соли, которые не являются вредными для пациента. Такие соли включают соли присоединения фармацевтически приемлемой кислоты, фармацевтически приемлемые соли металлов, соли аммония и алкилированного аммония. Соли присоединения кислоты включают соли как неорганических кислот, так и органических кислот. Репрезентативные примеры пригодных неорганических кислот включают соляную, бромистоводородную, йодистоводородную, фосфорную, серную, азотную кислоты и тому подобное. Репрезентативные примеры пригодных органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, молочную, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, ЭДТА, гликолевую, пара-аминобензойную, глутаминовую, бензолсульфоновую, пара-толуолсульфоновую кислоты и тому подобное. Дополнительные примеры фармацевтически приемлемых солей присоединения неорганической или органической кислоты включают фармацевтически приемлемые соли, перечисленные в J. Pharm. Sci. 1977, 66, 2, который включен в данное описание посредством ссылки. Примеры солей металлов включают соли лития, натрия, калия, магния и тому подобное. Примеры солей аммония и алкилированного аммония включают соли аммония, метиламмония, диметиламмония, триметиламмония, этиламмония, гидроксиэтиламмония, диэтиламмония, бутиламмония, тетраметиламмония и тому подобное.
Термин "терапевтически эффективное количество" соединения означает количество, достаточное для лечения, облегчения или частичного прекращения клинических проявлений данного заболевания и его осложнений. Количество, достаточное для осуществления этого, определяют как "терапевтически эффективное количество". Эффективные количества для каждой цели будут зависеть как от тяжести заболевания или повреждения, так и от массы и общего состояния субъекта. Должно быть понятно, что определение подходящей дозировки может быть достигнуто с использованием рутинных экспериментов путем построения матрицы значений и тестирования различных точек на этой матрице, что находится в пределах обычной компетенции практикующего врача или ветеринара.
Термины "лечение" и "лечить", как их используют в данном описании, означают оказание помощи и уход за пациентом для борьбы с состоянием, таким как заболевание или расстройство. В этот термин следует включать весь спектр терапий для данного состояния, которым страдает пациент, таких как введение активного соединения, для облегчения симптомов или осложнений, для замедления прогрессирования заболевания, расстройства или состояния, для облегчения или ослабления симптомов и осложнений и/или для лечения или элиминации заболевания, расстройства или состояния, а также для предупреждения этого состояния, где предупреждение следует понимать как оказание помощи и уход за пациентом для борьбы с заболеванием, состоянием или расстройством и включает введение активных соединений для предупреждения появления симптомов или осложнений. Пациент, подлежащий лечению, предпочтительно представляет собой млекопитающее, в частности человека, но также может включать животных, таких как собаки, кошки, коровы, овцы и свиньи.
Раскрытие изобретения
Трансглутаминаза (Е.С.2.3.2.13), также известная как белок - глутамин-γ-глутамилтрансфераза, катализирует общую реакцию
В одном варианте осуществления изобретения Q-C(O)-NH2 (акцептор амина) представляет собой глутаминсодержащий пептид и Q′-NH2 (донор амина) представляет собой первое соединение, как указано выше, либо Q-С(O)-NH2 представляет собой первое соединение, как указано выше, и Q′-NH2 тогда представляет собой лизинсодержащий пептид. В конкретном варианте осуществления изобретения, однако, Q-C(O)-NH2 представляет собой глутаминсодержащий пептид и Q′-NH2 представляет собой первое соединение, как указано выше.
Общий донор амина in vivo представляет собой лизин, связанный пептидной связью, и тогда приведенная выше реакция дает образование поперечных связей пептидов. Фактор свертывания крови фактор XIII представляет собой трансглутаминазу, которая осуществляет свертывание крови при повреждениях. Различные трансглутаминазы отличаются друг от друга, например, тем, что аминокислотные остатки вокруг Gln требуются этому белку в качестве субстрата, то есть различные трансглутаминазы будут иметь различные Gln-содержащие пептиды в качестве субстратов в зависимости от того, какие аминокислотные остатки являются соседними с остатком Gln. Данный аспект может быть использован, если пептид, подлежащий модификации, содержит более чем один остаток Gln. Если желательно избирательно конъюгировать пептид только при некоторых из присутствующих остатков Gln, эта избирательность может быть получена путем отбора трансглутаминазы, которая принимает только релевантный(е) остаток(ки) Gln в качестве субстрата. Альтернативно один или более чем один аминокислотный остаток, близкий к Gln, может быть изменен, например, методами генной инженерии, в сторону модификации активности данной трансглутаминазы в отношении указанного остатка Gln.
Известно, что, является ли соединение субстратом для данного фермента, в принципе зависит от условий реакции, например временных рамок. При достаточном времени многие соединения, обычно не рассматриваемые в качестве субстратов, в действительности являются субстратами. Когда выше указано, что для данной трансглутаминазы некоторые остатки Gln могут являться субстратами, тогда как другие не являются, это должно указывать на то, что "другие не являются" до той степени, где желаемая избирательность все же может быть достигнута. Если один или более чем один остаток Gln, для которого желательно, чтобы он остался не конъюгированным, в действительности является субстратом для трансглутаминазы, однако, только если он находится в контакте с трансглутаминазой в течение продолжительного периода времени, избирательность может быть достигнута путем удаления или инактивации трансглутаминазы спустя подходящее время.
Примеры полезных трансглутаминаз включают микробные трансглутаминазы, такие как, например, из Streptomyces mobaraense, Streptomyces cinnamoneum и Streptomyces griseocarneum (все раскрыты в US 5156956, который включен в данное описание посредством ссылки) и Streptomyces lavendulae (раскрыта в US 5252469, который включен в данное описание посредством ссылки), а также Streptomyces ladakanum (JP2003199569, который включен в данное описание посредством ссылки). Следует отметить, что члены вышеуказанного рода Streptoverticillium в настоящее время включены в род Streptomyces [Kaempfer, J. Gen. Microbiol., 137, 1831-1892, 1991]. Другие полезные микробные трансглутаминазы были выделены из Bacillus subtilis (раскрыты в US 5731183, который включен в данное описание посредством ссылки) и из различных Myxomycetes. Другими примерами полезных микробных трансглутаминаз являются те, которые раскрыты в WO 96/06931 (например, трансглутаминаза из Bacilus lydicus) и WO 96/22366, обе из которых включены в данное описание посредством ссылки. Полезные не микробные трансглутаминазы включают трансглутаминазу печени морской свинки и трансглутаминазу из различных морских источников, таких как камбала Pagrus major (раскрыта в ЕР-0555649, которая включена в данное описание посредством ссылки), и японская устрица Crassostrea gigas (раскрыта в US 5736356, который включен в данное описание посредством ссылки).
В одном варианте осуществления изобретения Q′-NH2, то есть первое соединение, как указано выше, представляет собой азотсодержащий нуклеофил, где нуклеофил понимают как основное, богатое электронами соединение, которое имеет тенденцию атаковать ядро атома углерода. Азотсодержащий нуклеофил может представлять собой, например, амин или оксипроизводное амина.
В одном варианте осуществления изобретения изобретение относится к способу конъюгации пептидов, где пептид, содержащий остаток Gln, представленный формулой
подвергают взаимодействию в одну или более чем одну стадию с азотсодержащим нуклеофильным соединением (первым соединением), представленным формулой
в присутствии трансглутаминазы с образованием трансаминированного пептида формулы
затем, при желании, указанную скрытую функциональную группу в Х активируют,
полученный трансаминированный пептид подвергают дальнейшему взаимодействию со вторым соединением формулы
с образованием конъюгированного пептида формулы
где D представляет собой связь или кислород;
R представляет собой линкер или связь;
Х представляет собой радикал, содержащий одну или более чем одну функциональную группу или скрытую функциональную группу, недоступную в аминокислотных остатках, составляющих пептид P-C(O)-NH2;
Y представляет собой радикал, содержащий одну или более чем одну функциональную группу, причем эти группы взаимодействуют с функциональными группами, присутствующими в X, и не взаимодействуют с функциональными группами, доступными в пептиде Р-С(O)-NH2;
Е представляет собой линкер или связь;
А представляет собой группу, образованную путем взаимодействия между парой функциональных групп, содержащихся в Х и Y, и
Z представляет собой группу, которую нужно конъюгировать с пептидом.
После конъюгации конъюгированный пептид можно выделить и очистить с помощью методик, хорошо известных в данной области техники. Конъюгированный пептид можно также превратить в фармацевтически приемлемую соль или пролекарство, если необходимо.
В частности, указанный способ может также включать стадию, где препарат полученного в результате конъюгированного пептида готовят в виде фармацевтической композиции.
Группа А, образованная при взаимодействии между функциональными группами Х и Y, может в принципе иметь любой вид в зависимости от того, какие свойства конечного конъюгированного пептида желательны. В некоторых ситуациях может быть желательным иметь лабильную связь, которую можно расщепить на какой-либо более поздней стадии, например, под действием какого-либо фермента или путем фотолиза. В некоторых ситуациях может быть желательным иметь стабильную связь, так чтобы получить стабильный конъюгированный пептид. Конкретно упомянуты типы групп, образованных в результате взаимодействий между производными амина и карбонильными группами, такие как оксим-, гидразон-, фенилгидразон- и семикарбазоновые группы.
В одном варианте осуществления изобретения функциональные группы Х и Y выбраны среди карбонильных групп, таких как кето- и альдегидные группы, и аминопроизводных, таких как
| Производные гидразина | -NH-NH2 |
| Производные гидразинкарбоксилата | -O-C(O)-NH-NH2 |
| Производные семикарбазида | -NH-C(O)-NH-NH2 |
| Производные тиосемикарбазида | -NH-C(S)-NH-NH2 |
| Производные дигидразида карбоновой кислоты | -NHC(O)-NH-NH-C(O)-NH-NH2 |
| Производные карбазида | -NH-NH-C(O)-NH-NH2 |
| Производные тиокарбазида | -NH-NH-C(S)-NH-NH2 |
| Производные арилгидразина | -NH-C(O)-C6H4-NH-NH2 и |
| Производные гидразида | -C(O)-NH-NH2 либо |
| Производные оксиламина, такие как | -O-NH2, -С(O)-O-NH2, -NH-С(O)-O-NH2 и -NH-C(S)-O-NH2 |
Должно быть понятно, что, если функциональная группа, содержащаяся в X, представляет собой карбонильную группу, то функциональная группа, содержащаяся в Y, представляет собой производное амина, и наоборот. Считают, что благодаря наличию групп -NH2 в большинстве пептидов лучшая избирательность получается, если Х содержит кето- или альдегидную функциональную группу.
Другим примером подходящей пары функциональных групп, присутствующих в Х и Y, являются производные азида (-N3) и алкины, которые взаимодействуют с образованием триазольной группы. Еще одним другим примером подходящей пары является алкин и нитрилоксид, которые взаимодействуют с образованием изооксазолидиновой группы.
Должно быть понятно, что функциональная группа, содержащаяся в X, может быть скрытой в том смысле, что ее нужно активировать перед взаимодействием с Y-E-Z. Например, Х может содержать группу, которая при взаимодействии с подходящим реагентом превращается в альдегид или кетон. Примеры таких групп включают
где R9 представляет собой Н, C1-6алкил, арил или гетероарил. Конкретные примеры включают метил, этил и пропил. Указанные группы можно превращать в альдегид или кетон путем окисления подходящим агентом, таким как, например, периодат, или путем гидролиза водной кислотой, возможно в присутствии катализатора, такого как соли меди, серебра или ртути.
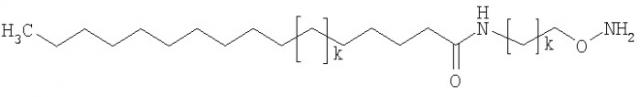
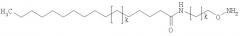
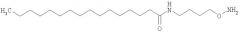
В частности, соединение формулы (первое соединение),
может быть выбрано из 4-(аминометил)фенилэтанона, 4-(2-аминоэтил)фенилэтанона, N-(4-ацетилфенил)-2-аминоацетамида, 1-[4-(2-аминоэтокси)фенил]этанона, 1-[3-(2-аминоэтокси)фенил]этанона, 1,4-бис(аминокси)бутана, 3-оксапентан-1,5-диоксиамина, 1,8-диаминокси-3,6-диоксаоктана, 1,3-бис(аминокси)пропан-2-ола, 1,11-бис(аминокси)-3,6,9-триоксаундекана, 1,3-диамино-2-пропанола, 1,2-бис(аминокси)этана и 1,3-бис(аминокси)пропана.
Как соединение для трансаминирования (первое соединение), так и соединение для взаимодействия с трансаминированным пептидом (второе соединение) содержит линкер, R и Е, соответственно. Эти линкеры, которые являются независимыми друг от друга, могут отсутствовать или могут быть выбраны среди бирадикалов алкана, алкена или алкина и бирадикалов гетероалкана, гетероалкена и гетероалкина, где один или более чем один возможно замещенный ароматический гомоциклический бирадикал или бирадикал гетероциклического соединения, например бирадикал фенилена или пиперидина, может быть встроен между вышеупомянутыми бирадикалами. Должно быть понятно, что указанные линкеры могут также содержать заместители, выбранные из гидроксила, галогена, нитро, циано, карбоксила, арила, алкила и гетероарила.
Как Е, так и R представляют собой связи или линкеры, и в настоящем контексте термин "линкер" означает группу, функционирующую как средство для отделения Y от Z и Х от NH2-D- соответственно. Одной из функций линкеров Е и R может быть обеспечение адекватной подвижности в связи между пептидом и конъюгированной группировкой Z. Типичные примеры Е и R включаю