Ген hgfopt фактора роста гепатоцитов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к технологии получения генно-инженерных конструкций с целью их применения в клеточной и генной терапии. Представлен оптимизированный для экспрессии в клетках млекопитающих ген фактора роста гепатоцитов человека. Изобретение позволяет увеличить в два раза продукцию фактора роста гепатоцитов по сравнению с использованием природного гена человека. 3 ил.
Реферат
Изобретение относится к области биотехнологии, а именно к технологии получения генно-инженерных конструкций для экспрессии трансгенов в клетках млекопитающих in vitro и in vivo с целью их применения в клеточной инженерии и в генной терапии, а именно к к фрагменту вектора - модифицированной последовательности гена фактора роста гепатоцитов, и предназначенных для трансфекции клеток млекопитающих с целью экспрессии в них белкового продукта - фактора роста гепатоцитов.
Фактор роста гепатоцитов (HGF) стимулирует регенерацию печеночной ткани, оказывает защитное действие на гепатоциты и другие клетки, предотвращая их апоптоз, а также оказывает антифиброзное действие, индуцируя синтез протеиназ внеклеточного матрикса (Gohda E., Nakamura S., Yamamoto I., Minowada J. Leuk. Lymphoma, 1995, Vol.19, pp.197-205). Помимо этого, HGF стимулирует рост сосудов (Morishita R., Aoki M., Hashiya N., Yamasaki K., Kurinami H., Shimizu S., Makino H., Takesya Y., Azuma J., Ogihara T. Curr. Gene Ther., 2004, Vol.4, pp.199-206). Наконец, HGF стимулирует миграцию резидентных стволовых клеток сердца из мест их локализации в участки повреждения, в частности при инфаркте миокарда - в зону инфаркта (Vandervelde S., van Luyn M.J., Tio R.A., Harmsen M.C. J. Mol. Cell Cardiol, 2005, Vol.39, pp.363-376).
Для продуцирования HGF используют ДНК, содержащую природный ген фактора роста гепатоцитов человека (Yang J., Chen S., Huang L., Michalopoulos G.K., Liu Y. Hepatology, 2001, Vol.33, p.848-859), однако при его использовании не удается получить высокий уровень экспрессии данного белка.
Технической задачей, решаемой авторами настоящего изобретения, являлось создание такой модифированной последовательности гена HGF, чтобы при ее включении в состав эукариотического вектора обеспечивался более высокий уровень экспрессии HGF в клетках, трансфицированных таким вектором.
Технический результат достигался модификацией природной последовательности гена HGF, в основе которой лежала вырожденность генетического кода. Последовательность модифицировали таким образом, чтобы триплеты нуклеотидов, кодирующие некоторые из аминокислот белковой последовательности фактора роста гепатоцитов, встречались в генах человека наиболее часто. При этом использовали опубликованные в открытых источниках данные по частотам встречаемости кодонов (http://del.mediaglyphs.org/mg/bf/nucs_aa.html).
На фиг.1 показана последовательность нуклеотидов гена HGFopt (верхние строчки) в сравнении с последовательностью нуклеотидов природного гена фактора роста гепатоцитов человека HGF (средние строчки). Показана также последовательность аминокислот кодируемого белкового продукта (нижние строчки). Жирным шрифтом выделена область, кодирующая белок. Подчеркнуты триплеты нуклеотидов, подвергшиеся оптимизации. Затемнены сигналы разрушения мРНК АТТТА и полиаденилирования ААТААА.
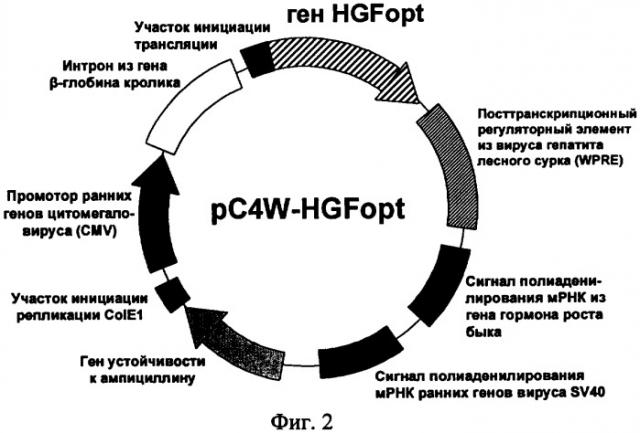
На фиг.2 приведена функциональная карта плазмиды pC4W-HGFopt.
На фиг.3 показан вестерн-блоттинг белков культуральной среды клеток НЕК293, трансфицированных плазмидой pC4W-HGFopt (дорожка 1). Для сравнения на дорожку 2 нанесен рекомбинантный фактор роста гепатоцитов человека.
Синтез гена и плазмиды осуществляли с помощью стандартной технологии и оборудования, применяемых для решения подобных задач в генной инженерии (Watson, J.D., Oilman, M., Witkowski, J., Zoller, M. Recombinant DNA, Scientific American Books, New York, 1992).
Дизайн оптимизированной последовательности нуклеотидов, кодирующей фактор роста гепатоцитов человека HGF, производили следующим образом. Используя частоты встречаемости кодонов, приведенные на вэб-сайте http://del.mediaglyphs.org/mg/bf7nucs_aa.html, среди триплетов нуклеотидов, кодирующих аминокислоты белковой последовательности природного гена HGF, выявляли такие, которые встречаются в генах человека наиболее редко. Выявленные редкие триплеты, а также соседние с ними триплеты, меняли на триплеты, кодирующие ту же аминокислоту, но при этом встречающиеся в генах человека наиболее часто. Кроме того, с целью повышения стабильности матричной РНК HGF такими же методами из кодирующей белок области природного гена HGF удаляли сигналы разрушения мРНК "АТТТА" и сигналы полиаденилирования "ААТААА" (Barreau С., Paillard L., Osbome B.H. Nucleic Acids Research, 2005, Vol.33, pp.7138-7150). В результате благодаря вырожденности генетического кода все аминокислоты природного гена HGF остались неизмененными. Полученная последовательность нуклеотидов представлена на фиг.1.
кДНК фактора роста гепатоцитов человека HGF получали методом RT-PCR с использованием в качестве матрицы суммарной РНК из печени человека и клонировали в экспрессионный вектор pcDNA3 (Invitrogen, США) с получением плазмиды pcDNA3-hHGF и в экспрессионный вектор pC4W (000 "фирма МО-НА", РФ) с получением плазмиды pC4W-hHGF. Плазмиду pC4W-HGFopt, несущую оптимизированный ген HGFopt, получали методом генно-инженерного конструирования, как описано ниже.
На первой стадии:
- химически синтезированную пару олигонуклеотидов
VEC01 (AGCTTGGCATTCCGGTACTGTTGGTAAAGCCACCATG) и
VEC02(GTACCATGGTGGCTTTACCAACAGTACCGGAATGCCA)
отжигали, смешивали и клонировали в расщепленный рестриктазами HindIII и Асс65I вектор pUC19 с получением промежуточной плазмиды pUC-KNA;
- химически синтезированную пару олигонуклеотидов
VEC03 (GCCATGGAGATCTG) и
VEC04(AATTCAGATCTCCATGGCTGCA) отжигали, смешивали и клонировали в расщепленный рестриктазами PstI и EcoRI вектор pBluescriptII-SK+ с получением промежуточной плазмиды pBSKN.
На второй стадии проводили серию реакций амплификации с использованием плазмиды pcDNA3-hHGF в качестве матрицы и пар химически синтезированных олигонуклеотидов:
- HGF3F (GCGGATCCATGTGGGTGACCAAGCTGCTG) и
HGF4R(GGGCGGGGTCGATCTTGATCAGGGTGGTC),
- HGF5F (GATCAAGATCGACCCCGCCCTGAAGATCAAGACC) и
HGF6R(GTTCCTGGTACATCTATTGGCACACTGGTC),
- HGF7F (GCCAATAGATGTACCAGGAACAAGGGCCTGCCATTC) и
HGF8R(GCTGGGCCCTGCAGGTCCTTGCCCCGGTAGCTGGAAGGC AGAAAGC),
- HGF1IF (CGGAGCTCATGCATCCAGGGCCAGGGCGAGGGCTAC) и HGF 12R (GGATTCCGGCAGTAGTTCTCCCGCAGGTCC),
- HGF13F (GGACCTGCGGGAGAACTACTGCCGGAATCC) и HGF 14R (GGCCAGATCTGGTCTGGGACAGGTTGCC),
- HGF15F (GACCAGATCTGGCCTGACCTGTTCAA) и
HGF16R(GATGTGCCGGTGCAGGTCCTCCATG),
- HGF17F (GGACCTGCACCGGCACATCTTCTGG) и
HGF18R (GCGCCCGGGTGGTCCAGGTTCACGATGGTAGG),
- HGF21F (GCGAGCTCGAAGACCAAGCAGCTGCGGGTGGTGAACG GGATCCCAAC) и
HGF22R(GCCGCAGATGTGCTTGTTTCTGTATCTCAGACTAACC),
- HGF23F (GAAACAAGCACATCTGCGGCGGCTCCCTGATCAAGGAG) и
HGF26R (GTAGTTAGGCAGGTCGATGGTGCTCACAAA),
- HGF25F (GATCAGATCTGGTGCTGATGAAGCTGGCCAGG) и
HGF26R(GTAGTTAGGCAGGTCGATGGTGCTCACAAA),
- HGF27F (ATCGACCTGCCTAACTACGGATGC) и
HGF28R(GCCACCCGCAGCAGGCCGTCGTAGTTGATCAGTCCAG),
- HGF29F (GACGGCCTGCTGCGGGTGGCCCACCTGTACATCATGGG) и
HGF30R (GCGAGCTCGAAGACCTTGTAGGTCAGGATGATCTT GTGGATCC) в качестве прямого и обратного праймеров.
В результате получали фрагменты ДНК, соответственно, HGF3-4, HGF5-6, HGF7-8, HGF11-12, HGF13-14, HGF15-16, HGF17-18, HGF21-22, HGF23-26, HGF25-26, HGF27-28, HGF29-30, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На третьей стадии проводили серию реакций амплификации с использованием
- фрагментов ДНК HGF3-4 и HGF5-6 в качестве матрицы и олигонуклеотидов HGF3F и HGF6R в качестве праймеров;
- фрагментов ДНК HGF5-6 и HGF7-8 в качестве матрицы и олигонуклеотидов HGF5F и HGF8R в качестве праймеров,
- фрагментов ДНК HGF11-12 и HGF13-14 в качестве матрицы и олигонуклеотидов HGF1 IF и HGF14R в качестве праймеров;
- фрагментов ДНК HGF15-16 и HGF17-18 в качестве матрицы и олигонуклеотидов HGF15F и HGF18R в качестве праймеров;
- фрагментов ДНК HGF21-22 и HGF23-26 в качестве матрицы и олигонуклеотидов HGF21F и HGF26R в качестве праймеров;
- фрагментов ДНК HGF25-26 и HGF27-28 в качестве матрицы и олигонуклеотидов HGF25F и HGF28R в качестве праймеров;
- фрагментов ДНК HGF27-28 и HGF29-30 в качестве матрицы и олигонуклеотидов HGF27F и HGF30R в качестве праймеров.
В результате получали фрагменты ДНК, соответственно, HGF3-6, HGF5-8, HGF11-14, HGF15-18, HGF21-26, HGF25-28, HGF27-30, которые очищали при помощи электрофореза в агарозном геле и электроэлюции.
На четвертой стадии проводили реакции амплификации с использованием
- фрагментов ДНК HGF3-6 и HGF5-8 в качестве матрицы и олигонуклеотидов HGF3F и HGF8R в качестве праймеров;
- фрагментов ДНК HGF25-28 и HGF27-30 в качестве матрицы и олигонуклеотидов HGF25F и HGF30R в качестве праймеров.
В результате получали фрагменты ДНК, соответственно, HGF3-8 и HGF25-30, которые очищали при помощи электрофореза в агарозном геле и электроэлюции. На пятой стадии фрагмент ДНК HGF3-8
- расщепляли рестриктазами ВаmHI и Apal и клонировали в расщепленный теми же рестриктазами вектор pBluescriptII-SK+ с получением промежуточной плазмиды pBSK-HGF3-8;
- фрагмент ДНК HGF11-14 расщепляли рестриктазами BglII и SacI и клонировали в расщепленную теми же рестриктазами плазмиду pBSKN с получением промежуточной плазмиды pBSKN-HGF11-14;
- фрагмент ДНК HGF15-18 расщепляли рестриктазами BglII и SacI и клонировали в расщепленную теми же рестриктазами плазмиду pBSKN с получением промежуточной плазмиды pBSKN-HGFl 5-18;
- фрагмент ДНК HGF21-24 расщепляли рестриктазами BglII и SacI и клонировали в расщепленную теми же рестриктазами плазмиду pBSKN с получением промежуточной плазмиды pBSKN-HGF21-24;
- фрагмент ДНК HGF25-30 расщепляли рестриктазами BglII и SacI и клонировали в расщепленную теми же рестриктазами плазмиду pBSKN с получением промежуточной плазмиды pBSKN-HGF25-30.
Встраивание соответствующих последовательностей ДНК подтверждали секвенированием.
На шестой стадии
- химически синтезированную пару олигонуклеотидов HGF9S
(GGAGAACTACTGCCGGAACCC) и HGF10A (TCGAGGGTTCCGG CAGTAGTTCTCCTGCA), BamHI - SbfI фрагмент плазмиды pBSK-HGF3-8 и Xhol - EcoRI фрагмент плазмиды pcDNA3-hHGF клонировали в вектор pBluescriptII-SK+, расщепленный рестриктазами ВаmHI и EcoRI, с получением промежуточной плазмиды pBSK-HGF3-10Z;
- SacI - BglII фрагмент плазмиды рВ SKN-HGF11-14 и BglII - Smal фрагмент плазмиды pBSKN-HGF15-18 клонировали в вектор pBluescripffl-SK+, расщепленный рестриктазами SacI и SmaI, с получением промежуточной плазмиды pBSK-HGF11-18;
- химически синтезированную пару олигонуклеотидов
HGF31S (TACAAGGTGCCACAGTCCTGATATCTGCAGT) и
HGF32A (CTAGACTGCAGATATCAGGACTGTGGCACCT), SacI - BglII фрагмент плазмиды pBSKN-HGF21-24 и BglII - BbsI фрагмент плазмиды pBSKN-HGF25-30 клонировали в вектор pBluescriptII-SK+, расщепленный рестриктазами SacI и XbaI, с получением промежуточной плазмиды pBSK-HGF21-32.
Встраивание соответствующих последовательностей ДИК подтверждали секвенированием.
На седьмой стадии
- химически синтезированную пару олигонуклеотидов HGF1S
(CATGTGG) и HGF2A (GTCACCCA) и BstEII - Асс651 фрагмент плазмиды pBSK-HGF3-10Z клонировали в плазмиду pUC-KNA, расщепленную рестриктазами Ncol и Асс651,с получением промежуточной плазмиды pUC-KHGF 1-10Z;
- химически синтезированную пару олигонуклеотидов HGF19S (CGTGATCTCTTGCGCCAAGACCA) и HGF20A (TGCTTGGTCTTGGCGCAAGAGATCACG) и SacI - SmaI фрагмент плазмиды pBSK-HGF11-18 клонировали в плазмиду pBSK-HGF21-32, расщепленную рестриктазами SacI и BbsI, c получением промежуточной плазмиды pBSK-HGF11-32.
Встраивание соответствующих последовательностей ДНК подтверждали секвенированием.
На восьмой стадии NcoI - Zsp2I фрагмент плазмиды pBSKN-HGF3-10Z и Zsp2I - Асс651 фрагмент плазмиды pBSKN-HGF11-32 клонировали в плазмиду pUC-KHGF1-10Z, расщепленную рестриктазами NcoI и Асс651, с получением промежуточной плазмиды pUC-HGFopt.
Встраивание соответствующих последовательностей ДНК подтверждали рестриктным анализом полученной плазмиды.
На девятой стадии HindIII - SbfI фрагмент и SbfI - XbaI фрагмент плазмиды pUC-HGFopt клонировали в экспрессионный вектор pC4W (ООО «Фирма Мона», Москва) расщепленный рестриктазами HindIII и XbaI, с получением плазмиды pC4W-HGFopt. Правильность встраивания оптимизированного гена HGFopt и соответствие дизайну его нуклеотидной последовательности подтверждали рестриктным анализом и секвенированием полученной плазмиды. Функциональная карта плазмиды pC4W-HGFopt, предназначенной для экспрессии гена фактора роста гепатоцитов в клетках млекопитающих, представлена на фиг.2.
Эффективность заявляемого изобретения иллюстрируется следующим примером
Пример. Клетки НЕК293, высеянные в лунки 24-луночной плашки (50000 клеток на лунку) в среде DMEM, содержащей 2% эмбриональной телячьей сыворотки, трансфицировали плазмидой pC4W-HGFopt, несущей оптимизированный ген фактора роста гепатоцитов человека HGFopt. Трансфекцию проводили с использованием 1 мкг ДНК и 1 мкл реагента Липофектамин 2000 (Invitrogen) в соответствии с протоколом производителя. Через 24 ч после трансфекции культуральную среду заменяли на свежую. Анализировали накопление HGF в культуральной среде за следующие 48 часов. Концентрацию HGF в культуральной среде измеряли при помощи набора "Human HGF Immunoassay Kit" компании Biosource International (США) в соответствии с протоколом производителя. Согласно этим измерениям концентрация HGF в культуральной среде составляла 1,4 мкг/мл.
Для наблюдения экспрессии HGF после трансфекции клеток использовали метод вестерн-блоттинга. Электрофорез белков в 10%-ном полиакриламидном геле проводили в денатурирующих условиях в присутствии додецилсульфата натрия без добавления бета-меркаптоэтанола. На дорожки геля наносили по 30 мкл культуральной среды.
Перенос белков из геля на PVDF-мембрану (Millipore) осуществляли в полусухих условиях в стандартном буфере. После переноса мембрану проинкубировали в 5%-ном растворе обезжиренного молока в TBS-буфере (Tris buffer saline) с 0,001%-ным Tween 20 (Pierce) в течение ночи при температуре +4°С. Далее проводили инкубацию с мышиными моноклональными антителами против HGF человека фирмы R&D Systems (США), которые разводили в 500 раз в 5% обезжиренном молоке в TBS-буфере с 0,001%-ным Tween 20. Мембрану троекратно отмывали в 5%-ном растворе обезжиренного молока в TBS-буфере с 0,001%-ным Tween 20 в течение 15 минут и инкубировали с меченными пероксидазой крысиными антителами против иммуноглобулинов мыши в 5%-ном обезжиренном молоке с 0,001%-ным Tween 20 при комнатной температуре в течение 60 мин. После этого мембрану обрабатывали набором реактивов двухкомпонентной системы ECL (Pierce) и экспонировали с рентгеновской пленкой "Bio Max" (Kodak). Результаты представлены на фиг.3, где приведен вестерн-блоттинг белков культуральной среды клеток НЕК293, трансфицированных плазмидой pC4W-HGFopt (дорожка 1). Для сравнения на дорожку 2 нанесен рекомбинантный фактор роста гепатоцитов человека.
Полученные результаты о высокой эффективности плазмиды pC4W-HGFopt с использованием модифицированного гена HGFopt. Выход целевого белка по сравнению с использованием плазмиды с природным геном увеличивается примерно в 2 раза.
Ген фактора роста гепатоцитов человека, оптимизированный для экспрессии в клетках млекопитающих и обладающий последовательностью нуклеотидов, приведенной на фиг.1.