Способ прогнозирования бесплодия у женщин - работниц нефтехимических производств
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к области молекулярной биологии и генетики. Для определения риска развития нарушений репродуктивной функции у работниц нефтехимического производства, подвергшихся комбинированному комплексному воздействию химических веществ, выделяют ДНК из лимфоцитов периферической венозной крови, проводят генотипирование полиморфизма A2455G и Т3801С гена CYP1A1 и -163С/А и -2467delT гена CYP1A2. При обнаружении гаплотипа CYP1A1*2A, генотипа *1А*1А полиморфных локусов -163С/А и -2467delT гена CYP1A2, гаплотипа CYP1A2*ID прогнозируют развитие бесплодия. При определении гаплотипа CYP1A2*1L прогнозируют устойчивость к формированию бесплодия у работниц. Использование изобретения позволяет получить прогностические критерии развития бесплодия или устойчивости к нему на основе молекулярно-генетических маркеров у женщин-работниц нефтехимических производств. 3 табл.
Реферат
Изобретение относится к медицине, а именно к области молекулярной биологии и генетики, и может быть использовано, в частности, в акушерстве и гинекологии при определении риска развития нарушений репродуктивной функции у работниц нефтехимического производства, подвергшихся комбинированному комплексному воздействию химических веществ (предельные, непредельные, ароматические, хлорированные углеводороды и др.).
Изучение генов ферментов метаболизма ксенобиотиков на молекулярном уровне позволяет установить причинную связь действующего производственного химического фактора с возникающими патологическими изменениями в организме работниц. В этом случае варианты генетического полиморфизма ферментов метаболизма ксенобиотиков, ассоциированных с предрасположенностью к развитию бесплодия, изменением менструального цикла за время работы женщин, а также наличием у женщин детей с врожденными пороками развития (ВПР), являются основанием для выделения в группе работниц лиц, обладающих повышенной чувствительностью к воздействию производственных химических факторов.
Репродуктивная система уязвима в отношении воздействия ксенобиотиков, а изменения, затрагивающие генетический материал генеративных клеток, приводят к серьезным патологиям плода, проявляющимся в виде мертворождений, врожденных пороков развития или отдаленных эффектов. Изучение генов, контролирующих активность ферментов микросомальной монооксигеназной системы, может выявить предрасположенность к заболеваниям репродуктивной системы, вызванным действием токсичных производственных факторов.
Система цитохрома Р-450, называемая также микросомальной системой метаболизма или монооксигеназной системой, локализована в основном в мембранах эндоплазматического ретикулума. Данный класс ферментов в организме выполняет две важнейшие функции [Кулинский В.И., Колесниченко Л.С. Биологическая роль глутатиона // Успехи современной биологии. - 1990. - Т.110, № 1. - С.20-33; Кулинский В.И. Обезвреживание ксенобиотиков // Соросовский образовательный журнал. - 1999. - №1. - С.8-12]. Во-первых, они играют важную роль в эндогенном метаболизме; во-вторых, участвуют в первой фазе биотрансформации поступающих извне химических соединений (ксенобиотиков) путем образования в молекуле гидрофильных функциональных групп [Райс Р.X., Гуляева Л.Ф. Биологические эффекты токсических соединений. - Новосибирск: изд-во НГУ, 2003; Баранов B.C., Баранова Е.В., Иващенко Т.Е. Геном человека и "гены предрасположенности". Введение в предиктивную медицину. СПб.: Интермедика - 2000. - 272 с.; Nebert D.W. Drug-metabolizing enzymes, polymorphisms and interindividual response to environmental toxicants // Clin. Chem. Lab. Med. - 2000. - V.38, № 9. - P.857-61]. Обеспечивая утилизацию кислорода для биотрансформации химических соединений, цитохром Р450-зависимые монооксигеназы в определенных условиях способны к генерации активных форм кислорода, а также других короткоживущих молекул (оксид азота) и являются одной из основных прооксидантных систем клетки [Сибиряк С.В., Вахитов В.А., Курчатова Н.Н. Цитохром Р450 и иммунная система. «Гилем» - Уфа, 2003 - 210 с.]. Монооксигенирование ксенобиотиков не всегда сопровождается их детоксикацией, а наоборот, может приводить к токсификации некоторых веществ (полициклические ароматические углеводороды, азобензолы, ароматические амины, толуол, анилин). В основе многообразия реализуемых реакций лежит множественность цитохромов Р450, представляющих собой целое суперсемейство изоферментов. Суперсемейство генов, кодирующих различные изоформы цитохромов Р450, представлено приблизительно 100 генами, картированными на разных хромосомах [там же]. Один из наиболее известных представителей семейства цитохромов Р450 - цитохром Р450 1А1 (арилгидрокарбонкарбоксилаза), кодируемый геном CYP1A1.
Ген CYP1A1 расположен на 15 хромосоме на участке q22-q24, экспрессируется преимущественно в лёгких, печени, желудочно-кишечном тракте, головном мозге, лимфоцитах и макрофагах [там же]. Известно несколько полиморфизмов этого гена. Один из них - однонуклеотидный полиморфизм 7-го экзона, представленный транзицией аденина на гуанин в положении 2455 (2455A/G), который приводит к замене аминокислоты изолейцин на валин в 462 кодоне молекулы цитохрома Р-450 (Ile462Val), расположенном в каталитическом центре фермента [Hayashi S.I., Watanabe J., Nakachi K., Kawajiri K. PCR detection of an A/G polymorphism within exon 7 of the CYP1A1 gene //Nucleic Acids Res. - 1991. - V.19, №17. - P.4797]. В результате такой замены продуцируется «быстрая» форма фермента, что ведет к накоплению промежуточных токсических метаболитов фазы I [Cosma G., Crofts F., Taioli E., Toniolo P., Garte S. Relationship between genotype and function of the human CYP1A1 gene //J Toxicol Environ Health. - 1993- V.40, № 2-3, P.309-16].
Ещё одним представителем семейства CYP1 является ген CYP1A2. Субстратами для CYP1A2 являются гетероциклические амины, ариламины и нитрозоамины, ПАУ. В последнее время появились доказательства участия этого фермента в метаболизме эндогенных соединений, в том числе стероидов. Цитохром р-450 1А2 играет основополагающую роль в метаболизме многих лекарственных препаратов (клозапин, кофеин, парацетамол, фенацетин, теофилин и т.д.) и нейротоксинов [Sachse С., Brockmoller J., Bauer S., Roots I. Functional significance of a C-->A polymorphism in intron 1 of the cytochrome Р450 CYP1A2 gene tested with caffeine//Br J Clin Pharmacol. - 1999. - V.47(4). P.445-9]. Метаболитическая активация ариламинов осуществляется в два этапа. На первом происходит N-гидроксилирование CYP1A2, за тем следует О-этерификация, катализируемая N-ацетилтрансферазой. Кроме того, цитохром р-450 1А2 определяет эстрогенное воздействие на организм, поскольку отвечает за метаболизм 17β-эстрадиола.
Ген CYP1A2 включает 7 экзонов в локусе 15q22 и имеет более 40 однонуклеотидных полиморфизмов (SNPS). Содержит 7.8 kb и состоит из 7 экзонов. Кодирующий регион начинается с 10 нуклеотида 2 экзона. Известно, что 2-6 экзоны являются высоко консервативными для человека, мыши и крысы. Высококонсервативные регионы были обнаружены и в 1 интроне, что прогнозирует его регуляторную роль. Ферменты CYP1A2 и CYP1A1 имеют 71% схожесть последовательности аминокислот и соответственно перекрывающуюся субстратную специфичность.
Индивидуальные различия в уровне CYP1A2 опосредуются также наличием генетического полиморфизма гена CYP1A2. Первоначально описывалось 4 полиморфизма гена CYP1A2: A (G-3860A), В (T-2467delT), С (Т-739G) и D (A-163C), которые впоследствии получили наименование CYP1A2*1В, 1D, 1E и 1F, соответственно. В последующих работах были выявлены и другие SNPs и высказано предположение, что наиболее функционально значимыми являются только CYP1A2*1D и CYP1A2*1F [Sachse С., Bhambra U., Smith G., Lightfoot T.J., Barrett J.H., Scollay J., Garner R.C., Boobis A.R., Wolf C.R., Gooderham N.J. Polymorphisms in the cytochrome P450 CYP1A2 gene (CYP1A2) in colorectal cancer patients and controls: allele frequencies, linkage disequilibrium and influence on caffeine metabolism //Br J Clin Pharmacol. - 2003. - V.55(l). P.68-76]. Установлено, что полиморфизм 1 интрона гена CYP1A2 (-163А/С CYP1A2*1F) приводит к изменению каталитической активности фермента и увеличению его индуцибельности [Murayama N., Minoshima M., Shimizu M., Guengerich F.P., Yamazaki H. Involvement of human cytochrome P450 2B6 in the omega- and 4-hydroxylation of the anesthetic agent propofol. // Xenobiotica. - 2007 - V.37, №7, P.717-24]. Что же касается других вариантов этого гена, в частности CYP1A2*1D, то их функциональная значимость не достаточно ясна. Чаще встречаются среди европейцев и находятся в сцеплении два полиморфизма: -164А/С (аллель CYP1A2*1F) и -2464T/delT (CYP1A2*1D), что позволяет проводить рутинное генотипирование данного гена по этим вариантам [Sachse С., Bhambra U., Smith G., Lightfoot T.J., Barrett J.H., Scollay J., Gamer R.C., Boobis A.R., Wolf C.R., Gooderham N.J. Polymorphisms in the cytochrome P450 CYP1A2 gene (CYP1A2) in colorectal cancer patients and controls: allele frequencies, linkage disequilibrium and influence on caffeine metabolism // Br J Clin Pharmacol - 2003. - V.55 (1). P.68-76].
Известен способ прогнозирования преждевременной недостаточности яичников у женщин репродуктивного возраста с олигоменореей, включающий эхографическое определение объема яичников и числа антральных яичников. При выявлении наличия одного из аллелей DRB1*01, DRB*04, DRB1*03, DQB1*302, DQB1*501 HLA II класса, флюктуирующего уровня фолликулостимулирующего гормона на фоне еще сохраненного ритма менструации или первых задержек менструации и объема яичников менее 5 см3, числа антральных фолликулов менее 10, повышения пульсационного индекса более 1,1 и индекса резистентности 0,71 в воротах и паренхиме более 0,9 и 0,55 соответственно сосудистого кровотока яичников прогнозируют преждевременную недостаточность яичников [патент RU 2326386, 2008].
Известен способ оценки предрасположенности к развитию привычного невынашивания беременности, предусматривающий одновременное тестирование ДНК на наличие полиморфизма R353Q гена фактора VII свертывания крови и полиморфизма С677Т гена метилентетрагидрофолатредуктазы (MTHFR), определение генотипа пациентки с учетом данных по двум исследуемым генам и составление заключения, где генотип RRTT квалифицируется как крайне неблагоприятный, генотипы RRCC, RRCC и RQTT - как неблагоприятные, генотипы RQCC и RQCT - как благоприятные прогностические признаки [патент RU 2330071, 2008].
В имеющихся данных литературы показано наличие ассоциации полиморфных вариантов генов CYP1A1 и CYP1A2 с развитием невынашивания беременности [Хамадьянов У.Р., Викторова Т.В., Исхакова Г.М. Генетические аспекты первичного невынашивания беременности // Материалы IX Всероссийского научного форума «Мать и дитя», с.252] и эндометриоза [Абазова Э.Ф., Викторова Т.В., Исхакова Г.М., Галимов Ш.М. Оценка генетического риска развития эндометриоза у женщин в промышленном регионе // Медицинская генетика. - 2005. - Т4, №4, С.144].
В доступной научно-медицинской и патентной литературе не обнаружено сведений об известности способа прогнозирования бесплодия.
В литературе представлены данные, свидетельствующие, что свободнорадикальное окисление играет ключевую роль в патогенезе многих заболеваний. Окислительный стресс - устойчивое смещение существующего в организме про- и антиоксидантного равновесия в пользу окислительных процессов. Окислительный стресс сопровождается образованием многочисленных высокореакционных продуктов, так называемых активных форм кислорода, и затем - продуктов перекисного окисления липидов, которые способны повреждать макромолекулярные и клеточные структуры.
Попытка реализовать указанный принцип была положена в основу настоящего изобретения.
Задачей изобретения является разработка способа прогнозирования развития бесплодия, основанного на анализе микросомальной монооксигеназной системы организма женщин-работниц в условиях воздействия комплекса химических веществ.
Технический результат - получение прогностических критериев развития бесплодия или устойчивости к нему на основе молекулярно-генетических маркеров у женщин-работниц нефтехимических производств.
Предлагаемый способ осуществляется следующим образом. Производят забор венозной крови натощак. Выделяют ДНК методом фенол-хлороформной экстракции. Анализ полиморфизма A2455G и Т3801С гена CYP1A1 и -163С/А и -2467delT гена CYP1A2 проводят методом ПЦР/ПДРФ (полиморфизма длин рестрикционных фрагментов). При обнаружении гаплотипа CYP1A1*2A, генотипа *1А*1А полиморфных локусов -163C/A и -2467delT гена CYP1A2, гаплотипа CYP1A2*1D прогнозируют развитие бесплодия. При определении гаплотипа CYP1A2*1L прогнозируют устойчивость к формированию бесплодия у работниц.
Осуществление изобретения.
I. Материалы и методы.
1. Критерии отбора пациенток с ПН для проведения анализа.
В исследуемую группу отбирались женщины российской популяции, работающие лаборантами и контролерами в условиях воздействия комплекса химических веществ (предельные, непредельные, хлорированные и ароматические углеводороды и др.)
При этом в анализируемую группу не включали пациенток с наличием хромосомной патологии, воспалительных заболеваний половой сферы, анатомических аномалий репродуктивных органов. Контрольная группа формировалась из здоровых женщин российской популяции.
2. Отбор образцов крови и выделение ДНК.
Венозная кровь в объеме 10 мл забиралась в пробирки, содержащие ЭДТА в качестве антикоагулянта (1 объем раствора 0,5 М Na2-ЭДТА, pH 8,0+9 объемов крови). После тщательного перемешивания образцы помещались в морозильную камеру и хранились при -20°С. Выделение геномной ДНК проводили с помощью модифицированного метода с протеиназой К и экстракцией фенол-хлороформом. Для этого в 1,5 мл пробирку (Eppendorf) вносили 700 мкл анализируемого образца крови и 700 мкл ТЕ-буфера (10 мМ Трис-HCl, pH 8,0, 1 мМ ЭДТА) для гемолиза эритроцитов. Процедуру повторяли 2 раза, а затем к клеточному осадку добавляли 400 мкл буфера для протеиназы К, содержащего 200 мкг/мл протеиназы К, после чего инкубировали 4 часа при 60°С на термошейкере с постоянным перемешиванием (850 об/мин). Далее проводили фенол-хлороформную экстракцию ДНК с последующим осаждением 96% этанолом и центрифугированием в течение 10 мин при 10000 об/мин. После серии промывок ДНК элюировали ТЕ буфером (200 мкл). Концентрация выделенной ДНК составляла от 30 до 50 нг/мкл.
3. ПЦР-амплификация и анализ ПЦР-продуктов.
Для определения полиморфизмов в исследуемых генах применялся метод ПДРФ. ПЦР проводили в термоциклере Master Cycler Gradient фирмы Eppendorf. При этом для каждого из генов использовали специфические праймеры и условия реакции.
ПЦР проводили в объеме 25 мкл в растворе следующего состава: по 6 пмоль каждого праймера, четыре дезоксинуклеозидтрифосфата (каждый в концентрации 0,2 мМ), 1 мкл геномной ДНК, ПЦР-смесь фирмы Amplisense, содержащая Taq-полимеразу, буфер для Taq-полимеразы и MgCl2.
Для рестрикционного анализа продукты ПЦР подвергали обработке соответствующей рестриктазой в течение 6 часов. На реакцию рестрикции брали 9 мкл ампликона, 0,5 мкл рестриктазы (3-4 ЕД) и 1 мкл 10 × буфера для рестриктазы.
Продукты рестрикции/амплификации анализировали посредством электрофореза в 2% агарозном геле, содержащем 1 мкг/мл бромистого этидия. Размер фрагментов определяли с помощью стандарта массы 500 п.о. - Ladder фирмы «Fermentas».
4. Статистическая обработка результатов.
Обработку результатов, полученных при ДНК-тестировании, проводили с помощью программы «Статистика 6.0» методом χ2.
Проведенный анализ полиморфизма генов монооксигеназной системы CYP1A1, CYP1A2 показал наличие различий в распределении генотипов сравниваемых группах работниц и женщин контрольной группы.
У работниц ОАО «Салаватнефтеоргсинтез» установлены генетические маркеры предрасположенности к развитию репродуктивной патологии по вариантам: *1А*2А гена CYP1A1 (A2455G), *1А*1А гена CYP1A1 (Т3801С), *1А*1А гена CYP1A2 (-163С/А), *1А*1А гена CYP1A2 (-2467delT), гаплотипа CYP1A1*2A и гаплотипа CYP1A2*1D.
Осуществление изобретения включало следующие этапы:
а) изучение полиморфных маркеров гена ферментов микросомальной монооксигеназной системы CYP1A1, CYP1A2 у женщин-работниц с нарушением репродукции;
б) анализ ассоциации полиморфных вариантов генов ферментов микросомальной монооксигеназной системы (CYP1A1, CYP1A2) с развитием репродуктивной патологии при воздействии токсических веществ.
Проведён анализ полиморфных вариантов генов CYP1A1 (2455A/G, 3801Т/С), CYP1A2 (-2464T/delT, -163С/А) в группах работниц с нарушением репродукции.
Проведение ДНК-диагностики пациенток с целью определения аллельных вариантов проводилось, главным образом, с помощью метода полиморфизма длин рестрикционных фрагментов, однако следует иметь в виду, что при осуществлении предлагаемого способа может быть применен любой из известных ныне методов, обеспечивающий надежное детектирование точечных замен в последовательности ДНК, в частности аллель-специфичная ПЦР, масс-спектрометрия, метод гибридизации, ПЦР в реальном времени и т.д.
Проведенный анализ ДНК у 238 женщин-работниц выявил следующие результаты:
при наличии гаплотипа CYP1A1*2А, генотипа *1А*1А полиморфных локусов -163С/А и -2467delT гена CYP1A2, а также гаплотипа CYP1A2*1D прогнозируется развитие бесплодия. При определении гаплотипа CYP1A2*1L прогнозируется устойчивость к формированию бесплодия у работниц.
Примеры реализации и результаты.
1. В работе исследованы образцы ДНК 238 женщин, работающих на предприятии ОАО «Салаватнефтеоргсинтез» в возрасте от 20 до 55 лет (средний возраст 32,7±1,2). Анализ исследуемой выборки показал, что 93.3% обследуемых имели стаж работы в условиях вредных производств свыше 5 лет. По профессиональному составу основную массу составили лаборанты (16.4%) и контролеры (66%). Контрольную группу составили 300 практически здоровых неродственных фертильных женщин, проживающих в Республике Башкортостан и не имеющих профессионального контакта с токсичными веществами. Средний возраст женщин контрольной группы составил 41±14.8 лет. Контрольная группа подобрана с учетом возраста и этнической принадлежности.
Выявлено, что осложнения, связанные с беременностью, встречаются у 50% работниц. Ведущими осложнениями беременности у женщин являются токсикоз первой половины беременности (34.8%), токсикоз второй половины беременности (25.3%), анемия (25.0%), угроза прерывания беременности (34.8%).
По клиническим признакам исследуемая выборка была разделена следующим образом:
а) первую группу составили женщины с бесплодием (n=19);
б) вторую группу (группу "риска" по развитию бесплодия) (n=48);
в) третью группу составили женщины, имеющие детей с врожденными пороками развития (ВПР) и мертворожденных детей (n=48);
в) четвертая группа была представлена здоровыми женщинами-работницами (n=122).
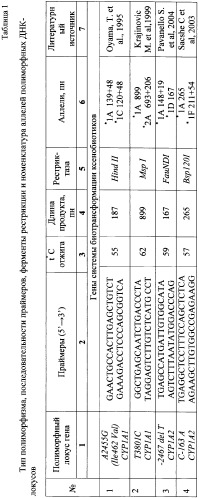
Пример 2. Проведение полимеразной цепной реакции синтеза ДНК и рестрикционного анализа.
Анализ полиморфных локусов генов цитохромов Р450: CYP1A1 (Т3801С, A2455G), (С-164А, T-2464delT) (номенклатура аллелей приведена согласно www.imm.ki.se/CYPalleles/ Human Cytochrome P-450 (CYP) genes: a web page for the nomenclature of alleles) проводили методом полимеразной цепной реакции синтеза ДНК (ПЦР) на термоциклере в автоматическом режиме с использованием локусспецифических олигонуклеотидных праймеров. Перечень исследованных локусов, последовательности специфических олигонуклеотидных праймеров, а также номенклатура аллелей представлены в табл.1. Во всех случаях реакционная ПЦР - смесь содержала следующие обязательные компоненты: 1,25 мкл 1 × ПЦР-буфера (60 мМ Tris-HCl pH 8.5), 1,5 mM MgC12, 25 mМ KCl, 10 mM 2-меркаптоэтанол, 0.1% тритон Х-100), 200 мМ каждого dNTP, по 1 мкл соответствующих праймеров, примерно 100 нг геномной ДНК, 1 ед. Taq-полимеразы («Сибэнзим») и необходимое количество деионизированной воды до объема 12.5 мл. В случае необходимости для некоторых локусов для локусов генов CYP1A1 (Msp I) добавляли бычий сывороточный альбумин (10Х) с целью оптимизации ПЦР.
Пример 3. Проведение статистического анализа ДНК.
Математическую обработку результатов исследования проводили с использованием пакетов статистических программ: STATISTICA v.6.0, Microsoft Access, BIOSTAT (Primer of Biostatistics version 4.03), а также программы "The EH software program" (Rockefeller University; New York, NY).
Частоты аллелей и генотипов изученных локусов, соответствие распределения частот генотипов равновесию Харди-Вайнберга (χ2) определяли по стандартным формулам при помощи программы BIOSYS-2 [Swofford L., Selander В. 1997. BIOSYS-2: Computer program for the analysis of allelic variation in genetics. Department of genetics and development University of Illinois].
Частоты гаплотипов сцепленных локусов генов (CYP1A1, CYP1A2) рассчитывали в программе "The EH software program" с использованием ЕМ алгоритма (Expectation-Maximization algorithm) и метода максимального подобия [Xie X., Ott J. 1993. Testing linkage disequilibrium between a disease gene and marker loci. Am. J. Hum. Genet. 53, 1107].
Для сравнения распределения частот аллелей в различных группах использовали критерий χ2 с поправкой Йетса на непрерывность (при числе единиц наблюдения менее 10).
В случае попарного сравнения выборок по частоте одного признака, т.е. когда k=2 и m=2, использовали точный критерий Фишера [Животовский Л.А. // Популяционная биометрия. М.: Наука, 1991. - С.120-137]:
χ2[N1N2(p1-p1)]/[Npcp(1-pcp)];
здесь pcp=(p1N1+p2N2)/N - средневзвешенная частота фенотипа. Уровень значимости определяется по χ2 критерию с одной степенью свободы.
Ассоциацию генотипов, аллелей и гаплотипов с развитием заболевания выявляли, сравнивая выборки больных и здоровых индивидов по частоте одного признака с использованием критерия χ2. Статистически значимыми считали различия при p<0.05.
Относительный риск заболевания по конкретному признаку вычисляли как соотношение шансов (OR -odds ratio): OR = (a x d)/(b x c),
где a - частота аллеля (генотипа) в выборке больных, b - частота аллеля (генотипа) в контрольной выборке, с - сумма частот остальных аллелей (генотипов) в выборке больных, d - сумма частот остальных аллелей (генотипов) в контрольной выборке. Доверительный интервал для относительного риска рассчитывали по следующей формуле:
В случае, когда один из показателей был равен 0, показатель OR вычислялся по формуле: [(2a+1)·(2d+1)]/[(2b+1)·(2c+1)] (Schlesselman J., Case-control studies. Design, conduct, analysis//New York, Oxford: Oxford University Press. - 1982. - P.58-96).
Значение OR=1 показывало отсутствие ассоциации, значение OR>1 рассматривали как положительную ассоциацию заболевания с признаком («фактор риска»), OR<1 - как отрицательную ассоциацию («фактор устойчивости»).
С целью выявления генотипов, определяющих чувствительность организма женщин к действию токсичных производственных факторов, группу женщин-работниц сравнивали с контрольной группой женщин, не имеющих профессиональной токсической нагрузки.
Для идентификации генотипов, ассоциированных с предрасположенностью к бесплодию, проводили сравнение между женщинами с бесплодием и здоровыми женщинами-работницами.
Для выявления генотипов, ассоциированных с развитием гинекологической патологии, сравнивали группу "риска"со здоровыми женщинами-работницами.
Для определения генотипов, ассоциированных с риском формирования врожденных пороков развития (ВПР) у детей, сравнивали женщин, имеющих детей с ВПР или мертворожденных детей, со здоровыми женщинами, имеющими здоровых детей.
Проведение анализа ДНК на носительство полиморфных вариантов A2455G и Т3801С гена CYP1A1 и его результаты.
Отбор образцов крови, выделение ДНК, ПЦР-амплификацию и анализ ПЦР-продуктов проводили в соответствии с методиками, описанными в разделе «Материалы и методы».
ПЦР проводили при следующих условиях: денатурация (94°С, 5 мин) - 1 цикл, денатурация (94°С, 60 с), отжиг (55, 62°С, 60 с) и элонгация (72°С, 60 с) - 30 циклов, конечная элонгация (72°С, 5 мин) - 1 цикл.
Для получения специфических рестрикционных фрагментов применяли рестриктазу Hind II (А2455) и Msp I (T3801C). О наличии в образце определенных аллельных вариантов гена CYP1A1 судили по появлению в геле фрагментов с размерами, указанными в табл.1.
При проведении ДНК-тестирования на носительство полиморфизма A2455G были получены следующие результаты.
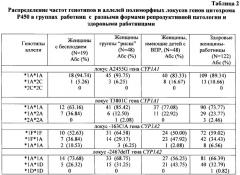
а) Определение частоты встречаемости аллелей в группе доноров показало соответствие этого показателя равновесию Харди-Вайнберга, что свидетельствовало о репрезентативности выборки. Распределение частот генотипов и аллелей по полиморфному маркеру A2455G гена CYP1A1 в группе женщин-работниц и в контрольной группе было сходным (χ2=1.20, р=0.548 для генотипа). Так, частота гомозиготного генотипа *1А*1А была одинаково высока как в группе работниц (89.34%), так и в группе здоровых женщин (90.67%), а гетерозиготы *1А*2С встречались с частотой 10.66% и 8.67%, соответственно.
Анализ распределения частот аллелей и генотипов полиморфного маркера T3801C гена CYP1A1 установил сходные частоты в группе работниц и в контроле (табл.2) (χ2=0.568, р=0.753). Анализ распределения частот генотипов полиморфизма T3801C гена CYP1A1 показал повышение частоты варианта *1А*2А у женщин с бесплодием (36.84%) и снижение частоты данного генотипа у женщин группы риска (12.50%) по сравнению со здоровыми работницами. Анализ гаплотипов гена CYP1A1 показал повышение частоты гаплотипа CYP1A1*2А до 16.67% у женщин с бесплодием по сравнению с 8.16% гаплотипа CYP1A1*2А среди здоровых женщин.
На основании результатов тестирования ДНК на носительство полиморфных вариантов A2455G и T3801C гена CYP1A1 был сделан вывод, что носительство гаплотипа CYP1A1*2A является при прогнозировании бесплодия выраженным неблагоприятным признаком OR=, а гаплотипы *1А, *2С и *2В гена CYP1A1 с точки зрения предрасположенности к заболеванию представляются нейтральными.
Пример 3. Проведение анализа ДНК на носительство полиморфных вариантов -163 С/А и -2467delT гена CYP1A2 и его результаты.
Отбор образцов крови, выделение ДНК, ПЦР-амплификацию и анализ ПЦР-продуктов проводили в соответствии с методиками, описанными в разделе «Материалы и методы». При этом для амплификации использовали праймеры, представленные в таблице 1.
ПЦР проводили при следующих условиях: денатурация (94°С, 5 мин) - 1 цикл, денатурация (94°С, 30 с), отжиг (59, 57°С, 30 с) и элонгация (72°С, 30 с) - 30 циклов, конечная элонгация (72°С, 5 мин) - 1 цикл. О наличии в образце определенных аллельных вариантов -163С/А и -2467delT гена CYP1A2 судили по появлению в гене фрагментов с размерами, указанными в табл. 1.
При проведении ДНК-тестирования на носительство аллельных вариантов -163С/А и -2467delT гена CYP1A2 были получены следующие результаты.
а) Определение частоты встречаемости аллелей и генотипов полиморфных вариантов -163С/А и -2467delT гена CYP1A2 в группе контроля показало соответствие этого показателя равновесию Харди-Вайнберга, что свидетельствовало о репрезентативности выборки. Изучение частот аллелей и генотипов полиморфных маркеров гена CYP1A2 -163С/А и -2467delT установило достоверное повышение частоты генотипа *1F*1F (-163C/A) до 59.02% по сравнению с 41.67% в контрольной группе женщин (χ2=10.629, р=0.005). Сходное распределение аллелей и генотипов полиморфного маркера -2467delT гена CYP1A2 наблюдалось в группах работниц и в контроле.
б) Анализ частот генотипов полиморфного локуса -163С/А CYP1A2 установил тенденцию к повышению частоты гомозиготного генотипа *1А*1А у работниц с бесплодием до 10.53% против 6.56% в группе здоровых женщин. Изучение полиморфного локуса -2467delT CYP1A2 показало увеличение частоты генотипа *1А*1А среди женщин с бесплодием (73,68%) и снижение частоты этого варианта до 56.25% среди женщин, имеющих детей с ВПР, по сравнению со здоровыми работницами (табл.2).
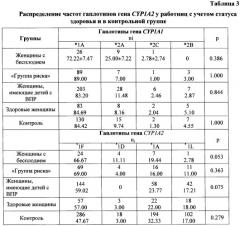
Анализ гаплотипического распределения гена CYP1A2 установил повышение частоты гаплотипа CYP1A2*1D у женщин с бесплодием до 11.11% по сравнению с 3.00% среди здоровых работниц. Выявлено, что гаплотип CYP1A2*1L достоверно чаще встречался у здоровых работниц и его частота составила 18.00%, тогда как у женщин с бесплодием на его долю приходилось 2.78% (χ2=3.915, р=0.047) (табл. 3).
На основании полученных данных был сделан вывод, что гомозиготное носительство аллеля *1А полиморфизмов -163С/А и -2467delT гена CYP1A2, а также носительство гаплотипа CYP1A2*1D при прогнозировании бесплодия должно рассматриваться как предрасполагающий к бесплодию признак. Гаплотип CYP1A2*1L может быть определен как протективный (препятствующий развитию патологии) признак.
Способ оценки предрасположенности к развитию бесплодия у женщин, подвергшихся комбинированному комплексному воздействию химических веществ, характеризующийся тем, что из лимфоцитов периферической венозной крови выделяют ДНК, проводят генотипирование полиморфизма A2455G и Т3801С гена CYPlA1 и -163С/А и -2467delT гена CYPlA2 и при обнаружении гаплотипа CYPlA1 *2А, генотипа *1А*1А полиморфных локусов -163С/А и -2467delT гена CYPlA2, гаплотипа CYPlA2* ID прогнозируют развитие бесплодия, а при определении гаплотипа CYPlA2* 1L прогнозируют устойчивость к формированию бесплодия у женщин.