Покрытие предметных стекол для проведения иммуноцитохимических и гистологических исследований
Иллюстрации
Показать всеИзобретение относится к общим и частным гистологическим исследованиям. Для исследования гистологических препаратов срезы биологических тканей необходимо наклеивать на предметные стекла, а затем производить их окрашивание и изучение биологического материала под микроскопом. Предлагаемое покрытие для предметных стекол представляет собой бычий сывороточный альбумин, а его использование по предлагаемому назначению заключается в том, что срезы биологического материала, полученного при производстве биопсий, патологоанатомических и судебно-медицинских вскрытий, наклеивают на предметные стекла, обработанные адгезивным раствором, содержащим бычий сывороточный альбумин (фракция V по Кону). В иммунологии, в том числе и в иммуноцитохимических исследованиях, бычий сывороточный альбумин (фракция V по Кону) используют для блокировки неспецифического связывания антител с тканевыми антигенами. Использование бычьего сывороточного альбумина в качестве адгезива обеспечивает стойкое прилипание срезов и способствует сохранению их на предметных стеклах во время проведения любых гистологических методик, не влияя на сроки хранения препаратов и качество сохраняемых препаратов. 2 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к медицине, а именно к диагностическим гистологическим исследованиям, к проведению иммуноцитохимических исследований, при которых срезы биологического материала изучают под микроскопом на предметных стеклах.
Заявляемое покрытие для предметных стекол характеризуется тем, что является бычьим сывороточным альбумином - фракция V по Кону, который обычно используется в иммуноцитохимических исследованиях для блокировки неспецифического связывания антител с тканевыми антигенами. По изобретению срезы биологического материала, полученного при производстве биопсий, патологоанатомических и судебно-медицинских вскрытий наклеивают на предметные стекла, обработанные адгезивным раствором, содержащим бычий сывороточный альбумин. В результате препараты для исследований получаются качественными, длительно хранящимися без каких-либо изменений.
При изготовлении гистологических препаратов издавна встречались с проблемой потери срезов биологических тканей при их наклеивании на предметные стекла. Даже при проведении обычного окрашивания препаратов гематоксилин-эозином срезы отклеиваются независимо от типа исследуемой ткани. Манипулирование со стеклами, содержащими толстые срезы (10 мкм и более), необходимые для некоторых исследований, например: нейрогистологические исследования, конфокальная микроскопия, - требует чрезвычайной аккуратности и высокой квалификации от исследователя, чтобы сохранить срезы на стеклах до конца необходимой процедуры окрашивания. Использование хорошо обезжиренных предметных стекол без использования адгезивов не изменяет ситуацию. В результате происходит потеря ценного, иногда невосполнимого материала, расход дорогостоящих реактивов и напрасно затраченный труд исследователя.
Ранее были предложены различные адгезивы, обеспечивающие надежное прилипание срезов к предметным стеклам (желатин, казеин, белок куриного яйца) [Практическая иммуногистохимия, 2002, СПб, с.19, Микроскопическая техника, 1996, М., с.35]. Наибольшее распространение среди них получил белок куриного яйца из-за дешевизны и удобства его применения, однако использовать его при постановке иммуноцитохимических реакций не рекомендуется в связи с возможностью неспецифического фонового окрашивания [Молекулярная клиническая диагностика. Методы, 1999, М., с.77], препятствующего правильной интерпретации результатов окраски.
Известен способ использования свежей цельной сыворотки животных [Курс патологической техники, 1969, Ленинград, с 103] для наклеивания срезов на предметные стекла, однако он неприменим в иммуноцитохимических исследованиях из-за возможности развития перекрестной реакции иммуноглобулинов сыворотки с иммуноцитохимическими реагентами. Вследствие этого развивается интенсивное окрашивание фона препаратов, и результаты исследования становятся неудовлетворительными.
В настоящее время весьма ограниченное распространение (из-за очень высокой стоимости, недоступной большинству лабораторий) получили предметные стекла, заранее обработанные адгезивными веществами - полилизином и аминоалкилсиланом. Самостоятельная же подготовка таких стекол трудоемка и сопряжена с использованием токсических соединений [Практическая иммуногистохимия. 2002, СПб, с.19].
Чтобы избежать негативных свойств распространенных адгезивов, сделать доступными для иммуноцитохимического исследования обычные предметные стекла и сохранить срезы путем их закрепления на поверхности предмеиного стекла, был использован бычий сывороточный альбумин, фракция V по Кону (БСА). Обычно он используется для блокировки неспецифического связывания антител и как антиагрегант при производстве иммуноцитохимических и гибридизационных исследований [Молекулярная клиническая диагностика. Методы, 1999, М., с 77-115].
При применении БСА в качестве покрытий для предметных стекол для фиксирования биологических срезов развитие неспецифического фона невозможно, так как БСА сам не вступает в реакцию связывания с первичными антителами.
В результате была получена хорошо воспроизводимая методика. Использование БСА в заявляемом покрытии способствует отсутствию перекрестной реакции реагентов и неспецифического фона. Покрытие обладает ценовой доступностью и простотой изготовления таких предметных стекол. Сухие, обработанные раствором БСА стекла можно как использовать непосредственно после приготовления, так и хранить сложенными в картонные коробочки (при комнатной температуре - не менее 1 недели, при 4°С - не менее 1 месяца). Разведенный раствор для покрытия можно хранить при 4°С не более 6 месяцев. Сохраняемость срезов на стеклах увеличилась до 98% (вместо 60%).
Для получения покрытия на чистые обезжиренные стекла наносят раствор, состоящий из 0,1-0,3% БСА в дистиллированной воде или БСА в насыщенном растворе камфоры в 50% водном растворе глицерина в соотношении 0,8-1,2 г БСА и 3,6-4,4 мл насыщенного раствора камфоры в 50% водном растворе глицерина.
Описание эксперимента. Покрытие наносится на предметное стекло одним из способов: 1) путем размазывания капли разведенного водой (1:20) раствора БСА (в насыщенном растворе камфоры в 50% водном растворе глицерина) с помощью шлифованного края любого другого стекла, размер капли 5-10 мкл;
2) путем помещения предметных стекол в стакан с 0,1-0,3% водным раствором БСА с последующим высушиванием при комнатной температуре или в термостате при 37°С.
На покрытых таким образом стеклах работают с исследуемым материалом по стандартной методике, как и при других используемых в практике покрытиях.
1. Извлеченные для исследования кусочки ткани почки помещали в 10% формалин или другие формалинсодержащие фиксаторы на 18-24 часа.
2. Фиксированные кусочки ткани обезвоживали этиловым спиртом и заливали в парафин.
3. Из парафиновых блоков на ротационном микротоме Leica RM 2125RT готовили срезы толщиной 5 мкм и наклеивали на предметные стекла с нанесенным БСА.
4. Обеспарафиненные и регидратированные обычным способом предметные стекла со срезами помещали в стаканчик с 3% перекисью водорода (3%Н2О2) на 5-10 мин для блокировки эндогенной пероксидазы (или капали 3%Н2О2 на срезы на аналогичное время).
5. Смывали 3% Н2О2 дистиллированной водой и помещали в фосфатный буфер рН 7,4 на 5-10 мин.
6. Аккуратно обводили срезы гидрофобным фломастером. Блокировочный раствор 5% БСА наносили на срезы и оставляли при комнатной температуре на 10 мин.
7. Удаляли излишек блокировочного раствора без промывки, аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, наносили на срезы необходимое количество (для покрытия срезов) антител. Помещали стекла во влажную камеру и ставили в термостат, установленный на оптимальную для инкубации температуру и на время, необходимое для связывания тканевого антигена с антителами.
8. Смывали антитела фосфатным буфером рН 7,4 и помещали в свежую порцию того же буфера на 5-10 мин.
9. Аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, обрабатывали срезы при помощи вторичных реагентов в соответствии с рекомендациями производителя.
10. Смывали антитела фосфатным буфером рН 7,4 и помещали в свежую порцию того же буфера на 5-10 мин.
11. Аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, наносили на срезы необходимое количество рабочего раствора DAB+(Dako). В течение 1-3 мин происходит образование окрашенного продукта гистохимической реакции. Этот процесс необходимо контролировать под микроскопом, чтобы остановить реакцию до появления осадка бензидина.
12. Смывали раствор хромогена и промывали препараты в 2-3 порциях дистиллированной воды по 10-15 мин в каждой.
13. При необходимости препараты подкрашивают гематоксилином или другими гистологическими красителями.
14. Обезвоживали и просветляли препараты в батарее: 96° этанол, 99% изопрапанол, изопрапанол:ксилол 1:14 ксилол 1, ксилол 2 (каждая ванна минимум по 1-2 мин) и заключали в канадский бальзам или DPX и др. подобные среды.
Возможность осуществления изобретения представлена тремя примерами (аутопсия - почка, биопсия - кишка, аутопсия - головной мозг).
Пример 1.
На предметные стекла с нанесенным 0,1-0,3% БСА в водном растворе приклеивали срезы почки человека (аутопсия)
Описание способа
1. Извлеченные для исследования кусочки ткани почки помещали в 10% формалин на 24 часа.
2. Фиксированные кусочки ткани обезвоживали этиловым спиртом и заливали в парафин.
3. Из парафиновых блоков на ротационном микротоме Leica RM 2125RT готовили срезы толщиной 5 мкм и наклеивали на предметные стекла с нанесенным БСА.
4. Обеспарафиненные и регидратированные обычным способом предметные стекла со срезами помещали в стаканчик с 3% перекисью водорода на 5-10 мин для блокировки эндогенной пероксидазы.
5. Смывали перекись дистиллированной водой и помещали в фосфатный буфер рН 7,4 на 5-10 мин.
6. Аккуратно обводили срезы гидрофобным фломастером. Блокировочный раствор 5% БСА наносили на срезы и оставляли при комнатной температуре на 10 мин.
7. Удаляли излишек блокировочного раствора без промывки, аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, наносили на срезы необходимое количество (для покрытия срезов) антител к альфа-актину. Помещали стекла во влажную камеру и ставили в термостат, установленный на 37°С на 30 мин.
8. Смывали антитела фосфатным буфером рН 7,4 и помещали в свежую порцию того же буфера на 5-10 мин.
9. Аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, наносили на срезы необходимое количество вторичных антител из набора LSAB2 (Dako) и оставляли на время на 35 мин при комнатной температуре.
10. Смывали антитела фосфатным буфером рН 7,4 и помещали в свежую порцию того же буфера на 5-10 мин.
11. Аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, наносили на срезы необходимое количество стрептавидин-пероксидазы из набора LSAB2 (Dako) и оставляли на время на 15 мин при комнатной температуре.
12. Смывали реагент фосфатным буфером рН 7,4 и помещали в свежую порцию того же буфера на 5-10 мин.
13. Аккуратно промокнув фильтровальной бумагой стекло вокруг срезов, наносили на срезы необходимое количество рабочего раствора DAB+(Dako) до образования окрашенного продукта гистохимической реакции.
14. Смывали раствор хромогена и промывали препараты в 2 порциях дистиллированной воды по 10-15 мин в каждой.
15. Препараты подкрашивали гематоксилином.
16. Обезвоживали и просветляли препараты в батарее: 96° этанол, 99% изопрапанол, изопрапанол: ксилол 1:1, ксилол 1, ксилол 2 (каждая ванна минимум по 1-2 мин) и заключали в Bio Mount (BioOptica).
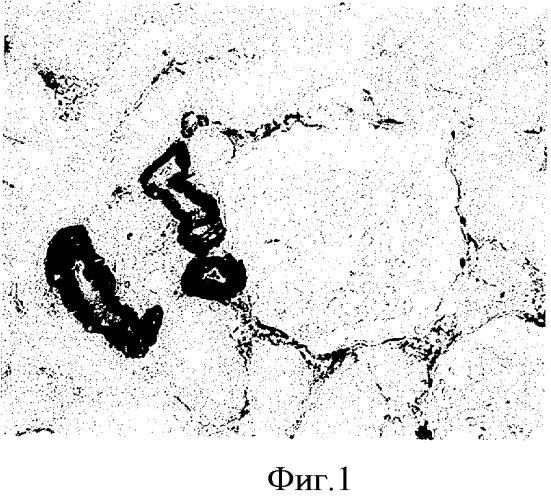
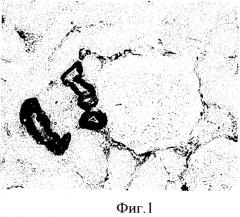
После проведения, описанной процедуры, все срезы на обработанных раствором БСА сохранились (6 стекол), тогда как на необработанных стеклах на одном из препаратов отклеились и были утрачены все срезы (3 шт.), на 3-х стеклах осталось по одному срезу из 3, причем на оставшихся срезах намечалась тенденция отклеивания по краям, и только 2 стекла имели срезы (по 1-2 из 3-х) удовлетворительного качества. Результаты иммуноцитохимической реакции, проведенной на срезах, наклеенных на предметные стекла с использованием предлагаемого покрытия, представлены на (фиг.1).
Пример 2: На предметные стекла с нанесенным БСА в насыщенном растворе камфоры в 50% водном растворе глицерина приклеивали срезы двенадцатиперстной кишки человека (биопсия). Воспроизводится методика примера 1.
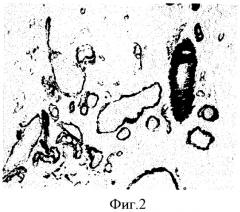
Результаты иммуноцитохимической реакции, проведенной на срезах двенадцатиперстной кишки, наклеенных на предметные стекла с использованием предлагаемого покрытия, представлены на (фиг.2).
Пример 3: На предметные стекла с нанесенным БСА в насыщенном растворе камфоры в 50% водном растворе глицерина приклеивали срезы мозжечка человека. Воспроизводится методика примера 1. В пунктах 1-8, за исключением использования в п.7 антител к белкам нейрофиламентов (Dako) и температуры инкубации (40°С).
Вместо п.9-11 помещали препараты в реагент EnVision+(Dako) и оставляли при комнатной температуре на 35 мин.
Дальнейшую обработку проводили в соответствии с п.п.12-16.
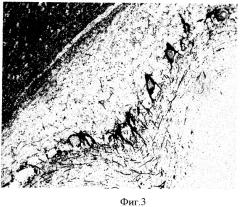
Результаты иммуноцитохимической реакции, проведенной на срезах мозжечка, наклеенных на предметные стекла с использованием предлагаемого покрытия, представлены на (фиг.3).
1. Применение бычьего сывороточного альбумина фракции V по Кону в качестве покрытия предметных стекол для проведения иммуноцитохимических исследований и/или обычных гистологических исследований.
2. Применение по п.1, отличающееся тем, что водный раствор бычьего сывороточного альбумина для нанесения имеет концентрацию от 0,1 до 0,3%.
3. Применение по п.1, отличающееся тем, что бычий сывороточный альбумин в количестве 0,8-1,2 г растворен в 3,6-4,4 мл насыщенного раствора камфоры в 50%-ном водном растворе глицерина.