Суспензии анальгетиков с контролируемым высвобождением
Иллюстрации
Показать всеИзобретение относится к области медицины. Предложены варианты фармацевтической жидкой суспензионной лекарственной формы, содержащей частицы NSAID и/или ацетаминофена. Указанные частицы покрыты одним слоем контролируемо высвобождающейся композиции. Лекарственная форма имеет продолжительность терапевтического эффекта в течение 8 часов после ее начального введения млекопитающему. Также предложен способ лечения боли у млекопитающего, предусматривающий введение данной лекарственной формы в эффективном количестве для обеспечения облегчения боли в течение 12 часов после введения лекарственной формы. Также предложен способ введения ацетаминофена и/или NSAID в жидкой суспензионной фармацевтической лекарственной форме млекопитающему, при котором млекопитающее получает контролируемо высвобождающуюся дозу указанного вещества свыше 12 часов после введения лекарственной формы, где ацетаминофен и/или NSAID дополнительно не обеспечиваются в течение указанного 12-часового периода времени. 5 н. и 11 з.п. ф-лы, 2 ил., 1 табл.
Реферат
Настоящее изобретение относится к фармацевтическому составу с контролируемым высвобождением, подходящему для жидких лекарственных форм для введения активных ингредиентов, таких как анальгетики.
Уровень техники изобретения
Терапевтические средства для лечения боли, воспаления и лихорадки включают анальгетики, противовоспалительные и жаропонижающие средства. Нестероидные противовоспалительные средства (NSAID) представляют собой один тип таких терапевтических средств. Они включают производные пропионовой кислоты, производные уксусной кислоты, производные фенамовой кислоты, производные дифенилкарбодиловой кислоты, оксикамы и селективные NSAID циклооксигеназы-2 (CОX-2).
Пропионовые кислоты включают, например, ибупрофен, напроксен и кетопрофен. В частности, ибупрофен представляет собой широко применяемое, хорошо известное NSAID, обладающее анальгезирующим и жаропонижающим свойствами. В течение нескольких лет он был коммерчески доступен во многих формах как продаваемое без рецепта лекарственное средство. Химически ибупрофен представляет собой 2-(4-изобутилфенил)пропионовую кислоту.
Обычно NSAID вводятся от одного до четырех раз в день, суточная доза колеблется в пределах от примерно 50 до примерно 2000 миллиграммов, предпочтительно от примерно 100 до 1600 и наиболее предпочтительно от примерно 200 до примерно 1200 миллиграммов.
Ацетаминофен является хорошо известным анальгетиком, его суточная доза колеблется в пределах от примерно 325 до примерно 4000 миллиграмм, предпочтительно от примерно 650 до примерно 4000 миллиграмм. Первым ацетаминофен в медицине применил Van Mering в 1893 г., но только с 1949 г. ацетаминофен приобрел популярность как эффективная альтернатива аспирину в качестве анальгетического средства, отпускаемого без рецепта на рынке. Фармакология АРАР рассмотрена В.Ameer и др., Ann. Int. Med. 87, 202 (1977). Рассматривая широко распространенное применение АРАР и объем его производства, как его производство, так и его применение в качестве анальгетика хорошо известны специалистам в данной области.
Известно введение NSAID, ацетаминофена и других лекарственных средств в несколько приемов в течение 12 или 24 часов. Например, известно введение нескольких доз, содержащих равные количества ибупрофена, в течение 12 или 24 часов. Дополнительно, также известно введение более высокой начальной дозы с последующими относительно низкими поддерживающими дозами. См., например, Palmisano и др., Advances in Therapy, издание 5, номер 4, июль/август 1988 г. (применение многократных доз кетопрофена (начальная доза 150 мг с последующими дозами 75 мг) и ибупрофена (начальная доза 800 мг с последующими дозами 400 мг)).
В частности, в отношении перорально вводимых анальгетиков, желание увеличить продолжительность терапевтического эффекта привело к разработке составов с контролируемым высвобождением, которые позволяют вводить их один раз в день. Благоприятно, что введение один раз в день улучшает соблюдение пациентами рекомендованных дозировок на протяжении терапевтического лечения.
Фармацевтические лекарственные формы с контролируемым высвобождением долго применялись для оптимизации доставки лекарственного средства и увеличения соблюдения пациентами, особенно путем уменьшения числа доз лекарственного средства, которые пациент должен принимать в течение дня. Часто с этой целью желательно уменьшить скорость высвобождения лекарственного средства или другого активного ингредиента из лекарственной формы в желудочно-кишечных («ж.к.») соках пациента, особенно для обеспечения пролонгированного действия лекарственного средства в организме.
Скорость, с которой перорально вводимое лекарственное средство достигает его места действия в организме, зависит от ряда факторов, включающих скорость и степень абсорбции лекарственного средства в кровь через ж.к. слизистую оболочку. Однако перед абсорбцией лекарственного средства в кровь, сначала оно должно быть растворено в ж.к. соках. Для многих лекарственных средств абсорбция через ж.к. мембраны относительно быстрая в сравнении с их растворением в ж.к. соках, что таким образом, определяет растворение лекарственного средства как лимитирующую стадию абсорбции лекарственного средства. Поэтому разработчик рецептур может эффективно контролировать скорость абсорбции в кровь лекарственного средства путем модификации скорости растворения лекарственного средства.
Также особенно желательно для фармацевтических лекарственных форм вводить более одного лекарственного средства, каждое с модифицированной скоростью. Так как начало и продолжительность терапевтической эффективности лекарственных средств широко варьируют, так же как их соответствующие абсорбция, распределение, метаболизм и выделение, часто желательно модифицировать высвобождение разных лекарственных средств различными способами или сделать так, чтобы первое лекарственное средство немедленно высвобождалось из лекарственной формы, в то время как второе лекарственное средство высвобождалось «модифицированным» образом, например, или отсрочено, или контролируемо.
Хорошо известные механизмы, посредством которых лекарственные формы могут доставлять лекарственное средство с контролируемой скоростью (например, длительное, пролонгированное, продленное или замедленное высвобождение), включают диффузию, эрозию и осмос. Часто практикуется разработка лекарственных форм, которые сочетают комбинацию вышеуказанных механизмов для достижения особенно желательного профиля контролируемого высвобождения для отдельного активного ингредиента.
Неблагоприятно, что многие применения с контролируемым высвобождением используют твердые лекарственные формы, имеющие итоговые большие размер и вес. Введение таких лекарственных форм проблематично, особенно пациентам с затрудненным глотанием, таким как дети и пожилые. Поэтому, кроме того, желательно обеспечить лекарственные средства с контролируемым высвобождением или в разжевываемой, или в перорально размельчаемой твердой форме, или жидкой форме. Для многих пациентов жидкие пероральные лекарственные формы более предпочтительны, так как они могут быть проглочены без дополнительного этапа разжевывания.
Обычно в течение многих лет для доставки лекарственных средств с немедленным высвобождением применялись пероральные жидкие формы. См., например, патенты США № 5374659, 4788220, 4975465 и 5183829. Однако включение лекарственного средства с контролируемым высвобождением в жидкую лекарственную форму представляет значительные рецептурные проблемы. В частности, обычно для переноса порции лекарственного средства с модифицированным высвобождением используются покрытые или химически связанные частицы. Свойства таких частиц должны быть совместимы со свойствами жидкого носителя для их суспендирования так, чтобы частицы могли сохраняться в однородно дисперсном состоянии. Особую проблему представляет собой предотвращение преждевременного высвобождения лекарственного средства из суспендированных частиц во время хранения жидкой лекарственной формы до употребления пациентом. Дополнительно, поддержание желательного профиля растворения, так же как желательной дозовой однородности жидкой лекарственной формы на протяжении срока хранения представляет собой дополнительные проблемы, которые будут отнесены к составлению перорального жидкого суспензионного продукта с контролируемым высвобождением.
В патенте Соединенных Штатов № 5527545 микрогранулы активного ингредиента были покрыты четырьмя последовательными покрытиями для сохранения характеристик высвобождения лекарственной формы в жидкой суспензии. Однако мало того, что этап многократного покрытия в целом увеличил стоимость и время производственного цикла продукта, но также результирующие лекарственные формы не сумели обеспечить потребителю немедленно высвобождающуюся дозу.
Поэтому, кроме того, было бы желательно иметь жидкую лекарственную форму с контролируемым высвобождением, имеющую суспендируемый активный ингредиент, такой как анальгетик, который не только приятен на вкус, но также представлен в стабильной форме, которая гарантирует требуемый профиль высвобождения после введения. Кроме того, было бы желательно иметь такой суспензионный продукт анальгетика, который бы обеспечивал потребителю как немедленно высвобождающуюся дозу, так и длительно высвобождающуюся дозу анальгетика.
Краткое описание изобретения
Изобретение относится к фармацевтической лекарственной форме, подходящей для введения NSAID и/или ацетаминофена в жидкой суспензии, указанная лекарственная форма включает, состоит из и/или в основном состоит из
а) первой порции, содержащей NSAID и/или ацетаминофен, NSAID и/или ацетаминофен высвобождаются из лекарственной формы в значительной степени немедленным образом после контакта лекарственной формы со средой растворения; и
b) второй порции частиц, содержащих NSAID и/или ацетаминофен, NSAID и/или ацетаминофен высвобождаются из частиц контролируемым образом после контакта лекарственной формы со средой растворения, где фармацевтическая лекарственная форма имеет продолжительность терапевтического эффекта в течение по меньшей мере примерно 8 часов после введения.
Другой вариант осуществления настоящего изобретения направлен на жидкую суспензионную лекарственную форму, включающую, состоящую из и/или в основном состоящую из
а) первой порции, содержащей NSAID и/или ацетаминофен, NSAID и/или ацетаминофен высвобождаются из лекарственной формы в значительной степени немедленным образом после контакта лекарственной формы со средой растворения;
b) второй порции частиц, содержащих NSAID и/или ацетаминофен, NSAID и/или ацетаминофен высвобождаются из частиц контролируемым образом после контакта лекарственной формы со средой растворения; и
c) воды или смесей воды и фармацевтически приемлемого водорастворимого вспомогательного растворителя, выбранного из группы, состоящей из гликолей, спиртов и глицерина,
где лекарственная форма имеет продолжительность терапевтического эффекта в течение по меньшей мере примерно 12 часов после введения.
Другой вариант осуществления настоящего изобретения направлен на способ введения ацетаминофена и/или NSAID в фармацевтической лекарственной форме млекопитающему, нуждающемуся в этом, указанный способ включает, состоит из и/или в основном состоит из обеспечения млекопитающему лекарственной формы таким образом, что млекопитающее получает немедленно высвобождающуюся дозу указанного ацетаминофена и/или NSAID в начале указанного 12-часового периода времени и контролируемо высвобождающуюся дозу ацетаминофена и/или NSAID в течение периода времени свыше примерно 12 часов после введения лекарственной формы, где в течение указанного 12-часового периода времени ацетаминофен и/или NSAID дополнительно не обеспечиваются.
Другой вариант осуществления настоящего изобретения направлен на фармацевтическую жидкую суспензионную лекарственную форму, включающую, состоящую из и/или в основном состоящую из
частиц NSAID и/или ацетаминофена, частицы в значительной степени покрыты одним слоем композиции с контролируемым высвобождением,
где фармацевтическая жидкая суспензионная лекарственная форма имеет продолжительность терапевтического эффекта в течение по меньшей мере примерно 8 часов после ее начального введения млекопитающему.
Другой вариант осуществления настоящего изобретения направлен на фармацевтическую жидкую суспензионную лекарственную форму, включающую, состоящую из и/или в основном состоящую из
а) частиц, содержащих NSAID и/или ацетаминофен, частицы в значительной степени покрыты одним слоем покрытия с контролируемым высвобождением; и
b) воды или смесей воды и фармацевтически приемлемого водорастворимого вспомогательного растворителя, выбранного из группы, состоящей из гликолей, спиртов и глицерина,
где фармацевтическая лекарственная форма имеет продолжительность терапевтического эффекта в течение по меньшей мере примерно 8 часов после введения.
Другой вариант осуществления настоящего изобретения направлен на способ введения ацетаминофена и/или NSAID в жидкой суспензионной фармацевтической лекарственной форме млекопитающему, нуждающемуся в этом, способ включает, состоит из и/или в основном состоит из обеспечения млекопитающему указанной лекарственной формы таким образом, что млекопитающее получает дозу указанного ацетаминофена и/или NSAID контролируемо высвобождающуюся свыше примерно 12 часов после введения указанной лекарственной формы, где в течение указанного 12-часового периода времени ацетаминофен и/или NSAID дополнительно не обеспечиваются.
Другой вариант осуществления настоящего изобретения направлен на фармацевтическую жидкую суспензионную лекарственную форму, включающую, состоящую из и/или в основном состоящую из
а) частиц, содержащих NSAID и/или ацетаминофен, частицы в значительной степени покрыты одним слоем композиции с контролируемым высвобождением, композиция с контролируемым высвобождением содержит по отношению к общему весу композиции с контролируемым высвобождением больше, чем примерно 0% и меньше, чем примерно 90% нерастворимого пленкообразующего полимера и больше, чем примерно 0% и меньше, чем примерно 10% кишечнорастворимого полимера; и
b) воды или смесей воды и фармацевтически приемлемого водорастворимого вспомогательного растворителя, выбранного из группы, состоящей из гликолей, спиртов и глицерина,
где фармацевтическая лекарственная форма имеет продолжительность терапевтического эффекта в течение по меньшей мере примерно 12 часов после ее введения.
Краткое описание чертежей
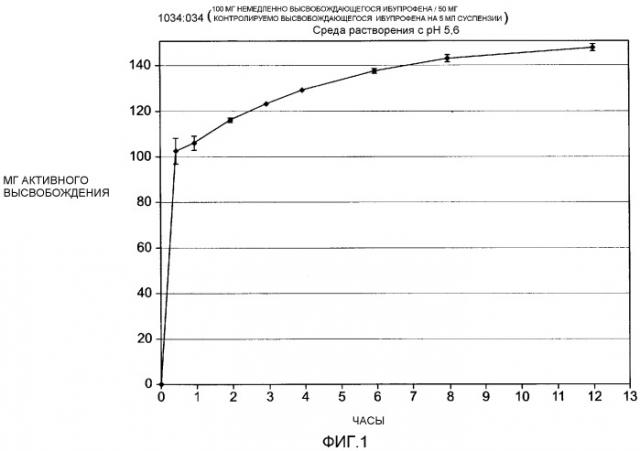
Фиг.1 изображает график зависимости высвобожденного активного ингредиента (мг) от времени (часы) для жидкой суспензионной лекарственной формы, содержащей как немедленную дозу, так и контролируемо высвобождающуюся дозу ибупрофена.
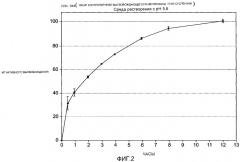
Фиг.2 изображает график зависимости высвобожденного активного ингредиента (мг) от времени (часы) для жидкой суспензионной лекарственной формы, содержащей только контролируемо высвобождающуюся дозу ибупрофена.
Подробное описание изобретения
Применяемый в данном описании термин «в значительной степени покрывает» или «в значительной степени непрерывный» обозначает, что вообще покрытие непрерывно и вообще покрывает всю поверхность ядра или подлежащего слоя таким образом, что не обнажен ни активный ингредиент, ни подлежащий слой или обнажены немного.
Применяемый в данном описании «ATDAIRD» будет обозначать среднюю терапевтическую продолжительность действия эффективной немедленно высвобождающейся дозы отдельного активного ингредиента. Например, типичная продолжительность действия, т.е. период терапевтического эффекта, немедленно высвобождающейся дозы ибупрофена или кетопрофена составляет от примерно 4 до примерно 6 часов. Соответственно, ATDAIRD для ибупрофена или кетопрофена составляет 5 часов. Типичная продолжительность действия немедленно высвобождающейся дозы напроксена составляет от примерно 8 до примерно 12 часов. ATDAIRD для напроксена, следовательно, составляет 10 часов. Терапевтическую продолжительность действия отдельного активного ингредиента легко можно определить из инструкций по дозированию на этикетке для продуктов с немедленным высвобождением, содержащих тот отдельный активный ингредиент.
Применяемое в данном описании «модифицированное высвобождение» будет применено к измененному высвобождению или растворению активного ингредиента в среде растворения, такой как ж.к. соки. Активный ингредиент или ингредиенты, которые могут быть высвобождены модифицированным образом, могут содержаться внутри, например, лекарственных форм, покрытий или частиц, или в любой их порции, такой как, например, частицы, растворенные в жидкой суспендирующей среде. Типы модифицированного высвобождения включают 1) контролируемое высвобождение; или 2) отсроченное высвобождение. Под «контролируемым высвобождением» подразумевается то, что после введения активный ингредиент высвобождается из лекарственной формы в значительной степени непрерывно, регулируемым образом, и время полного высвобождения, т.е. истощения, активного ингредиента из лекарственной формы больше, чем время, связанное с лекарственной формой с немедленным высвобождением того же самого ингредиента. Типы контролируемого высвобождения включают пролонгированный, длительный, продленный и подобное. Под «отсроченным высвобождением» подразумевается то, что после введения существует по меньшей мере один период времени, когда активный ингредиент не высвобождается из лекарственной формы.
Применяемая в данном описании «среда растворения» будет обозначать любую подходящую жидкую среду, в которой может быть растворена суспензионная лекарственная форма согласно настоящему изобретению, такую как, например, среда растворения in vitro, применяемая для тестирования продукта, или желудочно-кишечные соки. Подходящая среда растворения in vitro, применяемая для тестирования растворения активного ингредиента или ингредиентов из суспензионной лекарственной формы согласно настоящему изобретению включает среды, описанные на странице 786 Фармакопеи США 23 (1995), которая включена в данное описание в виде ссылки.
Один вариант осуществления настоящего изобретения направлен на фармацевтическую лекарственную форму с контролируемым высвобождением, подходящую для введения активных ингредиентов в жидкой суспензии, содержащей а) немедленно высвобождающуюся порцию, например, порцию, содержащую по меньшей мере один активный ингредиент, который немедленно высвобождается из лекарственной формы; и b) контролируемо высвобождающуюся порцию, например, порцию, содержащую по меньшей мере один активный ингредиент, который высвобождается в кровоток в значительной степени непрерывным образом свыше контролируемого периода времени, такого как, например, от примерно 4 часов до примерно 12 часов после начального введения лекарственной формы. Применяемое в данном описании «немедленное высвобождение» обозначает то, что характеристики растворения по меньшей мере одного активного ингредиента отвечают описаниям Фармакопеи США для таблеток с немедленным высвобождением, содержащих этот активный ингредиент. Например, для таблеток ацетаминофена Фармакопея США 24 устанавливает, что в фосфатном буфере с рН 5,8, применяя аппарат 2 Фармакопеи США (лопасти) при 50 оборотах в минуту, по меньшей мере 80% ацетаминофена, содержащегося в лекарственной форме, высвобождается оттуда в течение 30 минут после дозирования, и для таблеток ибупрофена Фармакопея США 24 устанавливает, что в фосфатном буфере с рН 7,2, применяя аппарат 2 Фармакопеи США (лопасти) при 50 оборотах в минуту, по меньшей мере 80% ибупрофена, содержащегося в лекарственной форме, высвобождается оттуда в течение 60 минут после дозирования. См. Фармакопею США 24, версию 2000, 19-20 и 856 (1999). Дополнительно, суспензия ибупрофена может быть проанализирована на растворение, применяя ацетатный буфер с рН 5,6, применяя аппарат 2 Фармакопеи США (лопасти) при 50 оборотах в минуту, где по меньшей мере 80% ибупрофена, содержащегося в лекарственной форме, высвобождается оттуда в течение 60 минут после дозирования для немедленно высвобождающейся дозы.
Немедленно высвобождающаяся порция может содержать один или более активных ингредиентов, которые растворены на молекулярном уровне, например, расплавлены или растворены, внутри лекарственной формы, или активный ингредиент может быть в форме частиц, которые, в свою очередь, могут быть покрыты или не покрыты. В вариантах осуществления, где активный ингредиент представлен в форме частиц, частицы (или покрытые, или непокрытые) обычно имеют средний размер частиц от примерно 1 микрона до примерно 2000 микрон. В одном варианте осуществления такие частицы представлены в форме кристаллов, имеющих средний размер частиц от примерно 1 микрона до примерно 300 микрон. В другом варианте осуществления частицы представлены в форме гранул или пилюль, имеющих средний размер частиц от примерно 25 микрон до примерно 2000 микрон, например, от примерно 25 микрон до примерно 1000 микрон или от примерно 25 микрон до примерно 400 микрон.
Контролируемо высвобождающаяся порция содержит по меньшей мере один активный ингредиент в разнообразии частиц, имеющих свойства контролируемого высвобождения. В одном варианте осуществления ядро этих частиц в контролируемо высвобождающейся порции может состоять из активного ингредиента в чистой, кристаллической форме, которая в значительной степени покрыта композицией с контролируемым высвобождением. Альтернативно, ядра частиц могут состоять из смеси гранул, состоящих из одного или более активных ингредиентов с необязательными ингредиентами, такими как связывающие вещества, наполнители и подобное, известное в уровне техники, и такие гранулы также в значительной степени покрыты композицией с контролируемым высвобождением. В другом варианте осуществления частицы активных ингредиентов могут быть растворены в матрице, состоящей из композиции с контролируемым высвобождением. В еще другом варианте осуществления один или более активных ингредиентов могут быть химически связаны или «комплексованы» со смолой, например, ионообменной смолой, для формирования частиц, которые необязательно могут быть в значительной степени покрыты покрытием с контролируемым высвобождением. Применяемое в данном описании «в значительной степени покрыты» будет обозначать, что обнажено меньше, чем примерно 1%, например, меньше, чем примерно 0,1%, площади поверхности частицы, например, не покрыто желательным покрытием.
Любой специалист в данной области без ненужного экспериментирования легко оценил бы, что конкретная ионообменная смола для применения в этом варианте осуществления зависит от разных факторов, таких как, например, заряд иона активного ингредиента. Пример подходящей ионообменной смолы для активных ингредиентов NSAID включает, но не ограничен им, холестирамин, который коммерчески доступен от Rohm & Haas под товарным наименованием «Duolite® AP143». Дополнительные детали комплексообразования с полимерными смолами хорошо известны в уровне техники и описаны, например, в патентах США № 4221778, 4847077 и 6001392, которые включены в данное описание в виде ссылки.
В одном отдельном варианте осуществления контролируемо высвобождающаяся порция лекарственной формы в значительной степени свободна от ионообменных смол. Под «в значительной степени свободный от ионообменных смол» подразумевается, что количество ионообменной смолы по отношению к общему весу всех частиц активных ингредиентов в лекарственной форме меньше, чем примерно 1%, например, меньше, чем примерно 0,5% или меньше, чем примерно 0,1%.
Один или более покрывающих слоев на частицах могут состоять из любых подходящих композиций с контролируемым высвобождением. Пример подходящей композиции с контролируемым высвобождением содержит по отношению к общему весу композиции с контролируемым высвобождением от примерно больше, чем примерно 0% до примерно 90%, например, от примерно 10% до примерно 60%, нерастворимого пленкообразующего полимера и больше, чем примерно 0% и меньше, чем примерно 10%, например, от примерно 0,5% до примерно 20%, кишечнорастворимого полимера. Весовое соотношение кишечнорастворимого полимера к нерастворимому пленкообразующему полимеру в композиции с контролируемым высвобождением может быть в пределах от примерно 0,5:99,5 до примерно 20:80, например, от примерно 5:95 до примерно 10:90. Подобные композиции с контролируемым высвобождением также могут быть применены в матрице, в которой могут быть растворены частицы активных ингредиентов.
Подходящие нерастворимые пленкообразующие полимеры включают, но не ограничены ими, ацетат целлюлозы, этилцеллюлозу, поли(этилакрилата, метилметакрилата, триметиламмониоэтилметакрилата хлорид) 1:2:0,1, который коммерчески доступен от Rohm Pharma под товарным наименованием «EUDRAGIT RS», и их сополимеры и смеси. В одном варианте осуществления нерастворимый пленкообразующий полимер выбран из целлюлозы ацетата и/или этилцеллюлозы.
Подходящие кишечнорастворимые полимеры включают, но не ограничены ими, фталат гидроксипропилметилцеллюлозы, сукцинат ацетата гидроксипропилметилцеллюлозы, фталат ацетата целлюлозы, фталат поливинилацетата, основанные на полиметакрилате полимеры и их сополимеры и смеси. Примеры подходящих основанных на полиметакрилате полимеров включают, но не ограничены ими, поли(метакриловую кислоту, метилметакрилат) 1:2, который коммерчески доступен от Rohm Pharma GmbH под товарным наименованием полимеры «EUDRAGIT S», и поли(метакриловую кислоту, метилметакрилат) 1:1, который коммерчески доступен от Rohm Pharma GmbH под товарным наименованием полимеры «EUDRAGIT L». В одном варианте осуществления кишечнорастворимый полимер выбран из не акрилатных соединений, таких как фталат гидроксипропилметилцеллюлозы, сукцинат ацетата гидроксипропилметилцеллюлозы, фталат ацетата целлюлозы, фталат поливинилацетата и их сополимеры и смеси.
В одном варианте осуществления композиция с контролируемым высвобождением в значительной степени свободна от кишечнорастворимых полимеров, т.е., например, композиция с контролируемым высвобождением содержит по отношению к общему весу композиции с контролируемым высвобождением меньше, чем примерно 1% или меньше, чем примерно 0,25% кишечнорастворимых полимеров.
Частицы активного ингредиента, покрытые композицией с контролируемым высвобождением, содержат по отношению к общему весу сухих таких покрытых частиц от примерно 5% до примерно 40%, например, от примерно 10% до примерно 30% композиции с контролируемым высвобождением в форме по меньшей мере одного покрывающего слоя.
Покрытые частицы активного ингредиента могут быть образованы любым подходящим способом, известным в уровне техники. Подходящие способы образования и покрытия частиц включают высоко прозрачную грануляцию, жидкослойную грануляцию, например, роторную грануляцию, жидкослойное покрытие, коацервацию, сушку распылением, замораживание распылением и подобное, и описаны, например, в Pharmaceutical Dosage Forms: Tablets том 3, под редакцией Herbert A. Lieberman и Leon Lachman, главы 2, 3 и 4 (1982). В одном варианте осуществления средний диаметр частиц, покрытых композицией с контролируемым высвобождением, составляет от примерно 20 до примерно 400 микрон, например, от примерно 50 микрон до примерно 300 микрон.
Лекарственная форма согласно настоящему изобретению содержит один или более активных ингредиентов. Подходящие активные ингредиенты широко включают, например, фармацевтические препараты, минеральные вещества, витамины и другие питательные вещества, пероральные средства ухода, ароматизаторы и их смеси. Подходящие фармацевтические препараты включают анальгетики, противовоспалительные средства, средства против артрита, анестетики, антигистамины, противокашлевые средства, антибиотики, противоинфекционные средства, противовирусные средства, антикоагулянты, антидепрессанты, противодиабетические средства, противорвотные средства, средства от газообразования, противогрибковые средства, спазмолитические средства, средства, угнетающие аппетит, бронходилататоры, сердечно-сосудистые средства, средства для лечения центральной нервной системы, стимуляторы центральной нервной системы, противозастойные средства, оральные контрацептивы, диуретики, отхаркивающие средства, желудочно-кишечные средства, препараты от мигрени, продукты от морской болезни, муколитики, миорелаксанты, препараты от остеопороза, полидиметилсилоксаны, респираторные средства, снотворные средства, средства для лечения мочевых путей и их смеси.
Подходящие ароматизаторы включают ментол, мяту, мятные ароматизаторы, фруктовые ароматизаторы, шоколад, ваниль, ароматизаторы жевательной резинки, кофейные ароматизаторы, ликерные ароматизаторы и комбинации и подобное.
Примеры подходящих желудочно-кишечных средств включают антациды, такие как кальция карбонат, магния гидроксид, магния оксид, магния карбонат, алюминия гидроксид, натрия бикарбонат, дигидроксиалюминия натрия карбонат; слабительные средства, такие как бисакодил, каскара саграда, дантрон, сенна, фенолфталеин, алоэ, касторовое масло, рицинолевая кислота и дегидрохолевая кислота и их смеси; антагонисты Н2 рецепторов, такие как фамотадин, ранитидин, циметадин, низатидин; ингибиторы протонной помпы, такие как омепразол или лансопразол; желудочно-кишечные цитопротекторы, такие как сукрафлат и мизопростол; желудочно-кишечные прокинетики, такие как прукалоприд, антибиотики против Н. pylory, такие как кларитромицин, амоксициллин, тетрациклин и метронидазол; противодиарейные средства, такие как дифеноксилат и лоперамид; гликопирролат; противорвотные средства, такие как ондансетрон, анальгетики, такие как мезаламин.
Примеры подходящих полидиметилсилоксанов, которые включают, но не ограничены ими, диметикон и симетикон, описаны в патентах Соединенных Штатов № 4906478, 5275822 и 6103260, содержания каждого специально включены в данное описание в виде ссылки. Применяемый в данном описании термин «симетикон» относится к более широкому классу полидиметилсилоксанов, включающих, но не ограниченных ими, симетикон и диметикон.
В одном варианте осуществления изобретения по меньшей мере один активный ингредиент может быть выбран из бисакодила, фамотадина, ранитидина, циметидина, прукалоприда, дифеноксилата, лоперамида, лактазы, мезаламина, висмута, антацидов и их фармацевтически приемлемых солей, сложных эфиров, изомеров и смесей.
В другом варианте осуществления по меньшей мере один активный ингредиент выбран из анальгетиков, противовоспалительных средств и жаропонижающих средств, например, нестероидных противовоспалительных средств (NSAID), включающих а) производные пропионовой кислоты, например, ибупрофен, напроксен, кетопрофен и подобное; b) производные уксусной кислоты, например, индометацин, диклофенак, сулиндак, толметин и подобное; c) производные фенамовой кислоты, например, мефенамовую кислоту, меклофенамовую кислоту, флуфенамовую кислоту и подобное; d) производные бифенилкарбодиловой кислоты, например, дифлунизал, флуфенизал и подобное; e) оксикамы, например, пироксикам, судоксикам, изоксикам, мелоксикам и подобное; f) селективные ингибиторы циклооксигеназы-2 (COX-2); и g) фармацевтически приемлемые соли предыдущего.
В одном отдельном варианте осуществления по меньшей мере один активный ингредиент выбран из производных пропионовой кислоты NSAID, которые являются фармацевтически приемлемыми анальгетиками/нестероидными противовоспалительными средствами, имеющими свободный -СН(СН3)СООН или -СН2СН2СООН или фармацевтически приемлемую группу соли, такую как -СН(СН3)СОО-Nа+ или СН2СН2СОО-Nа+, которые обычно связаны непосредственно или через функциональную группу карбонила с кольцевой системой, предпочтительно ароматической кольцевой системой.
Примеры эффективных производных пропионовой кислоты включают ибупрофен, напроксен, беноксапрофен, напроксен натрий, фенбуфен, флурбипрофен, фенопрофен, фенбупрофен, кетопрофен, индопрофен, пирпрофен, карпофен, оксапрофен, пранопрофен, микропрофен, тиоксапрофен, супрофен, алминопрофен, тиапрофеновую кислоту, флупрофен, буклоксовую кислоту и их фармацевтически приемлемые соли, производные и комбинации.
В одном варианте осуществления изобретения производное пропионовой кислоты выбрано из ибупрофена, кетопрофена, флубипрофена и их фармацевтически приемлемых солей и комбинаций.
В другом варианте осуществления производным пропионовой кислоты является ибупрофен, 2-(4-изобутилфенил)пропионовая кислота или ее фармацевтически приемлемая соль, такая как аргининовая, лизиновая или гистидиновая соль ибупрофена. Другие фармацевтически приемлемые соли ибупрофена описаны в патенте США № 4279926, 4873231, 5424075 и 5510385, содержания которых включены в виде ссылки.
В другом отдельном варианте осуществления изобретения по меньшей мере один активный ингредиент может быть выбран из ацетаминофена, ацетилсалициловой кислоты, ибупрофена, напроксена, кетопрофена, флурбипрофена, диклофенака, циклобензаприна, мелоксикама, рофекоксиба, целекоксиба и их фармацевтически приемлемых солей, сложных эфиров, изомеров и смесей.
В другом отдельном варианте осуществления изобретения по меньшей мере один активный ингредиент может быть выбран из псевдоэфедрина, фенилпропаноламина, хлорфенирамина, декстрометорфана, дифенгидрамина, астемизола, терфенадина, фексофенадина, лоратадина, деслоратадина, цетиризина, их смесей и фармацевтически приемлемых солей, сложных эфиров, изомеров и их смесей.
В другом отдельном варианте осуществления по меньшей мере одним активным ингредиентом является NSAID и/или ацетаминофен и фармацевтически приемлемые их соли.
В одном варианте осуществления терапевтически эффективное количество активного ингредиента или ингредиентов может присутствовать в «объеме единичной дозы», которая может быть в форме порошка или водной суспензии. Применяемое в данном описании «терапевтически эффективное количество» представляет собой количество активного ингредиента, которое производит желательную терапевтическую реакцию после перорального введения. Любой специалист в данной области легко может определить «терапевтически эффективное количество» активного ингредиента для данного пациента, учитывая факторы, такие как, например, вводимый отдельный активный ингредиент, характеристики биодоступности активного ингредиента, желательный режим дозирования, возраст и вес пациента и подобное. Применяемым в данном описании «объемом единичной дозы» может быть любой удобный объем для перорального введения дозы данного продукта пациенту.
В этом варианте осуществления «объем единичной дозы» обычно сопровождается инструкциями по дозированию, которые инструктируют пациента принимать количество активного ингредиента, которое может быть множеством объема единичной дозы, в зависимости, например, от возраста или веса пациента. Обычно объем единичной дозы суспензии будет содержать количество активного ингредиента, которое терапевтически эффективно для самого маленького пациента. Например, подходящие объемы единичной дозы могут включать одну чайную ложку (около 5 мл), одну столовую ложку (около 15 мл), одну пипетку или один миллилитр.
Согласно изобретению, лекарственная форма, содержащая NSAID и/или ацетаминофен, может быть обеспечена млекопитающему, нуждающемуся в лечении, в частности, лечении, облегчающем боль, в единственном введении, которое обеспечивает высвобождение активного ингредиента в кровь свыше более длительного периода времени, например, свыше примерно 8-часового или примерно 12-часового периода. В нулевой точке отсчета времени млекопитающему обеспечивается, т.е. вводится начальная доза NSAID и/или ацетаминофена в виде активного ингредиента(ов) в немедленно высвобождающейся порции дозы. Активный ингредиент продолжает высвобождаться в кровь после примерно четырех, например, т.е. примерно, восьми, десяти или двенадцати часов от начального введения состава, содержащего активный ингредиент, в виде активного ингредиента(ов) в контролируемо высвобождающейся порции дозы. Другими словами, состав все еще сохраняет нерастворенный активный ингредиент после примерно четырех, например, т.е. примерно, восьми, десяти или двенадцати часов от начального введения.
В осуществлении настоящего изобретения лекарственная форма может состоять, по отношению к общему весу активного ингредиента, из от примерно 25% до примерно 75% немедленно высвобождающейся порции дозы активного ингредиента; и от примерно 75% до примерно 25% контролируемо высвобождающейся порции дозы активного ингредиента. Немедленно высвобождающаяся порция дозы и контролируемо высвобождающаяся порция дозы могут быть комбинированы с носителем для формирования либо сухой смеси, которая может быть суспендирована при необходимости, или готовой к употреблению жидкой суспензии.
Подходящие компоненты носителя могут включать, без ограничения, структурирующ