Новые модуляторы дофаминовой нейротрансмиссии
Иллюстрации
Показать всеИзобретение относится к новым соединениям 3-замещенного 4-(фенил-N-алкил)пиперазина формулы (1)
,
R1 представляет собой OSO2CF3, OSO2CH3, SO2R3, COCF3 и СОСН2СН3, R2 представляет собой C1-C4 алкил или аллил, R3 представляет собой C1-С3 алкил или CF3, а также к их фармацевтически приемлемым солям. Соединения по настоящему изобретению обладают способностью модулировать нейротрансмиссию допамина. Также в настоящем изобретении раскрываются фармацевтические композиции вышеназванных соединений, где вышеназванные соединения используются для лечения расстройств центральной нервной системы. 2 н. и 2 з.п. ф-лы.
Реферат
Настоящее изобретение относится к новым модуляторам дофаминовой нейротрансмиссии, более конкретно к новым замещенным 4-(фенил-N-алкил)пиперазинам и 4-(фенил-N-алкил)пиперидинам, и к их использованию.
Дофамин является нейротрансмиттером в головном мозге. С момента его открытия, происшедшего в 1950 году, функция дофамина в мозге широко использовалась. К настоящему времени точно установлено, что дофамин играет существенную роль в различных аспектах функции мозга, включая моторную, познавательную, чувствительную, эмоциональную и вегетативные функции (например, регуляция аппетита, температуры тела, сна). Так, модулирование функции дофамина может быть полезно при лечении широкого спектра заболеваний, затрагивающих функцию мозга. В действительности, как неврологические, так и психиатрические заболевания лечатся медикаментозными средствами, основанными на взаимодействии дофаминовых систем и дофаминовых рецепторов в мозге.
Лекарственные средства, которые непосредственно или опосредовано действуют на центральные дофаминовые рецепторы, обычно используют в лечении неврологических и психиатрических заболеваний, например болезни Паркинсона и шизофрении. В настоящее время доступные дофаминэргические фармацевтические средства обладают серьезными побочными эффектами, такими как экстрапирамидальные побочные эффекты и отдаленная дискинезия при использовании дофаминэргических антагонистов в качестве антипсихотических агентов, и дискинезии и психозов при использовании дофаминэргических антагонистов в качестве агентов, направленных на лечение болезни Паркинсона. Терапевтические действия неудовлетворительны во многих отношениях. Продолжаются поиски улучшения эффективности и снижения побочных эффектов лигандов дофаминэргических фармацевтических средств, новых лигандов дофаминовых рецепторов с избирательностью по отношению к специфическим подтипам дофаминовых рецепторов или региональной избирательностью. В этом контексте для достижения оптимального уровня стимулирования дофаминовых рецепторов также разрабатываются частичные антагонисты дофаминовых рецепторов, то есть лиганды дофаминовых рецепторов с некоторой, но не полной присущей им активностью относительно дофаминовых рецепторов, что позволяет избежать блокады дофаминового рецептора или его избыточного стимулирования.
Ранее были сообщения и о соединениях, принадлежащих к классу замещенного 4-(фенил-N-алкил)пиперазина и замещенных 4-(фенил-N-алкил)пиперидинов. Среди этих соединений некоторые являются неактивными в ЦНС, некоторые показывают серотонэргический или смешанный серотонэргический/дофаминэргический фармакологический профиль, в то время, как некоторые являются частичными или полными агонистами или антагонистами дофаминового рецептора с высоким сродством относительно дофаминовых рецепторов.
Ряд производных 4-фенилпиперазинов и 4-фенилпиперидина известен и описан, например, Costall et al. European J. Pharm. 31, 94, (1975), Newshaw et al. Bioorg. Med. Chem. Lett., 8, 295, (1998). Описанные соединения являются замещенными 4-фенилпиперазинами, причем большинство из них является 2-, 3- или 4-ОН фенилзамещенными и проявляющими свойства агонистов дофаминовых (DA) ауторецепторов.
Fuller R.W. et al., J. Pharmacol. Exp. Therapeut. 218, 636, (1981) раскрывает замещенные пиперазины (например, 1-(м-трифторметилфенил)пиперазин), которые, как сообщают, действуют как агонисты серотонина и ингибируют поглощение серотонина. Fuller R.W. et al., Res. Commun. Chem. Pathol. Pharmacol. 17, 551, (1977) раскрывают сравнительное воздействие на 3,4-дигидроксифенилуксусную кислоту, и Res. Commun. Chem. Pathol. Pharmacol. 29, 201, (1980) раскрывает сравнительное воздействие на концентрацию 5-гидроксииндолуксусной кислоты в мозге крысы посредством 1-(парахлорфенол)пиперазина.
Boissier J. еt al., Chem Abstr. 61:10691c, раскрывает двузамещенные пиперазины. Соединения представлены как адренолитические, антигипертензивные, потенциаторы барбитуратов и депрессанты центральной нервной системы.
Имеются публикации о ряде различных замещенных пиперазинов, таких как лиганды 5-HT1А рецепторов, например, Glennon R.A. et al., J. Med. Chem., 31, 1968, (1988), van Steen B.J., J. Med. Chem., 36, 2751, (1993), Mokrosz, J. et al., Arch. Pharm. (Weinheim) 328, 143-148 (1995), and Dukat M.-L., J. Med. Chem., 39, 4017, (1996). Glennon R.A. в международных патентных заявках WO 93/00313 и WO 91/09594 раскрывает различные амины, и среди них замещенные пиперазины, как лиганды сигма рецепторов. Клинические работы, исследующие свойства лигандов сигма рецепторов у больных шизофренией, не делают очевидным антипсихотическую активность или активность по отношению к каким-либо другим заболеваниям ЦНС. С обоими из наиболее изученных селективных антагонистов сигма рецепторов, BW234U (римказол) и BMY14802, проводились клинические исследования на больных шизофренией (Borison et al., 1991, Psychopharmacol Bull 27(2): 103-106; Gewirtz et al., 1994, Neuropsychopharmacology 10:37-40).
Кроме того, WO 93/04684 и GB 2027703 также описывают конкретные замещенные пиперазины, пригодные для лечения заболеваний ЦНС.
Изложение сущности изобретения
Задачей настоящего изобретения является создание новых фармакологически активных соединений, особенно пригодных в лечении заболеваний центральной нервной системы, которые не обладают недостатками вышеобсужденных веществ.
В результате разработки данного изобретения обнаружено, что желательно создание веществ со специфическими фармакологическими свойствами, а именно веществ, которые обладают модулирующим действием на нейротрансмиссию дофамина. Подобные свойства ранее не обсуждались, и их невозможно получить с ранее известными соединениями. Соединения в соответствии с настоящим изобретением обладают удивительным и интересным дуалистическим профилем допаминэргической активности с антагонист-подобными эффектами на нейрохимию головного мозга и умеренными агонист-подобными эффектами на нормальное поведение, но они вызывают подавление поведения при состояниях гиперактивности.
Таким образом настоящее изобретение относится к новым 3-замещенным 4-(фенил-N-алкил)пиперазинам и 3-замещенным 4-(фенил-N-алкил)пиперидинам в форме свободного основания или к их фармацевтически приемлемой соли, фармацевтическим композициям, содержащим названные соединения и использованию названных соединений в терапии.
Одним объектом изобретения является создание новых соединений для использования в терапии, и более точно, соединения для модулирования допаминэргических систем в головном мозге млекопитающего, включая мозг человека.
Другим объектом настоящего изобретения является создание соединений, обладающих терапевтическим действием после орального введения.
Более точно, настоящее изобретение относится к соединениям 3-замещенного 4-(фенил-N-алкил)пиперазина и 4-(фенил-N-алкил)пиперидина формулы 1:
и к их фармацевтически приемлемым солям,
где
Х выбран из группы, состоящей из N, СН и С, однако, Х может представлять собой только С, если соединение содержит двойную связь на участке, обозначенном пунктирной линией;
R1 выбран из группы, состоящей из OSO2CF3, OSO2CH3, SOR3, SO2R3, COR3, NO2 и CONНR3, где R3 такой, как определено выше, и когда Х представляет собой СН или С, R1 может также быть выбран из группы, состоящей из CF3, CN, F, Cl, Br и I;
R2 выбран из группы, состоящей из C1-C4 алкилов, аллилов, CH2SCH3, CН2CH2OCH3, CH2CH2CH2F, CH2CF3, 3,3,3-трифторпропила, 4,4,4-трифторбутила и -(CH2)-R4, где R4 такой, как определено ниже;
R3 выбран из группы, состоящей из С1-С3 алкилов, CF3 и N(R2)2, где R2 такой, как определено выше;
R4 выбран из группы, состоящей из С3-С6 циклоалкилов, 2-тетрагидрофурана и 3-тетрагидрофурана.
Соединения по настоящему изобретению обладают дофамин-модулирующими свойствами и пригодны в лечении ряда заболеваний центральной нервной системы, включая как психиатрическую, так и неврологическую симптоматику.
Заболевания, при которых могут быть полезны соединения с модулирующим действием на дофаминэргические системы, представляют собой заболевания, относящиеся к старению, для предупреждения брадикинезии и депрессии и для улучшения психических функций. Они также могут быть использованы для улучшения познавательных функций и связанных с ними эмоциональных расстройств при нейродегенеративных заболеваниях и нарушениях развития, а также после повреждения мозга.
Соединения по настоящему изобретению также могут быть использованы для улучшения всех симптомов психозов, включая шизофрению и шизофреноподобные заболевания, а также психотические нарушения, вызванные лекарственными средствами. Соединения по настоящему изобретению также могут использоваться при нарушениях поведения, обычно впервые диагносцирующиеся в младенчестве, детстве или юности, а также при нарушениях импульсного контроля. Также могут быть улучшены нарушения речи, такие как заикание. Они также могут быть использованы для лечения токсикомании, а также заболеваний, характеризующихся неправильным употреблением пищи.
Нарушения настроения и тревожные состояния, изменение личности и конверсивная истерия могут также лечиться с помощью соединений настоящего изобретения.
Неврологические показания включают лечение болезни Хантингтона и других расстройств движения, а также расстройств движения, вызванных лекарственными средствами. «Restless legs» и родственные заболевания, а также нарколепсия также могут лечиться соединениями, по настоящему изобретению. Они также могут улучшать психические и моторные функции при болезни Паркинсона, и при родственной паркинсоноподобной симптоматике. Они также могут использоваться для улучшения тремора различного происхождения. Они могут использоваться в лечении головных болей и для улучшения функции мозга после сосудистого или травматического повреждения мозга. Кроме того, они могут использоваться для ослабления боли при состояниях, характеризующихся повышением мышечного тонуса.
Неожиданно было обнаружено, что соединения по настоящему изобретению специфически воздействуют на дофаминэргические системы мозга. Они обладают воздействием на биохимические импульсы в мозге с характерными чертами избранных антагонистов дофамина, например, вызывая повышение концентрации метаболитов дофамина.
Кроме того, антагонисты рецепторов дофамина специфически подавляют поведенческую активность и вызывают каталепсию, в то время как соединения по изобретению не показывают или только ограничивают ингибиторные эффекты на спонтанную локомоторную активность. Напротив, они могут вызывать легкую поведенческую активизацию с сопутствующим усилением мелкомасштабных движений, например, остановки в центре области регистрации поведения, подобные тем, которые вызывают дофаминэргические антагонисты. Поведенческая активация является ограниченной, не достигая такого же полного повышения активности, какое вызывают прямые или непрямые допаминэргические антагонисты. С другой стороны, предпочтительные вещества снижают повышение активности, вызванное прямыми или непрямыми допаминэргическими агонистами, то есть д-амфетамином и веществами аналогичного действия.
Таким образом, соединения по настоящему изобретению неожиданно показали интересный дуалистический профиль дофаминэргической активности с антагонист-подобным действием на нейрохимию мозга и умеренным агонист-подобным действием на нормальное поведение, но подавлением поведения в состоянии гиперактивности. Профиль активности предлагает модуляторное действие на дофаминэргические функции, явно отличающиеся от известных соединений, принадлежащих к данным химическим классам или эффектам, ожидаемым от типичных антагонистов или агонистов дофаминовых рецепторов этих или других химических классов.
Учитывая участие дофамина в большом разнообразии функций ЦНС и клинические недостатки в настоящее время доступных фармацевтических средств, воздействующих на дофаминовые системы, можно доказать превосходство новых классов дофаминэргических модуляторов, присутствующих в данном изобретении, над известными в настоящее время дофаминэргическими соединениями в лечении некоторых заболеваний, относящихся к дисфункциям ЦНС, с точки зрения эффективности, а также побочных эффектов.
Обнаружено, что некоторые соединения по настоящему изобретению обладают удивительно хорошими фармакокинетическими свойствами, включая высокую степень биодоступности при оральном применении. Таким образом, они являются пригодными для получения фармацевтических средств для орального применения. В предыдущем уровне техники не существует руководства для получения соединений с такими эффектами на дофаминовые системы в мозге.
Подробное описание изобретения
Фармакология
Очевидно, что при психиатрических и неврологических заболеваниях нарушается нейротрансмиссия в ЦНС. Во многих случаях, например, при шизофрении или болезни Паркинсона, является применимой, но не оптимальной, фармакотерапия, основанная на антагонизме или агонизме дофаминовых рецепторов. В недавние годы много усилий было положено на открытие новых и селективных лигандов для субстратов дофаминового рецептора (D1, D2, D3, D4, D5) с целью улучшения эффективности и снижения побочных эффектов.
Настоящее изобретение предлагает другие принципы для новых терапевтических средств, основанных на взаимодействии с дофаминовыми системами. Соединения по настоящему изобретению обладают воздействием на нейрохимию мозга, подобным воздействию антагонистов дофаминовых D2 рецепторов. В противоположность используемым в настоящее время антагонистам дофаминового рецептора, соединения настоящего изобретения показывают отсутствие или ограничение воздействия на спонтанную двигательную активность. Они могут вызывать поведенческую активацию с одновременным повышением мелкомасштабных движений, например, остановки в центре области регистрации поведения, подобно остановкам, вызванным антагонистами дофамина. Поведенческая активация является ограниченной, не достигая такого же полного усиления активности, какое вызывают прямые или непрямые антагонисты дофамина. Удивительно, что предпочтительные вещества могут действительно снижать повышение активности, вызванное прямыми или непрямыми дофаминэргическими агонистами, то есть д-амфетапином и веществами аналогичного действия.
Предпочтительные структуры являются замещенными в мета-положении на ароматическом кольце. Примером такого соединения является 3-(1-пропилпиперидин-4-ил)фениловый эфир метансульфоновой кислоты, который представлен ниже в примере 14. У крыс это соединение повышает 3,4-дигидроксифенилуксусную кислоту в полосатом теле с 1265±74 (контроли) до 3208±236 нг/г ткани при 50 мкмоль/кг подкожно в сочетании с легким повышением поведенческой активности; 1485±328 см/30 мин (контроли) до 2126±240 см/30 мин при 50 мкмоль/кг подкожно, n=4. Другой предпочтительный пример соединения по изобретению представляет собой 4-(3-метансульфонилфенил)-1-пропилпиперидин, далее иллюстрированный в примере 6. У крыс это соединение повышает 3,4-дигидроксифенилуксусную кислоту в полосатом теле с 914±19 (контроли) до 1703±19 нг/г ткани при 50 мкмоль/кг подкожно. За подобным повышением оборота допамина следует тенденция в направлении повышения моторной активности с 2030±299 см/60 мин до 2879±398 см/60 мин р=0,14. У животных, приученных к коробке измерения подвижности, соединение в примере 6, 4-(3-метансульфонилфенил)-1-пропилпиперидин, повышает поведенческую активность с 476±279 см/60 мин (контроли) до 1243±72 см/60 мин, р<0,05, n=4, и 4-дигидроксифенилуксусную кислоту в полосатом теле с 975±23 (контроли) до 2074±144 нг/г ткани при 50 мкмоль/кг подкожно р<0,05, n=4.
Кроме того, соединение, описанное в примере 6, 4-(3-метансульфонилфенил)-1-пропилпиперидин, имеет предпочтительную способность снижать поведенческую активность, вызванную как д-амфетамином (1,5 мг/кг подкожно), так и дизолципином (Mk-801, 0,7 мг/кг интраперитонеально). д-Амфетаминовая гиперактивность снижается с 10694±2165 см/60 мин до 1839±344 см/60 мин, р<0,05 n=4, при 50 мкмоль/кг подкожно соединения, описанного в примере 6, и поведенческая активность, вызванная дизолципином (Mk-801) снижается с 32580±4303 см/60 мин до 18197±1389 см/60 мин р<0,05 при 50 мкмоль/кг подкожно. К удивлению соединение, описанное в примере 6, доступно при оральном введении (F) 85% у крыс.
В отличие от схожих соединений, описанных в WO 91/09594, у соединения из примера 6, 4-(3-метансульфонилфенил)-1-пропилпиперидин, отсутствует сродство к сигма-рецептору, <50% подавления [3H]-DTG связывания (в соответствии со способом измерения сигма-связывания, описанного Shirayama Y. еt al., 1993, Eur. J. Pharmacol. 237, p.117) при 10 мкмоль/л в мембранах головного мозга крыс.
С целью демонстрации удивительного действия соединений в соответствии с изобретением, некоторые из соединений сравнивают с подобными соединениями известного уровня техники. Таким образом, соединения, пригодные для сравнения с соединениями по изобретению в сравнительных примерах, не входят в объем настоящего изобретения, так как они не проявляют желательных свойств.
Сравнительный пример 1: 4-(4-метансульфонилфенил)-1-пропилпиперидин иллюстрирует, что замещение в пара-положении дает неактивные соединения. 4-(4-метансульфонилфенил)-1-пропилпиперидин не оказывает эффекта на 3,4-дигидроксифенилуксусную кислоту в полосатом теле, как показано в нейрохимическом эксперименте; 988±70 (контроли) нг/г ткани и 928±51 нг/г ткани при 50 мкмоль/кг подкожно. 4-(4-метансульфонилфенил)-1-пропилпиперидин не обладает желательными свойствами.
Сравнительный пример 2: Для дальнейшей иллюстрации важности замещения ароматического кольца для получения желательных свойств, 4-фенил-1-пропилпиперидин демонстрирует отсутствие активности при исследовании поведенческой активности у крыс, не подверженных предварительной обработке, с 3661±494 см/60 мин, контроли, до 2553±471 см/60 мин, р>0,05, n=4, при 33 мкмоль/кг и отсутствие воздействия на 3,4-дигидроксифенилуксусную кислоту в полосатом теле, как показано в нейрохимическом эксперименте; 1027±31 (контроли) нг/г ткани и 1190±70 нг/г ткани при 33 мкмоль/кг подкожно, р>0,05, 4-фенил-1-пропилпиперидин также не оказывает желательного подавления поведенческой активности при стимулировании д-амфетамином (с 17295±4738 см/60 мин, д-амфетамин, до 13764±2919 см/60 мин, n=4, р>>0,05 при 33 мкмоль/кг.
Сравнительный пример 3 : Кроме того обнаружено, что 1-фенил-4-пропилпиперазин, описанный в WO 91/09594, как соединение связывающее сигма-рецептор, снижает поведенческую активность у предварительно не обработанных животных с 3370±227, контроли, до 1923±204 см/60 мин, n=4, р<0,05 при 33 мкмоль/кг подкожно, таким образом обеспечивая желаемые свойства.
Сравнительный пример 4: Замещение в орто-положении, как проиллюстрировано на примере 1-(2-метоксифенил)-4-пропилпиперазина, дает соединение, которое повышает содержание 3,4-дигидроксифенилуксусной кислоты в полосатом теле с 1028±9 (контроли) нг/г ткани до 3836±65 нг/г ткани при 50 мкмоль/кг подкожно, n=4, р<0,05. Это сопровождается ингибированием поведенческой активности, нежелательной в настоящем изобретении; с 1651±300 см/60 мин (контроли) до 67±34 см/60 мин при 50 мкмоль/кг подкожно, р<0,05, n=4.
Сравнительный пример 5: Очень важны свойства заместителей в мета-положении. 1-пропил-4-(3-трифторметилфенил)пиперазин повышает содержание 3,4-дигидроксифенилуксусной кислоты в полосатом теле с 1066±46 (контроли) нг/г ткани до 3358±162 нг/г ткани при 50 мкмоль/кг подкожно, р<0,05, n=4, однако, затем следует подавление поведения с 1244±341 см/60 мин (контроли) до 271±137 при 50 мкмоль/кг подкожно, р<0,05, n=4, таким образом не обеспечивая желательные свойства.
Сравнительный пример 6: Далее, соединение 3-(4-пропилпиперазин-1-ил)бензонитрила повышает содержание 3,4-дигидроксиуксусной кислоты в полосатом теле с 1432±57 (контроли) нг/г ткани до 4498±234 нг/г ткани при 100 мкмоль подкожно р<0,05, n=4, и снижает содержание 5-гидроксииндолуксусной кислоты с 630±16 (контроли) нг/г ткани до 484±26 нг/г ткани при 100 мкмоль/кг, р<0,05, n=4. За этими эффектами следует подавление поведенческой активности с 3959±688 см/60 мин (контроли) до 634±266 при 100 мкмоль/кг подкожно, р<0,05, n=4, таким образом не обеспечивая свойства, желательные в настоящем изобретении. 3-(4-Пропилпиперазин-1-ил)бензонитрил обладает следующими свойствами: т.пл. 159°С (фумарат). MС m/z (относительная интенсивность 70 эВ) 229 (М+, 28), 200 (bp), 157 (27), 129 (22), 70 (25).
Сравнительный пример 7: Другой пример значения заместителя представляет собой препаративный пример 14, который также не оказывает воздействия на 3,4-дигидроксифенилуксусную кислоту в полосатом теле; с 1121±36 (контроли) нг/г ткани до 1169±42 нг/г ткани при 50 мкмоль/кг подкожно.
Сравнительный пример 8: Физико-химические свойства, оказываемые заместителем на основном азоте, также важны для получения желаемого профиля. Невозможно использовать любой заместитель, например, 1-фенетил-4-(3-трифторметилфенил)пиперазин, описанный как лиганд-сигма рецептора в WO 91/09594 и WO 93/00313, который имеет некоторое воздействие на 3,4-дигидроксифенилуксусную кислоту в полосатом теле; с 852±33 (контроли) до 1406±77 нг/г ткани при 50 мкмоль/кг подкожно, р<0,05, n=4, а также снижает как количество 5-гидроксииндолуксусной кислоты в полосатом теле с 358±20 (контроли) до 289±16 нг/г ткани при 50 мкмоль/кг подкожно р<0,05, n=4, так и серотонин (5-НТ) с 379±10 (контроли) до 282±6 нг/г ткани при 50 мкмоль/кг подкожно, р<0,05, n=4, что является нежелательным свойством в соответствии с данным изобретением, но как сообщается IC50 20,3 при 5-НТ1А рецепторе (WO 93/00313).
Сравнительный пример 9: Кроме того, 1-бензил-4-(3-метансульфонилфенил)пиперидин, и 3-(1-бензилпиперидин-4-ил)фенол, соединения с бензильным замещением на основном азоте, оба имеют нежелательные свойства для связывания с серотониновыми системами мозга. 1-Бензил-4-(3-метансульфонилфенил)пиперидин повышает уровень 5-гидроксииндолуксусной кислоты в полосатом теле с 428±20 (контроли) до 487±7 нг/г ткани при 50 мкмоль/кг подкожно, р<0,05, n=4, и снижает серотонин (5-НТ) с 442±15 (контроли) до 345±18 нг/г ткани при 50 мкмоль/кг подкожно, р<0,05, n=4, и вызывает синдром поведенческой активности обусловленный серотонином (синдром поведенческой активности, обусловлен серотонином, например, Tricklebank et al., 1985, Eur. J. Pharmacol, 106, pp.271-282). 3-(1-Бензилпиперидин-4-ил)фенол обладает нежелательной способностью повышать уровень 5-гидроксииндолуксусной кислоты в полосатом теле с 404±10 нг/г ткани до 492±26 нг/г ткани при 50 мкмоль подкожно, р<0,05, n=4, и снижает серотонин в лимбической области (5-НТ) с 734±8 (контроли) до 677±20 нг/г ткани при 50 мкмоль/кг подкожно, р<0,05, n=4.
Сравнительный пример 10: Замещение на основном азоте в соответствии с 2-[4-(3-метансульфонилфенил)пиперазин-1-ил]-этанолом, (описанным в GB 20277030), дает соединения, которые неактивны в тесте поведенческой активности; с 3238±1089 см/60 мин (контроли) до 3782±962 см/60 мин при 33 мкмоль/кг, подкожно р<0,05, n=4, а также в нейрохимическом тесте; воздействует на 3,4-дигидроксифенилуксусную кислоту в полосатом теле; с 1158±126 (контроли) до 1239±162 нг/г ткани при 33 мкмоль/кг подкожно, р<0,05, n=4.
Соединения по изобретению особенно пригодны для лечения заболеваний центральной нервной системы и в особенности для лечения заболеваний, опосредованных дофамином. Они могут, например, использоваться для снижения симптомов при нарушении настроения, при ожирении, в качестве аноректического агента и при других нарушениях питания, для улучшения когнитивных функций и связанных с ним эмоциональных расстройств, для улучшения когнитивной и моторной дисфункции, связанной с нарушениями развития, для исправления всех симптомов шизофрении и шизофреноподобных заболеваний, а также и других психозов, для улучшения имеющихся симптомов, а также для предупреждения проявления новых психических проявлений, для регулирования патологических состояний, связанных с употреблением пищи, кофе, чая, алкоголя, лекарственных средств, вызывающих привыкание, и т.д.
Таким образом, соединения по изобретению могут использоваться для лечения симптомов при, например:
- шизофрении и других психотических заболеваниях, таких как кататоническая, гебефреническая, параноидная, резидуальная или дифференциальная шизофрения; шизофреноподобные заболевания; шизоаффективные заболевания; бредовые состояния; краткие психотические расстройства, психотическое расстройство в результате общего болезненного состояния с бредом и/или галлюцинациями;
- расстройства настроения, такие как, например, дистимические расстройства и большие депрессивные расстройства; биполярные расстройства, например, биполярное I расстройство, биполярное II расстройство и циклотимическое расстройство; расстройство настроения в результате общего болезненного состояния с депрессивными и/или маниакальными чертами; и расстройство настроения вызванное определенными веществами;
- тревожные расстройства, такие как острое стрессовое расстройство, агорафобия без панического расстройства в эпикризе; тревожное расстройство в результате общего болезненного состояния, генерализованное тревожное расстройство, обсессивно-компульсивное расстройство, паническое расстройство с агарофобией, паническое расстройство без агарофобии, посттравматическое стрессовое расстройство, специфическая фобия, социальная фобия и тревожное расстройство, вызванное определенными веществами;
- расстройства питания, такие как нервная анорексия, нервная булимия и ожирение;
- расстройства сна, такие как диссомния, например, расстройство сна, связанное с дыханием, расстройство сна с нарушением циркадного ритма, гиперсомния, бессонница, нарколепсия и расстройство нормального циркадного ритма;
- не классифицированные расстройства импульсивного контроля, такие как расстройство импульсивного контроля, характеризующееся несколькими отдельными эпизодами потери контроля за агрессивными побуждениями, клептомания, патологическая азартность, пиромания и трихокриптомания;
- личностные расстройства, такие как параноидное, шизоидное или шизотипическое расстройство, антисоциальное, пограничное, лицемерие и нарциссизм; и замкнутость, зависимость, обсессивно-компульсивное расстройство;
- вызванные медикаментозными средствами расстройства движения, такие как нейролептический индуцированный паркинсонизм, нейролептический злокачественный синдром, нейролептически индуцированная и отдаленная дистония, нейролептически индуцированная акатизия, нейролептически индуцированная отдаленная дискинезия, медикаментозно-индуцированный тремор и медикаментозно-индуцированные дискинезии;
- вызванные веществами расстройства, такие как злоупотребление, зависимость, тревожные расстройства, интоксикация, токсический делирий, психотические расстройства, психотические расстройства с бредом, расстройства настроения, стойкое амнестическое расстройство, стойкая деменция, стойкое расстройство восприятия, половые дисфункции, расстройство сна, синдром отмены, абстинентный делирий вследствие злоупотребления алкоголем, амфетамином (или амфетамин-подобными веществами), кофеином, гашишем, кокаином, галлюциногенами, летучими препаратами, никотином, препаратами опия, фенциклидином (или фенциклидин-подобными веществами), седативными веществами, гипнотическими веществами, и/или транквилизаторами;
- расстройства, впервые диагносцируемые в младенчестве, детстве или юности, такие как олигофрения, расстройство обучения, расстройство моторных навыков, например, расстройство развития координации; коммуникационные расстройства, например, расстройство выразительности языка, фонологическое расстройство, расстройство восприятия-выражения языка и заикание; распространяющееся расстройство развития, например, болезнь Аспергера, аутизм, детская дезинтеграция, болезнь Ретта, дефицит внимания и разрушительное поведение, например, дефицит внимания/гиперактивность, расстройство поведения и оппозиционное неповиновение; расстройства питания и кормления младенцев или детей раннего возраста, например, расстройство кормления младенцев или детей раннего возраста, пикацизм, расстройство жевания; тики, например, хронический моторный или голосовой тик и расстройство Туретта; другие расстройства младенческого, детского или юношеского возраста, например, избирательный мутизм и стереотипическое расстройство движения;
- делирий, деменция, амнестические и другие родственные заболевания, такие как болезнь Альцгеймера, Крейтцфельдта-Якоба, dead травма, болезнь Гентингтона, ВИЧ, болезнь Пика, и диффузная деменция Леви;
- конверсивная истерия;
- состояния, связанные с нормальным старением, такие как расстройство двигательных функций и ментальных функций;
- болезнь Паркинсона и родственные заболевания, такие как множественная системная атрофия, например, стриальная дегенерация, оливопонтоцеребеллярная атрофия, синдром Шая-Джейджера; прогрессивный супрануклеарный паралич; кортикобазальная дегенерация; и сосудистый паркинсонизм;
- треморы, такие как существенный, ортостатический, тремор в покое, церебеллярный и вторичный тремор;
- головные боли, такие как мигрень, гемикрания, головная боль напряжения и параксизмальная головная боль;
- расстройства движения, такие как дискинезии, например, при общих медицинских состояниях, вторичные после травматического или сосудистого инсульта, гемибаллизм, атетозная, хорея Сиденгама и пароксизмальная дискинезия; синдром Экбома (restless legs), болезнь Вильсона, болезнь Галлервордена-Шпатца;
- реабилитационное лечение, например, реабилитация после сосудистого или травматического повреждения мозга;
- боль при состояниях, характеризующихся повышением мышечного тонуса, таких как фибромиалгия, мышечно-лицевой синдром, дистония и паркинсонизм; а также
- состояния, родственные вышеперечисленным, которые попадают в более широкий класс заболеваний, но не соответствуют критериям какого-либо конкретного заболевания в границах этих классов.
Синтез
Синтез настоящих соединений проводится способами, обычными для синтеза родственных им известных соединений. Синтез соединений формулы 1, в целом, включает взаимодействие промежуточных веществ, содержащих алкильную группу, с промежуточными пиперидином или пиперазином, содержащих амино группу формулы 2:
Обычный способ синтеза настоящих соединений состоит в использовании алкилйодида (например, 1-пропил-йодида). Альтернативно, на алкильной группе, конечно, могут использоваться другие уходящие группы кроме йодида, такие как сульфонаты, особенно метансульфонат или толуолсульфонат, группа брома и им подобные. Алкильные промежуточные соединения взаимодействуют с соответствующим амином в присутствии любого подходящего уловителя кислоты. Подходящими уловителями кислоты являются обычные основания, такие как карбонаты, бикарбонаты и гидроксиды щелочных или щелочноземельных металлов, как и некоторые органические основания, такие как триалкиламины и триалканоламины. Реакционной средой для подобных реакций может быть любой подходящий органический растворитель, инертный в щелочных условиях; могут использоваться ацетонитрил, сложные эфиры, такие как этилацетат и ему подобные, и галогенированные алкановые растворители. Обычно реакции проводятся при повышенной температуре реакционной смеси, например, от температуры окружающей среды до температуры кипения с обратным холодильником, в особенности от 50°С до около 100°С.
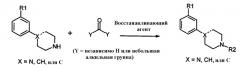
Другой удобный способ синтеза настоящих соединений включает восстановительное аминирование амином формулы 2:
с альдегидом или кетоном, или в присутствии восстанавливающего агента, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, или с последующим восстановлением, например, используя каталитическое гидрирование, получая соответствующее соединение формулы 1.
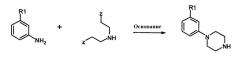
Соединение формулы 3
где Х=N, получают взаимодействием соединений формулы 4:
с соединениями формулы 5:
где Z представляет собой уходящую группу, подобную йодиду. Конечно, на алкильной группе могут использоваться и другие уходящие группы, кроме йодида, такие как сульфонаты, в особенности метансульфонат, или толуолсульфонат, группа брома и им подобные. Алкильное промежуточное вещество взаимодействует с соответствующим амином в присутствии любого подходящего уловителя кислоты. Подходящими уловителями кислоты являются обычные основания, такие как карбонаты, бикарбонаты и гидроксиды щелочных или щелочноземельных металлов, как и органические основания, такие как триалкиламины и триалканоламины. Реакцию проводят в подходящем растворителе, таком как н-бутанол, с нагреванием при около 50-150°С.
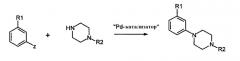
Соединения формулы 1, где Х=N также получают взаимодействием соединений формулы 6:
с арилом, замещенным уходящей группой формулы 7:
где Z представляет собой галогенид, например хлор, бром, йод, или сульфонат, например, -OSO2CF3 или -OSO2F в присутствии основания и катализатора в виде переходного металла с нулевой валентностью, такого как Pb или Ni, в соответствии с известным способом (Tetrahedron Letters, vol.37, 1996, 4463-4466, J. Org. Chem., vol.61, 1996, 1133-1135).
Катализатор, предпочтительно Pd, обладает способностью образовывать лигандный комплекс и подвергаться окислительному присоединению. Типичный Pd катализатор представляет собой Pd2(dba)3, где dba относится к дибeнзилиденацетону), Pd(PPh3)4, Pd(OAc)2 или PdCl2[P(o-tol)3]2, и типичные фосфиновые лиганды представляют собой BINAP, P(o-tol)3, dppf и им подобные. Подходящими уловителями кислоты являются обычные основания, такие как карбонаты, бикарбонаты и алкилоксиды щелочных или щелочноземельных металлов, как и некоторые органические основания, такие как триалкиламины и триалканоламины. Реакционной средой для подобных реакций может быть любой общепринятый органический растворитель, инертный в щелочных условиях; подходящими растворителями являются ацетонитрил, толуол, диоксан, НMП (N-метил-2-пирролидон), ДМЕ (диметоксиэтан), ДМФ (N,N-диметилформамид), ДМСО (диметилсульфоксид) и ТГФ (тетрагидрофуран). Обычно реакции проводят при повышенной температуре реакционной смеси, например, от температуры окружающей среды до температуры кипения с обратным холодильником, особенно от 50°С до около 120°С.
Соединения формулы 1, где Х=N, также получают взаимодействием соединений формулы 6 с арилом, замещенным уходящей группой (например, F или Cl), посредством реакции нуклеофильного ароматического замещения в присутствии основания, как объяснялось выше.
Соединения формулы 1, где Х=СН, также получают путем катализируемой переходным металлом реакции перекрестного связывания, известной специалистам в данной области техники как, например, реакции Suzuki и Stille.
Реакции могут проводиться между соединениями формулы 8:
где Y представляет собой, например, диалкилборан, диалкенилборан или бороновую кислоту (например, BЕt2, B(OH)2 (пунктирные линии могут представлять собой двойные связи) или триалкиламин (например, SnMe3, SnBu3), и арил, замещенный уходящей группой формулы 7:
(определение Z смотри выше) в присутствии основания и катализатора в виде переходного металла с нулевой валентностью, такого как Pd или Ni, в соответствии с известными способами (Chem. Pharm. Bull., vol.33, 1985, 4755-4763, J. Am. Chem. Soc., vol.109, 1987, 5478-5486, Tetrahedron Lett., vol.33, 1992, 2199-2202). Кроме того, Y может представлять собой цинк- или магнийгалогенидную группу (например, ZnCl2, ZnBr2, ZnI2, MgBr2, MgI2) в соответствии с известными способами (Tetrаhedron Lett., vol.33, 1992, 5373-5374, Tetrahedron Lett., vol.37, 1996, 5491-5494).
Катализатор, предпочтительно Pd, обладает способностью образовывать лигандный комплекс и подвергаться окислительному пр