Композиции и способы лечения неврологических нарушений
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неврологии, и касается лечения неврологических нарушений, обусловленных амилоидными отложениями. Для этого вводят терапевтически эффективное количество композиции на основе протеосомы, содержащей препарат белка наружной мембраны из грамотрицательных бактерий. Способ обеспечивает уменьшение амилоидных отложений за счет их фагоцитоза активированной микроглией без индукции нейротоксических эффектов. 16 з.п. ф-лы, 9 ил., 4 табл.
Реферат
Декларация относительно прав на изобретения, выполненных при федеральном финансировании научно-исследовательских работ
Это изобретение было выполнено при правительственной поддержке в рамках гранта, предоставленного Министерством здравоохранения и социального обеспечения. Правительство имеет определенные права на это изобретение.
Ссылки на родственные заявки
Эта заявка имеет приоритет предварительной заявки на патент США 60/582999, поданной 25 июня 2004, которая включена сюда во всей своей полноте, как если бы она была полностью здесь изложена.
Область изобретения
Описаны композиции, применяемые для лечения неврологических нарушений, включающих нейродегенеративные нарушения, связанные с болезнетворной белковой агрегацией, аберрантной укладкой белка и/или нейродегенеративными аутоиммунными нарушениями, такими как амилогенные заболевания мозга. Также описаны способы применения указанных композиций.
Уровень техники
В общем случае неврологические заболевания характеризуются потерей нейронов в одной или нескольких областях центральной нервной системы. Примеры неврологических заболеваний включают болезнь Альцгеймера, нейрофиброматоз, болезнь Хантингтона, депрессию, амиотрофический латеральный склероз, рассеянный склероз, нарушение мозгового кровообращения, болезнь Паркинсона и мультиинфарктную деменцию. Они являются сложными как в начале, так и в развитии и, как подтверждается, являются одними из наиболее трудных заболеваний в лечении. Фактически для некоторых неврологических заболеваний нет препаратов, которые обеспечивают значительный терапевтический эффект. Трудность в обеспечении лечения еще более трагична на фоне разрушительного действия, которое оказывают эти заболевания на пациентов.
Болезнь Альцгеймера (AD) представляет собой дегенеративное заболевание мозга, клинически характеризующееся прогрессивной потерей памяти, восприятия, логического мышления, здравого смысла и эмоциональной стабильности, что постепенно приводит к глубокому умственному нарушению и в конечном итоге к смерти. AD является очень распространенной причиной прогрессирующего умственного расстройства (деменции) у пожилых людей и, как полагают, является четвертой из самых распространенных медицинских причин смерти в США. AD наблюдается у всех рас и этнических групп по всему миру и представляет главную настоящую и будущую проблему здравоохранения. Как оценивают, только в США заболевание охватывает приблизительно четыре миллиона индивидуумов. В настоящее время AD является неизлечимой. Для лечения симптомов AD у людей применяют некоторые лекарственные средства. Однако в настоящее время не известно ни одного лекарственного средства, которое эффективно предотвращает AD или полностью прекращает симптомы или течение болезни у людей.
В головном мозге индивидуумов с AD наблюдаются характерные поражения, которые называют сенильными бляшками и нейрофибриллярными клубками. Сенильные бляшки, характерные при AD, наиболее часто локализуются внеклеточно, тогда как нейрофибриллярные клубки наиболее часто локализуются внутриклеточно. В общем случае большое количество этих поражений (повреждений) обнаружено у больных с AD в нескольких областях человеческого мозга, отвечающих за память и когнитивную функцию. Меньшее количество этих повреждений в более ограниченном анатомическом распределении иногда обнаруживаются в головном мозге пожилых людей, у которых нет клинической AD. Основным химическим компонентом сенильных бляшек и сосудистых амилоидных отложений (амилоидная ангиопатия), характерная особенность AD, является белок, называемый амилоидный-β пептид (Aβ), который также может упоминаться как βAP, AβP или β/A4. Внеклеточные бляшки, содержащие Aβ, могут быть плотнорасположенными или рассеянными. Плотнорасположенные бляшки упоминаются часто как фибриллярные бляшки. О первом очищенном Aβ и о неполной аминокислотной последовательности сообщали Glenner и Wong (1984) Biochem. Biophys. Res. Commun. 120:885-890. Методика выделения и данные последовательности для первых 28 аминокислот описаны в Патенте США № 4666829. Впервые о формах Aβ, содержащих более 40 аминокислот, было сообщено Kang et al. (1987) Nature 325:733-736.
AD невропатологически характеризуется, в той или иной степени, четырьмя главными поражениями: a) внутринейронные, цитоплазматические отложения нейрофибриллярных клубков (NFT), b) паренхимальные амилоидные отложения, называемые нейритными бляшками (старческими бляшками), c) цереброваскулярный Aβ амилоидоз (например, амилоидная ангиопатия), и d) синаптическая и нейронная потеря. Одним из ключевых событий в AD является отложение амилоида (например, Aβ пептида) в виде нерастворимой фиброзной массы (амилоидогенез), что приводит к внеклеточным нейритным бляшкам и отложениям по стенкам церебральных кровеносных сосудов. Основным компонентом нейритных бляшек и церебральной амилоидной ангиопатии является Aβ, хотя эти отложения могут также содержать другие белки, такие как гликозаминогликаны и аполипопротеины. Solomon, B. et al. (1997) PNAS 94 (8):4 4109-1-2 показал, что моноклональное антитело против N-концов Aβ может связываться с ними и дезагрегировать существующие ранее отложения Aβ-пептида и/или предотвращать фибриллярную агрегацию in vitro и предотвращать токсичность в нейронных клеточных культурах. Schenk, D. et al., Nature 400 (6740): 173-177 (1999) показал, что иммунизация амилоидом-β уменьшила патологию, подобную болезни Альцгеймера у трансгенных мышей PDAPP, которые являются экспериментальной моделью на животных для отложений амилоида-β и невропатологий, подобных болезни Альцгеймера. Они сообщили, что иммунизация молодых животных до начала невропатологий типа болезни Альцгеймера по существу предотвратила развитие формирования β-амилоидных бляшек, невритической дистрофии и астроглиоза, тогда как при лечении взрослых животных после появления невропатологий типа болезни Альцгеймера наблюдали уменьшение степени и прогрессии этих невропатологий. Этот эффект опосредован антителами, так как при периферическом введении антител против Aβ наблюдали уменьшение мозговой паренхимальной амилоидной массы (Bard F. et al., (2000) Nat. Med. 6(8):916-9). Кроме того, интраназальная иммунизация свежеприготовленным солюбилизированным Aβ 1-40 уменьшает церебральную амилоидную массу (Weiner, H.L. et al., (2000) Ann. Neuro. 48(4):567-79). Два исследования, выполненные Morgan, D. et al., (2000) Nature 408(6815):982-5; и Janus, C. et al., (2000) Nature 408(6815):979-82, с использованием системы экспериментальных моделей на животных, показали, что сокращение амилоидных отложений в мозгу, вызванное вакцинацией, привело к улучшениям восприятия. Дополнительные исследования были направлены на различные аспекты этой же темы, включая Dodart et al., (2002) Nat. Neuroscience 5(5):452-7 и Kotilinek, L.A. et al., (2002) J. Neuroscience 22(15):6331-5. Хотя при вакцинации Aβ были показаны некоторые благоприятные исходы в различных исследованиях при использовании экспериментальных моделей AD на животных, клинические исследования иммунизации людей Aβ 1-40/42 пептидами, приготовленными с адъювантом (QS21), были остановлены из-за вредного и/или неприемлемо высокого числа случаев возникновения побочных эффектов, таких как менингоэнцефалит. Таким образом, существует потребность в терапевтически приемлемых методах лечения и/или профилактики AD и родственных нейродегенеративных нарушений, связанных с агрегацией белка.
Аутоиммунные заболевания характеризуются отклоняющимся от нормы иммунным ответом, направленным на самих себя или на аутогенные ткани. В зависимости от типа имеющего место иммунного ответа (или иммунной реакции), в общем случае, аутоиммунные заболевания у млекопитающих могут быть отнесены к одному из двух разных типов: нарушения, опосредованные клеткой (то есть опосредованные Т-клетками) или опосредованные антителом. Рассеянный склероз (MS) представляет собой аутоиммунное заболевание, опосредованное Т-клетками (Trapp et al. New Eng. J. Med. 338 (5):278 (1998)). Более чем 1000000 молодых людей по всему миру в возрасте от тридцати до сорока лет имеют MS. MS является самым распространенным заболеванием центральной нервной системы и представляет собой самую распространенную причину неврологической неспособности у молодых людей. Патофизиологически циркулирующие аутореактивные Т-клетки являются посредниками разрушения большой части центральной нервной системы, отмечающегося у пациентов с MS (Rudick et al. New Eng. J. Med. 337:1604 (1997)).
При MS Т-клетки реагируют с основным белком миелина (MBP), который является компонентом миелина в центральной нервной системе. Доказательство, что активированные Т-клетки, специфические к MBP, могут быть выделены у пациентов с MS, подтверждает предположение, что MS является аутоиммунным заболеванием, где Т-клетки уничтожают сами себя или аутогенную нейрональную ткань (Allegretta et al. Science: 247: 778 (1990)).
В настоящее время MS лечат некоторыми противовоспалительными и иммуносупрессорными агентами, такие агенты включают: (i) кортикостероиды, которые обладают как иммуномодуляторным, так и иммуносупрессорным действием; (ii) интерферон-β; (iii) глатирамер ацетат (GA); (iv) азатиоприн, аналог пурина, который подавляет как опосредованный клеткой, так и гуморальный иммунитет; (v) внутривенный иммунный глобулин; (vi) метотрексат, который ингибирует дигидрофолатредуктазу и подавляет опосредованный клеткой и гуморальный иммунитет; (vii) циклофосфамид, алкилирующий агент, который оказывает цитотоксическое и иммуносупрессорное действие; и (viii) циклоспорин, который обладает мощным иммуносупрессорным действием посредством ингибирования активации Т-клетки. Несмотря на лечение такими противовоспалительными или иммуносупрессорными препаратами, состояние более чем 50% пациентов с MS неуклонно ухудшается из-за фокального разрушения спинного мозга, мозжечка и церебральной коры.
Многие препараты, используемые в настоящее время для лечения MS, имеют ограничение эффективности длительного воздействия, частично, потому что они оказывают значительное цитотоксическое действие. Например, длительное лечение циклофосфамидом может вызвать облысение, тошноту, рвоту, геморрагический цистит, лейкопению, миокардит, бесплодие и легочный внутритканевый фиброз. Лечение иммуносупрессорами может в итоге вызвать "общую" иммуносупрессию у пациента, подвергаемого лечению, которая значительно увеличивает риск инфекции. Пациенты, подвергаемые воздействию длительной общей иммуносупрессии, имеют повышенный риск развития тяжелых медицинских осложнений при лечении, таких как злокачественные опухоли, почечные расстройства и диабет.
Альтернативный вариант лечения MS заключается в использовании внутривенного или перорального приема MBP для регулирования Т-клеточного иммунного ответа, который может быть с ним ассоциирован. Внутривенное введение MBP или его фрагментов, содержащих иммунодоминантные эпитопы MBP, подавляет иммунную систему, вызывая клональную анергию или Т-клеточную иммунологическую толерантность, которая дезактивирует Т-клетки, специфичные для MBP. Конечный результат заключается в том, что MBP-специфичные Т-клетки больше не пролиферируют в ответ на MBP. Неспособность Т-клеток пролиферировать приводит к уменьшению разрушения невральных тканей, опосредованных Т-клетками.
Иммунохимический аналог MBP, используемый для лечения MS, представляет собой глатирамер ацетат (GA) или сополимер 1 (COP-1) (Патент США № 3849550; Заявка PCT WO/95/31990). GA, в его коммерчески доступном виде, является смесью случайных синтетических полипептидов, состоящих из L-аланина, L-глутаминовой кислоты, L-лизина и L-тирозина в молярном соотношении 6,0:1,9:4,7:1,0. Изначально он был синтезирован как иммунохимический миметик MBP. Например, некоторые моноклональные антитела к GA дают перекрестную реакцию с MBP (Teitelbaum et al. Proc. Natl. Acad. Sci. USA 88:9258 (1991)). Как было также обнаружено, GA индуцирует T супрессорные клетки, специфичные к MBP (Lando et al. J. Immunol. 123:2156 (1979)). Эксперименты на мышах показывают, что GA также специфически ингибирует MBP-специфические Т-клетки, которые вызывают разрушение тканей центральной нервной системы при экспериментальном аллергическом энцефаломиелите (EAE) (Teitelbaum et al. Proc. Natl. Acad. USA 85:9724 (1995)).
Введение GA может: (i) увеличить процент NK клеток; (ii) уменьшить сывороточные рецепторы IL-2; (iii) подавить TNF-α; и (iv) увеличить TGF-β и IL-4 (Ariel et al. Multiple Sclerosis 3(5), S053 (1997)).
Хотя пациентов с MS относительно успешно лечили парентеральным введением GA (Bornstein et al. Transactions American Neurological Association, 348 (1987)), текущий режим лечения и эффекты в целом могут быть улучшены.
Цитирование приведенных выше документов не должно быть истолковано как признание того, что какой-либо из указанных документов представляет относящийся к делу предшествующий уровень техники. Все утверждения, касающиеся даты или изложения относительно содержания указанных документов, основаны на информации, доступной заявителям, и не предполагают какое-либо допущение относительно корректности дат или содержания указанных документов.
Краткое описание изобретения
Настоящее изобретение обеспечивает способы и композиции для лечения неврологических заболеваний или нарушений у млекопитающих, нуждающихся в таком лечении. Указанные неврологические заболевания или нарушения могут представлять собой ассоциируемые с системным или локализованным отложениями белка или белкового материала (например, амилоидоз), болезнетворными белковыми агрегациями (неправильная укладка белка) и/или нейродегенеративным аутоиммунитетом. Особый интерес представляют заболевания, формирующие амилоид, такие как болезнь Альцгеймера и/или другие амилогенные заболевания мозга, включающие заболевания, связанные с прионами, болезнь Хантингтона, болезнь Паркинсона и церебральную амилоидную ангиопатию (CAA) (Revesz, T. et al. (2003) J. Neuropathol. Exp.Neurol. 62 (9):885-98). Лечение указанных заболеваний, связанных с амилоидом, может включать предотвращение формирования новой амилоидной бляшки (отложения), поддержание текущих уровней амилоидных бляшек и/или уменьшение количества существующих амилоидных бляшек или общего количества амилоидного белка в мозге (включая Aβ, который не может быть отложен в бляшках), измеренного по определению общей амилоидной нагрузки (растворимого и нерастворимого Aβ) или количества фибриллярной Aβ-амилоидной нагрузки. Указанные неврологические заболевания или нарушения могут быть связаны с опосредованным клетками аутоиммунным заболеванием, таким как рассеянный склероз. Лечение указанных аутоиммунных нарушений может включать предотвращение формирования аутореактивных Т-клеток, поддержание текущих концентраций аутореактивных Т-клеток и/или уменьшение концентрации аутореактивных Т-клеток.
По настоящему изобретению заявляются и используются различные композиции на основе протеосомы и/или композиции GA, необязательно в форме субмикронной эмульсии или наноэмульсии, в качестве лекарственного средства для лечения неврологических заболеваний или нарушений у млекопитающих, включающих заболевания или нарушения, связанные с Aβ бляшками, и аутоиммунные заболевания или нарушения, опосредуемые клеткой.
Краткое описание фигур
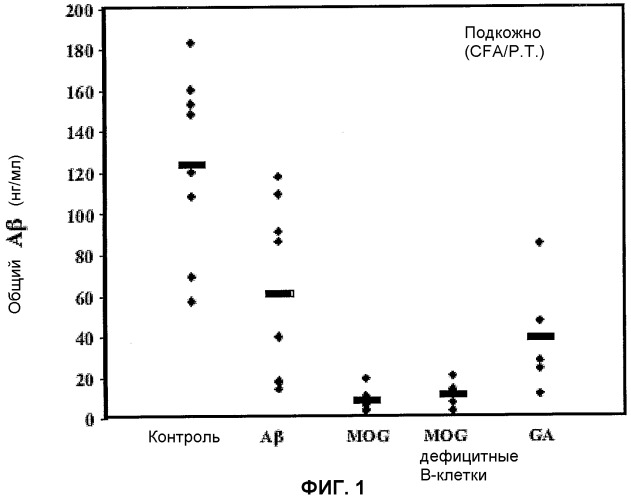
Фиг.1: Действие подкожной иммунизации на уровни общего Aβ в мозге. Для количественного определения амилоидной нагрузки, правое полушарие экстрагировали в 5,0 М хлорида гуанидиния (pH 8) в течение 3 часов при комнатной температуре. Растворы использовали для измерения уровней Aβ40 и Aβ42 методом твердофазного иммуноферментного анализа (ELISA).
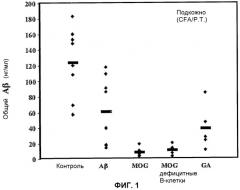
Фиг.2: Действие назальной иммунизации на общие уровни общего Aβ в мозге. Концентрационные уровни общего Aβ по Aβ40 и Aβ42 из отдельных мышей после назальной обработки, измеренные методом твердофазного иммуноферментного анализа (ELISA).
Фиг.3: Активация CD11b+ клеток приводит к клиренсу фибриллы Aβ у мышей, обработанных парентерально и назально. (A) Окрашивание фибриллы Aβ в гиппокампальной области тиофлавином-S (увеличение х10) или совместное окрашивание общего Aβ с анти-Aβ антителом (R1288) и анти-CD11b (микроглия/макрофаг) (увеличение x40) после подкожной иммунизации. (B) Совместное окрашивание анти-Aβ антитела (R1288) и анти-CD11b (микроглия/макрофаг) (в гиппокампальной области увеличение x40) после назальной иммунизации.
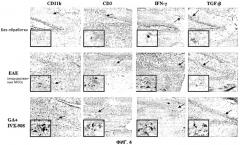
Фиг.4: Иммуногистология мозговых срезов после подкожной иммунизации MOG и назальной вакцинации глатирамер ацетатом. Серийные срезы области гиппокампа из необработанных или иммунизированных мышей спустя 50 дней после иммунизации были помечены с использованием анти-CD11b, CD3, IFN-γ и TGF-β антител (увеличение x20, увеличение на вкладках x60).
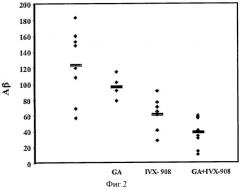
Фиг.5: Уменьшение астроцитоза после назального введения GA+IVX-908. Четкие гиппокампальные области (Брегма-1.44mm) отбирали для количественного анализа активированных астроцитов с использованием GFAP окрашивания. Уровень активации астроцита выражали как процент на мм2 гиппокампальной области; p=0,039 GA+IVX-908 по сравнению с контролем; p=0,02 по сравнению с EAE (MOG).
Фиг.6: Невропатология в мозговых средах после подкожной иммунизации MOG и назальной вакцинации глатирамер ацетатом. Серийные срезы коры из необработанных или обработанных мышей спустя 50 дней после иммунизации были помечены с использованием маркеров нейротоксичности: SMI32, TUNEL и iNOS (первоначальное увеличение x20). Стрелки показывают метки для изученных маркеров. Мечение для маркеров нейротоксичности наблюдали у EAE животных, но не у животных, обработанных GA-IVX-908.
Фиг.7: Целостность гематоэнцефалитического барьера на срезе гиппокампа после подкожной иммунизации MOG и назальной вакцинации глатирамер ацетатом. Серийные срезы коры от необработанных или обработанных мышей спустя 50 дней после иммунизации были помечены с использованием маркера окрашивания плазмы - фибриногена. Мечение для маркеров фибриногена наблюдали у EAE животных, но не у животных, обработанных GA-IVX-908. (Увеличение x20, увеличение на вкладке x40).
Фиг.8: Невропатология в обонятельных срезах после подкожной иммунизации MOG и назальной вакцинации глатирамер ацетата. Серийные срезы коры из необработанных или обработанных мышей спустя 50 дней после иммунизации были помечены с использованием маркеров фибриллярного амилоида: ThS, активация микроглии CD11b, BBB целостность, Фибриноген. (Увеличение x20)
Фиг.9: Окрашивание для CD68+клеток в ЦНС у необработанных мышей и мышей, иммунизированных MOG и обработанных GA+IVX-908. Стрелки указывают на CD68+клетки, которые проникают в ЦНС при EAE, но остаются локализованными у хороидного сплетения у мышей, обработанных GA+IVX-908. У необработанных мышей не наблюдали окрашивания. Срезы брали из мозжечка (Увеличение x20).
Осуществление изобретения
Термин "неврологическое заболевание" относится к заболеванию или нарушению, которое затрагивает нейронные клетки нервной системы. Особо включены: прионные заболевания (например, болезнь Крейтцфельда-Якоба); патологии развития мозга (например, врожденные дефекты в аминокислотном метаболизме, такие как аргининосукцинурия, цистатионурия, гистидинемия, гомоцистинурия, гипераммониемия, фенилкетонурия, тирозинемия и синдром ломкой X-хромосомы); патологии мозга у взрослых (например, нейрофиброматоз, болезнь Хантингтона, депрессии, амиотрофический латеральный склероз, рассеянный склероз); состояния, которые поражают в зрелом возрасте (например, болезнь Альцгеймера, болезнь Крейтцфельда-Якова, болезнь тела Леви, болезнь Паркинсона, синдром Пика); и другие патологии мозга (например, нарушение мозга, повреждения мозга, кома, инфекции различными агентами, недостаточность рациона, нарушение мозгового кровообращения, мультиинфарктная деменция и сердечно-сосудистые осложнения).
Предпочтительными заболеваниями или нарушениями по настоящему изобретению являются заболевания, повреждающие мозг у взрослых, такие как рассеянный склероз, и те, которые обычно поражают в зрелом возрасте, такие как болезнь Альцгеймера.
Термин "болезнь Альцгеймера", обозначенный здесь аббревиатурой "AD", относится к нейродегенеративному заболеванию центральной нервной системы. В общих чертах, заболевание относится к двум категориям: поздняя, которая встречается в престарелом возрасте (обычно после 65 лет) и ранняя, которая развивается задолго до старческого периода, например между 35 и 60 годами. При обоих типах заболевания патология сходна, но в случаях, начавшихся в более раннем возрасте, отклонения имеют тенденцию быть более тяжелыми и широко распространенными. AD характеризуется накоплением внеклеточно локализованного мозгового амилоида (например, пептид Aβ), амилоидными бляшками (которые можно дополнительно разделить на плотнорасположенные или рассеянные) и внутриклеточно локализованными нейрофибриллярными клубками, сконцентрированными в некоторых уязвимых областях мозга, таких как гиппокамп и кора. AD представляет собой прогрессирующее заболевание, приводящее к старческой деменции. Амилоидные бляшки представляют собой области дезорганизованных нейрофибриллярных волокон, которые могут быть объединены с нейтрофилами вплоть до 150 мм в ширину с внеклеточным бета-амилоидными (Aβ) отложениями в центре, видимые при микроскопическом анализе срезов мозговой ткани. Нейрофибриллярные клубки представляют собой внутриклеточные отложения тау-белка (часто гиперфосфорилированного), состоящие из двух парноскрученных филаментов. AD связан с патологическим накоплением Aβ пептида, являющегося следствием измененного протеолитического процессинга амилоидного белка-предшественника (APP). Патологическое накопление Aβ коррелирует с рядом мутаций, таких как аутосомные доминантные мутации APP и мутации в генах, кодирующих белки, называемые пресенилин 1 (PS1) и пресенилин 2 (PS2), которые влияют на протеолитическую активность, соответственно, γ (гамма) или β (бета) секретазы, вызывая повышенные уровни, например, Aβ 1-42; тогда как протеолитическая активность α (альфа) секретазы возможно связана с нормальным процессингом APP. При AD обнаружены различные типы бляшек, включающие без ограничения нейритные бляшки, связанные с патологическими дистрофическими невритами. Показателем заболевания также является наличие воспалительной реакции ЦНС, включая активированную микроглию и астроциты. Накопление отложений дисфункционального белка (например, Aβ и прионного белка), связанное с неврологическими нарушениями, как считают, является причиной, или способствует, или влияет иначе на развитие некоторых неврологических нарушений (Ingelsson, M. and Hyman B.T. (2002) Annals of Med. 34:259-271). Нейродегенеративные нарушения, связанные с болезнетворной белковой агрегацией, включают болезнь Альцгеймера, синдром Пика, болезнь Паркинсона, прионное заболевание нарушения Хантингтона и мотонейронные нарушения (Shastry, Neurochemistry International, 2002, 43: 1-7).
Термин "амилоид" относится к внеклеточному (например, Aβ, прионным заболеваниям и заболеванию множественной миеломы легкой цепи) или внутриклеточному (например, нейрофибриллярные клубки тау-белка при AD и альфа-синуклеина при болезни Паркинсона) отложению белковых агрегатов (Trojanowski J.Q. and Mathson M.P. (2003) Neuromolecular Medicine 4:1-5). Амилоидное отложение может быть обнаружено в мозге у пациентов с AD и синдромом Дауна, а также в артериях, артериолах, капиллярах и венах центральной нервной системы. Амилоидные отложения могут быть идентифицированы вследствие их способности связаться с красителями, такими как конго красный и тиофлавин-S, и образовывать фибриллы, включая перекрестную B-складчатую конформацию.
Термин "амилоидоз" относится к большой разнородной группе нарушений, характеризующихся абберантными нерастворимыми отложениями обычно растворимых белков, которые могут представлять собой белки с неправильной укладкой, включая белковые агрегации.
Кроме болезни Альцгеймера (AD), ранней болезни Альцгеймера, поздней болезни Альцгеймера и предсимптоматической болезни Альцгеймера, другие заболевания, характеризующиеся амилоидными отложениями, например сывороточный амилоид А(SAA) амилоидоз, наследственный исландский синдром, множественная миелома, прионные заболевания и т.п., или другие амилогенные заболевания мозга (Revesz, T. et al. (2003) J. Neuropathol. Exp.Neurol. 62 (9):885-98), могут лечиться композициями и способами, предложенными здесь. Самыми распространенными прионными заболеваниями у животных являются скрейпи овец и коз и губчатая энцефалопатия (BSE) крупного рогатого скота (Wilesmith и WeIIs (1991) Curr. Top.Microbiol. Immunol. 172:22-38). Четыре прионных заболевания были идентифицированы у людей: (i) куру, (ii) болезнь Крейтцфельда-Якоба (CJD), (iii) болезнь Герстманна-Штройсслера-Шейнкера (GSS) и (iv) фатальная семейная бессонница (FFI) (Gajdusek, округ Science 197(4307):943-60 и Medori, R. et al., (1992) N. Engl. J. Med. 326 (7):444-9).
Главным компонентом сенильных бляшек является пептид Aβ. Пептид Aβ представляет собой внутренний фрагмент из 39-43 аминокислот в белке-предшественнике APP. Несколько мутаций в белке APP коррелируют с наличием болезни Альцгеймера (см., например, Goate, A. et al., (1991) Nature 349(6311):704-6, Murrell, M. et al., (1991) Science 254(5028):97-9, Mullan, M. et al., (1992) Nat. Genet. l(5):345-7).
Термин "белок-предшественник β-амилоида" (APP), как здесь используется, определен как полипептид, который кодируется геном с таким же названием, который находится у людей в длинном плече хромосомы 21 и который включает Aβ в пределах трети у карбоксильного конца. APP является гликозилированным белком, пронизывающим мембрану один раз, который экспрессируется широким рядом клеток во многих тканях млекопитающих.
Мутации APP, как считают, влияют на развитие болезни Альцгеймера посредством усиленного или измененного протеолитического процессинга АPP в Aβ, в частности, процессинга APP, приводящего к повышенным количествам длинной формы Aβ (то есть Aβ 1-42 и Aβ 1-43). Мутации в других генах, таких как гены пресенилина, PS1 и PS2, как считают, косвенно воздействуют на протеолитический процессинг APP, приводящий к повышенным количествам длинной формы Aβ (см. Hardy, J. (1997) Trends Neurosci. 20 (4): 154-9). Эти наблюдения указывают, что Aβ, и особенно его длинная форма, является причиной болезни Альцгеймера.
Термин "фрагменты APP", как здесь используется, относится к фрагментам APP, отличным от тех, которые состоят исключительно из Aβ или фрагментов Aβ. То есть фрагменты APP включают аминокислотные последовательности APP в дополнение к тем, которые образовывают интактный Aβ или фрагмент Aβ.
Термин "бета-амилоидный пептид" является синонимом с терминами "β-амилоидный пептид", "βAP", "βA" и "Aβ". Все эти термины относятся к пептиду, формирующему бляшку, произведенному из фрагментов амилоидного белка-предшественника.
Как здесь используется, определение терминов фибриллярный Aβ и общий Aβ следующие. "Фибриллярный" Aβ представляет собой Aβ-пептид, содержащийся во внеклеточных амилоидных отложениях, которые также упоминаются как Aβ бляшки или «plagues»; в некоторых случаях Aβ бляшки можно дополнительно разделить на рассеянные или плотнорасположенные. "Общая" амилоидная нагрузка или общая Aβ нагрузка представляет собой сумму растворимого и нерастворимого (например, фибриллярного) пептида Aβ, большая часть которого, как предполагают, является внеклеточной. Как полагают, существует динамическая зависимость между растворимым и нерастворимым Aβ, где внеклеточный нефибриллярный Aβ может представлять собой источник Aβ, который может стать фибриллярным амилоидом.
Как здесь используется, термин экспериментальный аллергический энцефаломиелит (EAE) представляет собой основную экспериментальную модель на животных для MS. EAE может быть без труда вызван у малых млекопитающих иммунизацией MBP в подходящем адъюванте или пассивным переносом CD4+, MBP-реактивных Т-клеток (Alvord Jr, E. C, et al. eds. in Experimental Allergic Encephalomyelitis a Useful Model for Multiple Sclerosis, A.R. Liss, N.Y., 1984; Makhtarian et al. Nature 309: 356 (1984); Ben-Nun et al. J. Immunol. 129:303 (1982)). Т-клетки, которые вызывают EAE как у мышей, так и у крыс, распознают пептиды, соответствующие областям антигенной детерминанты MBP, представленной антиген-представляющими клетками по классу II главного комплекса гистосовместимости (MHC) молекул.
По одному аспекту настоящего изобретения обеспечивается способ лечения неврологического заболевания или нарушения у млекопитающего. Способ по этому аспекту настоящего изобретения является эффективным посредством введения терапевтически эффективного количества GA и композиции на основе протеосомы субъекту, нуждающемуся в этом. Дополнительным аспектом по настоящему изобретению является то, что указанное неврологическое заболевание или нарушение представляет собой заболевание или нарушение с формированием амилоидных бляшек. Самые известные неврологические заболевания или нарушения, для лечения GA и композицией на основе протеосомы, по одному аспекту настоящего изобретения, представляют собой болезнь Альцгеймера и рассеянный склероз. В дополнение к терапевтической композиции GA, объединенной с протеосомой, для лечения вышеупомянутых неврологических заболеваний или нарушений дополнительные воплощения без ограничения включают применение следующих терапевтических композиций для лечения: композиция на основе протеосомы без композиции GA, GA в виде субмикронной эмульсионной композиции, или GA в виде наноэмульсионной композиции. Предыдущие воплощения также могут включать любой фармацевтически приемлемый разбавитель, наполнитель, стабилизатор или носитель.
Еще одним дополнительным аспектом по настоящему изобретению является то, что лечение указанного неврологического заболевания или нарушения у млекопитающего включает введение терапевтически эффективного количества GA и композиции на основе протеосомы, которая вызывает независящий от антитела ответ у указанного млекопитающего.
Дополнительное воплощение настоящего изобретения заключается в способе лечения амилоидного заболевания, которое может представлять собой болезнь Альцгеймера. Лечение амилоидного заболевания может осуществляться посредством, например, предотвращения увеличения фибриллярной амилоидной нагрузки, предотвращения увеличения общей амилоидной нагрузки, поддерживания текущей фибриллярной и/или общей амилоидной нагрузки или уменьшения фибриллярной и/или общей амилоидной нагрузки в мозге. Поскольку известно, что амилоидные белки могут быть обнаружены по всему телу, воплощения настоящего изобретения не ограничены мозговым амилоидом. Кроме того, хотя настоящее изобретение конкретно касается β-амилоида, настоящее изобретение охватывает также другие амилоидные классы, такие как сывороточный амилоид А (SAA), прионное заболевание, наследственный исландский синдром, болезнь Хантингтона, паркинсонизм, синдром Дауна и церебральную амилоидную ангиопатию. Лечение вышеупомянутых амилоидных заболеваний может сопровождаться введением одной из следующих терапевтических композиций: терапевтически эффективное количество GA и композиции на основе протеосомы, композиция на основе протеосомы без композиции GA, GA в форме субмикронной эмульсии и/или GA в форме наноэмульсии. Предыдущие воплощения также могут включать любой фармацевтически приемлемый разбавитель, наполнитель, стабилизатор или носитель.
Глатирамера ацетат
Глатирамера ацетат (GA), или сополимер-1 (СОР-1) (Патент США № 3849550; заявка PCT WO/95/31990), представляет собой иммунохимический аналог MBP, эффективный при лечении рассеянного склероза (MS). GA, в его коммерчески доступном виде, является смесью случайных синтетических полипептидов, состоящих из L-аланина, L-глутаминовой кислоты, L-лизина и L-тирозина в молярном соотношении 6,0:1,9:4.7:1,0. Впервые он был синтезирован как иммунохимический миметик MBP. Например, некоторые моноклональные антитела к GA дают перекрестную реакцию с MBP (Teitelbaum et al. Proc. Natl. Acad. Sci. USA 88:9258 (1991)). Также было установлено, что GA индуцирует T-супрессорные клетки, специфичные к MBP (Lando et al. J. Immunol. 123:2156 (1979)). Эксперименты на мышах показывают, что GA также специфически ингибирует MBP-специфические Т-клетки, которые участвуют в разрушении ткани центральной нервной системы при EAE (Teitelbaum et al. Proc. Natl. Acad. USA 85:9724 (1995); и Angelov, D.N. et al. PNAS 100 (8):4790-4795 (2003)), показывают, что GA может быть использован для лечения амиотрофического латерального склероза, где индукция хорошо отрегулированной аутоиммунной реакции, как оказывается, влияет на выживаемость при наличии Т-клеточной реакции против себя, которая может быть усилена введением GA.
GA по настоящему изобретению может быть приготовлен способами, известными в данной области. Например, GA может быть приготовлен способом, раскрытым в патенте США № 3849550, где N-карбоксиангидриды тирозина, аланина, γ-бензилглутамата и є-N-трифторацетиллизина полимеризуются при температуре среды в безводном диоксане с диэтиламином в качестве ингибитора. Разблокирование γ-карбоксильной группы глутаминовых кислот выполняют бромводородом в ледяной уксусной кислоте и с последующим удалением трифторацетильных групп от остатков лизина посредством 1M пиперидина. Полученная смесь полипептидов состоит, по существу, из полимеров аланина, глутаминовой кислоты, лизина и тирозина в молярном соотношении приблизительно 6:2:5:1.
GA также коммерчески доступен от Teva Pharmaceuticals, Kfar-Saba, Israel.
GA может быть приготовлен для применения по настоящему изобретению в любой из форм, которые обеспечивают его терапевтическую полезность. Они включают смеси пептидов с различными молекулярными массами. GA, имеющий желательный диапазон молекулярных масс, может быть получен способами, известными в данной области. Такие способы включают гель-фильтрацию высокоэффективной жидкостной хроматографией GA для удаления высокомолекулярных форм, как раскрыто в WO 95/311990. В одном воплощении GA имеет приблизительно 75% его полимерной формы в диапазоне молекулярных масс от приблизительно 2 кДа до приблизительно 20 кДа. В другом воплощении GA имеет среднюю молекулярную массу приблизительно от 4 кДа до 9 кДа. Должно быть понятно, что GA может быть подвергнут ферментативному или другому разложению для включения полимерных форм, имеющих длину, отличную от, или иначе модифицированных по сравнению с обычным GA, полученным известными способами.
GА и протеосомы
GA, приготовленный с протеосомами (например, IVX-908 или Protollin), может вводиться, например, инъекционно или интраназально. При инъекционной доставке, такая доставка может представлять собой одну инъекцию (комбинированное одновременное введение). Альтернативно доставка GA композиции и композиции на основе протеосомы может обеспечиваться по отдельности, выполнением инъекций в несколько участков, которые могут проводиться одновременно или через определенные промежутки времени и где в один участок вводят только GA композицию (то есть без протеосомы) и во второй участок вводят только композицию на основе протеосомы (то есть без GA). Также рассматривается, что GA может вводиться инъекционно, тогда как композиция на основе протеосомы вводится, например, интраназально в это же или в другое время. Таким образом, в одном воплощении по настоящему изобретению композиция GA доставляется инъекционно и отдельно от композиции на основе протеосомы, которая вводится интраназально.
Пептиды GA по настоящему изобретению также могут быть приготовлены содержащими гидрофобную якорную часть последовательности, которая, как ожидается, усилит нековалентную ассоциацию с протеосомами. В патенте США № 6476201 описывается изготовление и получение протеосомо-амфифильных детерминантных вакцин, предназначенных как для парентерального, так и особенно для введения через слизистую оболочку, включая желудочно-кишечное введение, чтобы вызвать образование антител как системно, так и в слизистой оболочке. Амфифильная детерминанта представляет собой молекулу, имеющую гидрофобные и гидрофильные области, которые при соответствующем приготовлении с протеосомами связываются с протеосомами, чтобы образовать комплекс, который вызывает иммунную реакцию у субъекта. Обычные амфифильные детерминанты включают гликолипиды, липосахариды (включая детоксифицированные липополисахариды), липопептиды, трансмембранные домены, внешние или токсоидные белки или белки или пептиды с внутренними гидрофобными аминокислотными якорями.
Эмульсионные композиции
GA может вводиться или быть приготовленным в форме субмикронной эмульсии или наноэмульсии, как описано в патентах США № 5961970 или 5716637 соответственно. Композиция включает субмикронную эмульсию типа «масло-в-воде», содержащую от приблизительно 0,5 до приблизительно 50% масла, от приблизительно 0,1 до приблизительно 10% эмульгатора, от приблизительно 0,05 до приблизительно 5% неионогенного поверхностно-активного вещества и от приблизительно 0,00001