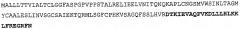Молекулы антител человека к il-13
Иллюстрации
Показать всеИзобретение относится к иммунологии и биотехнологии. Предложены варианты антител к IL-13 человека, в том числе на основе CDR антитела BAK278D6. Описана композиция на их основе, а также изолированная нуклеиновая кислота, клетка-хозяин для получения антител и варианты способа получения антител. Раскрыто использование антител для производства лекарственного средства и композиции для лечения различных заболеваний, опосредованных активностью IL-13. Использование изобретения обеспечивает антитела, нейтрализующие IL-13, что может найти применение в медицине для приготовления вакцины. 13 н. и 39 з.п. ф-лы, 32 ил., 7 табл.
Реферат
Настоящее изобретение относится к специфическим связывающим партнерам, в частности к молекулам анти-IL-13-антител человека и особенно молекулам, которые нейтрализуют активность IL-13. Изобретение, кроме того, относится к способам применения молекул анти-IL-13-антител в диагностике или лечении связанных с IL-13 расстройств, включая астму, атопический дерматит, аллергический ринит, фиброз, воспалительное заболевание кишечника и лимфому Ходжкина.
В предпочтительных вариантах осуществления настоящего изобретения используют домен VH и/или VL антитела из молекулы антитела, называемого в данном описании BAK502G9, и других молекул антител линии BAK502G9 и линии BAK278D6, которые определены в данном описании. В следующих предпочтительных вариантах используют определяющие комплементарность области (CDR) линии BAK278D6 и предпочтительно BAK502G9, в частности CDR3 VH, в каркасных областях других антител. Следующие аспекты настоящего изобретения относятся к композициям, содержащим специфические связывающие партнеры согласно изобретению, и к их применениям в способах ингибирования или нейтрализации IL-13, включая способы терапевтического лечения организма человека или животного.
Настоящее изобретение относится к молекулам антител, имеющим особое значение в связывании и нейтрализации IL-13 и, следовательно, имеющим применение в любом из множества терапевтических способов лечения, как продемонстрировано в экспериментальной работе, приведенной в данной описании, и, кроме того, подтверждается технической литературой.
Интерлейкин (IL) 13 является цитокином из 114 аминокислот с немодифицированной молекулярной массой примерно 12 кД [1, 2]. IL-13 наиболее близок IL-4, с которым он обладает 30% сходством последовательностей на аминокислотном уровне. Ген IL-13 человека расположен в хромосоме 5q31 рядом с геном IL-4 [1], [2]. Указанная область хромосомы 5q содержит последовательности генов других, происходящих из лимфоцитов Th2 цитокинов, включая GM-CSF и IL-5, уровни которых вместе с IL-4, как показано, коррелируют с тяжестью заболевания у больных астмой и моделях аллергического воспаления у грызунов [3], [4], [5], [6], [7], [8].
Хотя IL-13 первоначально идентифицирован как производимый лимфоцитами Th2CD4+ цитокин, он также продуцируется T-клетками Th1CD4+, T-лимфоцитами CD8+ NK-клетками и популяциями клеток, не являющихся T-клетками, такими как тучные клетки, базофилы, эозинофилы, макрофаги, моноциты и клетки гладкой мускулатуры дыхательных путей.
Сообщается, что IL-13 опосредует свои эффекты через систему рецепторов, которая включает α-цепь рецептора IL-4 (IL-4Rα), которая сама по себе может связывать IL-4, но не IL-13, и, по меньшей мере, два других белка клеточной поверхности, IL-13Rα1 и IL-13Rα2 [9], [10]. IL-13Rα1 может связывать IL-13 с низкой аффинностью, затем мобилизируя IL-4Rα с образованием высокоаффинного функционального рецептора, который передает сигнал [11], [12]. В базе данных Genbank зарегистрирована аминокислотная последовательность и последовательность нуклеиновой кислоты IL-13Rα1 в виде NP_001551 и Y10659 соответственно. Исследования дефицитных по STAT6 (сигнальный трансдуктор и активатор транскрипции 6) мышей показали, что IL-13 сходным с IL-4 образом передает сигнал, используя путь JAK-STAT6 [13], [14]. IL-13Rα2 обладает 37% идентичностью последовательностей с IL-13Rα1 на аминокислотном уровне и связывает IL-13 с высокой аффинностью [15], [16]. Однако IL-13Rα2 имеет более короткий цитоплазматический хвост, в котором отсутствуют известные мотивы для передачи сигнала. Клетки, экспрессирующие IL-13Rα2, не отвечают на IL-13 даже в присутствии IL-4Rα [17]. Поэтому предполагается, что IL-13Rα2 действует в качестве рецептора-ловушки, регулирующего функционирование IL-13, но не IL-4. Это подтверждается исследованиями дефицитных по IL-13Rα2 мышей, фенотип которых соответствует повышенной чувствительности к IL-13 [18], [19]. В базе данных Genbank приведены аминокислотная последовательность и последовательность нуклеиновой кислоты IL-13Rα2 в виде NP_000631 и Y08768 соответственно.
Передающий сигналы комплекс рецепторов IL-13Rα1/IL-4Rα экспрессируется на B-клетках, тучных клетках, моноцитах/макрофагах, дендритных клетках, эозинофилах, базофилах, фибробластах, эндотелиальных клетках, эпителиальных клетках дыхательных путей и гладкомышечных клетках дыхательных путей человека.
Бронхиальная астма является распространенным персистирующим воспалительным заболеванием легких, характеризующимся гиперчувствительностью дыхательных путей, избыточным образованием слизи, фиброзом и повышенными уровнями IgE в сыворотке. Гиперчувствительность дыхательных путей (AHR) представляет собой чрезмерное сужение дыхательных путей в ответ на неспецифичные стимулы, такие как холодный воздух. Считают, что как AHR, так и избыточное образование слизи ответственны за непостоянную обструкцию дыхательных путей, которая приводит к затруднению дыхания, характерному для приступов астмы (обострений), и которая является причиной смертности, связанной с данным заболеванием (около 2000 смертей/год в Великобритании).
Заболеваемость астмой наряду с другими аллергическими заболеваниями значительно возросла в последние годы [20], [21]. Например, в настоящее время около 10% популяции в Великобритании диагностированы как больные астмой.
Современные рекомендации Британского торакального общества (BTS) и Глобальной инициативы против астмы (GINA) предлагают поэтапный подход к лечению астмы [22, 23]. Слабо и умеренно выраженную астму, как правило, можно контролировать, используя ингалируемые кортикостероиды в комбинации с бета-агонистами или ингибиторами лейкотриена. Однако из-за документально подтвержденных побочных эффектов кортикостероидов пациенты склонны не соблюдать режим лечения, что снижает эффективность лечения [24-26].
Существует очевидная потребность в новых способах лечения субъектов с более тяжелым заболеванием, которые часто получают очень ограниченную пользу либо от высоких доз ингалируемых, либо от пероральных кортикостероидов, предлагаемых в рекомендациях по астме. Долговременное лечение пероральными кортикостероидами связано с побочными эффектами, такими как остеопороз, замедленные скорости роста у детей, диабет и пероральный кандидоз [88]. Как целебные, так и неблагоприятные эффекты кортикостероидов опосредованы одним и тем же рецептором, и лечение представляет собой баланс между безопасностью и эффективностью. Госпитализация указанных пациентов, которые составляют около 6% популяции астматиков в Великобритании, в результате тяжелых обострений определяет основную часть значительного экономического бремени, связанного с астмой, для органов здравоохранения [89].
Предполагается, что патология астмы вызвана продолжающимся воспалением, опосредованным лимфоцитами Th2, которое возникает в результате неадекватных ответов иммунной системы на неопасные антигены. Накапливаются доказательства о вовлечении IL-13, а не классического образуемого клетками Th2 цитокина IL-4, в качестве ключевого медиатора патогенеза развившегося заболевания дыхательных путей.
Введение рекомбинантного IL-13 в дыхательные пути нативных несенсибилизированных грызунов вызывало множество признаков фенотипа астмы, включая воспаление дыхательных путей, образование слизи и AHR [27], [28], [29], [30]. Сходный фенотип наблюдали у трансгенной мыши, у которой IL-13 специфично сверхэкспрессировался в легких. В данной модели дополнительное воздействие IL-13 также приводило к фиброзу [31].
Кроме того, в моделях аллергического заболевания у грызунов многие признаки фенотипа астмы были связаны с IL-13. Показано, что мышиный IL-13Rα2, сильный нейтрализатор IL-13, ингибирует AHR, повышенное выделение слизи и приток воспалительных клеток, которые являются характерными признаками данной модели на грызунах [27], [28], [30]. В дополнительных исследованиях у мышей, у которых был делегирован ген IL-13, не развивалась индуцированная аллергеном AHR. AHR можно было восстановить у указанных дефицитных по IL-13 мышей введением рекомбинантного IL-13. Напротив, у мышей, дефицитных по IL-4, в данной модели развивалось заболевание дыхательных путей [32], [33].
Используя долговременную модель индуцированного аллергеном воспаления легких, Taube et al. продемонстрировали эффективность растворимого мышиного IL-13Rα2 против развившегося заболевания дыхательных путей [34]. Растворимый мышиный IL-13Rα2 ингибировал AHR, повышенное образование слизи и в меньшей степени воспаление дыхательных путей. Напротив, растворимый IL-4Rα, который связывает и антагонизирует IL-4, мало влиял на AHR или воспаление дыхательных путей в данной системе [35]. Указанные данные подтвердили Blease et al., которые разработали модель хронической астмы грибкового генеза, в которой поликлональные антитела против IL-13, но не против IL-4, были способны снижать повышенное образование слизи, AHR и субэпителиальный фиброз [36].
Ряд типов генетического полиморфизма в гене IL-13 также связывали с аллергическим заболеванием. В частности, вариант гена IL-13, в котором остаток аргинина в положении аминокислоты 130 заменен глутамином (R130Q), связывали с бронхиальной астмой, атопическим дерматитом и повышенными уровнями IgE в сыворотке [37], [38], [39], [40]. Указанный конкретный вариант IL-13 также назван вариантом Q110R (остаток аргинина в положении аминокислоты 110 заменен глутамином) некоторыми группами, которые исключили 20-аминокислотную сигнальную последовательность из нумерации аминокислот. Arima et al. [41] сообщают, что указанный вариант связан с повышенными уровнями IL-13 в сыворотке. Вариант IL-13 (R130Q) и антитела к данному варианту обсуждаются в WO 01/62933. Полиморфизм промотора IL-13, который изменяет продукцию IL-13, также связывали с аллергической астмой [42].
Повышенные уровни IL-13 также измеряли у людей с астмой, атопическим ринитом (сенной лихорадкой), аллергическим дерматитом (экземой) и хроническим синуситом. Например, обнаружено, что уровни IL-13 выше в биопсии бронхов, мокроте и клетках бронхоальвеолярного лаважа (BAL) у больных астмой по сравнению с контрольными субъектами [43], [44], [45], [46]. Кроме того, уровни IL-13 в образцах BAL повышались у больных астмой в случае провокации аллергеном [47], [48]. Кроме того, показано, что способность Т-клеток CD4(+) продуцировать IL-13 является полезным маркером риска последующего развития аллергического заболевания у новорожденных [49].
Li et al. [114] недавно сообщили о воздействиях нейтрализующего антитела против IL-13 мыши в модели хронической астмы у мышей. Хронический подобный астматическому ответ (такой как AHR, тяжелое воспаление дыхательных путей, повышенное образование слизи) индуцировали у сенсибилизированных OVA мышей. Li et al. сообщают, что введение IL-13-антитела во время каждой провокации OVA подавляет AHR, инфильтрацию эозинофилов, уровни IgE в сыворотке, уровни провоспалительных цитокинов/хемокинов и ремоделирование дыхательных путей [14].
В заключение, полученные данные представляют свидетельство того, что IL-13, а не IL-4 является более привлекательной мишенью для лечения аллергического заболевания человека.
IL-13 может играть роль в патогенезе воспалительного заболевания кишечника. Heller et al. [116] сообщают, что нейтрализация IL-13 введением растворимого IL-13Rα2 уменьшало воспаление ободочной кишки в мышиной модели язвенного колита человека [116]. Соответственно экспрессия IL-13 была выше в образцах биопсии прямой кишки от пациентов с язвенным колитом по сравнению с контролями [117].
Кроме астмы, IL-13 связывали с другими фиброзными состояниями. Повышенные уровни IL-13 до уровней в 1000 раз выше, чем IL-4, измерены в сыворотке пациентов с системным склерозом [50] и в образцах BAL от пациентов, пораженных другими формами легочного фиброза [51]. Соответственно сверхэкспрессия IL-13, но не IL-4, в легких мышей приводила к выраженному фиброзу [52], [53]. Вклад IL-13 в фиброз в других тканях, отличных от легких, широко исследован в мышиной модели индуцированного паразитами фиброза легких. Специфичное ингибирование IL-13 введением растворимого IL-13Rα2 или нарушением гена IL-13, но не исключение образования IL-4, предотвращало фиброгенез в печени [54], [55], [56].
Хроническое обструктивное легочное заболевание (COPD) охватывает популяции пациентов с различной степенью хронического бронхита, заболевания малых дыхательных путей и эмфиземы и характеризуется прогрессирующим необратимым снижением функции легких, которое плохо поддается современной терапии, основанной на лечении астмы [90]. Частота заболеваемости COPD сильно возросла в последние годы, и заболевание стало четвертым среди главных причин смертности во всем мире (Всемирная организация здравоохранения). Поэтому лечение COPD представляет собой большую неудовлетворенную потребность для медицины.
Причины, лежащие в основе COPD, остаются плохо понятными. «Датская гипотеза» предполагает, что существует общая чувствительность к COPD и астме и, следовательно, такие сходные механизмы могут вносить вклад в патогенез обоих расстройств [57].
Zheng et al. [58] показали, что сверхэкспрессия IL-13 в легких мыши вызывала эмфизему, повышенное образование слизи и воспаление, отражая признаки COPD человека. Кроме того, показано, что AHR, IL-13-зависимый ответ в мышиных моделях аллергического воспаления, является прогностическим признаком снижения функции легких у курильщиков [59]. Также была установлена связь между полиморфизмом промотора IL-13 и чувствительностью к развитию COPD [60].
Следовательно, имеются свидетельства того, что IL-13 играет важную роль в патогенезе COPD, особенно у пациентов с подобными астме признаками, включая AHR и эозинофилию. Показано, что уровни мРНК IL-13 выше в аутопсийных образцах тканей от субъектов с COPD в истории болезни по сравнению с образцами легких от субъектов, у которых не зарегистрировано легочное заболевание (J. Elias, Oral communication at American Thoracic Society Annual Meeting, 2002). В другом исследовании повышенные уровни IL-13 показаны посредством иммуногистохимии в периферических срезах легких от пациентов с COPD [91].
Болезнь Ходжкина является распространенным типом лимфомы, которая составляет примерно 7500 случаев в год в Соединенных Штатах. Болезнь Ходжкина является необычной среди злокачественных опухолей, так как неопластические клетки Рид-Штернберга, часто происходящие из B-клеток, составляют только небольшую часть клинически выявляемой массы. Полученные в случае болезни Ходжкина линии клеток и первичные клетки Рид-Штернберга часто экспрессируют IL-13 и его рецептор [61]. Так как IL-13 стимулирует жизнеспособность клеток и пролиферацию нормальных B-клеток, то сделано предположение, что IL-13 может действовать в качестве фактора роста для клеток Рид-Штернберга. Skinnider et al. показали, что нейтрализующие антитела против IL-13 могут ингибировать рост полученных в случае болезни Ходжкина линий клеток in vitro [62]. Указанные наблюдения свидетельствуют, что клетки Рид-Штернберга могут повышать свою собственную жизнеспособность посредством аутокринной и паракринной цитокиновой петли IL-13. В соответствии с данной гипотезой повышенные уровни IL-13 выявлены в сыворотке некоторых пациентов с болезнью Ходжкина по сравнению с нормальными контролями [63]. Поэтому ингибиторы IL-13 могут предотвращать прогрессирование заболевания в результате ингибирования пролиферации злокачественных клеток Рид-Штернберга.
Многие клетки злокачественной опухоли человека экспрессируют иммуногенные специфичные для опухоли антигены. Однако несмотря на то, что многие опухоли спонтанно регрессируют, некоторые избегают иммунной системы (иммунологического надзора), подавляя опосредованный T-клетками иммунитет. Terabe et al. [64] продемонстрировали роль IL-13 в иммуносупрессии в мышиной модели, в которой опухоли спонтанно регрессируют после начального роста и затем рецидивируют. Специфичное ингибирование IL-13 растворимым IL-13Rα2 защищало указанных мышей от рецидива возникновения опухоли. Terabe et al. [64] далее показали, что IL-13 подавляет дифференцировку специфичных для опухоли цитотоксических лимфоцитов CD8+, которые опосредуют противоопухолевые иммунные ответы.
Поэтому ингибиторы IL-13 могут быть использованы терапевтически для предотвращения рецидивов опухолей или метастазов. Показано, что ингибирование IL-13 усиливает противовирусные вакцины в животных моделях и может быть полезным при лечении ВИЧ и других инфекционных заболеваний [65].
Следует отметить, что, как правило, в данном описании указание интерлейкин-13 или IL-13 за исключением случаев, когда контекст диктует иное, относится к IL-13 человека. В некоторых случаях его также называют «антигеном». Настоящее изобретение относится к антителам к IL-13 человека, в частности антителам человека, которые перекрестно реагируют с IL-13 примата, отличного от человека, включая IL-13 макак-крабоедов и макак-резус. Антитела согласно некоторым вариантам осуществления настоящего изобретения распознают вариант IL-13, в котором остаток аргинина в положении аминокислоты 130 заменен глутамином. В других аспектах и вариантах осуществления настоящего изобретения предлагаются специфические связывающие партнеры против IL-13 мышей и крыс, в частности против мышиного IL-13.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показана эффективность нейтрализации (% ингибирования) в случае BAK167A11 (заштрихованные квадраты) и его производного BAK615E3 (незаштрихованные квадраты) в виде scFv против 25 нг/мл IL-13 человека в анализе пролиферации клеток TF-1. Треугольники означают нерелевантный scFv. Данные представляют собой средние значения с линиями стандартных ошибок на основе определений в трех повторах в одном и том же эксперименте.
На фиг.2 показана эффективность нейтрализации (% ингибирования) в случае BAK278D6 (заштрихованные квадраты) и его производного BAK502G9 (незаштрихованные квадраты) в виде scFv против 25 нг/мл IL-13 человека в анализе пролиферации клеток TF-1. Треугольники означают нерелевантный scFv. Данные представляют собой средние значения с линиями стандартных ошибок на основе определений в трех повторах в одном и том же эксперименте.
На фиг.3 показана эффективность нейтрализации (% ингибирования) в случае BAK209B11 (заштрихованные квадраты) в виде scFv против 25 нг/мл мышиного IL-13 в анализе пролиферации клеток TF-1. Треугольники означают нерелевантный scFv. Данные представляют собой средние значения с линиями стандартных ошибок на основе определений в трех повторах в одном и том же эксперименте.
На фиг.4 показана эффективность нейтрализации (% ингибирования) в случае BAK278D6 (заштрихованные квадраты) в виде scFv против IL-13 в анализе пролиферации клеток TF-1. Треугольники означают нерелевантный scFv. Данные представляют собой средние значения с линиями стандартных ошибок на основе определений в трех повторах в одном и том же эксперименте.
На фиг.4A показана эффективность против 25 нг/мл IL-13 человека.
На фиг.4B показана эффективность против 25 нг/мл варианта IL-13 человека.
На фиг.4C показана эффективность против 50 нг/мл IL-13 примата, отличного от человека.
На фиг.5 показано сравнение эффективности анти-IL-13-антител человека в анализе пролиферации TF-1. Данные представляют собой средние значения эффективности нейтрализации с линиями стандартных ошибок на основании 5-7 экспериментов против 25 нг/мл IL-13 человека. Эффективность относительно коммерчески доступного антитела B-B13 оценивали статистически, осуществляя однофакторный ANOVA с использованием критерия Даннета. *P<0,05, **P<0,01 по сравнению с B-B13.
На фиг.6 показана эффективность нейтрализации (% ингибирования) в случае BAK502G9 (заштрихованные квадраты), BAK1167F2 (заштрихованные треугольники) и BAK1183H4 (заштрихованные перевернутые треугольники) в виде IgG4 человека против целевого IL-13 в анализе пролиферации клеток TF-1. Незаштрихованные треугольники означают нерелевантный IgG4. Данные представляют собой средние значения с линиями стандартных ошибок на основе трех отдельных экспериментов.
На фиг.6A показана эффективность против 25 нг/мл IL-13 человека.
На фиг.6B показана эффективность против 25 нг/мл варианта IL-13 человека.
На фиг.6C показана эффективность против 50 нг/мл IL-13 примата, отличного от человека.
На фиг.7 показана эффективность нейтрализации (% ингибирования) в случае BAK502G9 (заштрихованные квадраты), BAK1167F2 (заштрихованные треугольники), BAK1183H4 (заштрихованные перевернутые треугольники) в виде IgG4 человека и коммерческих анти-IL-13-антител человека (B-B13 - незаштрихованные квадраты; JES10-5A2 - незаштрихованные перевернутые треугольники) в анализе зависимой от нативного IL-13 пролиферации клеток HDLM-2. Незаштрихованные треугольники означают нерелевантный IgG4. Данные представляют собой средние значения с линиями стандартных ошибок на основе определений в трех повторах в одном и том же эксперименте.
На фиг.8 показано сравнение эффективности анти-IL-13-антител человека в анализе NHLF. Данные представляют собой средние значения эффективности нейтрализации (IC50 пМ) с линиями стандартных ошибок на основании 4-5 экспериментов против 10 нг/мл IL-13 человека в анализе высвобождения эотаксина NHLF. Эффективность по сравнению с коммерчески доступным антителом B-B13 оценивали статистически, осуществляя однофакторный ANOVA с использованием критерия Даннета. *P<0,05, **P<0,01 по сравнению с B-B13.
На фиг.9 показана эффективность нейтрализации (% ингибирования) в случае BAK502G9 (заштрихованные квадраты), BAK1167F2 (заштрихованные треугольники), BAK1183H4 (заштрихованные перевернутые треугольники) в виде IgG4 человека против повышающей регуляции VCAM-1 на поверхности HUVEC в ответ на 10 нг/мл IL-13 человека. Незаштрихованные треугольники означают нерелевантный IgG4. Данные представляют собой средние значения с линиями стандартных ошибок на основе определений в трех повторах в одном и том же эксперименте.
На фиг.10 показана эффективность нейтрализации (% ингибирования) в случае BAK502G9 (заштрихованные квадраты), BAK1167F2 (заштрихованные треугольники), BAK1183H4 (заштрихованные перевернутые треугольники) в виде IgG4 человека против высвобождения эотаксина из HUVEC с повышенной регуляцией VCAM-1 на поверхности в ответ либо на 1 нг/мл IL-4 человека (фиг.10A), либо на 0,5 нг/мл IL-1β человека (фиг.10B). Незаштрихованные треугольники означают нерелевантный IgG4. Данные представляют собой средние значения с линиями стандартных ошибок на основе определений в трех повторах в одном и том же эксперименте.
На фиг.11 показана эффективность нейтрализации (% ингибирования) в случае BAK209B11 (квадраты) в виде IgG4 человека против 1 нг/мл мышиного IL-13 в анализе зависимой от факторов пролиферации клеток B9. Незаштрихованные треугольники означают нерелевантный IgG4. Данные представляют собой средние значения с линиями стандартных ошибок на основе определений в трех повторах в одном и том же эксперименте.
На фиг.12 показан относительный уровень IL-13 в гомогенатах легких от сенсибилизированных (s) (столбик справа) и несенсибилизированных (ns) (столбик слева) мышей после провокации в мышиной модели острого аллергического воспаления легких. Влияние сенсибилизации оценивали на основе t-критерия Стьюдента, используя количественные данные по IL-13. *<0,05, **<0,01 по сравнению с нечувствительными контрольными животными (n=5-6 мышей). Данные представляют собой средние значения с линиями стандартных ошибок.
Фиг.13 иллюстрирует влияние в/в введения BAK209B11 в виде IgG4 человека в разных количествах по сравнению с совпадающим по изотипу IgG4 нерелевантным контрольным антителом на индуцированную овальбумином мобилизацию лейкоцитов в легкие сенсибилизированных овальбумином мышей. Показано количество лейкоцитов (×104). Влияние обработки антителами оценивали статистически, осуществляя однофакторный ANOVA с применением критерия Даннета, используя данные дифференцированного подсчета клеток. *<0,05, **<0,01 по сравнению с контрольными животными, которых подвергали провокации овальбумином и вводили PBS (=0% ингибирования; n=5-8 мышей). Данные представляют собой средние значения с линиями стандартных ошибок.
Фиг.14 иллюстрирует влияние в/в введения BAK209B11 в виде IgG4 человека в различных количествах по сравнению с совпадающим по изотипу IgG4 нерелевантным контрольным антителом на индуцированную овальбумином мобилизацию эозинофилов в легкие сенсибилизированных овальбумином мышей. Показано количество эозинофилов (×104). Влияние обработки антителами оценивали статистически, осуществляя однофакторный ANOVA с применением критерия Даннета, используя данные дифференцированного подсчета клеток. *<0,05, **<0,01 по сравнению с контрольными животными, которых подвергали провокации овальбумином и вводили PBS (=0% ингибирования; n=5-8 мышей). Данные представляют собой средние значения с линиями стандартных ошибок.
Фиг.15 иллюстрирует влияние в/в введения BAK209B11 в виде IgG4 человека в различных количествах по сравнению с совпадающим по изотипу IgG4 нерелевантным контрольным антителом на индуцированную овальбумином мобилизацию нейтрофилов в легкие сенсибилизированных овальбумином мышей. Показано количество нейтрофилов (×104). Влияние обработки антителами оценивали статистически, осуществляя однофакторный ANOVA с применением критерия Даннета, используя данные дифференцированного подсчета клеток. *<0,05, **<0,01 по сравнению с контрольными животными, которых подвергали провокации овальбумином и вводили PBS (=0% ингибирования; n=5-8 мышей). Данные представляют собой средние значения с линиями стандартных ошибок.
Фиг.16 иллюстрирует влияние в/в введения BAK209B11 в виде IgG4 человека в различных количествах по сравнению с совпадающим по изотипу IgG4 нерелевантным контрольным антителом на индуцированную овальбумином мобилизацию лимфоцитов в легкие сенсибилизированных овальбумином мышей. Индукция лимфоцитов зависимым от дозы образом ингибировалась BAK209B11 с максимальным ингибированием при 3 мкг/мл BAK209B11. Влияние обработки антителами оценивали статистически, осуществляя однофакторный ANOVA с применением критерия Даннета, используя данные дифференцированного подсчета клеток. *<0,05, **<0,01 по сравнению с контрольными животными, которых подвергали провокации овальбумином и вводили PBS (=0% ингибирования; n=5-8 мышей). Данные представляют собой средние значения с линиями стандартных ошибок.
Фиг.17 иллюстрирует влияние в/в введения BAK209B11 в виде IgG4 человека в различных количествах по сравнению с совпадающим по изотипу IgG4 нерелевантным контрольным антителом на индуцированную овальбумином мобилизацию моноцитов/макрофагов в легкие сенсибилизированных овальбумином мышей. Не было значимого увеличения уровней моноцитов/макрофагов у сенсибилизированных животных по сравнению с контрольными животными. Однако такие фоновые уровни указанных клеток понижались при >36 мкг/мл BAK209B11 у сенсибилизированных животных. Влияние обработки антителами оценивали статистически, осуществляя однофакторный ANOVA с применением критерия Даннета, используя данные дифференцированного подсчета клеток. *<0,05, **<0,01 по сравнению с контрольными животными, которых подвергали провокации овальбумином и вводили PBS (=0% ингибирования; n=5-8 мышей). Данные представляют собой средние значения с линиями стандартных ошибок.
На фиг.18 показано влияние коммерческого нейтрализующего анти-IL-13-антитела JES10-5A2 на приток клеток (показано количество лейкоцитов (×104)) к воздушному мешочку мыши, вызванный введением полученного в бактериях рекомбинантного IL-13 человека. Влияние обработки антителами оценивали статистически, осуществляя однофакторный ANOVA с применением критерия Даннета, используя данные дифференцированного подсчета клеток. *<0,05, **<0,01 по сравнению с контрольными животными CMC (=0% ингибирования; n=11-13 мышей). Данные представляют собой средние значения с линиями стандартных ошибок.
На фиг.19 показано выравнивание последовательностей IL-13 макак-крабоедов по сравнению с аминокислотными последовательностями IL-13 человека. Заштрихованы семь аминокислотных остатков, которые различны в IL-13 человека и макак-крабоедов. IL-13 макак-резус и макак-крабоедов имели идентичную аминокислотную последовательность.
Фиг.20 иллюстрирует влияние однократной болюсной дозы 10 мг/кг в/в BAK502G9 в виде IgG4 человека на уровни IgE в сыворотке у 4 страдающих аллергией, но не подвергнутых провокации приматов макак-крабоедов (2 самца/2 самки) в течение 29 дней. Концентрация IgE в сыворотке значимо снижается со 100% (до введения дозы) до 66±10% от контрольных значений (p<0,05) на 4 и 5 день после введения дозы. Указанное снижение концентрации IgE в сыворотке восстанавливается до 88±8% от контрольных уровней на 22 день. *=p<0,05 по сравнению с уровнями IgE до введения дозы, многократные измерения ANOVA с последующим использованием критерия множественных сравнений Даннета (n=4 животных).
На фиг.20B показаны относительные уровни IgE в сыворотке самцов и самок приматов макак-крабоедов относительно времени после однократной внутривенной дозы 10 мг/кг BAK502G9. Относительные данные для IgE в сыворотке выражены в виде арифметической средней ± SEM в процентах от значения исходного уровня.
Фиг.21 иллюстрирует влияние внутрибрюшинного введения BAK209B11 в разных количествах (H=237 мкг/сутки, M=23,7 мкг/сутки и L=2,37 мкг/сутки) по сравнению с совпадающим по изотипу IgG1 нерелевантным контрольным антителом на функцию легких сенсибилизированных овальбумином и подвергнутых провокации мышей. На фиг.21A функция легких представлена log PC50 (log концентрации метахолина, требуемой для увеличения PenH исходного уровня на 50%) перед любой обработкой (0 день) и после сенсибилизации, провокации и обработки лекарственным средством (25 день). На фиг.21A показаны исходные данные, используемые для расчета конечного результата исследования, показанного на фиг.21B (разность log PC50). Данные представляют собой средние значения с линиями стандартных ошибок для n=8.
На фиг.21B изменение функции легких показано в виде изменения log PC50 отдельной мыши (разность log PC50). Разность log PC50 определяют как изменение log PC50 индивидуумов на 25 день по сравнению с 0 днем. Данные представляют собой средние для группы значения разности log PC50 (индивидуальные изменения, усредненные по группам обработки) с линиями стандартных ошибок. Влияние обработки антителами оценивали статистически, осуществляя однофакторный ANOVA с применением критерия Даннета, используя данные о разности log PC50. **<0,01 по сравнению с сенсибилизированными овальбумином и подвергнутыми провокации контрольными животными (n=8 мышей).
Фиг.22 иллюстрирует влияние локального (i. po.) и системного (в/в) введения BAK502G9 в виде IgG4 человека в разных количествах по сравнению с совпадающим по изотипу IgG4 нерелевантным контрольным антителом на мобилизацию суммарных лейкоцитов (фиг.22A) и мобилизацию эозинофилов (фиг.22B) в воздушный мешочек мышей BALB/C. Данные представляют собой средние значения с линиями стандартных ошибок для n=10. Влияние обработки антителами оценивали статистически, осуществляя однофакторный ANOVA с применением критерия Даннета, используя преобразованный в виде log данные. *<0,05, **<0,01 по сравнению с мышами, подвергнутыми провокации huIL-13 (n=10).
Фиг.23 иллюстрирует влияние в/б введения BAK502G9 в виде IgG4 человека по сравнению с совпадающим по изотипу IgG4 нерелевантным контрольным антителом на развитие AHR после внутритрахеального введения IL-13 человека в дыхательные пути мышей. Влияние обработки антителами оценивали статистически, осуществляя однофакторный ANOVA с применением критерия Даннета, используя данные для метахолина PC200. *<0,05, **<0,01 по сравнению с группой позитивного контроля с IL-13 человека (n=6-8 мышей). Данные представляют собой средние значения с линиями стандартных ошибок.
На фиг.24 показана эффективность нейтрализации (% максимального ответа) в случае BAK502G9 (заштрихованные квадраты) в виде IgG4 против 30 нг/мл IL-13 в анализе продуцирования IgE B-клетками человека. Незаштрихованные квадраты означают нерелевантный IgG4. Данные представляют собой средние значения с линиями стандартных ошибок для шести доноров из отдельных экспериментов.
На фиг.25 показано влияние BAK502G9 на индуцированное IL-13 усиление индуцированной агонистом передачи сигналов Ca2+ в гладкомышечных клетках бронхов. Площадь под кривой (AUC) ответа на гистамин в виде передачи сигнала Ca2+ определяли для каждого антитела +/- условия предварительной обработки IL-13. Объединенные данные из трех независимых экспериментов показаны для нерелевантного антитела CAT-001 (a) и BAK502G9 (b) в виде различий в процентах в AUC±SD с необработанными клетками (ns=не значимы (p>0,05), *p<0,05, **p<0,01). Результаты оценивали статистически, используя однофакторный дисперсионный анализ (ANOVA) и апостериорный критерий для множественных сравнений Бонферрони.
На фиг.26 показано влияние введенного в фазе II BAK502G9.
На фиг.26A показано влияние на AHR, измеренное по изменению площади под кривой дозовой зависимости ответа от гистамина (n=14).
На фиг.26B показано влияние на AHR, измеренное по изменению PC30 (n=18).
На фиг.26C показано влияние примирования антигеном (n=20).
На фиг.26D показано влияние воспаления BAL (n=21).
На фиг.27 показано влияние BAK502G9 на индуцированную IL-13 экспрессию CD23. Данные представляют ответ в процентах на IL-13 отдельно (100%) и выражены в виде среднего ± SEM % от контроля для 6 отдельных экспериментов от 6 отдельных доноров (выполнено в трех повторах).
На фиг.28 показано влияние BAK502G9 и нерелевантного IgG4 на индуцированную IL-13 и/или IL-4 экспрессию CD23 в PBMC. Данные представлены в виде ответа в процентах на IL-4 отдельно (100%) и выражены в виде среднего ± SEM % от контроля для 4 отдельных экспериментов от 4 отдельных доноров (выполнено в трех повторах).
На фиг.29A показано влияние BAK502G9 на продукцию эотаксина-1 NHLF, индуцированную 48-часовым культивированием в среде, содержащей IL-13/TNF-α/TGF-β1. Данные показаны в виде среднего арифметического ± SEM из определений в трех повторах для сред, используемых в данном исследовании для того, чтобы индуцировать изменение формы лейкоцитов.
На фиг.29B показано влияние BAK502G9 на изменение формы эозинофилов человека, индуцированное кондиционированными средами в разведении 1:16. Точки представленных данных означают средние ± SEM % по сравнению с изменением формы в контрольных средах для отдельных экспериментов от четырех отдельных доноров.
На фиг.30 показано выравнивание IL-13 человека и мышиного IL13 с отмеченными мутациями, которые вводили в IL-13 человека, чтобы получить первую панель химер IL-13. Четыре альфа-спирали выделены прямоугольниками и отмечены петля 1 и петля 3. Получали пять химерных белков, в которых спирали B, C и D и петлю 1 и петлю 3 заменяли мышиной последовательностью. Получены четыре дополнительных химерных белка и пронумерованы в соответствии с аминокислотами в пре-белке человека (но не с нумерацией множественного выравнивания, представленного выше), в которых аргинин в положении остатка 30 (положение 34 выше) мутирован, остатки 33 и 34 (положение 37 и 38 выше) мутированы, остатки 37 и 38 (VH) мутированы (положение 41 и 42 выше) и остатки 40 и 41 (TQ) мутированы (положение 44 и 45 выше).
На фиг.31 показано выравнивание IL-13 человека и мышиного IL-13 с отмеченными мутациями, которые вводили в IL-13 человека, чтобы получить вторую панель химер IL-13. Получали шесть химер, в которых остатком(ками) человека заменяли мышиный остаток(ки) (выделены прямоугольниками). Получены четыре следующих химерных белка (нумерация согласно положениям аминокислот в пре-белке человека), в которых лейцин в положении остатка 58 (62 на фигуре выше) мутирован, лейцин в положении остатка 119 (остаток 123 выше) мутирован, лизин в положении 123 (остаток 127 выше) мутирован и аргинин в положении остатка 127 (остаток 132 выше) мутирован.
На фиг.32 показаны мутации, сделанные в IL-13 человека. Мутации, обозначенные темно-серым, уменьшали связывание с BAK502G9, мутации, обозначенные светло-серым, не изменяли связывание. Показана линейная последовательность пре-IL-13 человека с мутантными остатками.
В различных аспектах и вариантах осуществления изобретения предлагаются предметы изобретения согласно формуле изобретения, приведенной далее.
Настоящее изобретение относится к специфическим партнерам, связывающим IL-13, в частности IL-13 человека, и/или примата, и/или вариант IL-13 (R130Q) и IL-13 мыши. Предпочтительными вариантами настоящего изобретения являются молекулы антител, либо полное антитело (например, IgG, такой как IgG4), либо фрагменты антител (например, scFv, Fab, dAb). Предлагаются антигенсвязывающие области антител, которые представляют собой домены VH и VL антител. В пределах доменов VH и VL предлагаются определяющие комплементарность области, CDR, которые могут быть представлены в разных каркасных областях, FR, чтобы образовать домены VH или VL в зависимости от обстоятельств. Антигенс