Рекомбинантные днк, обеспечивающие получение полипептидов р6, р7, р8, обладающих протективными свойствами в отношении streptococcus agalactiae и селективно-связывающих iga
Иллюстрации
Показать всеИзобретение может быть использовано при производстве вакцин против Streptococcus agalactiae - представителя стрептококков группы В (СГВ), при диагностике заболеваний - для создания системы по детекции уровня иммуноглобулина А в биологических жидкостях, в иммунохимии в качестве доступных иммунохимических реагентов (аффинное выделение фрагментов IgA). Предлагаемые уникальные рекомбинантные ДНК получены методом полимеразной цепной реакции (ПЦР) с использованием хромосомной ДНК штамма 219/4849 Ibc серотипа СГВ и уникальных праймеров. Одна из рекомбинантных ДНК содержит три нуклеотидные замены по сравнению с исходным участком хромосомной ДНК. Последующее клонирование амплифицированных фрагментов осуществлено в линейном векторе pGEM-T Easy, а на конечном этапе посредством системы экспрессионных векторов pQE30/31/32 в Е.coli JM 109. Полученные рекомбинантные ДНК кодируют аминокислотные последовательности рекомбинантных полипептидов, обладающих способностью селективно связывать различные молекулярные формы IgA и обозначенных как Р6, Р7, Р8. Полипептид Р6 вызывает синтез длительно циркулирующих высокоаффинных анти-Р6 антител, обладающих протективными свойствами против СГВ. Использование изобретения обеспечивает получение на основе N-терминальной консервативной части поверхностного Вас белка СГВ Ibc серотипа рекомбинантных полипептидов, включающих первый IgA-связывающий сайт А с измененной или нативной последовательностью MLKKIE, при этом полипептиды обладают иммуногенными и протективными свойствами, а также высокоселективно связывают IgA. 12 н.п. ф-лы, 20 ил., 4 табл.
Реферат
Изобретение относится к области микробиологии и молекулярной генетики и может быть использовано в медицинской промышленности при производстве вакцин против Streptococcus agalactiae. Изобретение также может быть использовано для создания диагностикума по детекции уровня иммуноглобулина A (IgA) в биологических жидкостях и может применяться в иммунохимии в качестве доступных иммунохимических реагентов.
Streptococcus agalactiae, представитель стрептококков группы В (СГВ), относится к условно-патогенным микроорганизмам, вызывающим тяжелые заболевания человека: артрит, эндокардит, пиелонефрит, мастит, септицемия, некротический фасцит, офтальмит и другие. СГВ являются одним из ведущих возбудителей в этиологии патологии беременности, тяжелых инфекций новорожденных и детей раннего возраста, вызывая возникновение сепсиса и менингита. Новорожденные приобретают бактерии через родовой канал их матери, являющейся носителем СГВ. Стрептококковая инфекция у детей старшего возраста часто выражена в виде артрита, остеомиелита и поражения кожных покровов. Стрептококки группы В также способны вызывать выкидыши, внутриутробное повреждение плода, послеродовой сепсис и другие патологии у взрослых. Описано распространенное носительство СГВ в урогенитальной области и в прямой кишке. Наиболее тяжело протекают заболевания у лиц с ослабленным иммунитетом. Широкий спектр тяжелых заболеваний, вызываемых СГВ, в основном, среди детей перинатального и раннего детского возраста, а также женщин детородного возраста, рассматривается как существенная медицинская и эпидемиологическая проблема в большинстве стран, в том числе и в развитых, несмотря на профилактические меры. Профилактику инфекционных заболеваний стрептококковой этиологии осуществляют с применением бензатин бензилпенициллина, эритромицина, ампициллина и сульбактама (Бурбелло А.Т. и др., Соврем. Лекар. Средства, СПб: Нева, 323-324, 332, 352 (2003)). Для лечения больных с заболеваниями, вызванными СГВ, используют антибиотики (Страчунский Л.С., Козлов С.Н., Соврем. Антимикроб. Химиотер., М.: Боргес, 1-432 (2002), Поляк М.С. Основы антибиотикотерапии, СПб: НИЦФ, 1-53 (2003)). Наибольшее распространение получили представители группы пенициллинов - бензилпенициллин и ампициллин, а также макролиды: эритромицин, ванкомицин, азитромицин, кларитромицин, рокситромицин ((Семина Н.А., Сидоренко С.В. и др., Клин. Микробиол. Антимикроб. Химиотер. 6(4): 306-359 (2004)), Зуева Л.П., Поляк М.С. и др., Микробиологический мониторинг, СПб: Медицинский информационно-аналитический центр, 1-72 (2004)).
Сложность при лечении и профилактике посредством антибиотикотерапии возникает в связи с многообразием побочных эффектов, проявляющихся у пациентов: негативное действие на центральную нервную и сердечно-сосудистую, иммунную системы организма, нарушение микробиоценоза организма, а также аллергические реакции. Неэффективность терапии с применением антибиотиков в ряде случаев обусловлена появлением антибиотико-резистентных штаммов СГВ.
Отсутствие безопасных и эффективных мер по профилактике и лечению заболеваний, вызываемых СГВ, делает актуальным направление по разработке антибактериальных вакцин, сконструированных, в том числе, на основе белков микробного происхождения.
Разработка вакцин - не единственное актуальное направление использования бактериальных белков. К примеру, белки G и L (поверхностные белки стрептококков С и G), протеин А стафилококков нашли активное применение в качестве иммунохимических реагентов, направленных, в основном, на определение IgG. В настоящее время возрос интерес к молекуле IgA, многообразие функций которой, а также возможность использования в диагностических целях требуют создания высокоселективных реагентов, обладающих IgA-рецепторной активностью.
В качестве существенного фактора вирулентности СГВ рассматривается уникальный поверхностный протеин - Вас белок, или β антиген (130 kDa), не имеющий гомологов среди других бактериальных белков, обладающих IgA-рецепторной активностью. Одной из особенностей Вас белка является наличие в его структуре области гомологии с белками суперсемейства иммуноглобулинов эукариот. Экспрессируемый многими штаммами серотипов Ia, Ib, II и V, Вас протеин практически не представлен в штаммах СГВ III-его серотипа.
Для реализации биологических функций β антиген обладает рядом свойств. Он неиммунно связывается с константным (Fc) участком IgA, основным иммуноглобулином, обеспечивающим защиту слизистых от проникновения микроорганизмов. Также Вас белок взаимодействует с фактором Н (FH) человека - белком плазмы крови, связывание которого приводит к инактивации альтернативного пути комплемента и способствует адгезии микроорганизма к человеческим клеткам. Способность вступать во взаимодействие с двумя указанными компонентами иммунной системы человека позволяет СГВ уклоняться от иммунного ответа (Eur. J.Immunol. - 1985. - №15. - Р.893-899; Adv. in host defense mechanisms. - 1985. - V.4. - P.31-61). Распространенность среди штаммов СГВ, важная роль в обеспечении вирулентности бактерий, консервативность структуры белка обусловили выбор β-антигена как основы для создания потенциальных компонентов вакцинных препаратов.
Впервые IgA-рецепторные свойства Вас белка, экстрагированного детергентами с поверхности бактерий и подвергнутого многоступенчатой очистке, описал Russell-Jones с соавторами в 1984 г. (J. exp.med. - 1984. - V.160. - P.1467-1475).
В 1987 году швейцарскими учеными впервые был проклонирован ген, кодирующий β антиген. Источником ДНК послужил клинический изолят СГВ Ic серотипа, являвшийся причиной менингита у новорожденных. Клонирование осуществлено с использованием плазмидного вектора pUC18 в Е.coli К-12 (Infection and immunity. - 1987. - V.55, №5. - P.1151-1155).
Прототипом изобретения является нуклеотидная последовательность, кодирующая IgA-связывающий сайт А в β антигене СГВ. ДНК штамма LA239 Ibc серотипа СГВ послужила источником такой нуклеотидной последовательности, клонирование которой в Е.coli К-12 537 с использованием экспрессионного плазмидного вектора рЕх31 осуществлено в 1991 году (Mol Microbiol. - 1991. - 5(4). - Р.843-9). В результате этой работы был экспрессирован и очищен рекомбинантный белок IABF (8,5 kDa).
В 1996 году получены укороченные фрагменты протеина IABF, а также идентифицирован гексапептид MLKKIE. Область MLKKIE, локализованная в IgA-связывающем сайте А (73 аминокислоты), предположительно, была ответственна за связывание Вас белком Fc-области IgA (Infection and immunity. - 1996. - V.64, №7. - P.2787-2793). Дериваты IABF, полученные авторами указанного исследования, не обладали IgA-рецепторной активностью, что не позволяет применять их в диагностических целях и в качестве IgA-связывающих агентов.
Задачей данного изобретения стало получение на основе N-терминальной консервативной части поверхностного Вас белка СГВ Ibc серотипа рекомбинантных полипептидов, включающих первый IgA-связывающий сайт А с измененной или нативной последовательностью MLKKIE. Причем полипептиды должны были обладать иммуногенными и протективными свойствами с целью использования их в качестве компонентов вакцины против стрептококков группы В. Помимо указанного, полипептиды должны были высокоселективно связывать IgA с целью создания IgA-рецепторных иммунохимических реагентов. Для определения возможности использования полипептидов в качестве рецепторов частично денатурированной молекулы IgA необходимо было выделить сайты связывания на молекуле IgA ранее описанного полипептида Р6, а также полипептидов, обозначенных как Р7, Р8, и проверить их устойчивость к денатурирующему воздействию. Также задачей изобретения стало создание штаммов-продуцентов рекомбинантных дериватов β антигена.
Результатом изобретения явилось получение обозначенных объектов биотехнологии.
Поставленная задача решалась конструированием пар уникальных праймеров, направленных к участкам гена вас, кодирующего белок Вас СГВ. Их использование в полимеразной цепной реакции позволило получить искомые фрагменты ДНК, лигированные впоследствии с плазмидным вектором pGEM-T Easy. Полилинкер указанного коммерческого вектора локализован в области, кодирующей β-галактозидазу, что дало возможность отобрать трансформанты Е.coli JM 109 с необходимой конструкцией. В дальнейшем клонирование фрагментов β антигена проведено с помощью системы экспрессионных векторов pQE30/31/ 32, позволяющей облегчить выделение и очистку рекомбинантных дериватов. Создание штаммов-продуцентов, обозначенных как Е.coli JM 109-Р6, Е.coli JM 109-P7 и Е.coli JM 109-P8, осуществлялось путем генетической трансформации штамма на основе штаммов Е.coli JM 109. Полученные штаммы-продуценты Е.coli JM 109-Р6, Е.coli JM 109-P7 и Е.coli JM 109-P8 включают плазмиды, содержащие участок последовательности гена bac опубликованной Pierre G. Jerlstrőm (Infection and immunity. - 1996. - V.64, №7. - P. 2787-2793), ассоциированный с участком ДНК вектора pQE32. Плазмида в штамме Е.coli JM 109-P7 содержит генетическую замену данной последовательности в области, кодирующей участок, описанный Jerlstrőm. Штамм Е.coli JM 109-P6 был идентичен штамму, созданному ранее (Журнал микробиологии, эпидемиологии и иммунобиологии. - 2005. - №2. - С.35-40), но включает ранее не установленную нуклеотидную последовательность, кодирующую полипептид Р6 с ранее не установленной аминокислотной последовательностью. Трансформация бактерий привела к появлению способности индуцибельной экспрессии рекомбинантных полипептидов Р6, Р7, Р8.
Сущностью предлагаемого изобретения является создание уникальных фрагментов гена вас - с 406 п.н. по 1287 п.н. (обозначен как p6), с 301 п.н. по 1653 п.н. (обозначен как р8) и рекомбинантной ДНК с 301 п.н. по 1653 п.н. (обозначена как р7), полученных в результате полимеразной цепной реакции. Причем создание рекомбинантной ДНК р7 произведено лигированием амплифицированных рекомбинантных ДНК с 301 п.н. по 682 п.н. (обозначена как p71) и с 662 п.н. по 1653 п.н. (обозначена как р72) гена вас. р71 и р72 включают, в свою очередь, по три нуклеотидные замены по сравнению с последовательностью гена вас. Амплификация указанных фрагментов осуществлена с использованием хромосомной ДНК штамма 219/4849 Ibc серотипа СГВ (штаммы из коллекции Национального стрептококкового центра России) в качестве матрицы, уникальных праймеров, обозначенных как Pr6 и Pr3 - для создания р6, Pr5 и Pr8 для р8, а также Pr5 и Pr2 для р71, Pr7 и Pr8 для р72 (последовательности праймеров приведены в таблице 1). Причем при создании р6 использованы вновь сконструированные праймеры, отличные от приведенных в ранее опубликованных работах (Журнал микробиологии, эпидемиологии и иммунобиологии. - 2005. - №2. - С.35-40). Последующее клонирование полученных фрагментов хромосомной ДНК и рекомбинантных ДНК происходило посредством сначала плазмидного вектора pGEM-T Easy (Promega, USA), а затем системы экспрессионных векторов pQE-30/31/32 (The QIAexpress System, Qiagen, США) в E.coli JM 109. Полученные фрагменты хромосомной ДНК и рекомбинантные ДНК кодируют уникальные аминокислотные последовательности рекомбинантных полипептидов Р6, Р7, Р8, причем, в зависимости от используемого экспрессионного вектора, у полипептидов присутствует или отсутствует ковалентная связь с шестью гистидинами, кодируемыми вектором pQE32.
Также сущностью предлагаемого изобретения является создание штаммов-продуцентов E.coli JM 109-Р6′, E.coli JM 109-P7′, E.coli JM 109-P8′, позволяющих при определенных условиях индуцировать синтез рекомбинантных полипептидов Р6, Р7, Р8.
Авторами получены фрагменты гена вас размером 882 п.н. (р6), 1353 н.п.(р8), 382 н.п. р71 и 992 н.п. р72 (после лигирования: 1353 н.п., р7) в ходе полимеразной цепной реакции на основе хромосомной ДНК штамма 219/4849 Ibc серотипа СГВ с использованием соответствующих пар праймеров. Также авторами проведено лигирование нуклеотидных последовательностей р6, р7, р8 с плазмидными векторами pGEM-T Easy, первичный отбор бактериальных клонов, содержащих необходимые вставки, и клонирование фрагментов р6, р7, р8 в системы экспрессионных векторов pQE-30/31/32 с дальнейшей трансформацией рекомбинантных плазмидных ДНК в гетерологической системе E.coli JM 109. В результате авторами получены штаммы-продуценты E.coli JM 109-Р6′, E.coli JM 109-P7′, E.coli JM 109-P8′ соответственно рекомбинантных протеинов Р6, Р7, Р8. Также авторами осуществлено выделение и одноступенчатая очистка рекомбинантных дериватов β антигена посредством индуцибельной экспрессии полипептидов Р6, Р7, Р8 и аффинной хроматографии на Ni-NTA-агарозе (Qiagen, США).
Кроме того, авторами получена иммунохимическая характеристика взаимодействия различных молекулярных форм IgA с полипептидами Р6, Р7, Р8, определено относительное положение сайта связывания полипептидов на молекуле IgA, его неконсервативность и устойчивость к денатурирующему воздействию.
Из литературных источников известно, что полипептид Р6, молекулярной массой 35 kDa, вызывает у мышей при внутрибрюшинном введении выработку специфических антител класса G, причем максимальный титр антител составил 1:100 000. Было установлено, что иммунный ответ гетерогенен по аффинитету антител. Значения констант связывания составляли от 108 М-1 до 1013 М-1 для Р6 (Медицинская иммунология, 2004, т.6, с.493-498). Полипептид Р6 обладает способностью к синтезу длительно циркулирующих высокоаффинных анти-Р6 антител, обладающих протективными свойствами против СГВ (Журнал микробиологии, эпидемиологии и иммунобиологии. - 2005. - №2. - С.35-40). Ранее изучены протективные свойства анти-Р6 и анти-ScaAB (поверхностный липопротеин СГВ) антител при совместном и раздельном введении в модельных экспериментах in vitro (опсонофагоцитарный тест с использованием перитонеальных мышиных макрофагов и стрептококков группы В) (Медицинская иммунология, 2006, т.8, с.109-478). Полипептиды Р6 и ScaAB, в связи с возможностью обеспечить протективность при крайне низких титрах антител, обладающих опсонизирующей активностью, в том числе и в отношении СГА, а также штаммов III серотипа СГВ, весьма перспективны в роли компонентов вакцины.
В изобретении показано, что рекомбинантные полипептиды Р6, Р7, Р8 обладают способностью селективно связывать различные молекулярные формы IgA. Полученные и охарактеризованные рекомбинантные полипептиды Р7, Р8 перспективны в качестве компонентов вакцинного препарата, специфичного в отношении широкого круга штаммов СГВ. Протеины Р6 и Р8, обладающие селективной IgA-рецепторной активностью, могут быть полезны для осуществления экспресс диагностики уровня иммуноглобулина А в различных биологических жидкостях для оценки клинического состояния больных или общего иммунного статуса, что может сыграть роль при диагностике заболеваний. Также рекомбинантные дериваты Р6, Р8 обладают широким спектром практического применения в иммунологии: в качестве доступных и удобных IgA-связывающих иммунохимических реагентов на основе белков бактериального происхождения в ИФА (как в адсорбированном состоянии, так и в роли выявляющих молекул), для манипуляций с денатурированной молекулой IgA - иммуноблот, с целью аффинного выделения фрагментов IgA.
Получение рекомбинантных полипептидов Р6, Р7, Р8
Источником хромосомной ДНК послужил штамм 219/4849 Ibc серотипа СГВ. ДНК, выделенная фенольно-хлороформной экстракцией, была использована в качестве матрицы в полимеразной цепной реакции (ПЦР) с целью получения фрагментов гена bac: р6 (с 406 п.н. по 1287 п.н., всего 882 п.н.), p7 (с 301 п.н. по 682 п.н., всего 382 п.н. и с 662 п.н. по 1653 п.н., всего 992 п.н., после лигирования двух фрагментов: 1353 п.н.), р8 (с 301 п.н. по 1653 п.н., всего 1353 п.н.), кодирующих соответственно полипептиды Р6, Р7 и Р8. Причем в область потенциальной антигенной детерминанты полипептида Р7 было решено ввести две аминокислотные замены (лизин в позиции 225 замещен на аргинин, а глутамат в позиции 227 на глутамин). В результате, отличительной особенностью полипептида Р7 является наличие измененной (по сравнению с областью MLKKIE белка Вас) последовательности из 6 аминокислот MLKRIQ, локализованной на IgA-связывающем сайте. С целью модификации гексапептида MLKKIE и, соответственно, создания области MLKRIQ, решено было осуществить амплификацию двух перекрывающихся фрагментов гена вас 301 п.н. - 682 п.н., 662 п.н. - 1653 п.н., захватывающих область, кодирующую MLKKIE. Для этого путем нуклеотидных замен были сконструированы обратный Pr2 и прямой Pr7 праймеры, соответственно участвующие в амплификации первого (382 п.н., p71) и второго (992 п.н., p71) фрагментов ДНК и содержащие сайт EcoRI. Олигонуклеотидные праймеры приведены в Таблице 1.
Причем в исходные последовательности праймеров Pr2′ (CTT CGATTT TTTTCAGCATAG) и Pr7′ (CTATGCTGAAAA AAATCG AAG) внесены по три нуклеотидные замены таким образом, что это привело к образованию праймеров Pr2 и Pr7, содержащих область GAA ТТС , кодирующую сайт EcoRI.
Анализ результатов ПЦР осуществлен путем разделения фрагментов ДНК в 1% агарозном геле при помощи горизонтального электрофореза. Выделение искомых амплифицированных участков ДНК проведено с использованием набора «QIAquick Gel Extraction Kit» (Qiagen, США).
Выделенные из агарозы фрагменты размером 382 н.п. и 992 н.п. подверглись обработке рестриктазой EcoRI, а затем были лигированы друг с другом, что привело к образованию нуклеотидной последовательности p7 (1353 н.п.), содержащей сайт EcoRI.
Нуклеотидная последовательность р6 представлена на фиг.1.
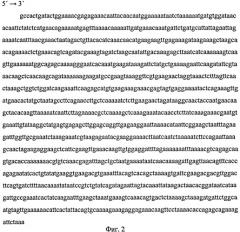
Нуклеотидная последовательность р7 представлена на фиг.2.
Нуклеотидная последовательность р8 представлена на фиг.3.
Нуклеотидную последовательность р6 лигировали с вектором pGEM-T Easy (Promega, USA, 3018 п.н.), не требующим наличия сайтов рестрикции, согласно инструкции производителя. В результате образовалась рекомбинантная плазмидная ДНК, обозначенная как pGEM-р6 и содержащая фрагмент вас гена 882 п.н. - р6, а также плазмиду pGEM-T Easy.
Аналогично получена рекомбинантная плазмидная ДНК, обозначенная как pGEM-p7 и содержащая фрагмент вас гена 1353 п.н. с тремя нуклеотидными заменами - р7, а также плазмиду pGEM-T Easy.
Аналогично получена рекомбинантная плазмидная ДНК, обозначенная как pGEM-p8 и содержащая фрагмент вас гена 1353 п.н. - р8, а также плазмиду pGEM-T Easy.
Продуктами лигирования проводили кальциевую трансформацию штамма E.coli JM109, после чего высевали трансформанты на чашки Петри с добавлением ампициллина (Ар), 5-бром-4-хлор-3-индолил-бета-D-галактопиранозида (X-gal) и изопропил-β-D-тиогалактопиранозида (IPTG). В векторной плазмиде pGEM-T полилинкер локализован в области, кодирующей β-галактозидазу. При росте на среде, содержащей Ар, X-gal и IPTG колонии, содержащие плазмиду без вставки, имеют голубой цвет, а колонии, содержащие рекомбинантную плазмиду, - белого цвета, что позволило провести отбор трансформантов со вставкой по цвету бактериальных колоний. Бактериальные клоны проверяли на наличие вставки из гена вас нужного размера методом ПЦР с использованием праймеров Pr6 и Pr3, Pr5 и Pr8 и последующим электрофоретическим анализом полученных фрагментов ДНК в 1,5% агарозном геле.
Из отобранных трансформантов, обозначенных как E.coli JM109-P6, E.coli JM109-P7, E.coli JM109-P8, с помощью Mini-prep plasmid DNA purification kit (Qiagen, USA), были выделены плазмиды, включающие фрагменты β антигена.
Для выделения фрагментов ДНК, кодирующих полипептиды Р6, Р7, Р8, полученные плазмидные ДНК (обозначенные как pGEM-p6, pGEM-p7, pGEM-р8) были рестрицированы. Рестрикция проведена по сайтам SphI-PstI, поскольку сайты рестрикции ферментами SphI и PstI были изначально заложены в последовательность вектора pGEM-T Easy. Система экспрессионных векторов pQE30/31/32 (The QIAexpress System, Qiagen, США), в которую будет клонирована каждая из трех вырезанных полноразмерных вставок, также предварительно была обработана ферментами SphI и PstI. Продукты рестрикции разделяли с помощью горизонтального электрофореза в 1% агарозном геле. Рестрицированную плазмиду pGEM-T и р6, р7, р8, фланкированные сайтами рестрикции SphI и PstI, выделяли из агарозы с помощью набора «QIAquick Gel Extraction Kit» (Qiagen, США). В результате проведенного клонирования в систему векторов pQE30/31/32 были получены рекомбинантные плазмидные ДНК (обозначенные pQE-p6, pQE-p7, pQE-p8), несущие рекомбинантные ДНК соответственно р6′ (состоит из р6 - 882 п.н. участка гена вас и 44 п.н. фрагмента плазмиды pQE-32), р7′ (состоит из р7 - 1353 п.н. модифицированного участка гена вас и 44 п.н. фрагмента плазмиды pQE-32), р8′ (состоит из р8-1353 п.н. участка гена вас и 44 п.н. фрагмента плазмиды pQE-32).
Рекомбинантные плазмидные ДНК pQE-p6, pQE-p7, pQE-p8 были трансформированы в Е.coli JM109 с помощью кальциевого метода и реактивов The QIAexpress System фирмы Qiagen, США. Трансформацию клеток Е coli JM 109 проводили рекомбинантными плазмидными ДНК pQE-p6, pQE-p7, pQE-p8 с использованием положительного (Е coli JM 109, трансформированная исходной плазмидной ДНК pQE30/31/32) и отрицательного (культура клеток Е coli JM 109, не трансформированная) контролей. Процесс трансформации осуществляли по методике трансформации кишечной палочки, предполагающей инкубацию культуры Е coli JM 109, суспендированной в растворе CaCl2, с плазмидной ДНК при разных температурах (Maniatis Т, Fritsch E.F., Sambrook J. Molecular cloning: a laboratory manual. - Cold Spring Harbor: Cold Spring Harbor Laboratory Press, 1982. - 867 p.). Селективные среды для отбора трансформантов содержали 50 мкг/мл ампициллина, 25 мкг/мл канамицина.
В каждом из трех вариантов бактериальных клонов, содержащих модифицированные плазмиды pQE, несущие гены устойчивости к указанным антибиотикам, были отбраны ампициллин- и канамицинустойчивые трансформанты. Наличие рекомбинантных плазмид pQE-p6, pQE-p7, pQE-p8 у трансформированных штаммов Е.coli JM109 определено при помощи ПЦР с использованием исходных праймеров Pr6 и Pr3, Pr5 и Pr8 и последующим электрофоретическим анализом полученных фрагментов ДНК в 1,5% агарозном геле, на основании чего был проведен отбор соответствующих клонов.
С целью выявить трансформанты, содержащие один из трех вариантов рекомбинантных плазмид pQE-30, pQE-31, pQE-32, у которых рамка трансляции гена E.coli совпала с рамкой трансляции встроенного гена, необходимо было проверить бактериальные клоны на способность к индуцибельной экспрессии рекомбинантных полипептидов Р6, Р7, Р8. Культуры штамма Е.coli JM109 культивировали в жидкой среде Terrific Broth с добавлением ампициллина и канамицина (во избежание кантоминации). Экспрессионные векторы pQE содержат гены устойчивости к ампицилину и канамицину, а также промотор для индукции транскрипции рекомбинантного белка путем добавления в среду IPTG, причем в качестве хозяина плазмид pQE использовали штаммы Е.coli с мутацией lacIQ, конститутивно продуцирующей lac-репрессор, препятствующий экспрессии протеина. Культуры продолжали выращивать с целью увеличения количества полипептидов, затем клетки E.coli осаждали центрифугированием, отмывали и суспендировали в связывающем буфере А, рН 7.9 и разрушали клеточную стенку ультразвуком на ультразвуковом дезинтеграторе. Лизат освобождали от клеточных обломков центрифугированием. Полипептиды очищали методом аффинной хроматографии, на Ni-NTA агарозе (Qiagen, США). Высокая степень очистки белка достигается за счет сильного аффинного взаимодействия между Ni и цепи из шести гистидинов, связанной с рекомбинантным полипептидом и кодируемой областью, предшествующей полилинкеру в плазмидах pQE. Неспецифически связавшиеся белки удаляли буфером А, элюция рекомбинантных дериватов Вас белка проходила с использованием элюирующего буфера Б рН 7.9, содержащего 400 mM EDTA. Полученные препараты полипептидов очищены от элюирующего буфера диализом против фосфатного буферного раствора, рН 7,4 (PBS).
Выделенные рекомбинантные протеины анализировали методом SDS-электрофореза в полиакриламидном геле, который позволил сделать заключение об удовлетворительном качестве очистки полипептидов, а также об их молекулярной массе: у Р6 - (35±0,5) кДа, у Р7 и Р8 - (52±0,5) кДа по сравнению с пробегом белков известной молекулярной массы (Precision Plus Protein standards (161-0373), Bio-Rad, США).
Экспрессия полипептидов Р6, Р7, Р8 реализована только у трансформированной культуры E.coli, включающей рекомбинантную плазмиду pQE32. Это свидетельствует о совпадении рамки трансляции гена E.coli с рамкой трансляции встроенного гена.
Чертежи иллюстрируют эксперимент.
Фиг.1 (Нуклеотидная последовательность фрагмента хромосомной ДНК р6) представляет нуклеотидную последовательность фрагмента хромосомной ДНК р6 - 882 п.н., кодирующую аминокислотную последовательность рекомбинантного полипептида Р6.
Фиг.2 (Нуклеотидная последовательность рекомбинантной ДНК р7) представляет нуклеотидную последовательность рекомбинантной ДНК р7 - 1353 п.н., кодирующую аминокислотную последовательность рекомбинантного полипептида Р7.
Фиг.3 (Нуклеотидная последовательность фрагмента хромосомной ДНК р8) представляет нуклеотидную последовательность фрагмента хромосомной ДНК р8 - 1353 п.н., кодирующую аминокислотную последовательность рекомбинантного полипептида Р8.
Фиг.4 (Аминокислотная последовательность рекомбинантного полипептида Р6) представляет аминокислотную последовательность рекомбинантного полипептида Р6, Р6 состоит из 294 аминокислотных остатков.
Фиг.5 (Аминокислотная последовательность рекомбинантного полипептида Р7) представляет аминокислотную последовательность рекомбинантного полипептида Р7, Р7 состоит из 451 аминокислотного остатка.
Фиг.6 (Аминокислотная последовательность рекомбинантного полипептида Р8) представляет аминокислотную последовательность рекомбинантного полипептида Р8, Р8 состоит из 451 аминокислотного остатка.
Таким образом, рекомбинантный полипептид Р6 является фрагментом аминокислотной последовательности поверхностного Вас белка СГВ штамма 219/4849 Ibc серотипа со 136 по 429 аминокислотный остаток. Рекомбинантный полипептид Р7 является фрагментом аминокислотной последовательности поверхностного Вас белка СГВ штамма 219/4849 Ibc серотипа со 101 по 551 аминокислотный остаток с двумя аминокислотными заменами. Рекомбинантный полипептид Р8 является фрагментом аминокислотной последовательности поверхностного Вас белка СГВ штамма 219/4849 Ibc серотипа со 101 по 551 аминокислотный остаток.
Аминокислотные последовательности трех указанных дериватов β антигена ковалентно связаны с шестью гистидинами, кодируемыми вектором pQE32 (The QIAexpress System, Qiagen, США). Полипептиды Р6 и Р8 сконструированы таким образом, что наряду с Вас белком содержат IgA-связывающий сайт, включая гексапептид MLKKIE. Полипептид Р7 также содержит сайт, отвечающий за реализацию IgA-рецепторной активности протеином, однако в области из шести аминокислот произведена замена двух из них - лизина 225 на аргинин, а глутамата 227 на глутамин, что значительно ухудшает связывание производного β антигена с IgA по данным авторов.
Расположение аминокислотных последовательностей, кодируемых р6, р7, р8, относительно аминокислотной последовательности поверхностного Вас белка СГВ показано на фиг.7.
На фиг.7 (Схема аминокислотных последовательностей Вас белка СГВ, рекомбинантных полипептидов Р6, Р7, Р8):
1 - сигнальная последовательность;
2 - участок, ответственный за связывание IgA;
3 - область, схожая с последовательностями белков суперсемейства иммуноглобулинов эукариот (IgSF);
4 - участок, ответственный за связывание фактора Н человека (FH);
5 - XPZ участок, обладает структурой полипролин-II, состоит из повторяющихся триплетов, богат пролином;
6 - С-терминальная якорная область (содержит LPYTG motif).
Изучение особенностей взаимодействия рекомбинантных полипептидов Р6, Р7, Р8 с различными молекулярными формами IgA
Авторами получена иммунохимическая характеристика рекомбинантных молекул Р6, Р7, Р8, представляющих собой фрагменты бактериального IgA-рецептора Вас. Результаты работы позволяют расширить область применения полипептидов Р6, Р7, Р8, дополнив ее использованием при создании диагностикумов и для аффинного выделения фрагментов IgA.
Проведено сопоставление рецепторной активности рекомбинантных дериватов Р6, Р7, Р8 в отношении молекулярных форм IgA, представленных следующими образцами: сывороточный IgA (mIgA) - поликлональный сывороточный IgA человека, меченный пероксидазой хрена; поликлональный сывороточный немеченый IgA; IgA1 и IgA2 - сыворотки крови пациентов с миеломной болезнью, а также секреторный IgA (SIgA) - выделенный из молозива секреторный поликлональный IgA; чигаин.
Установлено, что Р6, Р7, Р8 обладают способностью к селективному (в условиях непрямого ИФА подтверждено отсутствие взаимодействия с поликлональным IgG, а также с моноклональными образцами IgG с 1 по 4 подкласс) связыванию всех исследованных форм IgA в любом из использованных вариантов постановки ИФА (прямой ИФА, непрямой ИФА, ингибиторный ИФА, конкурентное ингибирование). Такой результат закономерен, если распространить свойства β антигена на его рекомбинантные дериваты. Несмотря на это, структурные различия между тремя полипептидами, реализованные, как указано выше, методами молекулярной генетики, способствуют существенной дифференцировке рекомбинантных протеинов Р6, Р7, Р8 по IgA-связывающим свойствам. Протеин Р7, содержащий измененную последовательность MLKRIQ, а в остальном полностью идентичный рекомбинантному протеину Р8, обладает более слабо выраженной способностью к связыванию всех рассмотренных молекулярных форм IgA. Последнее свидетельствует о важном значении гексапептида MLKKIE в реализации IgA-рецепторной активности белками. Минимальная эффективность связывания с иммуноглобулином класса А в ряду исследованных белков позволяет рассматривать Р7 в качестве одного из наиболее приемлемых вариантов для создания вакцины против СГВ. Показано, что структура рекомбинантного деривата Р6 оптимальна для реализации IgA-рецепторной активности среди полипептидов Р6, Р7, Р8. Преимущество протеина Р6 в связывании иммуноглобулина класса А перед Р8 можно объяснить отсутствием у последнего оптимальной конформации или генерацией стерических затруднений, вызванных взаимодействием с лигандом молекулы большого размера (Р6 укорочен по сравнению с Р8 с обоих концов). Данные по IgA-рецепторной активности трех белков приведены в Таблице 2.
Влияние молекулярной формы IgA на распознавание лиганда рецепторными молекулами Р6, Р7, Р8, оценивали с использованием непрямого ИФА. Полученные в ходе работы данные указывают на весьма слабое проявление IgA-рецепторной активности белками Р6, Р7, Р8 в отношении секреторного IgA (SIgA), по сравнению со связыванием сывороточного IgA. Сывороточный IgA и SIgA уравнены по концентрации (уравнены по массе).
| Таблица 2 | ||||||
| Сравнение эффективности связывания белками Р6, Р7, Р8 различных молекулярных форм IgA | ||||||
| Метод исследования | Молекулярые формы IgA | Отношение оптических плотностей, отражающих эффективность связывания IgA одним полипептидом по сравнению с другим | ||||
| Р6 по сравнению с Р8 | Р6 по сравнению с Р7 | Р8 по сравнению с Р7 | ||||
| прямой ИФА | mIgA | П | lgA человека, меченный пероксидазой хрена | 1,33 | 3,36 | 2,62 |
| непрямой ИФА | П | Немеченый IgA человека | 1,49 | 3,34 | 2,74 | |
| непрямой ИФА | П | IgA1 (к+λ) | 1,02 | 2,03 | 2,01 | |
| П | IgA2 (к+λ) | 1,09 | 1,82 | 1,87 | ||
| М | IgA1, 10 индивидуальных миеломных образцов | 1,13 | 3,74 | 3,31 | ||
| М | IgA2, 2 индивидуальных миеломных образца | 1,17 | 4,07 | 3,18 | ||
| SIgA | 1,89 | 3,45 | 1,87 | |||
| Примечание. mIgA - сывороточный IgA; | ||||||
| П - поликлональный препарат; | ||||||
| М - моноклональный препарат. |
На фиг.8 показана гистограмма, отражающая сопоставление IgA-рецепторной способности полипептидов Р6, Р7, Р8, а также сравнение связывания протеинами секреторной и сывороточной формы IgA.
На фиг.8 (Сравнение эффективности связывания полипротеинов Р6, Р7, Р8 с сывороточным IgA и секреторным IgA):
А - mIgA;
Б - SIgA;
По оси абсцисс - полипептиды Р6, Р7, Р8;
По оси ординат - оптическая плотность (OD492).
При изучении особенностей взаимодействия миеломных сывороточных образцов IgA1 и IgA2, в каждом случае смесь сывороток, содержащих парапротеины κ- и λ-типов, с рекомбинантными белками, был использован непрямой ИФА на адсорбированных Р6, Р7, Р8. Показано, что миеломные парапротеины иммуноглобулина А первого подкласса взаимодействуют с дериватами Вас протеина достоверно более эффективно, чем иммуноглобулин А второго подкласса.
Отмечены особенности в поведении протеинов в условиях ИФА. Полипептиды Р6 и Р8 способны вступать во взаимодействие с IgA как в растворе (ингибиторный ИФА), так и в адсорбированном состоянии (прямой, непрямой ИФА). Последнее свойство позволяет использовать их в качестве иммунохимических реагентов в ИФА, причем как в иммобилизованном виде, так и в роли выявляющих молекул при наличии ферментной метки.
Также рассмотрены некоторые структурные аспекты связывания иммуноглобулина А фрагментами β антигена: определено относительное положение сайта связывания на молекуле IgA (посредством непрямого и ингибиторного ИФА) - участок топографически приближен к эпитопам трех МкАт (из коллекции лаборатории гибридомной технологии ФГУ "РНЦРХТ Росмедтехнологий") 3В4, 1Н9, 1В12, установлена изменчивость сайта связывания полипептидов на молекуле IgA при анализе 10 индивидуалных миеломных парапротеинов IgA1 (непрямой ИФА), определена устойчивость этого участка к частичному изменению третичной структуры IgA. Последнее осуществлялось путем исследования влияния частичного восстановления дисульфидных связей в молекуле IgA на взаимодействие полипептидов Р6, Р8 с иммуноглобулинами этого класса. Проверка проведена под контролем МкАт. Денатурирующая обработка сывороточного IgA и чигаина дитиотреитолом привела к разрыву дисульфидных связей между α цепями молекулы IgA, в результате чего отмечено снижение связывания антителами эпитопов МкАт 1Н9 и 1В12, на выявление эпитопа ЗВ4 денатурация IgA не оказала влияния (конкурентное ингибирование). В то же время полипептиды Р6 и Р8 проявляют более выраженную IgA-рецепторную активность при взаимодействии с препаратом лиганда, обработанным дитиотреитолом, по сравнению с необработанным IgA (фиг.9). Это свидетельствует о сохранности сайта связывания после частичной денатурации, однако он претерпевает некоторые изменения. Способность протеинов Р6, Р8 связывать частично восстановленный лиганд может быть полезна для манипуляций с денатурированным IgA, в том числе для аффинного выделения самой молекулы иммуноглобулина и ее фрагментов.
На фиг.9 (Влияние восстановления дисульфидных связей в молекуле IgA на ее взаимодействие с рекомбинантными полипептидами Р6 и Р8):
В - связывание Р6, Р8 с обработанным IgA;
Г - связывание Р6, Р8 с необработанным IgA;
По оси абсцисс - полипептиды Р6, Р8;
По оси ординат - ингибирование, %.
Таким образом, исследована способность рекомбинантных дериватов Вас белка СГВ Р6, Р7, Р8 связывать IgA. Полипептиды Р6, Р7, Р8 селективно связывают все рассмотренные молекулярные формы IgA. IgA-рецепторные свойства исследуемых производных белка СГВ коррелируют со свойствами, характерными для полноразмерного Вас белка. В то же время особенности структуры каждого из трех полипептидов определяют различия между ними по IgA-связывающей активности.
Результатом изобретения являются рекомбинантные ДНК р6, р7, р8, нуклеотидные последовательности которых представлены на фиг.1, 2, 3 соответственно; рекомбинантные плазмидные ДНК pQE-p6, pQE-p7, pQE-p8, представляющие собой плазмиды pQE-32, несущие рекомбинантные ДНК р6, р7, р8 соответственно; штаммы Е.coli JM109, трансформированные рекомбинантными плазмидными ДНК pQE-p6, pQE-p7, pQE-p8, и экспрессирующие рекомбинантные полипептиды Р6, Р7, Р8 соответственно; рекомбинантные полипептиды Р6, Р7, Р8, имеющие аминокислотные последовательности, представленные на фиг.4, 5, 6 соответственно.
Рекомбинантные полипептиды Р6, Р7, Р8 обладают следующими свойствами:
а) Р6, Р7, Р8 обладают способностью селективно связывать различные молекулярные формы IgA;
б) Р6, Р7, Р8 взаимодействуют с частично денатурированным IgA, причем восстановление дисульфидных связей между α-цепями молекулы не приводит к изменению взаимодействия с рекомбинантными полипептидами;
в) Р6 при введении в организм млекопитающим (мышам и кроликам) вызывает синтез длительно циркулирующих анти-Р6 антител;
г) синтезируемые анти-Р6 антитела обладают протективными свойствами в отношении Streptococcus agalactiae.
Ниже приводятся конкретные примеры, иллюстрирующие некоторые варианты изобретения, но не ограничивающие его.
Пример 1. Получение фрагмента ДНК р6 методом полимеразной цепной реакции (ПЦР) на основе гена вас, кодирующего поверхностный Вас белок СГВ
ДНК-фрагмент р6 амплифицировали с использованием пары праймеров Pr6-Pr3, фланкирующей эту