Способ скрининга про- или антиапоптогенной активности терапевтических препаратов
Иллюстрации
Показать всеИзобретение относится к медицине и фармакологии и может быть использовано для изучения влияния на апоптоз терапевтических препаратов. Способ осуществляют следующим образом. Новорожденных крысят в возрасте 2-8 дней после рождения разделяют на две группы (контроль и опыт). Подопытным крысятам подкожно вводят исследуемый препарат в терапевтической дозе, а контрольным животным вводят эквивалентное количество физиологического раствора. Через 6-120 часов животных обеих групп декапитируют и выделяют заднюю и (или) корковую часть головного мозга, далее ткань мозга анализируют любыми доступными методами определения интенсивности апоптоза. При изменении интенсивности естественного апоптоза в структурах мозга крысят в 2 и более раз в подопытной группе по сравнению с контрольными животными выносят заключение о про- или антиапоптогенной активности исследуемого препарата. Способ позволяет повысить точность и надежность скрининга препаратов с предполагаемой про- или антиапоптогенной активностью. 1 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к области медицины и предназначено для использования в фармакологических фирмах и научно-исследовательских институтах медицинского и биологического профиля при изучении про- или антиапоптогенной активности (т.е. способствующей или препятствующей программируемой гибели клеток) вновь синтезированных или уже известных терапевтических препаратов.
Апоптоз является важным фундаментальным процессом гибели клеток мозга при нейродегенерации, сопровождающей болезни Паркинсона, Альцгеймера, а также травмы головного мозга, инсульты, ишемию и гипоксию, в том числе у новорожденных. Терапия таких состояний требует разработки препаратов с антиапоптозными свойствами. Необходимость активировать процесс апоптоза возникает при терапии онкологических больных препаратами с проапоптозными свойствами, индуцирующими гибель опухолевых клеток. Повышение эффективности и снижение стоимости создания новых инновационных лечебных препаратов диктует необходимость надежного скрининга возможной пользы и негативных эффектов их использования на ранних этапах разработок.
В настоящее время существует ряд способов, позволяющих определять про- или антиапоптогенные свойства препаратов, выполняемых преимущественно на культурах клеток. К ним относится проточная цитометрия, применение которой полностью ограничено культурами клеток и непременно нуждается в подкреплении другими методами (Kravtsov et al., Am J Pathol, 1999, v. 155, p.1327-1339). Биохимические способы: электрофоретическое определение фрагментации ДНК, выявление активной каспазы-3 и про- или антиапоптозных белков иммуноблотом, определение каспазоподобной активности по расщеплению специфических субстратов (Liu, Wang, Methods Enzymol, 2000, v.32, p.177-182), допускающее применение в культурах клеток автоматизированных микроплашечных методик. Гистологические способы, основанные на изучении препаратов культур клеток и срезов ткани, окрашенных антителами к белкам апоптоза, флюоресцентными красителями ДНК (пропидий йодид, DAPI - субъективно анализируется форма ядер клеток) или специфических ее разрывов (TUNEL - дающий высокий уровень ложно позитивных результатов), обеспечивают преимущественно лишь качественную оценку (Stähelin et al., J Clin Pathol: Mol Pathol 1998, v. 204, p.204-208).
Известные способы имеют очевидные ограничения, и результаты ни одного из них в отдельности не могут надежно характеризовать про- или антиапоптогенные свойства препарата. Способы, применяемые in vitro, естественным образом привязаны к культурам клеток, каждая из которых имеет собственный и отличный от нормальных клеток организма спектр рецепторов, на которые может действовать тестируемый препарат, а также специфику и активность механизмов, осуществляющих клеточную гибель. Кроме того, анализ на культурах клеток полностью не способен выявить про- или антиапоптогенность, возникающую в результате взаимодействия препарата с системами детоксикации и межклеточной коммуникации организма. Применение же методов in vivo на имеющихся тест-системах очень трудоемко, поскольку в большинстве тканей взрослых млекопитающих и человека клетки, находящиеся в процессе программируемой гибели, крайне редки и необходим очень большой объем анализируемого материала для получения надежного результата.
Наиболее ближайшим к заявляемому способу - прототипом, является способ детекции про- и антиапоптотической активности препаратов на культурах клеток млекопитающих (Lang et al., Nature Rev, 2006, v.5, p.343-356) с использованием биохимических методов - определение уровней про- или антиапоптозных белков и активной каспазы-3 методом иммуноблота, выявление активности каспаз по расщеплению их специфических субстратов, определение степени фрагментации ДНК.
Недостатками известного способа являются неточность определения про- или антиапоптогенности исследуемых препаратов при отсутствии естественной системы межклеточной коммуникации и детоксикации в культурах клеток в отличие от процессов, происходящих в нативных тканях целостного организма, невозможность определения эффективной терапевтической дозы для тестируемого препарата.
Технической задачей изобретения является повышение точности и надежности способа скрининга препаратов с предполагаемой про- или антиапоптогенной активностью.
Поставленная техническая задача достигается заявляемым способом, заключающимся в следующем.
Для выявления свойств препаратов с предполагаемым про- или антиапоптогенным действием новорожденных крысят в период интенсивного протекания апоптоза в ткани мозга (возраст 2-8 дней) разделяют на две группы (контроль и опыт). Подопытным крысятам подкожно вводят исследуемый препарат в терапевтической дозе, а контрольным животным вводят эквивалентное количество физиологического раствора или используемого для данного препарата растворителя. Через 6-120 часов животных обеих групп декапитируют и выделяют заднюю и (или) корковую часть головного мозга. Далее ткань мозга анализируют любым из известных или доступных методов определения интенсивности апоптоза, например: определение уровня мРНК и белка каспазы-3 - конечного фермента апоптоза в нервной ткани; определение уровней мРНК других про- и антиапоптозных белков (например, Вах и Bcl-xl); методами иммуноблота или гистохимически; оценка степени фрагметации ДНК по выявляемой на агарозном гель-электрофорезе лестнице фрагментов ДНК. Изменение интенсивности естественного апоптоза в структурах мозга крысят в 2 и более раз в подопытной группе по сравнению с контрольными животными свидетельствует о про- или антиапоптогенной активности исследуемого препарата. На основании такого сравнения составляют заключение о свойствах препарата.
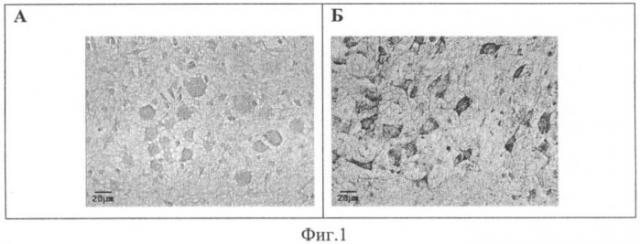
Предлагаемый способ является соединением выявленных авторами закономерностей протекания апоптоза у новорожденных лабораторных животных и известных методов выявления признаков программируемой гибели клеток. Проведенные нами ранее эксперименты показали, что естественная гибель избыточных клеток мозга путем апоптоза в раннем онтогенезе грызунов достаточно интенсивна для ее надежной детекции и в то же время чувствительна даже к очень умеренным по силе как про-, так антиапоптогенным воздействиям. Например, умеренная гипоксия, не влияющая на жизнеспособность, рост и двигательную активность новорожденных крысят, резко повышала экспрессию активной каспазы-3, выявляемой иммуногистохимически, в стволовой части головного мозга (фиг.1), что свидетельствует о проапоптозном действии используемого относительно слабого воздействия и выявляет высокую чувствительность предлагаемого способа скрининга препаратов.
Заявляемый способ позволяет выявлять апоптогенные свойства препаратов любого назначения, что особенно важно для создания препаратов нового поколения с использованием нано- и геномной технологий - композиционных фармакологических препаратов на основе наночастиц и иммобилизованных на них биологически активных компонентов - химических соединений, белков, РНК и других лигандов, возможные эффекты которых на жизнеспособность клеток организма в настоящее время остаются полностью неясными.
Определяющим отличием заявляемого способа от прототипа является то, что в качестве экспериментальной модели используют структуры мозга новорожденных крысят, что позволяет на фоне явления естественной гибели избыточных клеток головного мозга грызунов в раннем онтогенезе надежно судить о про- или антиапоптогенных свойствах препарата с учетом естественной системы межклеточной коммуникации и детоксикации в нативных тканях целостного организма.
Изобретение иллюстрируется примерами конкретного выполнения способа.
Пример 1.
Эксперимент провели на крысятах линии Вистар 8-суточного возраста. Устанавливали про- или антиапоптозную активность глюкокортикоидных гормонов (гидрокортизон, дексаметазон), широко используемых в клинической практике для предотвращения респираторного дистресс-синдрома новорожденных при преждевременных родах. Подопытным крысятам вводили глюкокортикоидный гормон (5 мг/кг гидрокортизона в 0,02 мл физиологического раствора), контрольным животным - 0,02 мл физиологического раствора. Через 6 часов крысят подопытной и контрольной групп забивали быстрой декапитацией, выделяли заднюю часть головного мозга, далее в тканях мозга определяли уровни мРНК прокаспазы-3 и степени фрагментации ДНК с использованием известных методик (Калинина и др. Бюл. Эксп. Биол. Мед., 2001, т.131, № 8, стр.161-163; Калинина и др. Бюл. Эксп. Биол. Мед., 2002, т.134, № 12, стр.641-644).
У подопытных животных с введением гормона обнаружено 2-кратное увеличение уровня мРНК прокаспазы-3 и степени фрагментации ДНК в области заднего мозга, что свидетельствует о выраженном проапоптозном действии используемого препарата.
Пример 2.
Эксперимент провели на крысятах линии Вистар 3-суточного возраста. Крысят разделили на 2 группы. 1-й группе вводили физиологический раствор (0,02 мл) (контроль); 2-й - терапевтическую дозу стимулятора альфа2-адренорецепторов - клонидина (0,4 мг/кг/0,02 мл), препарата используемого для терапии гипертонии, а также в качестве средства усиливающего и продлевающего действие анестетиков. Через 120 часов после введения исследуемого препарата крысят обеих групп забивали быстрой декапитацией, выделяли корковую часть головного мозга и у 8-суточных животных определяли уровни мРНК про- (Вах и каспазы-3) и антиапоптозных (Bcl-ХL) белков в коре головного мозга согласно известной методике (Баннова и др. Бюл. Эксп. Биол. Мед., 2005, т.139, №6, стр.669-671).
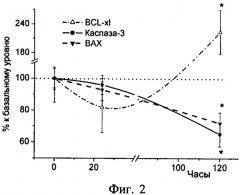
Было установлено, что препарат клонидин в терапевтической дозе обладает антиапоптозной активностью, т.к. экспрессия проапоптозных белков снижается, а антиапоптозного белка - повышается (фиг.2).
Предлагаемый способ скрининга про- или антиапоптогенных свойств новых и(или) уже созданных препаратов, основанный на использовании явления естественной гибели избыточных клеток мозга млекопитающих в раннем онтогенезе, позволяет по усилению или ослаблению гибели клеток мозга надежно судить о про- или антиапоптогенных свойствах препарата. Предлагаемый способ пригоден для тестирования не только противоопухолевых препаратов, терапевтический эффект которых нацелен на стимуляцию гибели клеток опухоли (гибель клеток здоровых тканей является нежелательной и при применении этих препаратов), но также и препаратов любого другого назначения, для которых стимуляция апоптоза является действием, ограничивающим их применение. Способ также пригоден и для тестирования антиапоптозных средств, необходимых для предотвращения невосполнимой потери клеток, например, при нейродегенеративных заболеваниях, инсультах, травмах головного мозга.
Фиг.1. Иммуногистохимическое окрашивание активной каспазы-3 в стволе головного мозга неонатальных крысят через 24 ч после 10-минутной гипоксии. А - условия нормоксии, Б - гипоксии. Масштабная линия на фотографиях - 20 мкм.
Фиг.2. Динамика изменения уровней мРНК антиапоптозного белка Bcl-ХL и проапоптозных белков каспазы-3 и Вах в головном мозге неонатальных крысят после введения клонидина (0,4 мг/кг) в процентах к базальному уровню, определенному у контрольных животных, получавших физиологический раствор. * - достоверное отличие (p <0,05) от контроля.
1. Способ скрининга про- или антиапоптогенной активности терапевтических препаратов, включающий исследование тестируемого препарата на экспериментальной модели, отличающийся тем, что в качестве модели используют новорожденных крысят линии Вистар в возрасте 2-8 дней, последних разделяют на две группы (контроль и опыт), подопытным крысятам подкожно вводят исследуемый препарат в терапевтической дозе, через 6-120 ч животных обеих групп декапитируют и выделяют заднюю и (или) корковую часть головного мозга, далее ткань мозга анализируют любыми доступными методами определения интенсивности апоптоза и при изменении интенсивности естественного апоптоза в структурах мозга крысят в два и более раз в подопытной группе, по сравнению с контрольными животными, выносят заключение о про- или антиапоптогенной активности исследуемого препарата.
2. Способ по п.1, отличающийся тем, что интенсивность апоптоза анализируют следующими методами: определение уровня мРНК и белка каспазы-3; определение уровней мРНК других про- и антиапоптозных белков; методами иммуноблота или гистохимически; оценка степени фрагментации ДНК по выявляемой на агарозном гель-электрофорезе лестнице фрагментов ДНК.