Ингаляционная композиция, содержащая сульфоалкиловый эфир циклодекстрина и кортикостероид
Иллюстрации
Показать всеНастоящее изобретение относится к химико-фармацевтической промышленности и касается ингаляционной композиции, содержащей SAE-β-CD и кортикостероид. Указанная композиция адаптирована для введения субъекту распылением при помощи распылителя. Данная композиция может быть предоставлена в наборе. Указанную композицию вводят в виде водного раствора, однако ее можно хранить в виде сухого порошка, готового к применению раствора или концентрированной композиции. Указанную композицию используют в усовершенствованной системе распыления для введения кортикостероида ингаляцией. SAE-β-CD, присутствующий в композиции, значительно усиливает химическую устойчивость будесонида. Настоящее изобретение относится также к способу введения указанной композиции ингаляцией. Данную композицию можно также вводить при помощи обычного устройства для доставки лекарственного средства через нос. Композиция обладает высокой стабильностью, и биодоступностью. 7 н. и 30 з.п. ф-лы, 16 ил, 17 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к ингаляционной композиции, содержащей сульфоалкиловый эфир циклодекстрина и кортикостероид, такой как будесонид, и к способу введения указанной композиции посредством ингаляции. Данное изобретение относится также к способам лечения легочных заболеваний и нарушений.
Уровень техники
Введение лекарственного средства ингаляцией делает возможным осаждение такого лекарственного средства в разных отделах дыхательных путей, таких как горло, трахея, бронхи и альвеолы. Как правило, чем меньше размер частицы, тем дольше частица остается взвешенной в воздухе и тем глубже в дыхательные пути может быть введено лекарственное средство. Кортикостероиды вводят путем ингаляции при помощи распылителей (небулайзеров), дозирующих ингаляторов или ингаляторов сухого порошка. Принципиальным преимуществом распылителей по сравнению с другими методами доставки лекарственного средства в легкие является то, что субъект не прилагает никаких усилий, что позволяет легче ввести более высокие дозы. Основными недостатками распылителей, однако, являются их высокая стоимость, недостаточная портативность, неудобство, связанное с необходимостью предварительного приготовления лекарственного средства, и более продолжительное время введения. Поэтому желателен способ, улучшающий введение распылением таких лекарственных средств как кортикостероиды.
Будесонид ((R,S)-11β,16α,17,21-тетрагидроксипрегна-1,4-диен-3,20-дион-цикло-16,17-ацеталь масляного альдегида; С25Н34О6; молекулярная масса 430,5) является хорошо известным лекарственным средством. Указанное лекарственное средство промышленно производится в виде смеси двух изомеров (22R и 22S). Будесонид является противовоспалительным кортикостероидом, обладающим сильной глюкокортикоидной активностью. Введение будесонида назначают при лечении астмы и в качестве профилактической терапии детей.
Коммерческие композиции будесонида компания AstraZeneca LP (Wilmington, DE) продает под товарными знаками ENTOCORT™ EC, PULMICORT RESPULES®, Rhinocort Aqua®, Rhinocort® Nasal Inhaler и Pulmicort Turbuhaler® и под родовым названием. PULMICORT RESPULES®, который представляет собой стерильную водную суспензию тонкоизмельченного будесонида, вводят ингаляцией при помощи распылителя, в частности при помощи пневматического струйного распылителя, который обеспечивает доставку 2-18% массы лекарственного средства от общего объема. RHINOCORT® NASAL INHALER™ представляет собой находящийся под давлением дозируемый аэрозоль, содержащий суспензию тонкоизмельченного будесонида в смеси с пропеллентами. RHINOCORT® AQUA™ представляет собой непахучую дозируемую композицию, распыляемую при помощи ручного насоса, который содержит суспензию тонкоизмельченного будесонида в водной среде. Указанные суспензии нельзя вводить при помощи ультразвукового распылителя.
Жидкость, предназначенная для распыления, желательно должна обладать нижеследующими свойствами: 1) низкая вязкость; 2) стерильная среда; 3) низкое поверхностное натяжение; 4) устойчивость к воздействию механизма распылителя; 5) среднее значение рН около 4-10; 6) способность образовывать капли с MMAD <5 мкм или предпочтительно <3 мкм; 7) отсутствие раздражающих консервантов и стабилизаторов; 8) приемлемый тонус. Причем суспензии обладают одними преимуществами, а растворы обладают другими преимуществами.
Смалдон и др. (Smaldone et al., J. Aerosol Med. (1998), 11, 113-125) представили результаты исследования по определению in vitro ингалируемой массы и распределения частиц в суспензии будесонида. Авторы вышеуказанной статьи пришли к выводу, что при использовании суспензии будесонида происходит доставка 2%-18% содержимого распылителя, из чего следует, что доставка будесонида является неполной, вызывая значительный расход лекарственного средства. В тринадцати наиболее эффективных системах суспензию можно распылять в достаточной степени для доставки в нижние отделы дыхательных путей.
В другом исследовании была продемонстрирована разная эффективность распыления в зависимости от типа распылителя. Барри и др. (Barry et al., J. Allergy Clin. Immunol. (1998), 320-321) отметили, что подобный разброс необходимо принимать во внимание при лечении субъектов распыляемым будесонидом. Берг и др. (Berg et al., J. Aerosol Sci. (1998), 19(7), 1101-1104) также сообщали о весьма различной эффективности распыления суспензии PULMICORT™ в зависимости от типа распылителя. Кроме того, средний аэродинамический диаметр массы (MMAD) распыляемых капель существенно изменяется в зависимости от типа распылителя. Как правило, суспензии распыляются менее эффективно, чем растворы (см. O'Riordan, Respiratory Care, (2002), 1305-1313). Ингалируемые кортикостероиды используют для лечения астмы, причем указанные лекарственные средства обладают значительным преимуществом благодаря доставке непосредственно к месту действия, то есть в легкие. Целью применения ингалируемого кортикостероида является проведение локальной терапии с достижением немедленной активности лекарственного средства в легких. Ингалируемые кортикостероиды хорошо абсорбируются из легких. Действительно можно предположить, что происходит системная абсорбция всего лекарственного средства, доставляемого к рецепторам в легких. Однако хорошо известно, что при использовании современных методов и композиций большая часть дозы ингалируемого кортикостероида проглатывается и становится доступной для пероральной абсорбции, вызывая нежелательные системные эффекты. Для ингалируемых кортикостероидов высокая легочная доступность имеет более важное значение по сравнению с высокой пероральной биологической доступностью, так как органом-мишенью являются легкие. Продукт с высокой легочной доступностью обладает более сильным действием, оказывающим положительное воздействие на легкие. Идеальная ингалируемая кортикостероидная композиция должна характеризоваться минимальным пероральным введением, уменьшая, таким образом, вероятность вредных системных эффектов.
Большая часть дозы кортикостероида, доставляемого в легкие, абсорбируется и оказывает системное действие. Биологическая доступность части ингалируемой дозы кортикостероида, вводимой перорально, зависит от абсорбции из желудочно-кишечного тракта и степени метаболизации при первом прохождении через печень. Так как пероральный компонент введения кортикостероида не оказывает благоприятного терапевтического действия, но может усилить системные побочные эффекты, желательно, чтобы пероральная биологическая доступность ингалируемого кортикостероида была относительно низкой.
На эффективность ингалируемого кортикостероида влияет как размер частиц, так и состав композиции. Состав лекарственного средства оказывает значительное влияние на доставку указанного лекарственного средства в легкие и, следовательно, на его эффективность. Особенно важное значение в процессе доставки лекарственного средства в легкие имеет аэрозольный носитель и размер доставляемых частиц. Кроме того, меньшая степень осаждения лекарственного средства в легких предполагает большую степень осаждения в ротовой части глотки. Из-за определенного состава некоторые кортикостероиды в большей степени осаждаются во рту и горле и могут вызывать вредные локальные эффекты.
Хотя распределение рецепторов является главной составляющей бронхорасширяющего действия, размер частиц, по-видимому, имеет более важное значение для определения эффективности ингалируемого кортикостероида. Внутренний периметр наиболее узких дыхательных путей равен 2 микрометрам (мкм) или меньше. Таким образом, ингалятор, содержащий частицы со средним аэродинамическим диаметром 1 мкм, характеризуется большей вдыхаемой фракцией, чем ингалятор, содержащий частицы со средним диаметром 3,5-4 мкм. Все частицы, предназначенные для введения субъектам, страдающим обтурирующим заболеванием легких, в идеале должны быть не более 2-3 мкм. Частица меньшего размера (менее 5 мкм) с большей долей вероятности будет ингалирована в более узкие дыхательные пути легких, что должно способствовать повышению эффективности. В отличие от этого частицы размером более 5 мкм могут осаждаться во рту и горле, уменьшая долю частиц, достигающих легких, и потенциально вызывая вредные локальные эффекты, такие как пероральный кандидоз и хрипота (дисфония). Считается, что частицы со средним аэродинамическим диаметром массы (MMAD), близким к 1 мкм, содержат большую вдыхаемую фракцию в одной дозе по сравнению с частицами, имеющими диаметр 3,5 мкм или больше.
Другим недостатком распыления суспензий будесонида является необходимость образования очень мелких капель с MMAD примерно <3 мкм. Так как распыляемые капли являются такими мелкими, частицы тонкоизмельченного будесонида должны быть еще меньше или находиться в диапазоне 0,5-2,0 мкм, при этом частицы должны характеризоваться распределением по размерам в узком диапазоне. Создание таких частиц вызывает большие трудности.
Поэтому были предприняты усилия для улучшения распыления суспензий будесонида при помощи ультразвуковых распылителей с использованием частиц в субмикронном диапазоне (Keller et al., in Respiratory Drug Delivery VIII (2002), 197-206). Суспензию наночастиц (0,1-1,0 мкм) кортикостероида можно использовать для увеличения доли вдыхаемых частиц по сравнению с суспензией более крупных частиц, имеющих место в суспензии PULMICORT™. Не было отмечено улучшений по сравнению с суспензией PULMICORT™ (размер частиц будесонида в суспензии равен примерно 4,4 мкм). Кроме того, суспензии наночастиц вызывают озабоченность, связанную с тем, что мелкие частицы (<0,05 мкм) могут индуцировать аллергическую реакцию у субъекта. Компания Sheffield Pharmaceuticals, Inc. (St. Louis, MO; “The Pharmacokinetics of Nebulized Nanocrystal Budesonide Suspension in Healthy Volunteers”, Kraft, et al., in J. Clin. Pharmacol., (2004), 44:67-72) представила данные о получении и оценке стандартного дозированного будесонида (UDB), который представляет собой композицию в виде суспензии, содержащей наночастицы будесонида, диспергированные в жидкой среде. Вышеуказанный продукт создан компанией MAP Pharmaceuticals, Inc. (Mountain View, California).
Известно, что ингаляция частиц лекарственного средства в отличие от растворенного лекарственного средства оказывает неблагоприятное действие. Брейн и др. (Bronchial Asthma, 2nd Ed. (Ed. E.B. Weis et al., Little Brown & Co. (1985), pp.594-603) сообщили, что менее растворимые частицы, которые осаждаются на слизистой оболочке дыхательных путей и носового хода, выводятся в глотку ресничками. Такими частицами являются более крупные частицы лекарственного средства, осажденные в верхнем отделе дыхательных путей. Слизь, клетки и инородные вещества, выводимые из полостей носа и легких, соединяются в глотке, смешиваются со слюной и поступают в желудочно-кишечный тракт при проглатывании. С помощью указанного механизма частицы удаляются из легких в течение периодов времени от нескольких минут до часов. Поэтому для растворения медленно растворяющихся лекарственных средств, таких как будесонид, остается мало времени. В отличие от этого частицы, осажденные в отделах, не имеющих ресничек, таких как альвеолы, располагают гораздо большим временем. Поскольку трудно получить очень мелкие частицы будесонида для глубокого осаждения в легких, большая часть ингалируемой суспензии осаждается в верхних и средних отделах дыхательных путей. Однако гораздо легче получить мелкие капли из раствора, чем из суспензии твердых частиц. По этой причине распыление раствора, содержащего будесонид, должно быть более предпочтительным по сравнению с распылением суспензии.
О'Риордан (O'Riordan, Respiratory Care (2002 Nov), 47(11), 1305-1313) заявил, что лекарственные средства могут доставляться распылением растворов или суспензий, но, как правило, распыление раствора предпочтительнее распыления суспензии. Вышеуказанный автор отметил, что ультразвуковые распылители непригодны для распыления суспензий, и их можно использовать только для распыления растворов.
О'Каллаган (O'Callaghan, Thorax, (1990), 45, 109-111), Сторр и др. (Storr et al., Arch. Dis. Child (1986), 61, 270-273) и Вебб и др. (Webb et al., Arch. Dis. Child (1986), 61, 1108-1110) заявили, что распыление растворов кортикостероида (в частности, беклометазона) может быть предпочтительнее распыления суспензий, так как суспензии могут оказаться неэффективными, если распыляемые частицы являются слишком крупными для проникновения в легкие в терапевтически эффективных количествах. Однако данные, представленные О'Каллаганом (O'Callaghan, J. Pharm. Pharmacol. (2002), 54, 565-569) для распыления раствора и суспензии флунизолида, показывают, что эффективность распыления обоих веществ является одинаковой. Поэтому нельзя сделать обобщение, из которого будет следовать, что распыление раствора является более предпочтительным по сравнению с распылением суспензии.
Таким образом, существует общепризнанная потребность в несуспензионных композициях, содержащих кортикостероид, предназначенный для введения распылением. Однако в ингаляционной терапии широкое применение находит стандартная дозированная суспензионная композиция PULMICORT®. Большим достижением в данной области терапии было бы создание способа, улучшающего введение суспензии PULMICORT™ или в более широком смысле стандартной дозированной суспензионной композиции, содержащей кортикостероид.
Однако в настоящее время основное внимание в распылительной терапии уделяется введению лекарственного средства в более высоких концентрациях, использованию растворов, предпочтительно в основном водных растворов в отличие от неводных, спиртовых или неводных спиртовых растворов или по возможности суспензий, сокращению времени процедуры, синхронизации распыления с ингаляцией и введению более мелких капель для более глубокого осаждения лекарственного средства в легких.
Известны кортикостероид-содержащие распыляемые растворы. Существует ряд способов получения распыляемых растворов. Указанные растворы обычно получают, добавляя сорастворитель, поверхностно-активное вещество или буфер. Однако использование сорастворителей, таких как этанол, полиэтиленгликоль и пропиленгликоль, допустимо лишь в малых количествах при введении ингаляцией из-за раздражения дыхательных путей. Существуют ограничения относительно приемлемых уровней указанных сорастворителей в ингалируемых продуктах. Сорастворители обычно могут составлять менее примерно 35 мас.% распыляемой композиции, хотя указанные пределы определяются общей дозой сорастворителя и его концентрацией. Пределы устанавливаются в зависимости от способности указанных растворителей вызывать местное раздражение тканей легких, образовывать гиперосмотические растворы, направляющие текучую среду в легкие, и/или вызывать интоксикацию субъекта. Кроме того, самые сильнодействующие гидрофобные лечебные средства являются недостаточно растворимыми в смесях указанных сорастворителей.
Саиди и др. (патент США № 6241969) описали получение кортикостероид-содержащих растворов для доставки в нос и легкие. Растворенные кортикостероиды находятся в концентрированной, по существу неводной форме, используемой для хранения, или в разведенной водной форме, используемой для введения.
Линц и др. (AAPS Annual Meeting and Exposition, 2004) описали получение жидких композиций, содержащих будесонид, воду, соль лимонной кислоты, хлорид натрия и спирт, пропиленгликоль и/или поверхностно-активное вещество, такое как твин, плюроник, или фосфолипиды со значениями HLB в пределах от 10 до 20.
Альтернативным подходом к введению суспензии PULMICORT™ является введение липосомной композиции. Волдреп и др. (Waldrep et al., J. Aerosol Med. (1994), 7(2), 135-145) сообщили об успешном получении липосомной композиции будесонида и производных фосфатидилхолина.
Ни одна из вышеуказанных композиций не была предназначена для улучшения введения стандартной дозированной суспензионной композиции, содержащей кортикостероид. Наоборот, общее внимание в данной области было сфокусировано на получении суспензии из предварительно полученной жидкой композиции, которую затем делят на несколько стандартных доз, упаковывают и продают для последующего применения.
Хорошо известно растворение лекарственных средств циклодекстринами и их производными. Циклодекстрины являются циклическими углеводами, получаемыми из крахмала. Немодифицированные циклодекстрины отличаются рядом звеньев глюкопиранозы, соединенных друг с другом с образованием цилиндрической структуры. Исходные циклодекстрины содержат 6, 7 или 8 звеньев глюкопиранозы и определяются соответственно как α-, β- и γ-циклодекстрины. Каждое субзвено циклодекстрина содержит вторичные гидроксильные группы в положениях 2 и 3 и первичные гидроксильные группы в положении 6. Циклодекстрины можно изобразить в виде полых усеченных конусов с гидрофильными наружными поверхностями и гидрофобными внутренними полостями. Указанные гидрофобные полости образуют в водных растворах убежище для гидрофобных органических соединений, которое может соответствовать всей или части структуры таких соединений. Данный процесс, известный как образование комплексов включения, может привести к увеличению кажущейся растворимости в воде и устойчивости комплексного лекарственного средства. Указанный комплекс стабилизируется гидрофобными взаимодействиями и не участвует в образовании любых ковалентных связей.
Вышеуказанный динамический и обратимый равновесный процесс может быть описан уравнениями 1 и 2, в которых количество комплекса находится в зависимости от концентраций лекарственного средства и циклодекстрина и константы равновесия или связывания Кb. При введении композиций, содержащих циклодекстрин, путем инъекции в кровоток комплекс быстро распадается вследствие растворения и неспецифического связывания лекарственного средства с компонентами крови и тканей.
Константы связывания циклодекстрина и активного агента можно определить методом равновесной растворимости (T. Higuchi et al., in “Advances in Analytical Chemistry and Instrumentation Vol.4”; C.N. Reilly ed.; John Wiley & Sons, Inc. 1965, pp. 117-212). Как правило, чем выше концентрация циклодекстрина, тем больше равновесный процесс, определяемый уравнениями 1 и 2, смещается к образованию большего количества комплекса, из чего следует, что концентрация свободного лекарственного средства обычно уменьшается при увеличении концентрации циклодекстрина в растворе.
Известно, что непроизводные исходные циклодекстрины взаимодействуют с тканями человека и экстрагируют холестерин и другие компоненты оболочки, в частности, при накоплении в клетках почечных канальцев, оказывая токсическое и иногда смертельное воздействие на почки.
Исходные циклодекстрины часто обладают отличающимся сродством к любому данному субстрату. Например, γ-циклодекстрин часто образует комплексы с ограниченной растворимостью, которые соответствуют кривым растворимости типа Bs. Такое поведение характерно для большого числа стероидов, что создает серьезные ограничения для использования γ-CD в жидких препаратах. Однако β-CD плохо образует комплексы с соединениями разных классов. Для β-CD и γ-CD установлено, что получение производных соединений, например, путем алкилирования, не только улучшает растворимость в воде производных соединений по сравнению с исходным CD, но и изменяет тип кривых растворимости с ограничивающего Bs-типа на более линейную кривую А-типа (Bernd W. Muller and Ulrich Brauns, “Change of Phase-Solubility Behavior by Gamma-Cyclodextrin Derivatization”, Pharmaceutical Research (1985), p.309-310).
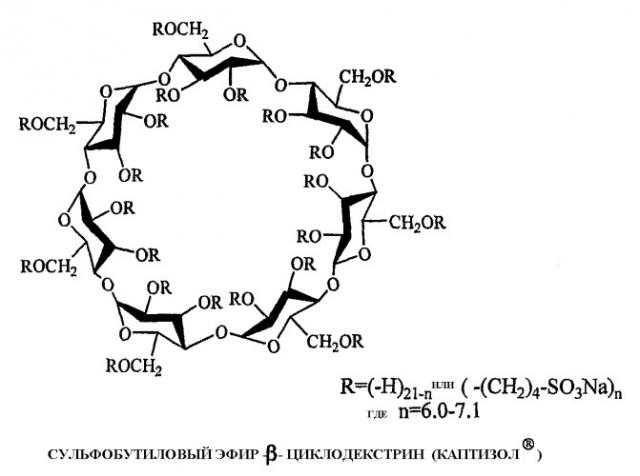
Химическая модификация исходных циклодекстринов (обычно в положении гидроксильных групп) позволила получить более безопасные производные при сохранении или улучшении комплексообразующей способности. Из многочисленных производных циклодекстринов, полученных до настоящего времени, только два соединения являются, по-видимому, коммерчески приемлемыми: 2-гидроксипропильные производные (НР-CD; нейтральные циклодекстрины, создаваемые на коммерческой основе «Янссен» и другими) и производные, образованные сульфоалкиловым эфиром, таким как сульфобутиловый эфир (SBE-CD; анионные циклодекстрины, создаваемые компанией CyDex, Inc.). Однако НР-β-CD по-прежнему является токсичным, в то время как у SBE-CD токсичность отсутствует.
В патентах США №№ 5376645 и 5134127, выданных Стелла и др., в патенте США № 3426011, выданном Пармертеру и др., в статьях Lammers et al. (Recl. Trav. Chim. Pays-Bas (1972), 91(6), 733-742); Staerke (1971), 23(5), 167-171) и Qu et al. (J. Inclusion Phenom. Macro. Chem., (2002), 43, 213-221) описаны производные циклодекстрина, образованные сульфоалкиловым эфиром. Вышеуказанные ссылки позволяют предположить, что SAE-CD пригодны для растворения целого ряда разных соединений.
Производное бета-циклодекстрина, образованное сульфобутиловым эфиром (SBE-β-CD), в частности, производное, имеющее в среднем примерно 7 заместителей в молекуле циклодекстрина (SBE7-β-CD), создано на коммерческой основе компанией CyDex, Inc. под товарным знаком CAPTISOL®. Сульфобутиловый эфир, являющийся анионным заместителем, существенно улучшает растворимость в воде исходного циклодекстрина. Кроме того, присутствие зарядов уменьшает способность молекулы образовывать комплекс с холестерином по сравнению с гидроксипропильным производным. Образование обратимого нековалентного комплекса лекарственных средств с циклодекстрином CAPTISOL® обычно способствует лучшей растворимости и устойчивости лекарственных средств в водных растворах. Хотя CAPTISOL® является относительно новым, но известным циклодекстрином, ранее не было исследована возможность его применения при получении кортикостероид-содержащих распыляемых растворов.
Композиции для парентерального введения обычно исследуют при помощи гемолитических анализов для определения пригодности конкретной композиции для инъекции в кровоток субъекта. Испытуемая композиция, вызывающая значительный гемолиз, обычно считается непригодной для введения субъекту. Обычно предполагается, что более высокая осмотическая концентрация раствора ассоциирована с более высоким гемолитическим потенциалом. Как показано на фиг.1 (Thompson, D.O., Critical Reviews in Therapeutic Drug Carrier Systems, (1997), 14(1), 1-104), гемолитическое поведение циклодекстрина CAPTISOL® сравнимо с аналогичным показателем исходного β-циклодекстрина, коммерчески доступных гидроксипропильных производных, циклодекстрина ENCAPSIN™ (степень замещения ~3-4), циклодекстрина MOLECUSOL® (степень замещения ~7-8) и двух других производных, образованных сульфобутиловым эфиром, SBE1-β-CD и SBE4-β-CD. В отличие от других производных циклодекстрина производные, образованные сульфоалкиловым эфиром (SAE-CD), в частности, такие как CAPTISOL® (степень замещения ~7) и SBE4-β-CD (степень замещения ~4), отличаются отсутствием гемолитического действия и обладают значительно меньшим потенциалом разрушения оболочки по сравнению с коммерчески доступными гидроксипропильными производными в концентрациях, обычно используемых для растворения фармацевтических композиций. Диапазон концентраций, показанных на фигуре, включает концентрации, обычно используемые для растворения фармацевтических композиций после первоначального растворения в кровотоке после инъекции. При пероральном введении SAE-CD не подвергается значительной системной абсорбции.
Осмотическая концентрация композиции обычно ассоциирована с ее гемолитическим потенциалом: чем выше осмотическая концентрация раствора (или в большей степени повышающая осмотическое давление), тем больше гемолитический потенциал. Занноу и др. (Zannou et al., “Osmotic properties of sulfobutyl ether and hydroxypropyl cyclodextrins”, Pharma. Res. (2001), 18(8), 1226-1231) сравнили осмотическую концентрацию растворов, содержащих SBE-CD и НР-CD. Как показано на фиг.2, растворы, содержащие SBE-CD, характеризуются более высокой осмотической концентрацией, чем растворы, содержащие НР-CD, при аналогичных концентрациях производного циклодекстрина. Таким образом, весьма удивительным является то, что SAE-CD вызывает меньший гемолиз по сравнению с НР-CD при эквивалентных концентрациях несмотря на то, что НР-CD имеет более низкую осмотическую концентрацию.
Были получены метилированные циклодекстрины и исследовано их гемолитическое действие на эритроциты человека. Установлено, что указанные циклодекстрины вызывают гемолиз от умеренного до сильного (Jodal et al., Proc. 4th Int. Symp. Cyclodextrins, (1988), 421-425; Yoshida et al., Int. J. Pharm., (1988), 46(3) 217-222).
Введение циклодекстринов в легкие млекопитающего может быть неприемлемым. Действительно, в научной литературе описана потенциальная или наблюдаемая токсичность природных циклодекстринов и производных циклодекстринов. Данные химического хранилища NTP свидетельствуют о том, что α-циклодекстрин может оказывать вредное воздействие при ингаляции. Нимбалкар и др. (Nimbalkar et al., Biotechnol. Appl. Biochem. (2001), 33, 123-125) предупреждают об опасности применения в легких комплекса НР-β-CD/диацетилдапсона из-за вызываемого данной композицией замедления роста клеток легкого.
Несмотря на это в научной литературе было сообщено о проведении ряда исследований по использованию циклодекстринов для ингаляции, хотя ни одно из них не стало источником коммерческой выгоды. Результаты вышеуказанных исследований показывают, что необходимы разные комбинации лекарственного средства и циклодекстрина для получения конкретных оптимальных или даже полезных композиций для ингаляции или введения в нос. Были сделаны попытки создать циклодекстрин-содержащие порошки и растворы для трансбуккальной, легочной и/или назальной доставки.
В патенте США № 5914122, выданном Оттербеку и др., описано получение устойчивых будесонид-содержащих распыляемых растворов. Авторы изобретения продемонстрировали использование циклодекстрина, такого как β-CD, γ-CD или НР-β-CD и/или EDTA, в качестве стабилизатора. Циклодекстрин предложено также использовать в качестве растворителя для увеличения концентрации будесонида в растворе. Наибольший срок хранения для всех композиций с точки зрения приемлемого сохранения активного ингредиента равен только трем-шести месяцам.
В предварительной публикации патента США № 20020055496, выданного Маккою и др., описаны по существу неводные композиции для перорального введения, содержащие НР-β-CD. Указанные композиции можно вводить с помощью аэрозоля, распыляющего насоса или пропеллента.
В патенте России № 2180217, выданном Чучалину, описан устойчивый будесонид-содержащий раствор для ингаляции. Указанный раствор содержит будесонид, пропиленгликоль, полиэтиленоксид, янтарную кислоту, трилон В, нипазол, тиомочевину, воду и необязательно НР-β-CD.
Мюллер и др. (Muller et al., Proceed. Int'l. Symp. Control. Rel. Bioact. Mater. (1997), 24, 69-70) представили результаты исследования по получению микрочастиц будесонида, предназначенных для применения в ингаляторе сухого порошка, при помощи сверхкритического процесса на основе диоксида углерода с использованием ASES (аэрозольная система экстракции растворителя). НР-β-CD предложено использовать в качестве носителя для порошка.
Мюллер и др. (патент США № 6407079) представили фармацевтические композиции, содержащие НР-β-CD. Авторы вышеуказанного изобретения отметили возможность введения в нос раствора, содержащего циклодекстрин.
В данной области известно о необходимости выполнения структурной оценки родственных вариантов производного циклодекстрина определенного типа для оптимизации связывания конкретного соединения с производным циклодекстрина данного типа. Однако существенные различия в связывании определенного соединения с первым вариантом производного декстрина по сравнению с его вторым вариантом часто отсутствуют. Например, очень редко встречаются существенные различия в связывании определенного лечебного средства с первым производным циклодекстрина и структурно родственным вторым производным циклодекстрина. Когда такие ситуации возникают, они оказываются неожиданными. Ворт и др. (Worth et al., 24th International Symposium on Controlled Release of Bioactive Materials (1997)) представили результаты исследования по оценке пригодности комплексов стероид/циклодекстрин для доставки лекарственного средства в легкие. Было произведено сравнение β-CD, SBE-β-CD и НР-β-CD в отношении их способности образовывать комплексы включения с дипропионатом беклометазона (BDP) и его активным метаболитом монопропионатом беклометазона (ВМР). ВМР легче растворялся циклодекстрином, при этом был выявлен нижеследующий порядок растворяющей способности: НР-β-CD (самая высокая) > β-CD > SBE7-β-CD. Таким образом, следует ожидать, что производные SAE-CD окажутся непригодными для растворения кортикостероидов, таких как ВМР или BDP. Хотя не были приведены результаты, касающиеся действительной пригодности применения в ингаляционных композициях, авторы статьи предположили, что ВМР будет лучшей альтернативой BDP для создания распыляемого раствора.
Киннаринен и др. (Kinnarinen et al., 11th International Cyclodextrin Symposium CD, (2002)) представили результаты исследования in vitro по введению в легкие комплекса включения будесонида/γ-CD путем ингаляции сухого порошка. Не было обнаружено преимуществ при образовании комплекса с γ-CD. Возон и др. (Vozone et al., 11th International Cyclodextrin Symposium CD, (2002)) представили результаты исследования по образованию комплекса будесонида с γ-циклодекстрином для ингаляции сухого порошка. Не было обнаружено различий при введении доз комплекса с циклодекстрином или физической смеси будесонида и CD. Но различие между фракциями тонкоизмельченных частиц в обоих композициях позволило предположить, что использование комплекса с циклодекстрином для доставки лекарственного средства в легкие может увеличить вдыхаемую фракцию сухого порошка.
Пинто и др. (Pinto et al., S.T.P. Pharma. Sciences (1999), 9(3), 253-256) представили результаты исследования по использованию НР-β-CD в ингалируемой композиции в виде сухого порошка для беклометазона. НР-β-CD оценивали в виде комплекса или физической смеси с лекарственным средством при исследовании осаждения in vitro дозы, доставляемой из устройства для ингаляции MICRO-HALER™. Количество вдыхаемой фракции лекарственного средства было наибольшим при использовании комплекса и самым низким при отдельном использовании тонкоизмельченного лекарственного средства.
Раджевски и др. (Rajewski et al., J. Pharm. Sci. (1996), 85(11), 1142-1169) сделали обзор фармацевтических применений циклодекстринов. В своем обзоре авторы привели исследования, в которых была произведена оценка использования комплексов с циклодекстрином в системах для ингаляции сухого порошка.
Шао и др. (Shao et al., Eur. J. Pharm. Biopharm. (1994), 40, 283-288) сообщили об эффективности циклодекстринов в качестве стимуляторов абсорбции лекарственного средства в легких. Показатели относительной эффективности циклодекстринов в усилении абсорбции инсулина в легких, измеренной путем определения фармакодинамики, и относительной действенности расположились в следующем порядке: диметил-β-циклодекстрин > α-циклодекстрин > β-циклодекстрин > γ-циклодекстрин > гидроксипропил-β-циклодекстрин. С учетом результатов данного отчета следует ожидать, что водорастворимое производное γ-CD будет менее пригодно для доставки соединений путем ингаляции, чем соответствующее производное β-CD, так как непроизводный β-CD является более пригодным, чем непроизводный γ-CD.
Вильямс и др. (Williams et al., Eur. J. Pharm. Biopharm. (1999 Mar), 47(2), 145-52) сообщили о результатах исследования по определению влияния метода получения 2-гидроксипропил-бета-циклодекстрина (НР-β-CD) на устойчивость аспирина в суспензионной композиции для использования в пневматическом дозирующем ингаляторе (pMDI), содержащем гидрофторалкановый (HFA) пропеллент. НР-β-CD был использован в pMDI в виде лиофилизованного комплекса включения или физической смеси с аспирином. Аспирин в лиофилизованном комплексе включения характеризовался наибольшей степенью разложения в течение 6 месяцев хранения, в то время как отдельно использованный аспирин в pMDI разлагался в умеренной степени. Аспирин в составе физической смеси отличался наименьшей степенью разложения. Таким образом, НР-β-CD может быть использован для повышения устойчивости химически неустойчивого лекарственного средства, но на устойчивость лекарственного средства может влиять метод получения композиции.
Гудмундсдоттир и др. (Gudmundsdottir et al., Pharmazie (2001 Dec), 56(12), 963-6) представили результаты исследования, в котором мидазолам получали в водном растворе буфера, содержащего (сульфобутиловый эфир)-бета-циклодекстрин. Раствор, распыляемый в нос, испытывали с участием здоровых добровольцев и сравнивали с мидазоламом для внутривенного введения при выполнении открытого перекрестного исследования. Композиция для введения в нос приближалась к внутривенной форме по скорости абсорбции, концентрации в сыворотке и клиническому седативному эффекту. Не было обнаружено серьезных побочных эффектов.
Сричана и др. (Srichana et al., Respir. Med. (2001 Jun), 95(6), 513-9) представили результаты исследования по созданию нового носителя в аэрозолях сухих порошков. Для исследования в качестве носителей в композициях в виде сухих порошков были выбраны циклодекстрины двух типов: гамма-циклодекстрин (γ-CD) и диметил-бета-циклодекстрин (DMCD). В исследовании был использован салбутамол в качестве модели лекарственного средства и контрольная композиция, содержащая лактозу и лекарственное средство. Для оценки эффективности доставки композиций в виде сухих порошков использовали двойной импинджер (TSI). С учетом полученных результатов было установлено, что доставка композиции, содержащей лекарственное средство, усиленное γ-CD, в нижний отдел TSI (осаждение = 65%) превышала доставку обеих композиций, содержащих DMCD (50%), и контрольной композиции (40%) (Р<0,05). Гемолиз эритроцитов, инкубированных с комплексом DMCD, был выше показателей, полученных для комплекса с γ-CD. Высвобождение лекарственного средства в обеих композициях, содержащих γ-CD и DMCD, происходило быстро (более 70% в течение 5 минут), и почти все лекарственное средство выделилось в течение 30 минут.
Ван дер Куй и др. (Van der Kuy et al., Eur. J. Clin. Pharmacol. (1999 Nov), 55(9), 677-80) представили результаты исследования фармакокинетических свойств двух композиций для введения в нос, содержащих мезилат дигидроэрготамина (DHEM), с использованием коммерчески доступной композиции для введения в нос. Указанные композиции содержали также произвольно метилированный β-циклодекстрин (RAMEB). Не было обнаружено статистически значимых различий в максимальной концентрации в плазме (Cmax), времени достижения Cmax (tmax), площади под кривой зависимости концентрации в плазме от времени (AUC 0-8 часов), Frel (t = 8 часов) и Cmax/AUC (t = 8 часов) для трех композиций для введения в нос. Полученные результаты показывают, что фармакокинетические свойства препаратов для введения в нос не имеют существенных отличий от коммерчески доступного раствора для распыления в нос.
В патентах США №№ 5942251 и 5756483, выданных Меркусу, рассмотрены фармацевтические композиции для введения в нос дигидроэрготамина, апоморфина и морфина, содержащие один из вышеуказанных фармкологически активных ингредиентов в комбинации с циклодекстрином, дисахаридом, полисахаридом и/или спиртом, полученным из сахара.
В патенте США № 5955454 описан фармацевтический препарат для введения в нос, содержащий прогестаген и метилированный β-циклодекстрин со степенью замещения 0,5-3,0.
В патенте США № 5977070, выданном Пьяцца и др., описана фармацевтическая композиция для введения в нос соединений, пригодных для лечения остеопороза, которая содержит эффективное количество физиологически активного аналога РТН или PTHrp с усеченной цепью или его соли и усилитель абсорбции, выбираемый из группы, включающей диметил-β-циклодекстрин.
В патенте США № 6436902, выданном Бекстрому и др., описаны композиции и способы введения в легкие паратиреоидного гормона в виде сухого порошка, пригодного для ингаляции, причем по крайней мере 50% сухого порошка состоит из (а) частиц с диаметром до 10 микрон или (b) агломератов таких частиц. Ингалятор сухого порошка содержит препарат, состоящий из сухого порошка, включающего (i) паратиреоидный гормон (PTH) и (ii) вещество, усиливающее абсорбцию РТН в нижних отделах дыхательных путей, в котором по крайней мере 50% компонентов (i) и (ii) представляют собой частицы диаметром до 10 микрон и которое выбирают из группы, включающей соль жирной кислоты, соль желчной кислоты или ее производное, фосфолипид, циклодекстрин или его производное.
В патенте США № 6518239, выданном Куо и др., описана диспергируемая аэрозольная ком