Композиция, содержащая растительный или рыбий жир, и соединения, содержащие неокисляющиеся структурные элементы жирных кислот
Иллюстрации
Показать всеИзобретение относится к композиции, полученной из сочетания растительного масла или рыбьего жира и соединения, содержащего не подвергающиеся β-окислению аналоги жирных кислот, и к применению указанной композиции для получения фармацевтической или пищевой композиции для профилактики и/или лечения резистентности к инсулину, ожирения, диабета, жировой инфильтрации печени, гиперхолестеринемии, дислипидемии, атеросклероза, коронарной болезни сердца, тромбоза, стеноза, вторичного стеноза, инфаркта миокарда, инсульта, повышенного кровяного давления, эндотелиальной дисфункции, состояния повышенной свертываемости крови, синдрома поликистоза яичников, метаболического синдрома, злокачественной опухоли, воспалительного нарушения и пролиферативных нарушений кожи. Изобретение также относится к корму для животных, полученному из сочетания растительного масла или рыбьего жира и соединения, содержащего не подвергающиеся β-окислению аналоги жирных кислот, к применению указанного корма для улучшения состава тканей организма животного, и к продукту, полученному из указанных животных. 4 н. и 43 з.п. ф-лы, 12 табл., 4 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Было показано, что при использовании сочетания соединений, содержащих не подвергающиеся β-окислению структурные элементы жирных кислот, и растительного или рыбьего жира, достигаются неожиданные синергические эффекты. Настоящее изобретение относится к композиции, полученной комбинированием соединений, содержащих не подвергающиеся β-окислению структурные элементы жирных кислот и растительный и/или рыбий жир. Указанная композиция может использоваться для изготовления фармацевтической или пищевой композиции для профилактики и/или лечения резистентности к инсулину, ожирения, диабета, жировой инфильтрации печени, гиперхолестеринемии, дислипидемии, атеросклероза, коронарной болезни сердца, тромбоза, стеноза, вторичного стеноза, инфаркта миокарда, инсульта, повышенного кровяного давления, эндотелиальной дисфункции, состояния повышенной свертываемости крови, синдрома поликистоза яичников, метаболического синдрома, злокачественной опухоли, воспалительных нарушений и пролиферативных нарушений кожи. Указанная композиция также может использоваться в качестве дополнительного компонента в корме для животных для повседневного кормления животных в целях влиять на состав тканей их организма в общем, и, конкретно, на состав жирных кислот.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В более ранних патентных заявках авторы изобретения описали лечебное применение не подвергающихся β-окислению аналогов жирных кислот по настоящему изобретению для лечения и профилактики ожирения (NO 2000 5461), диабета (NO 2000 5462), первичного и вторичного стеноза (NO 2000 5463), злокачественной опухоли (NO 2002 5930), пролиферативных нарушений кожи (NO 2003 1080), воспалительных и аутоиммунных нарушений (NO 2003 2054).
Далее, неожиданно авторы настоящего изобретения показали, что применение сочетания соединений, содержащих не подвергающиеся β-окислению структурные элементы жирных кислот, с растительным или рыбьим жиром оказывает синергические полезные биологические эффекты. Авторы изобретения показали, что сочетание не подвергающихся β-окислению структурных элементов жирных кислот с растительным или рыбьим жиром приводит к снижению концентрации в плазме холестерина, триглицеридов и фосфолипидов и к повышению активности ацил-CoA-оксидазы жиров. Кроме того, авторы изобретения описывают, каким образом не подвергающиеся β-окислению структурные элементы жирных кислот и растительный или рыбий жир могут быть непосредственно добавлены в корм для животных. Корм является легко перевариваемым, и для него были показаны неожиданные эффекты на состав жирных кислот у животных. На основе этих неожиданных открытий ожидается, что сочетание соединений, содержащих не подвергающиеся β-окислению структурные элементы жирных кислот, и растительного или рыбьего жира будет обладать повышенным профилактическим и/или терапевтическим эффектом в отношении всех заболеваний, против которых эффективны соединения, содержащие не подвергающиеся β-окислению структурные элементы жирных кислот, по сравнению с эффектом соединений, содержащих аналоги жирных кислот, отдельно.
Липиды являются более дешевыми источниками энергии, чем белки, и фермеры предпочитают, чтобы животные получали максимальное количество энергии из липидов в рационе (с повышенным окислением липидов) и минимальное количество из белков. Также, если корм содержит большое содержание жиров, то существует тенденция к более быстрому росту животного, что, как правило, является желательным качеством. Изобретение иллюстрируется здесь в отношении разведения рыб и в отношении рыб, особенно атлантического лосося.
Таким образом, для роста мышц может использоваться увеличение количества белков. Ранее было известно, что не подвергающиеся β-окислению аналоги жирных кислот, такие как 3-тиа жирная кислота тетрадецилтиоуксусная кислота (TTA), могут приводить к повышению митохондриального и пероксисомального окисления жирных кислот в печени и мышцах у млекопитающих (Berge et al., 1989b, Aarsland et al, 1989, Asiedu et al., 1993, Skrede et al., 1993, Asiedu et al., 1995) и к снижению содержания жиров в организме у крыс (Spiegelman 1998, Madsen et al., 2002).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению препарата, содержащего сочетание:
1) растительного жира и/или рыбьего жира; и
2) одного или нескольких соединений, содержащих не подвергающиеся β-окислению структурные элементы жирных кислот, представленные
(a) общей формулой R"-COO-(CH2)2n+1-X-R', где X представляет собой атом серы, атом селена, атом кислорода, группу CH2, группу SO или группу SO2; n представляет собой число от 0 до 11; и R' представляет собой линейную или разветвленную алкильную группу, насыщенную или ненасыщенную, необязательно замещенную, где главная цепь указанного R' содержит от 13 до 23 атомов углерода и необязательно одну или несколько гетерогрупп, выбранных из группы, содержащей атом кислорода, атом серы, атом селена, атом кислорода, группу CH2, группу SO и группу SO2; и R" представляет собой атом водорода или алкильную группу, содержащую от 1 до 4 атомов углерода; и/или
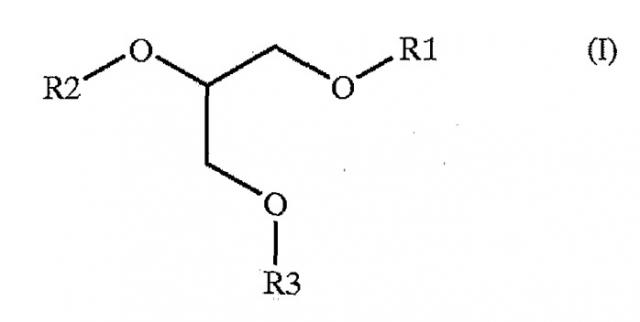
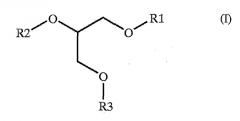
(b) общей формулой (I),
где R1, R2 и R3 представляют собой
i) атом водорода; или
ii) группу формулы CO-R, в которой R представляет собой линейную или разветвленную алкильную группу, насыщенную или ненасыщенную, необязательно замещенную, и главная цепь указанного R содержит от 1 до 25 атомов углерода; или
iii) группу формулы CO-(CH2)2n+1-X-R', где X представляет собой атом серы, атом селена, атом кислорода, группу CH2, группу SO или группу SO2; n представляет собой число от 0 до 11; и R' представляет собой линейную или разветвленную алкильную группу, насыщенную или ненасыщенную, необязательно замещенную, где главная цепь указанного R' содержит от 13 до 23 атомов углерода и необязательно одну или несколько гетерогрупп, выбранных из группы, содержащей атом кислорода, атом серы, атом селена, атом кислорода, группу СН2, группу SO и группу SO2;
iv) структурный элемент, выбранный из группы, содержащей -PO3CH2CHNH3COOH (фосфатидилсерин), PO3CH2CH2NH3 (фосфатидилэтаноламин), PO3CH2CH2N(СН3)3 (фосфатидилхолин), PO3CH2CHOHCH2OH (фосфатидилглицерин) и РО3(СНОН)6 (фосфатидилинозитол); где R1, R2 и R3 выбраны независимо из i), ii), iii) или iv), но по меньшей мере один из R1, R2 или R3 определяется как iii); и/или
(с) общей формулой (II),
где A1, A2 и A3 выбраны независимо и представляют собой атом кислорода, атом серы или группу N-R4, в которой R4 представляет собой атом водорода или линейную или разветвленную алкильную группу, насыщенную или ненасыщенную, необязательно замещенную, содержащую от 1 до 5 атомов углерода;
где R1, R2 и R3 представляют собой
i) атом водорода или линейную или разветвленную алкильную группу, насыщенную или ненасыщенную, необязательно замещенную, содержащую от 1 до 23 атомов углерода; или
ii) группу формулы CO-R, в которой R представляет собой линейную или разветвленную алкильную группу, насыщенную или ненасыщенную, необязательно замещенную, и главная цепь указанного R содержит от 1 до 25 атомов углерода; или
iii) группу формулы СО-(СН2)2n+1-X-R', где Х представляет собой атом серы, атом селена, атом кислорода, группу CH2, группу SO или группу SO2; n представляет собой число от 0 до 11; и R' представляет собой линейную или разветвленную алкильную группу, насыщенную или ненасыщенную, необязательно замещенную, где главная цепь указанного R' содержит от 13 до 23 атомов углерода и необязательно одну или несколько гетерогрупп, выбранных из группы, содержащей атом кислорода, атом серы, атом селена, атом кислорода, группу СН2, группу SO и группу SO2;
iv) структурный элемент, выбранный из группы, содержащей - PO3CH2CHNH3COOH (фосфатидилсерин), PO3CH2CH2NH3 (фосфатидилэтаноламин), PO3CH2CH2N(СН3)3 (фосфатидилхолин), PO3CH2CHOHCH2OH (фосфатидилглицерин) и РО3(СНОН)6 (фосфатидилинозитол);
где R1, R2 и R3 выбраны независимо из i), ii), iii) или iv), но по меньшей мере один из R1, R2 или R3 определяется как iii); и/или
соли, пролекарства или комплекса соединений по пп.(а)-(с).
В предпочтительном варианте осуществления соединения по этому изобретению по меньшей мере один из R1, R2 или R3 представляет собой алкил.
В предпочтительном варианте осуществления соединения по этому изобретению по меньшей мере один из R1, R2 или R3 представляет собой алкен.
В предпочтительном варианте осуществления соединения по этому изобретению по меньшей мере один из R1, R2 или R3 представляет собой алкин.
В предпочтительном варианте осуществления соединения по этому изобретению по меньшей мере один из R1, R2 или R3 представляет собой тетрадецилтиоуксусную кислоту.
В предпочтительном варианте осуществления соединения по этому изобретению по меньшей мере один из R1, R2 или R3 представляет собой тетрадецилселеноуксусную кислоту.
Предпочтительными вариантами осуществления соединений по этому изобретению являются не подвергающиеся β-окислению жирные кислоты.
В предпочтительном варианте осуществления соединения по этому изобретению X представляет собой атом серы или атом селена.
Предпочтительными вариантами осуществления соединений по этому изобретению являются тетрадецилтиоуксусная кислота (TTA), тетрадецилселеноуксусная кислота и 3-тиа-15-гептадецин.
В предпочтительном варианте осуществления соединения по этому изобретению n представляет собой 0 или 1.
В предпочтительном варианте осуществления соединения по этому изобретению указанное соединение представляет собой фосфолипид, где указанный фосфолипид выбран из группы, содержащей фосфатидилсерин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозитол, фосфатидилглицерин, дифосфатидилглицерин.
В предпочтительном варианте осуществления соединения по этому изобретению указанное соединение представляет собой триацилглицерин.
В предпочтительном варианте осуществления соединения по этому изобретению указанное соединение представляет собой диацилглицерин.
В предпочтительном варианте осуществления соединения по этому изобретению указанное соединение представляет собой моноацилглицерин.
В предпочтительном варианте осуществления соединения по этому изобретению указанное соединение представляет собой производное фосфатидилхолина (PC) 1,2-дитетрадецилтиоацетоил-sn-глицеро-3-фосфохолин.
В предпочтительном варианте осуществления соединения по этому изобретению указанное соединение представляет собой производное фосфатидилэтаноламина (PE) 1,2-дитетрадецилтиоацетоил-sn-глицеро-3-фосфоэтаноламин.
Предпочтительными вариантами осуществления соединений по этому изобретению являются моно-, ди- или триацилглицериды.
Предпочтительными вариантами осуществления соединений по этому изобретению являются триацилглицериды, содержащие тетрадецилтиоуксусную кислоту (TTA).
В предпочтительном варианте осуществления соединения формулы (II) каждый из A1 и A3 представляет собой атом кислорода, в то время как A2 представляет собой атом серы или группу N-R4, в которой R4 представляет собой атом водорода или линейную или разветвленную алкильную группу, насыщенную или ненасыщенную, необязательно замещенную, содержащую от 1 до 5 атомов углерода.
Соединения по этому изобретению являются аналогами природных соединений и по существу распознаются теми же системами, которые перерабатывают природные соединения, включая ферменты, которые осуществляют β-окисление и в некоторых случаях ω-окисление природных длинноцепочечных жирных кислот. Аналоги отличаются от их природных эквивалентов тем, что они не могут полностью окисляться таким способом.
Соединения по этому изобретению могут представлять собой не подвергающиеся β-окислению аналоги жирных кислот, как представлено формулой R"CCO-(CH2)2n+1-X-R'. Однако указанные соединения также могут представлять собой более сложные структуры, полученные из одного или нескольких из указанных не подвергающихся β-окислению аналогов жирных кислот, как представлено общими формулами (I) или (II). Эти соединения представляет собой аналоги природных моно-, ди- и триацилглицеринов или фосфолипидов, включая фосфатидилсерин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозитол, фосфатидилглицерин и дифосфатидилглицерин. Указанные соединения также могут содержать замену в остове глицерина, как представлено в формуле (II). Указанного замещения кислорода(ов) достигают замещением кислорода(ов) группой, содержащей серу или азот. Это может блокировать гидролиз перед захватом в тонком кишечнике, таким образом, повышая биодоступность соединений.
Указанные выше комплексные структуры, полученные из одного или нескольких из указанных не подвергающихся β-окислению структурных элементов жирных кислот, оказывают свой эффект вследствие того, что они содержат аналоги жирных кислот, которые не способны к полному β-окислению. Указанные комплексные структуры могут оказывать эффект в качестве целых структур и в качестве образованных вследствие природной деградации продуктов, содержащих аналоги жирных кислот. Вследствие того, что соединения не способны к полному β-окислению, они накапливаются и это запускает повышение β-окисления природных жирных кислот. Множество эффектов соединений по этому изобретению являются следствием такого повышения β-окисления.
В процессе β-окисления ферментативно окисленная жирная кислота расщепляется между атомами углерода 2 и 3 (если считать от карбоксильного конца жирной кислоты), что приводит к удалению двух атомов углерода с каждой стороны участка окисления в виде уксусной кислоты. Эта стадия затем повторяется с только что укороченной на два атома углерода жирной кислотой, и снова повторяется до тех пор, пока жирная кислота не окислится полностью. β-окисление является обычным путем, которым in vivo осуществляется катаболизм большинства жирных кислот. Блокирования β-окисления соединениями по этому изобретению достигают встраиванием не подвергающейся окислению группы в положение X формулы по настоящему изобретению. Вследствие того, что механизм β-окисления хорошо известен, X определяется как S, O, SO, SO2, CH2 или Se. Специалист в данной области может допустить, без изобретательского уровня, что эти соединения все будут блокировать β-окисление аналогичным образом.
Кроме того, соединения могут содержать более одного блока, т.е. в дополнение к X, R' может необязательно содержать одну или несколько гетерогрупп, выбранных из группы, содержащей атом кислорода, атом серы, атом селена, атом кислорода, группу CH2, группу SO и группу SO2. В качестве примера, для того, чтобы вызвать изменения в деградации жирной кислоты и, таким образом, получить модулированный эффект, в качестве X можно встроить два или три атома серы. Большое количество атомов серы в некоторой степени также приводит к изменению полярности и стабильности. С фармакологической точки зрения для избежания или предотвращения проблем, связанных с устойчивостью, как правило, более желательно иметь возможность получить набор соединений, чем только одно соединение.
В дополнение к структуре X, его положение также является предметом обсуждения. Расстояние от X до карбоксильного конца жирной кислоты определяется тем, какое количество групп CH2 находится между X и карбоксильным концом жирной кислоты, которое определятся как (CH2)2n+1, где n представляет собой число от 0 до 11. Таким образом, получается нечетное число групп CH2, то есть положение X относительно карбоксильной группы такое, при котором X в итоге блокирует β-окисление. Диапазон значений n выбран так, чтобы включать все варианты аналога жирных кислот, который обладает требуемым биологическим эффектом. Поскольку теоретически β-окисление может действовать на молекулы неограниченной длины, n может представлять собой бесконечную величину, однако на практике это не так. Длина жирных кислот, которые в норме подвергаются β-окислению, как правило, составляет от 14 до 24 атомов углерода, и такая длина, таким образом, является наиболее оптимальной для осуществления ферментативного β-окисления. Таким образом, диапазоны n и R' приведены так, чтобы аналоги жирных кислот охватывали этот диапазон. (Аналогично для того, чтобы получить аналоги природных соединений параметр ii) формул (I) и (II) определяет R, как обладающий от 1 до 25 групп углерода, и параметр i) формулы (II) определяет алкильную группу, как содержащую от 1 до 23 атомов углерода). Общее количество атомов углерода в остове жирной кислоты предпочтительно составляет между 8 и 30, наиболее предпочтительно между 12 и 26. Этот диапазон размеров также является желательным для захвата аналогов жирных кислот по настоящему изобретению и их транспорта через клеточные мембраны.
Несмотря на то, что аналоги жирных кислот с нечетным положением блокатора β-окисления X, удаленным от карбоксильного конца, блокируют окисление, величина их биологического эффекта может варьировать. Это происходит вследствие различия времени биологической деградации для различных соединений. Авторы изобретения провели эксперименты с целью показать эффект дальнейшего удаления X от карбоксильного конца жирной кислоты. В этих экспериментах активность (нмоль/мин/мг/белок) митохондриального β-окисления аналогов жирных кислот в печени измеряли при наличии серы в 3, 5 и 7 положениях относительно карбоксильного конца. Активность составляла 0,81 для серы в 3 положении, 0,61 для серы в 5 положении, 0,58 для серы в 7 положении и 0,47 для пальмитиновой кислоты, не блокирующего β-окисление контроля. Как ожидалось, это показывает, что β-окисление действительно блокируется аналогами жирных кислот с различным положением блока, и что их эффект снижается при дальнейшем удалении положения блока от карбоксильного конца, вследствие того, что требуется больше времени для достижения блока при β-окислении, так что к тому времени деградируется большее количество жирных кислот. Однако, поскольку отклонение является значительным при переходе от 3 к 5 положению, но небольшим при переходе от 5 к 7 положению, то обоснованно можно предположить, что при продвижении вдоль цепи это отклонение будет далее уменьшаться, и, таким образом, что к тому моменту, когда совсем не будет наблюдаться никакого эффекта (по сравнению с контролем), положение безусловно окажется значительно удаленным.
Таким образом, обоснованным является включение в качестве соединений по настоящему изобретению аналогов жирных кислот и других соединений, представленных общими формулами (I) и (II), (которые содержат указанный аналог(и) жирной кислоты), которые блокируют β-окисление на различных расстояниях от карбоксильного конца аналогов, как соединений по настоящему изобретению, действительно блокирующих β-окисление, даже если эффект может быть модулированным. Это модулирование в конечном итоге может различаться в истощающих условиях; в различных тканях, при истощающих дозировках, и при изменении аналога жирных кислот, так чтобы он не так легко распадался, как описано далее. Таким образом, обоснованным является включение в формулу всех расстояний блокатора β-окисления от карбоксильного конца аналога жирной кислоты, которые являются биологически пригодными.
Несмотря на то, что аналоги жирных кислот, как описано, с блоком в положении X не могут подвергаться β-окислению, они тем не менее могут подвергаться ω-окислению. Это значительно менее универсальный и более медленный биологический процесс, при котором происходит окисление жирных кислот не с карбоксильного конца, а предпочтительнее с метильной/гидрофобной концевой группы, здесь обозначаемой R'. При этом каскаде атом углерода с ω-конца жирной кислоты гидроксилируется членом семейства ферментов цитохрома P450. Затем эта гидроксилированная жирная кислота превращается алкогольдегидрогеназой в альдегид, и затем этот альдегид превращается альдегиддегидрогеназой в карбоксильную группу. В результате, конечным продуктом каскада является дикарбоновая жирная кислота, которая может далее деградироваться ω-окислением с ω-конца.
Полагают, что ω-окисление является главным путем деградации аналогов жирных кислот, как описано, с блоком в положении X. Таким образом, проводили эксперименты, где R' изменяли для блокирования ω-окисления введением тройной связи в метильный конец аналога жирной кислоты. Результатом этого оказался аналог жирной кислоты 3-тиа-15-гептадецин, для которого при тестировании были показаны следующие ожидаемые результаты: существенно увеличенное время деградации in vivo. Это является важным для применения аналогов жирных кислот в фармацевтическом препарате, поскольку это может усиливать эффекты подвергающихся β-окислению аналогов жирных кислот дальнейшим снижением их распада.
С другой стороны, как в случае блокирования β-окисления, общепринятой практикой является выявление других аналогов жирных кислот, которые будут блокировать ω-окисление точно таким же способом, на основе знаний о том, как происходит ω-окисление. Например, двойная связь будет обладать таким же эффектом, как и тройная связь, и, таким образом, в определение метильной/гидрофобной концевой группы молекулы, обозначаемой здесь R', включается, что она может быть насыщенной или ненасыщенной. Разветвление также может приводить к блокированию окисления, так что группа R' определяется как линейная или разветвленная.
В целях блокировать ω-окисление встраиванием заместителя в R', указанный R' может быть замещен в одном или нескольких положениях гетерогруппой, выбранной из группы, содержащей атом кислорода, атом серы, атом селена, атом кислорода, группу CH2, SO и группу SO2. R' также может быть замещен одним или несколькими соединениями, выбранными из группы, содержащей фторид, хлорид, гидрокси, C1-С4алкокси, C1-С4алкилтио, C2-С5ацилокси или C1-С4алкил.
Таким образом, соединения в соответствии с настоящим изобретением представляют собой либо жирные кислоты, аналогичные природным жирным кислотам, которые не способны подвергаться β-окислению, либо природные липиды, содержащие указанные аналоги жирных кислот. Было показано, что in vivo аналоги жирных кислот строго предпочтительно встраиваются в фосфолипиды. В некоторых случаях действительно является предпочтительным имитировать свойства и встраивать аналоги жирных кислот в природные липиды, такие как моно-, ди- и триглицериды и фосфолипиды. Это приводит к изменению всасывания соединений (при сравнении жирных кислот с жирными кислотами, встраиваемыми в более крупные липидные структуры) и может повышать биодоступность или стабильность.
Например, можно получать комплекс встраиванием жирной кислоты(кислот), которая не способна подвергаться β-окислению, в триацилглицерин. Такие соединения охватываются формулами (I) и (II). При пероральном приеме такого триацилглицерина, например, в продукте корма для животных, он, вероятно, будет транспортироваться подобно любому триацилглицерину из тонкого кишечника в хиломикронах и из печени в липопротеинах крови для запасания в жировой ткани или использования в мышцах, сердце или печени, с гидролизом триацилглицерина до глицерина и 3 свободных жирных кислот. Свободные жирные кислоты на данном этапе окажутся исходным соединением по настоящему изобретению, и не будут более представлять собой комплекс.
Другие возможные глицерофосфолипидные производные жирных кислот по настоящему изобретению включают в себя, но не ограничиваются ими, фосфатидилхолины, фосфатидилэтаноламины, фосфатидилинозитолы, фосфатидилсерины и фосфатидилглицерины.
Другим способом этерификации жирных кислот, выявленным in vivo, который легко можно использовать для получения комплекса с соединением по настоящему изобретению, может являться получение спирта или полиспирта, соответствующего жирной кислоте, например, можно получить производное сфинголипида, такое как церамид или сфингомиелин, получением соответствующего аминоспирта. Подобно глицерофосфолипидным комплексам, такие комплексы могут быть в высокой степени нерастворимыми в воде и менее гидрофильными. Эти типы гидрофобных комплексов по настоящему изобретению будут легче проходить через биологические мембраны.
Другими возможными полярными комплексами по настоящему изобретению могут быть, но не ограничиваться ими, лизофосфолипиды, фосфатидиновая кислота, алкоксисоединения, глицероуглеводы, ганглиозиды и цереброзиды.
Несмотря на то, что могут существовать большие структурные различия между различными соединениями, содержащими не подвергающиеся β-окислению структурные элементы жирных кислот по настоящему изобретению, можно ожидать, что биологические функции всех таких соединений являются очень сходными вследствие того, что все они блокируют β-окисление сходным образом. Такая неспособность аналогов жирных кислот к β-окислению (и в некоторых случаях, к ω-окислению) приводит к накоплению аналогов в митохондриях, которые запускают β-окисление in vivo природных жирных кислот, которое, в свою очередь, приводит к множеству биологических эффектов соединений, содержащих аналоги жирных кислот по настоящему изобретению. (Berge RK et al. (2002) Curr Opin Lipidol 13(3):295-304).
Каскад β-окисления жирных кислот представляет собой главный путь метаболизма жиров. Начальная и скорость-лимитирующая реакция осуществляются ацил-CoA-оксидазой в пероксисомах печени. Ацил-CoA-оксидаза катализирует дегидрогенизацию ацил-CoA-тиоэфиров до соответствующего транс-2-еноил-CoA. Аналог жирной кислоты формулы (I); тетрадецилтиоуксусную кислоту (TTA), авторы изобретения ранее использовали для анализа различных биологических эффектов жирных кислот. Для настоящего изобретения анализировали ее действие на ацил-CoA-оксидазу, а также эффект различных растительных жиров и рыбьего жира, отдельно или в сочетании. Было показано, что TTA отдельно вызывает значительное повышение ферментативной активности по сравнению с отрицательным контролем. Растительный и рыбий жиры демонстрировали очень небольшое повышение активности ацил-CoA-оксидазы по сравнению с отрицательным контролем. При совместном введении подсолнечное масло не повышало активность TTA. Поэтому можно ожидать, что активность ацил-CoA-оксидазы при введении TTA с жирами будет оставаться такой же, что и без добавления жиров. Было показано, что рыбий жир и оливковое масло вызывают незначительное усиление повышения посредством TTA активности ацил-CoA-оксидазы. Соевое масло без TTA обладало незначительными эффектами на активность ацил-CoA-оксидазы, но в сочетании с TTA оно вызывало 60% повышение, по сравнению с эффектами TTA отдельно. Это усиление TTA в качестве активатора ацил-CoA-оксидазы соевым маслом оказалось совершенно неожиданным.
Для настоящего изобретения, также анализировали действие не подвергающихся β-окислению структурных элементов жирных кислот на уровень фосфолипидов, а также эффект различных растительных масел и рыбьего жира, отдельно или в сочетании с TTA. Подсолнечное масло и рыбий жир снижали уровень фосфолипидов, и усиливали способность TTA снижать уровень фосфолипидов с увеличением способности в отношении снижения уровня фосфолипидов, по сравнению со способностью TTA или жиров отдельно. Соевое масло и оливковое масло, в действительности, повышали уровень фосфолипидов, однако, неожиданно эти масла значительно усиливали способность TTA снижать уровень фосфолипидов. Эффект соевого масла является особенно примечательным, самостоятельно оно повышало уровень фосфолипидов на 10% по сравнению с контролем, однако при введении совместно с TTA оно снижало уровень фосфолипидов дополнительно на 40% по сравнению с TTA отдельно.
Для настоящего изобретения также анализировали эффект не подвергающихся β-окислению структурных элементов жирных кислот, а также эффект различных растительных масел и рыбьего жира, отдельно или в сочетании с TTA, на уровень холестерина в плазме. TTA снижала уровень холестерина в большей степени, чем любое из растительных масел или рыбий жир отдельно. Подсолнечное масло или рыбий жир без TTA в некоторой степени снижали уровень холестерина, совместно с TTA, уровень холестерина снижался в большей степени, чем TTA отдельно. Оливковое и соевое масло, в действительности, самостоятельно повышали уровень холестерина, однако, совершенно неожиданно, при добавлении к TTA эти масла повышали способность TTA снижать уровень холестерина. Этот эффект в отношении усиления TTA, был наибольшим у соевого масла, которое снижало уровень холестерина на 60% по сравнению TTA отдельно.
Было показано, что TTA снижает уровень триглицерина в плазме вследствие увеличения количества митохондрий и стимуляции митохондриального β-окисления обычных насыщенных и ненасыщенных жирных кислот до кетоновых тел (Froyland L et al. (1997) J Lipid Res 38:1851-1858). Для настоящего изобретения было выявлено, что такой эффект дополнительно неожиданно усиливается добавлением растительного или рыбьего жира. Оливковое, подсолнечное масло и рыбий жир самостоятельно снижали уровень триацилглицерина, подсолнечное масло и рыбий жир снижали даже в большей степени, чем TTA отдельно, и дополнительно усиливали эффект TTA в отношении снижения уровня холестерина в большей степени, чем наблюдалось как для масел, так и для TTA по отдельности. Для соевого масла были показаны наиболее яркие результаты; самостоятельно оно, в действительности, повышало уровень холестерина на 15% по сравнению с контролем, однако совершенно неожиданно оно усиливало эффект TTA в отношении снижения уровня холестерина на 130%.
Для настоящего изобретения анализировали эффект кормления атлантического лосося кормом, содержащим не подвергающиеся β-окислению аналоги жирных кислот, масло, обычные компоненты корма и необязательно ферментированный белковый материал сои. В примере 2.1, корм для рыб состоял из покрытых обычных кормовых гранул с рыбьим жиром, включающих TTA. Такой корм затем использовали в примере 2.2 в качестве питания для атлантического лосося, и наличие TTA оказывало благоприятные эффекты на полученный таким образом корм для рыб по сравнению с эквивалентным кормом без TTA (примеры 2.3 и 2.4).
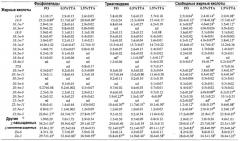
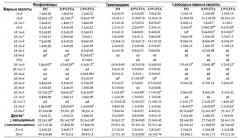
Обычные используемые кормовые гранулы содержат главным образом рыбную кормовую муку, немного пшеницы и витаминные и минеральные добавки. Масло, используемое для покрытия гранул, также было морского происхождения, из мойвы, и содержало различные количества смешанной с ним TTA. В таблице 1 описаны состав и химическая композиция рационов. Источник белка (рыбная мука) или углеводов (пшеница) сам по себе не очень важен, важной частью является то, что корм представляет собой обычный корм, хорошо подходящий для анализируемых видов (в этом примере атлантический лосось), для которого при добавлении TTA были показаны благоприятные эффекты.
Несмотря на то, что источник белка сам по себе не является важным, в находящейся на рассмотрении заявке (№ 20043093) было показано, что TTA, введенная совместно с белком обладает дополнительным полезным эффектом по сравнению с эффектом TTA отдельно. Выбор источника жиров для рациона может являться более важным, поскольку было показано здесь, что TTA оказывает неожиданные эффекты совместно с маслами, особенно морского происхождения. Таким образом, тот факт, что этот обычный корм является кормом с высоким содержанием жиров и белков и с низким содержанием углеводов, вероятно, усиливает полезные эффекты TTA по сравнению с эффектами TTA, вводимой отдельно, или совместно с питанием с большим количеством углеводов.
В примере 2.4 определяли эффекты конкретного белкового материала, ферментированного белкового материала сои. Ферментированный белковый материал сои получают в результате ферментации бобов сои. Он содержит модифицированные и немодифицированные белки сои и изофлавоны, а также другие составляющие сои. В предпочтительном варианте осуществления по этому изобретению используется ферментированный белковый материал сои Gendaxin®.
В таблице 2 описан состав жирных кислот рационов. В составе жирных кислот рационов существовали совсем незначительные различия (все содержали приблизительно 100% рыбий жир), процентное содержание n-3 жирных кислот (FA) было практически одинаковым. Рацион, в который была добавлена TTA, при этом приводил к значительным изменениям процентного содержания в составе n-3 жирных кислот фосфолипидов (PL), триацилглицеринов (TAG) и свободных жирных кислот (FFA) в жабрах, сердце и в печени атлантического лосося. Введение TTA в течение 8 недель также приводило к снижению процентного содержания насыщенных FA практически во всех липидных фракциях. Процентное содержание n-3 FA, особенно DHA, повышалось в жабрах и сердце, как можно видеть в примере 2.3.
Атлантический лосось, которого кормили рационом, содержащим TTA, рос медленнее, чем рыбы, которых кормили контрольным рационом. Уровень липидов в организме рыб, которых кормили рационом с добавлением TTA, был значительно более низким, чем уровень у рыб, которых кормили контрольным рационом.
Существуют благоприятные эффекты на здоровье самих рыб, которых кормили кормом по этому изобретению. У старых рыб может развиваться склероз артерий и приводить к проблемам со здоровьем, как и у человека, и снижение липидов оказывает благоприятный эффект в этом отношении.
В общем, полагают, что постные сорта мяса, полученные способом по настоящему изобретению, являются полезными у большинства видов животных, которых разводят для потребления. Таким образом, эффект снижения общего уровня липидов сам по себе является преимущественным. Кроме того, конкретные изменения в составе жирных кислот являются особенно положительными. Общепризнанным является то, что употребление меньшего количества насыщенных жирных кислот полезно для здоровья, и повышенное потребление n-3 связано с пользой для здоровья всего организма, от снижения вероятности заболеваний сердца до противовоспалительных эффектов и даже для повышения интеллекта у детей.
Другие животные продукты, полученные из животных, которых кормили кормом по настоящему изобретению, также могут обладать полезными эффектами. В качестве примера рыбий жир, полученный таким образом, будет обладать преимущественным пищевым составом по сравнению с маслом из рыбы, которую кормили коммерческим рационом. Другие продукты, такие как шкура рыбы, также могут обладать положительными эффектами, наблюдаемыми при улучшении состава тканей всего организма.
Уровень жирных кислот в крови в норме определяется относительными скоростями расщепления жиров и этерификации в жировой ткани и потреблением жирных кислот в мышцах. В мышцах жирные кислоты ингибируют потребление глюкозы и окисление. Повышенный уровень жирных кислот и триацилглицерина в крови и мышцах, таким образом, коррелирует с ожирением и резистентностью к инсулину, а также со снижением способности метаболизировать глюкозу (Olefsky JM (2000) J Clin Invest 106:467-472; Guerre-Millo M et al. (2000) J Biol Chem 275:16638-16642). Стимуляцией окисления жирных кислот и снижением концентрации жирных кислот в плазме не подвергающимися β-окислению структурными элементами жирных кислот и растительным и/или рыбьим жиром можно, таким образом предотвращать и лечить резистентность к инсулину и вызванные ей заболеваний (Shulman GI (2000) J Clin Invest 106(2):171-176). Было выявлено, что TTA полностью предотвращает вызванную рационом с высоким содержанием жиров резистентность к инсулину и ожирение, и снижает ожирение, гипергликемию и чувствительность к инсулину у крыс с ожирением (Madsen M et al. (2002) J Lipid Res 43 (5): 742-50). Вследствие неожиданных синергических результатов, обнаруженных авторами изобретения при использовании как TTA, так и растительного и рыбьего жира, без подтверждения какой-либо объясняющей полученные результаты конкретной теорией, авторы настоящего изобретения в настоящее время ожидают, что такое сочетание окажется даже более эффективным при лечении этих состояний. Авторы настоящего изобретения также ожидают, что эффект TTA будет усиливаться рыбьим и растительным жиром, и также необязательно маслом, при лечении сходных заболеваний и