Замещенные в индольном ядре производные трииндолилметанов, способ их получения и их антибактериальная и противогрибковая активность
Иллюстрации
Показать всеИзобретение относится к новым производным трииндолилметанов общей формулы I или II, обладающим антибактериальным и противогрибковым действием. Соединения могут найти применение при бактериальной или грибковой инфекции и для защиты разнообразных изделий от вредного воздействия на них бактерий или грибков, в частности как антисептики или для дезинфекции. В общих формулах I или II
где R1; R7; R13 представляют собой независимо водород, алкил, замещенный алкил, R2; R8; R14 представляют собой независимо водород, алкил, замещенный алкил , -ОН, -OR, С1-С4ацил, где R представляет собой алкил или замещенный алкил , R3-R6; R9-R12; R15-R18 представляют собой независимо водород, алкил, замещенный алкил , -ОН, -OR, С1-С4ацил, где R представляет собой алкил или замещенный алкил, Y- представляет собой анион фармакологически приемлемой органической или неорганической кислоты; R19 представляет собой водород, алкил, замещенный алкил ацил, ион металла. Изобретение также относится к способам получения соединений формулы I, II, фармацевтической композиции и применению. Изобретение относится к способу получения трииндолилметана формулы III мононезамещенного в группе метана, являющегося промежуточным соединением. 14 н. и 3 з.п. ф-лы, 4 табл.
Реферат
Изобретение относится к новым производным трииндолилметанов, замещенных в индольном ядре, соответствующим общим формулам I или II, обладающим антибактериальным и противогрибковым действием, а также фармацевтической композиции на их основе и способам получения и ингибирования. Создание новых лекарственных соединений и препаратов на их основе, воздействующих на грамположительные и грамотрицательные патогены остается чрезвычайно актуальным в связи с бурным развитием бактериальной резистентности к существующим лекарственным средствам. В последние годы из крови больных выделяют штаммы болезнетворных бактерий, устойчивых не только к бета-лактамам 3-го поколения, но также к фторхинолонам, аминогликозидам, ванкомицину. Не менее актуален поиск новых соединений с противогрибковой активностью, поскольку применение макролидных лактонов типа амфотерицина В осложняется высокой токсичностью этих соединений. Кроме того, к широко применяемым в настоящее время противогрибковым соединениям - производным гетероциклов - быстро развивается лекарственная устойчивость. Особенно быстро и опасно происходит развитие и распространение бактерий и грибков с лекарственной устойчивостью в больничных условиях, и лечение больничных инфекций, резистентных к существующим лекарственным средствам, требует создания новых препаратов с новым механизмом действия.
Известно производное трииндолилметана, выделяемое в процессе роста генно-модифицированным штаммом Е.Coli с искусственно встроенным в ее хромосому 24546-членным метагеномным фрагментом, сконструированным из ДНК, экстрагированной из бактерий почвы. Это производное, соответствующее формуле I, где R1-R18=H, получило название турбомицина А. Однако соединение обладает невысокой антибактериальной активностью в отношении грамотрицательных и грамположительных микроорганизмов in vitro [Gillespie D.E.; Brady S.F.; Bettermann and others. Applied and Environmental Microbiology; Sept. 2002, p.4301-4306].
Наиболее близкие соединения к соединениям настоящего изобретения описаны в заявке на патент США 20010047029. Соединения являются производными три(индол-3-ил)метилия, замещенными в бензольных ядрах, и обладают невысокой антибактериальной и противогрибковой активностью. Все известные соединения, описанные в этом патенте, не содержат заместителей при атомах азота индольных ядер. Соединения настоящего изобретения формулы I или II (соли трииндолилметилия, а также трииндолилкарбинолы) в отличие от известных соединений имеют как минимум одно или более индольных ядер с заместителем при атоме азота индольного цикла. Введение такого заместителя позволяет добиться антибактериальной и противогрибковой активности, значительно превосходящей описанные аналоги.
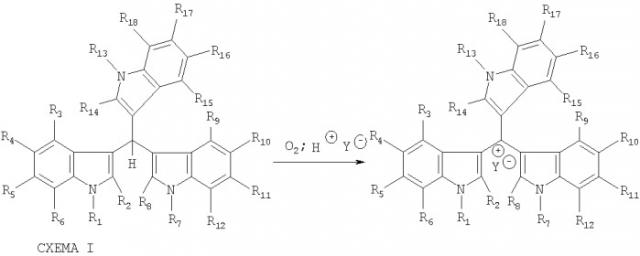
Известны способы получения производных трииндолилметанов (солей трииндолилметилия) окислением соответствующих индолсодержащих трииндолилметанов различными окислителями, такими как дициандихлорхинон или хлоранил [Gillespie D.E.; Brady S.F.; Bettermann and others. Applied and Environmental Microbiology; sept. 2002, p.4301-4306; Budzikiwicz H., H.Eckau and M.Ehrenberg, Tet. Lett., 1972, 36, p.3807-3810]; тритил перхлоратом [Stupnikova, Т.V.; Rybenko, L.A.; Skorobogatova Z.M.; Sheinkman A.K.Khim. Geterotsikl. Soedin. 1978, 416]; FeCl3 [Muller J.; Pindur, U.Arch. Pharm. 1984, 317, 555-561] и ряд др. Предложенный согласно настоящему изобретению способ окисления трииндолилметанов, приводящий к солям трииндолилметилия, позволяет удешевить и упростить процедуру окисления, выделения и очистки последних, избежать использования дорогостоящих и токсичных реагентов, загрязняющих окружающую среду.
Известны способы получения исходных трииндолилметанов конденсацией соответствующих индолов с индолальдегидами в условиях катализа трифлатами лантаноидов [Chen Y.С.; Yu L.; Wang P.G. Tetrahedron Letters 1995, 26, 4467], катализа слабыми кислотами, например уксусной кислотой [J.Bergmann, J.Heterocyclic Chem., 1971, 8,329; Budzikiwicz H., H.Eckau, and M.Ehrenberg, Tet. Lett., 1972, 36, p.3807-3810; Jun Li, Bing Guang and others Heterocycles, 2003, Vol 60, No 6; 1307-1315], слабокислой глины Монтмориллонита К-10 [M. Chakrabarty and S. Sarkar, Tet. Lett, 2002,43, стр.1351-1353] и рядом др. Согласно настоящему изобретению способ получения исходных трииндолилметанов, которые затем применяются для получения заявленных соединений изобретения, не имеет аналогов и в отличие от известных способов позволяет получать продукты с высоким выходом, быстро нарабатывать библиотеки соединений для скрининга и получать в некоторых случаях несимметричные трииндолилметаны, труднодоступные другими методами.
Согласно настоящему изобретению предлагаются соединения, соответствующие формулам I или II
где R1; R7; R13 представляют собой независимо водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил. При этом обязательным условием является то, что как минимум один из заместителей R1; R7; R13 должен отличаться от Н.
R1; R7; R14 представляют собой независимо водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил; галоген, -ОН, -OR, =О; -СООН, -COOR; -NH2, -N(R)2; -N+(R)3, -CN, , -SO2R, -SOR,-CRO, ацил, карбамоил, тиокарбамоил, R; где R может быть одинаковыми или разными заместителями, выбираемыми из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил. Любой из заместителей может в свою очередь быть замещенным. Положение и количество любых заместителей могут варьироваться R3-R6; R9-R12; R15-R18 - представляют собой независимо водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил; галоген, -ОН, -OR, -СООН, -COOR; -NO2, -NO, -NH2, -NHRa; -N(R)2; -N+R3, -CN,, -SO2R, -SO2N(R)2; -SOR,-CRO, -O-Sug, -N-Sug, ацил, карбамоил, тиокарбамоил, R; где R может быть одинаковыми или разными заместителями, выбираемыми из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил. Sug представляет собой любой циклический или ациклический углевод. Любой из заместителей может в свою очередь быть замещенным. Положение и количество любых заместителей могут варьироваться;
Y- представляет собой анион любой фармакологически приемлемой органической или неорганической кислоты;
R19. - представляет собой водород, алкил, ацил, ион металла.
Вышеуказанные соединения формулы I или II включают в себя также любые стереоизомеры - энантиомеры или диастереомеры (индивидуальные, рацематы, обогащенные одной из форм и т.д.) в случае, если существование таковых возможно. Вышеуказанные соединения общей формулы I или II включают в себя любые агрегатные состояния указанных соединений - в том числе аморфные формы, кристаллические формы, сольваты.
Вышеуказанные соединения общей формулы I или II включают в себя также любые фармакологически приемлемые солевые формы перечисленного, в случае если существование таковых возможно.
Кроме того, изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения соответствующего формуле I или II в смеси по меньшей мере с одним приемлемым носителем.
Термином «алкил» обозначается прямая или разветвленная, замещенная или незамещенная, насыщенная или ненасыщенная C1-C24 углеводородная цепь, содержащая или не содержащая подходящие гетероатомы. Количество и положение ненасыщенных связей и гетероатомов могут варьироваться. Гетероатомы независимо могут выбираться из группы, состоящей из атомов азота, кислорода, серы, фосфора. Характер, количество и положение заместителей могут варьироваться. Заместители могут независимо выбираться из группы, состоящей из -ОН, -OR, -COOH, -COOR; -NO2, -NO, -NH2, -NHRa; -N(Ra)2; -N+(Ra)3, -CN, -SO2Ra, -SORa,-CRaO, -О-Sug,-N-Sug, ацил, карбамоил, тиокарбамоил, галоген, Ra; где Ra может быть одинаковыми или разными заместителями, выбираемыми из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил. Sug представляет собой любой циклический или ациклический углевод. Любой из заместителей может в свою очередь быть замещенным. Положение и количество любых заместителей могут варьироваться.
Термином «циклоалкил» обозначается насыщенная или ненасыщенная, замещенная или незамещенная моноциклическая, бициклическая, трициклическая или макроциклическая С3-С-24 углеводородная цепь. Характер, количество и положение заместителей могут варьироваться. Заместители могут независимо выбираться из группы, состоящей из -ОН, -OR, -COOH, -COOR; -NO2, -NO, -NH2, -NHRa; -N(Ra)2;-N+R3, -CN, -SO2R, -SOR,-CRO, -О-Sug,-N-Sug, ацил, карбамоил, тиокарбамоил, галоген, R; где R может быть одинаковыми или разными заместителями, выбираемыми из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил. Sug представляет собой любой циклический или ациклический углевод, Любой из заместителей может в свою очередь быть замещенным. Положение и количество любых заместителей могут варьироваться.
Примерами типичных циклоалкилов могут служить циклопропил, циклобутилциклопентенил, циклопентил, циклогексил, циклогексенил, циклогептил, циклододецил, бициклопентил, бициклогексил, бициклогептил, адамантил, борнил, норборнил и другие подобные.
Термином «гетероциклоалкил» обозначается насыщенная или ненасыщенная, замещенная или незамещенная моноциклическая, бициклическая, трициклическая или макроциклическая C2-О-24 углеводородная цепь, содержащая подходящий гетероатом, выбираемый из S, О, N или В. Характер, количество и положение заместителей могут варьироваться. Заместители могут независимо выбираться из группы, состоящей из -ОН, -OR, -COOH, -COOR; -NO2, -NO, -NH2, -NHRa; -N(R)2; -N+R3, -CN, -SO2R, -SOR,-CRO, -О-Sug,-N-Sug, ацил, карбамоил, тиокарбамоил, галоген, R; где R может быть одинаковыми или разными заместителями, выбираемыми из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил. Sug представляет собой любой циклический или ациклический углевод. Любой из заместителей может в свою очередь быть замещенным. Положение и количество любых заместителей могут варьироваться.
Примерами типичных гетероциклоалкилов могут служить пиперазинил, пиперидинил, морфолинил, хинуклидинил, краун эфиры, азакраун эфиры и другие подобные.
Термином «арил» обозначается стабильное, насыщенное или ненасыщенное, замещенное или незамещенное, С6 моноциклическое кольцо; стабильное, насыщенное или ненасыщенное, замещенное или не замещенное С12-С14 сочлененное бициклическое кольцо; стабильное, насыщенное или ненасыщенное, замещенное или не замещенное C12-C14 сочлененное трициклическое кольцо; стабильное, насыщенное или ненасыщенное, замещенное или не замещенное C14-C16 сочлененное тетрациклическое кольцо. Предпочтительно арил замещен одним или более остатков. Характер, количество и положение заместителей могут варьироваться. Заместители могут независимо выбираться из группы, состоящей из -ОН, -OR, -COOH, -COOR; -NO2, -NO, -NH2, -NHRa; -N(R)2; -N+R3, -CN,, -SO2R, -SOR,-CRO, -О-Sug,-N-Sug, ацил, карбамоил, тиокарбамоил, галоген, R; где R может быть одинаковыми или разными заместителями, выбираемыми из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил. Sug представляет собой любой циклический или ациклический углевод. Любой из заместителей может в свою очередь быть замещенным. Положение и количество любых заместителей могут варьироваться.
Примерами типичных арилов могут служить фенил, бифенил, нафтил, флуоренил и другие подобные.
Термином «гетероарил» обозначается стабильное, насыщенное или ненасыщенное, замещенное или незамещенное C4-С7 органическое моноциклическое кольцо, имеющее гетероатом, выбираемый из S, О и N; стабильное, насыщенное или ненасыщенное, замещенное или не замещенное С9-С10 сочлененное бициклическое кольцо, имеющее один или более гетероатомов, выбираемых из S, О и N; стабильное, насыщенное или ненасыщенное, замещенное или не замещенное C12-C14 сочлененное трициклическое кольцо, имеющее один или более гетероатомов, выбираемых из S, О и N. Атомы азота и серы в этих кольцах могут быть окислены, атом азота может быть четвертичным. Предпочтительно гетероарил замещен одним или более остатков. Характер, количество и положение заместителей могут варьироваться. Заместители могут независимо выбираться из группы, состоящей из -ОН, -OR, -COOH, -COOR; -NO2, -NO, -NH2, -NHRa; -N(R)2; N+R3, -CN, -SO2R, -SOR, -CRO, -O-Sug.-N-Sug, ацил, карбамоил, тиокарбамоил, галоген, R; где R может быть одинаковыми или разными заместителями, выбираемыми из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил. Sug представляет собой любой циклический или ациклический углевод. Любой из заместителей может в свою очередь быть замещенным. Положение и количество любых заместителей могут варьироваться.
Примерами типичных гетероарилов являются индолил, пиперидил, тиенил, пиридил и другие подобные.
Термином «ацил» обозначается группа, соответствующая формуле: -COR, где R может быть заместителем, выбираемым из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил.
Термином «карбамоил» обозначается группа, соответствующая формуле -CON(R)2, где R может быть одинаковыми или разными заместителями выбираемыми из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил.
Термином «тиокарбамил» обозначается группа, соответствующая формуле:
-CSN(R)2, где R может быть одинаковыми или разными заместителями, выбираемыми из ряда: водород, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил. Термином «углевод» обозначается любой циклический или ациклический углевод.
Термин «галоген» означает радикал фтор, бром, хлор, иод.
Термин «стереоизомеры» означает изомеры, которые отличаются пространственным расположением атомов. Стереоизомеры, которые являются несовместимыми зеркальными изображениями друг друга, называются энантиомерами или оптическими изомерами. Стереоизомеры, которые не являются зеркальными изображениями друг друга, называются диастереомерами.
Термин «Фармацевтически приемлемый» означает группу или соединение, которые используют при получении фармацевтической композиции и которые обычно являются безопасными в биологическом или ином отношении, нетоксичными и приемлемыми как в ветеринарии, так и в фармацевтике.
Термин «Фармацевтически приемлемые соли» означает соли, которые являются фармацевтически приемлемыми и которые обладают необходимой фармакологической активностью исходного соединения. Такие соли включают соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или соли органических кислот, таких как муравьиная, уксусная, пропионовая, бензойная, бензолсульфоновая, толуолсульфоновая, этансульфоновая, метансульфоновая, камфорсульфоновая, янтарная, фумаровая, малеиновая, молочная, яблочная, миндальная, винная, лимонная, глюконовая, глюкуроновая, гликолевая, салициловая, триметилуксусная и т.п. Подразумевается, что все фармацевически приемлемые соли включают сольваты или кристаллические формы указанной соли. Термин «сольваты» означает сольватированные формы, содержащие стехиометрическое или нестехиометрическое количество растворителя.
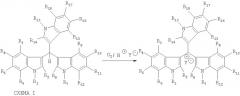
Настоящее изобретение также относится к способу получения веществ, соответствующих формуле I окислением соответствующих трииндолилметанов.
Способ включает следующие этапы:
растворение или диспергирование исходного трииндолилметана в органическом или неорганическом растворителе с добавлением кислоты, соответствующей получаемой соли, либо
растворение или диспергирование трииндолилметана непосредственно в кислоте, соответствующей получаемой соли.
Затем такой раствор или дисперсию приводят в контакт с кислородом или кислородсодержащими газовыми смесями, или растворами, содержащими растворенный кислород, в присутствии или в отсутствие веществ, увеличивающих поверхность контакта жидкой и газообразной фазы, таких как, например, активированный уголь, либо прочих веществ и условий, способствующих повышению растворимости кислорода в данных средах. Затем продукт выделяют в виде соответствующей соли трииндолилметилия. Способ получения соединений, соответствующих формуле I, осуществляют согласно схеме I:
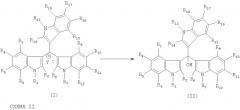
Настоящее изобретение также относится к способу получения соответствующих соединений формулы II из соединений, соответствующих формуле I (которые в свою очередь могут быть получены как вышеописанным методом, так и любым другим известным), обработкой последних в растворенном или твердом или в расплавленном состоянии растворами, имеющими рН>7, или сплавлением, или действием на них твердыми солями щелочных или щелочноземельных металлов, или действием на них основных солей или карбонатов металлов или аминов. Способ осуществляется согласно схеме II:
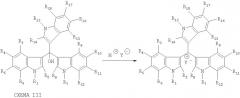
Изобретении также относится к способу получения соединений, соответствующих формуле I, из соединений, соответствующих формуле II (которые в свою очередь могут быть получены как вышеописанным методом, так и любым другим известным), обработкой их в растворенном или твердом или в расплавленном состоянии растворами, имеющими рН<7, или действием на них жидких, твердых или газообразных кислот. Способ осуществляют согласно схеме III:
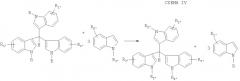
Настоящее изобретении относится к способу получения соединений, соответствующих формуле III (в которой значения R1-R18 соответствуют таковым для формулы I), которые являются исходными веществами для синтеза веществ, соответствующих формулам I и II. Способ заключается в том, что не замещенные по 3-С атому индолы с более электронодонорными заместителями в ядре (заместителями которые увеличивают электронную плотность на 3-С атоме индольного цикла) замещают индолы с менее электронодонорными заместителями в трииндолилметанах под действием слабокислотных катализаторов и/или кислот Льюиса, при смешении компонентов: с нагреванием или без него, в подходящих растворителях или в расплавах. Наилучший результат достигнут при кипячении в спиртах и при использовании в качестве катализаторов трифлатов лантаноидов. Способ осуществляют согласно схеме IV:
Используя эту схему, для создания ряда производных можно иметь только один начальный представитель ряда, из которого можно получать дальнейшие аналоги простым действием замещенных индолов (схема IV).
Соединение формулы III.
где R, R1'-заместители, суммарно или по отдельности создающие электронную плотность на 3-С атоме индольного цикла меньшую, чем R2' и R3' суммарно или по отдельности. Причем R выбран из алкила или замещенного алкила, R1' выбран из водорода и алкила, R2' означает алкил или замещенный алкил, R3' имеет значения R3-R6,R9-R12, R15-R18.
Изобретение относится также к способу ингибирования активности грамположительных и грамотрицательных микроорганизмов введением фармацевтически эффективного количества соединения, соответствующего формулам I или II, или фармацевтической композиции, содержащей терапевтически эффективное количество по меньшей мере одного соединения, соответствующего формуле I или II в смеси по меньшей мере с одним приемлемым носителем или растворителем.
Способ введения может быть осуществлен человеку или животному, страдающему бактериальной инфекцией, одним из известных на настоящий момент способов (например, наружно, перорально, внутривенно, внутримышечно и др.)
Изобретение относится к способу ингибирования размножения патогенной бактериальной микрофлоры на объектах внешней среды или материалах, подверженных деструктивному воздействию бактериальной микрофлоры (например, при консервации), включающий обработку этих объектов, например для целей антисептики и дезинфекции, или материалов, например, для консервации эффективным количеством соединения, соответствующего формулам I или II, или композицией, содержащей эффективное количество по меньшей мере одного соединения, соответствующего формуле I или II в смеси по меньшей мере с одним приемлемым носителем или растворителем.
Изобретение относится к способу ингибирования грибковой активности, включающий введение фармацевтически эффективного количества соединения, соответствующего формулам I или II или фармацевтической композиции, содержащей терапевтически эффективное количество по меньшей мере одного соединения, соответствующего формуле I или II в смеси по меньшей мере с одним приемлемым носителем или растворителем.
Введение можно осуществлять одним из известных на настоящий момент способов (например, наружно, перорально, внутривенно, внутримышечно и др.) человеку или животному, страдающему грибковой инфекцией.
Изобретение относится к способу ингибирования активности патогенной грибковой микрофлоры на объектах внешней среды или материалах, подверженных деструктивному воздействию грибковой микрофлоры, включающий обработку этих объектов, например для целей антисептики и дезинфекции, или материалов, например при консервации, эффективным количеством соединения, соответствующего формулам I или II, или композицией, содержащей эффективное количество по меньшей мере одного соединения, соответствующего формуле I или II в смеси по меньшей мере с одним приемлемым носителем или растворителем.
Изобретение также относится к средству, представляющему собой трииндолилметаны общей формулы I или II по п.1 в качестве антибактериального или противогрибкового агента, препятствующего размножению патогенной бактериальной или грибковой микрофлоры, или в качестве антибактериального агента против грамположительных и грамотрицательных бактерий и в качестве противогрибкового агента. Типичные соединения по изобретению приводятся в таблицах I и II, где для каждого соединения, соответствующего формуле I, указана молекулярная масса по данным масс-спектрометрии (метод ионизации MALDI, прибор MALDI TOF Bruker BIFLEX III), а для соединений, соответствующих формуле II, приведены спектры ядерного магнитного резонанса (1Н ЯМР, частота 400 МГц, растворитель ДМСО-d6, прибор Varian Unity 400)
| Таблица I | |
| масс-спектры типичных полученных соединений соответствующих формуле I. | |
| вещество | масс-спектр |
| Вычислено: Mw=539,22 | |
| LCTA-1293 | Mwкатиона:: 444,24 |
| метансульфонат трис(1-этил-1Н-индол-3-ил)метилия | Найдено: 444.6 [М+] |
| Вычислено: Mw=581,27 | |
| Мwкатиона: 486,29 | |
| LCTA-1319 | Найдено: 486.68 [М+] |
| метансульфонат трис(1-пропил-1Н-индол-3-ил)метилия | |
| Вычислено: Mw=623,32 | |
| LCTA-1574 | Мwкатиона: 528,34 |
| метансульфонат трис(1-бутил-1Н-индол-3-ил)метилия | Найдено: 528,64 [М+] |
| Вычислено: Mw=665,37 | |
| М^укатиона: 570,38 | |
| LCTA-1578 | Найдено: 570,38 [M+] |
| метансульфонат трис(1-пентил-1Н-индол-3-ил)метилия |
| Вычислено: Mw=707,41 | |
| Mwкатиона: 612,43 | |
| Найдено: 612.92 [М+] | |
| LCTA-1340 | |
| метансульфонат трис(1-гексил-lH-индол-3-ил)метилия | |
| Вычислено: Mw=725,27 | |
| Mwкатиона: 630,29 | |
| Найдено: 630,41 [M+] | |
| LCTA-1575 | |
| метансульфонат трис(1-бензил-1Н-индол-3-ил)метилия | |
| n- | Вычислено: Mw=875,6 |
| Мwкатиона: 780,62 | |
| Найдено: 780,83 [М+] | |
| LCTA-1576 | |
| метансульфонат трис(1-децил-lH-индол-3-ил)метилия |
| Вычислено: Mw=683,15 | |
| метансульфонат трис(5-хлоро-1-пропил-1Н-индол-3-ил)метилия | Мwкатиона: 588,17 |
| LSN-89 | Найдено: 588,38 [М+] |
| Вычислено: Mw=593,29 | |
| ацетат трис(5-метокси-1-этил-1Н-индол-3-ил)метилия | Мwкатиона: 534,28 |
| LSN-90 | Найдено: 534,39 [М+] |
| Вычислено: Mw=545,3 | |
| ацетат трис(6-метил-1-этил-1Н-индол-3-ил)метилия | Mwкатиона: 486,29 |
| LSN-91 | Найдено: 486,31 Р^Г] |
| Вычислено: Mw=567,26 | |
| метансульфонат (1Н-индол-3-ил)бис(2-метил-1-пропил-1Н-индол-3-ил)метилия | Мwкатиона: 472,28 |
| LCTA-1376 | Найдено: 472.03 [М+] |
| Таблица II | |
| Спектры ядерного магнитного резонанса (1Н ЯМР, частота 400 МГц, растворитель ДМСО-d6) типичных полученных соединений, соответствующих формуле II | |
| 1.23 (9Н; m); 4.09(6Н; m); 5.70 (1Н; s); 6.82(3H; t); 6.97 (3Н; s); 7.03 (3Н; t); 7.36 (3Н; d); 7.49 (3Н; d) | |
| трис(1-этил-1Н-индол-3-ил)метанол | |
| LCTA-1588 | |
| 0.94 (9Н; m); 1.65 (6Н; m); 4.08(6Н; m); 5.69 (1Н; s); 6.77 (3Н; t); 6.90 (3Н; s); 7.01 (3Н; t); 7.36 (3Н; d); 7.49 (3Н; d) | |
| трис(1-пропил-1Н-индол-3-ил)метанол | |
| LCTA-1617 | |
| 0.83 (9Н; m); 1.16 (6Н; m); 1.65 (6Н; m); 4.08(6Н; m); 5.69 (1Н; s); 6.77 (3Н; t); 6.90 (3Н; s); 7.01 (3Н; t); 7.36 (3H; d); 7.49 (3H; d) | |
| трис(1-бутил-1Н-индол-3-ил)метанол | |
| LCTA-1589 |
| 0.85 (9Н; m); 1.14 (6Н; m); 1.23 (6Н; m); 1.65 (6Н; m); 4.09(6Н; m); 5.70 (1Н; s); 6.77 (3Н; t); 6.91 (3Н; s); 7.01 (3Н; t); 7.36 (3Н; d); 7.49 (3Н; d) | |
| трис(1-пентил-1Н-индол-3-ил)метанол | |
| LCTA-1590 | |
| 0.87 (9Н; m); 1.14 (6Н; m); 1.23 (6Н; m); 1.34(6Н; m); 1.68 (6Н; m); 4.09(6Н; m); 5.70 (1Н; s); 6.77 (3Н; t); 6.91 (3Н; s); 7.01 (3Н; t); 7.36 (3Н; d); 7.49 (3Н; d) | |
| трис(1-гексил-1Н-индол-3-ил)метанол | |
| LCTA-1618 | |
| 1.25 (9Н; m); 4.11 (6Н; m); 5.73 (1Н; s); 6.82 (3H; t); 6.97 (3Н; s); 6.93 (3Н; d); 7.06 (3Н; dd); 7.29 (3Н; d) | |
| трис(5-хлоро-1-этил-lH-индол-3-ил)метанол | |
| LSN-94 | |
| 1.23 (9Н; m); 3.71 (9Н; s); 4.10 (6Н; m); 5.70 (1Н; s); 6.69 (3Н; dd); 6.88 (3Н; d); 6.97 (3Н; s); 7.25 (3Н; d) | |
| трис(1-этил-5-метокси-1Н-индол-3-ил)метанол | |
| LSN-95 |
| 0.82 (6Н; t); 1.67(4Н; m); 2.19 (6Н; s); 4.06 (4Н; t); 6.13 (1Н; s); 5.67 (1H; s); 6.69 (2H; t;); 6.79 (1H; t); 6.93 (2H; t); 7.02 (3Н; m); 7.13 (1H; d); 7.33 (2H; d); 7.37 (1H; d); 10.56 (1H; s) | |
| (1H-индол-3-ил)бис(2-метил-1-пропил-1Н-индол-3-ил)метанол | |
| LCTA-1619 |
Примеры
Примеры приведены с целью предоставить возможность специалисту в данной области более подробно ознакомиться с предлагаемым изобретением и использовать его на практике. Примеры приведены с целью иллюстрации и не ограничивают объем изобретения.
Стадия I
Получение трииндолилметанов (веществ, соответствующих формуле III и являющимися исходными для синтеза веществ формул I и II)
Исходные трииндолилметаны можно получить как описанными в литературе методами (примеры 1 и 2), так и предложенным в настоящем изобретении методом (пример 3).
Трис-(1-этил-1H-индол-3-ил) метан (пример 1) [Chen, Y.С.; Yu, L.; Wang P.G. Tetrahedron Letters 1995, 26, 4467]
К смеси 1-этилиндола (2.9 г, 20 ммоль) и 1-этил-3-формилиндола (1.73 г, 10 ммоль) в этаноле (50 мл) добавили 50 мг La(OTf)3 и кипятили с обратным холодильником в течение 3-х часов, после охлаждения до комнатной температуры выпавший осадок отфильтровывали, промывали 50 мл этанола, высушивали и получали 4.25 г трис-(1-этил-1H-индол-3-ил) метана (выход 95%) в виде бесцветного твердого вещества.
Таким же способом можно получить из соответствующих исходных индолов и формилиндолов:
трис(1-метил-1H-индол-3-ил)метан,
трис(1-пропил-1H-индол-3-ил)метан,
трис(1-бутил-1H-индол-3-ил)метан,
трис(1-пентил-1H-индол-3-ил)метан,
трис{1-гексил-1H-индол-3-ил)метан,
трис(1-бензил-1H-индол-3-ил)метан,
трис(1-децил-1H-индол-3-ил)метан,
трис(1-пропил-5-хлоро-1H-индол-3-ил)метан,
трис(1-пропил-5-метокси-1H-индол-3-ил)метан
трис{1-пропил-6-метил-1H-индол-3-ил)метан
(1Н-индол-3-ил)бис(2-метил-1-пропил-1Н-индол-3-ил)метан
Трис-(1-этил-1H-индол-3-ил)метан (пример 2) [Jun Li, Bing Guang and others Heterocycles, 2003, Vol. 60, No 6; 1307-1315]
Смесь 1-этилиндола (2.9 г, 20 ммоль) и 1-этил-3-формилиндола (1.73 г, 10 ммоль) в уксусной кислоте (50 мл) с добавлением уксусного ангидрида кипятили с обратным холодильником в течение 2-х часов, после охлаждения до комнатной температуры выливали в воду, выпавший осадок отфильтровали, промывали 50 мл этанола, высушивали и получали 4.23 г трис-(1-этил-1H-индол-3-ил) метана (выход 95%) в виде бесцветного твердого вещества.
Таким же способом можно получить из соответствующих исходных индолов и формилиндолов:
трис(1-метил-1H-индол-3-ил)метан,
трис(1-пропил-1H-индол-3-ил)метан,
трис(1-бутил-1H-индол-3-ил)метан,
трис(1-пентил-1H-индол-3-ил)метан,
трис(1-гексил-1H-индол-3-ил)метан,
трис(1-бензил-1H-индол-3-ил)метан,
трис(1-децил-1H-индол-3-ил)метан,
трис(1-пропил-5-хлоро-1H-индол-3-ил)метан,
трис(1-пропил-5-метокси-1H-индол-3-ил)метан,
трис(1-пропил-6-метил-1H-индол-3-ил)метан.
Трис-(1-этил-1H-индол-3-ил)метан (пример 3)
К смеси трис(1-метил-1H-индол-3-ил)метана (4 г, 10 ммоль) (полученного, например, по способу, описанному в примере 1 или 2) и 1-этилиндола (4.35 г, 30 ммоль) в этаноле добавили 100 мг La(OTf)3 и кипятили с обратным холодильником в течение 4-х часов, после охлаждения до комнатной температуры выпавший осадок отфильтровали, промывали 50 мл этанола, высушивали и получали 4.25 г трис-(1-этил-1H-индол-3-ил) метана (выход 95%) в виде бесцветного твердого вещества.
Таким же способом можно получить из трис(1-метил-1H-индол-3-ил)метана и соответствующих исходных индолов:
трис(1-пропил-1H-индол-3-ил)метан,
трис(1-бутил-1H-индол-3-ил)метан,
трис(1-пентил-1H-индол-3-ил)метан,
трис(1-гексил-1H-индол-3-ил)метан,
трис(1-бензил-1H-индол-3-ил)метан,
трис{1-децил-1H-индол-3-ил)метан,
трис(1-пропил-5-хлоро-1H-индол-3-ил)метан,
трис(1-пропил-5-метокси-1H-индол-3-ил)метан,
трис(1-пропил-6-метил-1H-индол-3-ил)метан,
(1Н-индол-3-ил)бис(2-метил-1-пропил-1Н-индол-3-ил)метан.
Стадия II
Трис-(1-этил-1H-индол-3-ил)метилия метансульфонат (пример 4)
К суспензии 4.45 г (10 ммоль) трис-(1-этил-1H-индол-3-ил) метана в 100 мл бутанола добавили 0.5 г активированного угля, затем добавили 1.43 мл (20 ммоль) метансульфокислоты и перемешивали при доступе воздуха в течение 2 суток, затем отфильтровывали уголь, промывали бутанольный раствор 2 раза водой, упаривали его, растирали остаток с эфиром, отфильтровывали, промывали эфиром, получали 4.31 г трис-(1-этил-1H-индол-3-ил)метилия метансульфоната (выход 80%) в виде красного аморфного порошка.
Окислением соответствующих трииндолилметанов получали аналогично следующие метансульфонаты:
метансульфонат трис(1-пропил-1H-индол-3-ил)метилия,
метансульфонат трис(1-бутил-1H-индол-3-ил)метилия,
метансульфонат трис(1-пентил-1H-индол-3-ил)метилия,
метансульфонат трис(1-гексил-1H-индол-3-ил)метилия,
метансульфонат трис(1-бензил-1H-индол-3-ил)метилия,
метансульфонат трис(1-децил-1H-индол-3-ил)метилия,
метансульфонат трис(1-пропил-5-хлоро-1H-индол-3-ил)метилия,
метансульфонат трис(1-пропил-5-метокси-1H-индол-3-ил)метилия,
метансульфонат трис(1-пропил-6-метил-1H-индол-3-ил)метилия,
метансульфонат (1Н-индол-3-ил)бис(2-метил-1-пропил-1Н-индол-3-ил)метилия, используя эту методику и ее модификации, при использовании других кислот, можно получать и другие соли трииндолилметилия.
Трис(1-этил-1Н-индол-3-ил)метанол (пример 5)
К суспензии 5.4 г (10 ммоль)метансульфоната трис-(1-этил-1H-индол-3-ил)метилия в этилацетате (40 мл) добавили раствор NaHCO3 (10 мас.%, 30 мл), инкубировали при перемешивании в течение 30 мин, отделяли органический слой, упаривали его и получали трис(1-этил-1Н-индол-3-ил)метанол (4.5 г, выход 98%) в виде светло-желтого аморфного вещества.
аналогично получали:
трис(1-пропил-1H-индол-3-ил)метанол,
трис(1-бутил-1H-индол-3-ил)метанол,
трис(1-пентил-1H-индол-3-ил)метанол,
трис(1-гексил-1H-индол-3-ил)метанол,
трис(1-бензил-1H-индол-3-ил)метанол,
трис(1-децил-1H-индол-3-ил)метанол,
трис(1-пропил-5-хлоро-1H-индол-3-ил)метанол,
трис(1-пропил-5-метокси-1H-индол-3-ил)метанол,
трис(1-пропил-6-метил-1H-индол-3-ил)метанол,
1Н-индол-3-ил)бис(2-метил-1-пропил-1Н-индол-3-ил)метанол, используя эту методику и ее модификации, из соответствующих солей трииндолилметилиев можно получать и другие трииндолилметанолы.
Тестирование биологической активности.
1. Изучение антибактериальной активности образцов.
Определялась антибактериальная активность в отношении грамположительных и грамотрицательных бактерий. Для определения этой активности использовали метод серийных разведении в бульоне Мюллер-Хинтон (поставщик компания "Acumedia" США) с определением минимальной подавляющей концентрации (МПК) на 96-луночных планшетах (согласно рекомендациям NCCLC: Национального Комитета стандартов для клинических лабораторных исследований и Руководству по экспериментальному доклиническому изучению новых фармакологических веществ (Москва, изд-во Ремедиум, 2000 г.))
Исходные вещества растворяли в дистиллированной воде в концентрации 1 мг/мл. Титровали бульоном, начинали титрование с концентрации 64 мкг/мл с дальнейшими двукратными разведениями. Каждое определение проводилось дважды. В качестве бактериального материала в работе были использованы штаммы в начальной концентрации 106 КОЭ/мл:
1) грамположительных бактерий
Staphylococcus epidermidis
Staphylococcus Haemolyticus
Staphylococcus aureus
Enterococcus faecalis
Enterococcus faecium
2) грамотрицательных бактерий
Esherihia Coli
Salmonella typhimurium
Klebsiella pneumonia
Pseudomonas aeruginosa
после инкубации при 37°C в течение 24 часов производили учет результатов. За МПК принимали конечную концентрацию испытуемого вещества (в мкг/мл), при которой происходила видимая задержка роста микроорганизмов.
Данные об активности приведены в таблице III.
Определение активности противогрибковых препаратов
Материалы и методы
Определение противогрибковой активности
Активность испытуемых соединений в отношении дрожжей и несовершенных грибов определяли in vitro с помощью микрометода, рекомендованного Национальным Комитетом Клинических Лабораторных Стандартов США (NCCLS), описанного в документах М27-А и М38-А соответственно для дрожжей [Reference method for broth dilution antifungal susceptibility testing of yeasts: Approved standard М27-А. NCCLS, Wayne, PA, USA, 1997] и мицелиальных грибов [Reference Method for Broth Dilution Antifungal Susceptibility Testing of Conidium-Forming Filamentous Fungi: Approved Standard М38-А. NCCLS, Wayne, PA, USA, 2002].
Среда и буфер
В исследовании применяли среду RPMI 1640 с L-глютамином и феноловым красным без бикарбоната натрия с добавлением 0,2% глюкозы (ICN Biomedicals Inc., Ohio, USA), забуференную 0,165 М морфолинпропансульфоновой кислоты (MOPS; ACROS ORGANICS, New Jersey, USA), pH 7.0.
Противогрибковые препараты
Тестируемые вещества растворяли в диметилсульфоксиде (DMSO) с начальной концентрацией 1600 мкг/мл. Из исходного раствора в том же растворителе готовили серии разведении (1600 до 3,13 мкг/мл). Затем эти разведения в DMSO разводили в 50 раз (сначала в 10 раз, а потом в 5 раз) в стандартной используемой для опыта среде RPMI 1640. В дальнейшем при постановке опыта (при смешивании с инокулятом тест-микроорганизмов) они подвергались дальнейшему двукратному разведению, и концентрация растворителя в опыте снижалась до 1%. Конечная концентрация испытуемых препаратов при этом была от 16 до 0,03 мкг/мл. Растворы тест