Способ исследования клеток с помощью иммунологического биочипа
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к гематологии, клинической иммунологии, онкологии. Кроме того, изобретение может быть использовано в ветеринарии, а также в области биологии, а именно в иммунологии и цитологии. Предложен способ исследования клеток с помощью иммунологического биочипа, содержащего иммобилизованные антитела, специфичные к поверхностным антигенам клеток. Биочип инкубируют с суспензией клеток, после чего осуществляют его отмывку от не связавшихся с антителами клеток. Затем обрабатывают биочип раствором, повышающим прочность связывания с биочипом клеток, остающихся на его поверхности за счет взаимодействия с иммобилизованными антителами. Из биочипа приготовляют препарат для микроскопических исследований, проводят исследование связанных с биочипом клеток, осуществляют считывание и анализ полученного результата. В процессе проведения исследования может быть осуществлено окрашивание связавшихся клеток или выполнена их обработка меченными антителами. Способ позволяет предотвратить отрыв клеток с поверхности биочипа при выполнении различных манипуляций, что приводит к повышению чувствительности анализа. 12 з.п.ф-лы, 6 ил.
Реферат
Изобретение относится к области медицины и может быть использовано для диагностических целей в гематологии, онкологии и других отраслях медицины, а также в ветеринарии и биологии.
Известен способ исследования клеток с помощью иммунологических биочипов (см. А.В.Шишкин, И.И.Шмырев, С.А.Кузнецова, Н.Г.Овчинина, А.А.Бутылин, Ф.И.Атауллаханов, А.И.Воробьев «Иммунологические биочипы для параллельного определения поверхностных антигенов и морфологического исследования клеток». Биологические мембраны, 2008, том 25, №4, с 277-284), заключающийся в том, что биочип, содержащий иммобилизированные антитела, инкубируют с суспензией клеток. Клетки, имеющие на своей поверхности соответствующие антигены, связываются с антителами, иммобилизированными в строго определенных участках подложки. Затем биочип отмывают от клеток, не связавшихся с иммобилизированными антителами. Отмывка осуществляется путем ополаскивания биочипа буферным раствором. В результате на поверхности биочипа остаются только клетки, связавшиеся с антителами. Затем окрашивают препарат по Романовскому-Гимзе и проводят морфологическое исследование связавшихся клеток. Осуществляют определение плотности связывания клеток в области пятен биочипа. Исходя из ее значений, полученных для каждого пятна, рассчитывают содержание в суспензии клеток, экспрессирующих соответствующие поверхностные антигены. Способ позволяет проводить морфологическое исследование клеток параллельно с определением их поверхностных антигенов и устанавливать содержание в исследуемой суспензии клеток, экспрессирующих определяемые антигены.
Недостатком известного способа является недостаточная чувствительность, обусловленная тем, что скорости потока жидкости, возникающие при отмывке биочипа, не регулируются. При слишком высоких скоростях потока возможен отрыв клеток недостаточно прочно, связавшихся с антителами (из-за низкой аффинности антител или низкой экспрессии антигенов на поверхности клетки), что может искажать получаемые результаты. При манипуляциях, выполняемых после завершения отмывки, при смене растворов также возможен отрыв недостаточно прочно связанных клеток. Кроме того, известный способ не предусматривает возможность длительного хранения биочипа со связавшимися клетками и его повторного микроскопического исследования с использованием иммерсионных объективов.
Известен способ исследования клеток с помощью иммунологических биочипов (см. А.В.Шишкин, И.И.Шмырев, С.А.Кузнецова, Н.Г.Овчинина, А.А.Бутылин, Ф.И.Атауллаханов, А.И.Воробьев «Иммунологические биочипы для исследования эритроцитов человека». Биологические мембраны, 2008, том 25, №4, с 267-276), взятый в качестве прототипа, заключающийся в том, что биочип, содержащий иммобилизированные антитела, помещают в проточную камеру и инкубируют с суспензией клеток. Клетки, имеющие на своей поверхности соответствующие антигены, связываются с антителами, иммобилизированными в строго определенных участках подложки. Затем биочип отмывают от не связавшихся с антителами клеток потоком жидкости с заданной скоростью. Скорость потока жидкости может быть подобрана такой, что происходит отрыв только тех клеток, которые не связались с антителами, а клетки, даже слабо связавшиеся с антителами, остаются на поверхности биочипа. Наличие связавшихся клеток устанавливается путем просмотра пятен биочипа с помощью микроскопа.
Недостатком известного способа является отрыв клеток (всех или части) с поверхности биочипа при заполнении капилляра проточной камеры воздухом, необходимом для извлечения биочипа. Отрыв клеток происходит на границе между воздухом и жидкостью. Это делает невозможным окрашивание связавшихся с биочипом клеток способами, используемыми для дальнейшего морфологического исследования и требующими предварительного высушивания биочипа и проведения фиксации (например, по Романовскому-Гимзе). По этой же причине считывание результата и осуществление микроскопического исследования связавшихся клеток может осуществляться только при нахождении биочипа в проточной камере. Окрашивание связавшихся с биочипом клеток другими способами, пригодными только для их ориентировочного исследования (например, путем инкубации с раствором метиленового синего) непосредственно в проточной камере приводит к адсорбции красителя (или иных веществ, используемых в процессе окраски), что нарушает ее прозрачность. Это исключает или, по меньшей мере, затрудняет ее повторное использование. Кроме того, известный способ не позволяет осуществлять хранение биочипа, находящегося в заполненной жидкостью проточной камере, более нескольких часов после проведения анализа. При более длительном хранении происходит гибель клеток и их разрушение, что исключает повторное исследование в спорных случаях.
Все вышеперечисленное не позволяет проводить исследование биочипа вне проточной камеры, не позволяет проводить морфологическое исследование и идентифицировать клетки, связавшихся в области пятен биочипа (что в ряде случаев приводит к ошибкам при интерпретации результата), не позволяет длительно сохранять биочип после проведения анализа для его повторного исследования в спорных случаях.
Задачей заявленного изобретения является повышение надежности и точности способа, повышение информативности получаемых результатов, при сохранении чувствительности анализа.
Поставленная задача решается за счет того, что согласно способа исследования клеток с помощью иммунологического биочипа, включающего инкубирование биочипа, содержащего иммобилизированные антитела, с суспензией клеток, отмывку биочипа от не связавшихся клеток, считывание и анализ полученного результата, после завершения отмывки биочипа от не связавшихся с антителами клеток, биочип обрабатывают одним или несколькими растворами, содержащими одно или несколько веществ, вызывающих повышение прочности связывания клеток с поверхностью биочипа, окрашивают связавшиеся клетки, из биочипа приготовляют долговременный препарат для микроскопических исследований, проводят исследование связанных с биочипом клеток.
Осуществляют морфологическое исследование связавшихся клеток.
Осуществляют морфометрическое исследование связавшихся клеток.
Дополнительно обрабатывают связавшиеся клетки меченными антителами или смесью антител, меченных различными метками, биочип подвергают исследованию, позволяющему установить наличие метки (одной или нескольких) у той или иной связавшейся клетки и (или) оценить накопление метки в различных участках поверхности биочипа.
Клетки, связавшиеся с биочипом, обрабатывают растворами одного или нескольких веществ, молекулы которых включают метку, либо сами обладают свойствами метки, не являющихся антителами, но способных связываться с определенными молекулами, присутствующими внутри клетки или на ее поверхности.
Определяют плотность связывания клеток в области пятен биочипа, исходя из чего устанавливают содержание в исследуемой суспензии клеток, имеющих определяемые поверхностные антигены.
Осуществляют мечение клеток и определяют плотность их связывания в области тех или иных участков поверхности биочипа по степени накопления метки.
В исследуемых участках поверхности биочипа определяют число клеток, имеющих какой-либо отличительный признак или совокупность признаков, и определяют долю таких клеток от числа клеток, связавшихся в данном участке поверхности биочипа или от максимально возможного числа клеток, способного связаться при данных условиях на участке поверхности с данной площадью, или от числа клеток, характеризуемых по иному критерию.
При проведении эксперимента используют дополнительные контрольные биочипы (один или несколько), на которых иммобилизированы антитела, имеющие специфичность к другим эпитопам антигенов, выявляемых с помощью первого биочипа.
Для анализа одного и того же образца клеточной суспензии используют комплекс из нескольких биочипов, которые окрашивают различными способами, пригодными для проведения морфологического исследования связавшихся клеток.
Проводят дополнительные отмывки биочипа.
Перед проведением окрашивания осуществляют фиксацию связавшихся клеток.
На биочип или изготовленный из него долговременный препарат наносят разметку, облегчающую нахождение нужных пятен.
При считывании результата осуществляют сканирование поверхности биочипа с определением локализации каждой связавшейся клетки в двухмерной системе координат для установления принадлежности определяемых морфологических и (или) морфометрических и (или) иных признаков каждой конкретной клетке, связавшейся с биочипом.
Использование заявленного способа позволяет предотвратить отрыв клеток при извлечении биочипа из проточной камеры. Это позволяет осуществлять окрашивание связанных с биочипом клеток при сохранении высокой чувствительности анализа. При этом окрашивание связанных с биочипом клеток может осуществляться вне проточной камеры, что исключает химическое повреждение последней и адсорбцию на ее внутренней поверхности красителей и других используемых веществ. Приготовление из биочипа долговременного препарата позволяет многократно осуществлять морфологическое исследование связанных клеток с использованием иммерсионных объективов без загрязнения последних и без повреждения поверхности биочипа и связанных на ней клеток. Такой подход является весьма полезным, например, в тех случаях, когда для верной интерпретации результата может потребоваться просмотр препарата несколькими специалистами. Кроме того, этот подход позволяет проводить сравнительное морфологическое исследование клеток одного и того же больного подвергнутых анализу с помощью биочипов в разное время. Это может оказаться весьма полезным, например, для оценки динамики развития заболевания или для оценки результатов лечения. Приготовление долговременного препарата позволяет хранить биочип неограниченное время и делает его намного более устойчивым к различным повреждениям.
Параллельно с определением поверхностных антигенов клеток может осуществляться не только морфологическое, но и морфометрическое исследование связавшихся клеток, что существенно повышает ценность информации получаемой при использовании данного способа в исследовательских целях.
Для выявления коэкспрессии антигенов может осуществляться дополнительное исследование связавшихся клеток с помощью меченных антител. При этом за счет связывания клеток в области пятен биочипа при проведении такого исследования на каждой клетке определяется на 1 антиген больше. При использовании нескольких видов антител, меченных различными метками возможно определение большего числа антигенов на каждой клетке. Обработка биочипа со связавшимися клетками меченными антителами может осуществляться непосредственно в проточной камере, либо вне ее. При использовании проточных камер с малым внутренним объемом расходование меченных антител осуществляется более экономно. В том случае, если обработка биочипа раствором меченных антител (с последующей отмывкой) производится после обработки биочипа раствором веществ, повышающих прочность связывания клеток с подложкой, потери чувствительности анализа не происходит. Это достигается за счет того, что предотвращается отрыв клеток с поверхности биочипа при выполнении различных манипуляций.
Помимо меченных антител могут использоваться другие меченные вещества (одно или несколько), способные связываться с молекулами присутствующими внутри клетки или на ее поверхности (например, могут быть использованы меченные молекулы различных лигандов для определения способных связываться с ними рецепторов). Могут использоваться вещества, обладающие свойствами метки и способные связываться с определенными веществами, молекулы которых присутствуют внутри клетки, либо на ее поверхности (например, флюоресцентный краситель акридиновый оранжевый, способный связываться с ДНК). Это открывает широкие возможности для использования предлагаемого способа в исследовательских целях.
Исходя из величины плотности связывания клеток в области пятен биочипа, может осуществляться определение содержания в исследуемой суспензии клеток, экспрессирующих определяемые антигены. В зависимости от целей анализа и используемого способа определения и оценки плотности связывания клеток в области пятен биочипа может проводиться качественное, полуколичественное или количественное определение содержания в исследуемой суспензии клеток экспрессирующих данные антигены. Возможно использование любых способов определения плотности связывания клеток в области пятен биочипа. Могут быть применены способы, использующие прямой подсчет клеток в области заданных участков поверхности биочипа. Могут быть использованы непрямые способы, при которых осуществляется оценка изменения тех или иных свойств данных участков поверхности биочипа, зависящих от плотности связывания клеток. Может быть использовано мечение клеток (до инкубации с биочипом или после ее завершения) каким-либо способом и проведена оценка плотности связывания клеток по степени накопления метки в исследуемых участках биочипа. Любой из этапов проведения анализа, считывания и обработки его результатов может быть автоматизирован.
Проведение морфологического, морфометрического, иммунофлюоресцентного (иммуноцитохимического) или иного дополнительного исследования связавшихся клеток и подсчет клеток, имеющих те или иные признаки, позволяют определять их долю от числа клеток связавшихся на участках с заданной площадью или от максимально возможного числа клеток, способного связаться на участке поверхности пятна заданной площади или от числа клеток, характеризуемых по какому-либо иному критерию. Это делает предлагаемый способ весьма полезным при исследовании клеточных субпопуляций, различающихся по иммунологическим, морфологическим, морфометрическим или иным признакам. При этом возможно определение содержания в исследуемой суспензии клеток, относящихся к различным субпопуляциям.
При проведении анализа одного и того же образца могут быть использованы дополнительные контрольные биочипы (один или несколько), содержащие антитела, специфичные к другим эпитопам антигенов, выявляемых с помощью первого биочипа. Сравнение результатов, получаемых с помощью основного и контрольных биочипов, позволяют исключить ошибки, связанные с перекрестной реактивностью антител, а также ошибки, связанные с потерей активности используемых антител.
Для анализа одного и того же образца клеточной суспензии может быть использован комплекс из нескольких биочипов, которые окрашивают различными способами, пригодными для последующего проведения морфологического исследования связавшихся клеток. Это позволяет добиться большей точности и информативности анализа. В спорных случаях это поможет исключить возможные ошибки результатов морфологического исследования.
Для получения адекватных результатов исследования после выполнения определенных этапов анализа, например после выполнения обработки меченными антителами или после обработки красителем необходимо выполнение отмывок биочипа.
При использовании для окрашивания связавшихся клеток некоторых методик, например при проведении окраски по Романовскому-Гимзе, для достижения наилучших результатов необходимо проведение фиксации, которая осуществляется путем обработки биочипа определенными веществами, например метанолом.
На биочип или изготовленный из него долговременный препарат может быть нанесена разметка, облегчающая нахождение и идентификацию пятен, и позволяющая избежать возможных ошибок, например, при неавтоматизированном считывании результата.
При считывании результата может осуществляться сканирование поверхности биочипа с определением локализации каждой связавшейся клетки в двухмерной системе координат. Это позволяет установить принадлежность определяемых морфологических и (или) морфометрических и (или) иных признаков каждой конкретной клетке, связавшейся с биочипом, и провести ее идентификацию. При компьютерной обработке полученных данных и проведении статистического анализа значительно повышается точность исследования и его информативность.
Предлагаемый способ может использоваться в различных модификациях, пригодных как для клинических скрининговых исследований, так и для решения научно-исследовательских задач различного уровня сложности.
Заявленный способ поясняется микрофотографиями (фиг.1-3).
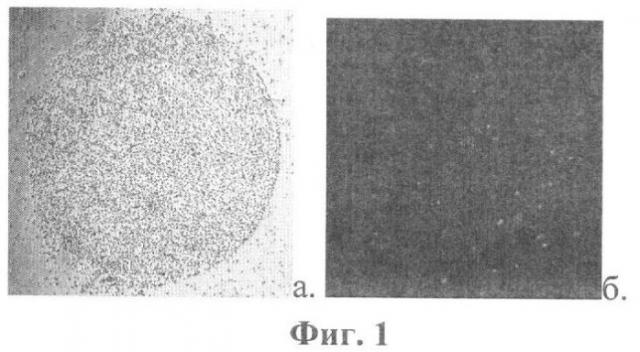
На фиг.1 представлены микрофотографии пятна биочипа с антителами анти-CD45. Биочип находится в проточной камере. Проведена инкубация с раствором антител анти-CD16, меченными флюоресцеина изотиоцианатом (FITC). а) Микрофотография выполнена при обычном освещении. б) Микрофотография выполнена при ультрафиолетовом освещении. 8% клеток флюоресцируют, следовательно, они экспрессируют не только антигены CD45, но и антигены CD16.
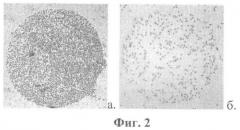
На фиг.2 представлены микрофотографии, демонстрирующие разную плотность связывания клеток в области пятен биочипа с различными антителами. Приводятся примеры определения в исследуемой суспензии процентного содержания клеток, экспрессирующих определяемые антигены, исходя из значений плотности связывания. Инкубация биочипа осуществлялась с суспензией лейкоцитов здорового человека без подачи потока жидкости и перемешивания. После отмывки от несвязавшихся клеток и последующей инкубации с раствором, содержащим соли кальция, и отмывки от него биочип извлечен из проточной камеры и окрашен по Романовскому-Гимзе. Для большей точности плотность связывания клеток определена путем прямого подсчета клеток на участках поверхности пятна заданной площади. Увеличение в 50 раз а) пятно с антителами анти-С045 (плотность связывания клеток 12000 кл/мм2, принимается за 100%, так как антиген CD45 экспрессируют все лейкоциты), б) пятно с антителами анти-CD8 (плотность связывания 2100 кл/мм2. Содержание CD8+ клеток в суспензии =2100/12000×100%=17,5%).
На фиг.3 представлены микрофотографии, демонстрирующие возможность выполнения морфологического исследования клеток, связавшихся в области пятен биочипов. Представленные микрофотографии пятен получены при исследовании трех разных образцов клинического материала. Окраска по Романовскому-Гимзе, увеличение в 1000 раз, а) бласты больного острым В-лимфобластным лейкозом (В-ОЛЛ), связавшиеся в области пятна с антителами анти-CD19, б) лимфоциты больного хроническим В-лимфолейкозом (В-ХЛЛ), связавшиеся в области пятна с антителами анти-CD5, в) различные лейкоциты здорового человека, связавшиеся в области пятна с антителами анти-CD45.
На фиг.4 представлена микрофотография участка поверхности биочипа, выполненная при ультрафиолетовом освещении (флюоресцентная микроскопия), увеличение в 25 раз. Биочип инкубировался с лейкоцитами, выделенными из крови больного хроническим В-лимфолейкозом (преобладают В-лимфоциты опухоли, в значительно меньшем количестве содержатся нормальные Т- и В-лимфоциты и миелоидные клетки). В различных пятнах биочипа содержатся те или иные из перечисленных клеток. Биочип обработан антителами анти-CD19, меченными флюоресцеина изотиоционатом (FITC). Антиген CD19 присутствует на поверхности нормальных и опухолевых В-лимфоцитов. Хорошо видна флюоресценция тех пятен биочипа, где связались В-лимфоциты. Разная яркость пятен свидетельствует о разной плотности связывания В-лимфоцитов в различных пятнах биочипа.
На фиг.5 представлены результаты определения с помощью биочипа процентного содержания клеток, экспрессирующих различные антигены. Клетки больного К., 70 лет. Диагноз хронический В-лимфолейкоз (В-ХЛЛ).
На фиг.6 представлены результаты определения с помощью биочипа процентного содержания клеток, экспрессирующих различные антигены. Клетки больной Б., 21 год. Диагноз острый В-лимфобластный лейкоз (В-ОЛЛ).
Заявленный способ осуществляется следующим образом. Биочип инкубируют с исследуемой клеточной суспензией. Клетки оседают на его поверхность и приходят в контакт с антителами, иммобилизированными в строго определенных участках. Если клетки имеют соответствующие поверхностные антигены, происходит их связывание в данных участках (пятнах) поверхности биочипа. Затем осуществляют отмывку биочипа для устранения клеток, не связавшихся с антителами. Отмывка биочипа может осуществляться в проточной камере (см. А.В.Шишкин, И.И.Шмырев, С.А.Кузнецова, Н.Г.Овчинина, А.А.Бутылин, Ф.И.Атауллаханов, А.И.Воробьев «Иммунологические биочипы для исследования эритроцитов человека». Биологические мембраны, 2008, том 25, №4, с 267-276). При этом биочип закрепляется в проточной камере до начала осуществления анализа, а предшествующая отмывке инкубация биочипа с клеточной суспензией осуществляется непосредственно в ней. После завершения отмывки в области пятен биочипа остаются связанными только те клетки, которые имеют соответствующие поверхностные антигены (фиг.1а, фиг.2).
После завершения отмывки от не вязавшихся с антителами клеток осуществляется обработка биочипа растворами веществ, повышающими прочность связывания оставшихся клеток с его поверхностью. Для этого может быть использована, например, питательная среда RPMI-1640, содержащая соли кальция и магния (ионы кальция и магния участвуют в процессах адгезии клеток к твердым поверхностям). Использование данного подхода способствует также лучшему распластыванию клеток по поверхности подложки, что в дальнейшем положительно влияет на качество краски клеток.
По факту связывания в области того или иного пятна биочипа на каждой отдельно взятой клетке определяется экспрессия одного антигена. В случае, если на каждой клетке необходимо определение экспрессии 2 антигенов, биочип инкубируют с флюоресцентно-меченными антителами, специфичными к дополнительно определяемому антигену. Этот этап удобнее проводить при нахождении биочипа в проточной камере. Раствор меченных антител вводится непосредственно в капилляр. Если на каждой клетке необходимо определить коэкспрессию большего числа антигенов используется раствор, содержащий несколько видов антител с разной специфичностью, меченных разными флюорохромами. Биочип инкубируют с меченными антителами в течение заданного времени (которое зависит от концентрации антител и подбирается экспериментально, обычно находится в пределах 10-60 минут), после чего производят его отмывку для устранения антител, не пришедших во взаимодействие с антигенами клеток. Затем в различных участках биочипа (в пятнах и фоновых участках) определяют наличие клеток, флюоресцирующих в заданной части спектра, и определяют их количество на участках заданной площади (фиг.1б). (Биочип при этом находится в проточной камере или может быть извлечен из нее). Данная задача может быть решена различными способами, например биочип может быть просмотрен под флюоресцентным микроскопом с использованием светофильтров, позволяющих обнаружить флюоресценцию использованных флюорохромных меток. При этом может быть проведено определение количества клеток, имеющих флюоресцентную метку и оценена выраженность экспрессии определяемых антигенов на каждой клетке по интенсивности флюоресценции метки. Также могут быть получены микрофотографии пятен биочипа и фоновых участков или фотографии всей поверхности биочипа (фиг.4). В каждом из участков поверхности может быть определено количество клеток, имеющих флюоресценцию в заданной части спектра. При этом при обработке изображения, по яркости соответствующих участков фотографии может быть оценена интенсивность флюоресценции отдельных клеток или целых участков биочипа, содержащих большое количество клеток. При анализе изображения клеток по расположению флюоресцирующих участков может осуществляться определение локализации дополнительно выявляемых антигенов (например, поверхностная, цитоплазматическая, ядерная локализация). Использование иммунофлюоресцентного мечения связавшихся с биочипом клеток может быть использовано также для оценки специфичности связывания, что требуется в некоторых случаях. По сравнению с иммунофлюоресцентными методами при окраске флюоресцентно-меченными антителами клеток, связавшихся на биочипе, на любой из клеток можно определять на один антиген больше за счет ее связывания в области того или иного пятна биочипа.
Помимо описанного выше варианта определения коэкспрессии антигенов на связавшихся с биочипом клетках путем прямого окрашивания меченными антителами может быть использовано непрямое иммунофлюоресцентное окрашивание (см. «Микроскопическая техника. Руководство для врачей и лаборантов». Под редакцией Д.С.Саркисова и Ю.Л.Петрова. М.: «Медицина», 1996 г., с.125-179). Может также быть использована обработка связавшихся клеток антителами с радиоизотопной меткой (см. «Микроскопическая техника. Руководство для врачей и лаборантов». Под редакцией Д.С.Саркисова и Ю.Л.Петрова. М.: «Медицина», 1996 г., с.253-271). При этом регистрацию результата осуществляют с помощью радиоавтографии (для чего, например, помещают биочип на фотопластинку, выдерживают необходимое время, после чего пластинку проявляют и исследуют). В указанных случаях на каждой из связавшихся с биочипом клеток дополнительно может быть выявлена экспрессия только одного антигена. Может быть использовано прямое или непрямое иммуноцитохимическое окрашивание связавшихся с биочипом клеток (см. «Микроскопическая техника. Руководство для врачей и лаборантов». Под редакцией Д.С.Саркисова и Ю.Л.Петрова. М.: «Медицина», 1996 г., с.125-179).
В некоторых случаях определение коэкспрессии антигенов может не требоваться. При этом описанный выше этап проведения анализа опускают.
Затем биочип извлекают из проточной камеры (если он не был извлечен из нее на предыдущем этапе) и высушивают. Высушивание биочипа может осуществляться, например, за счет испарения воды или, что более предпочтительно, с помощью устройства, использующего удаление капель с поверхности за счет центробежной силы (например, центрифуги, на роторе которой закрепляется биочип). Перед окрашиванием может быть осуществлено фиксирование препарата, например метанолом. Далее осуществляют обработку биочипа красителем (одним или несколькими) для окрашивания связавшихся клеток (например, по Романовскому-Гимзе), позволяющего в дальнейшем проводить их морфологическое исследование. Затем биочип отмывают от оставшегося красителя и высушивают.
Затем осуществляют приготовление долговременного препарата. Для этого на поверхность предметного стекла (или прозрачной пластины из иного материала, например, из поливинилхлорида) наносится капля канадского бальзама (или иного вещества с подобными свойствами, например жидкости для приготовления гистологических препаратов «Shandon-Mount»; производитель - «Thermo-electron corporation», США, Pitsburg). Сверху накладывают биочип (стороной со связавшимися клетками вверх) и прижимают таким образом, чтобы между ним и стеклом не оставалось пузырей воздуха. Затем на поверхность биочипа наносят еще одну каплю канадского бальзама (или иного вещества с подобными свойствами). Сверху накладывают и таким же образом прижимают покровное стекло (или тонкую прозрачную пластину из иного материала, например из поливинилхлорида). Препарат помещают под груз или пресс до затвердевания канадского бальзама (или заменяющего его вещества). В некоторых случаях более предпочтительным является изготовление постоянного препарата без использования предметного стекла. В этом случае на поверхность биочипа со связавшимися клетками наносят каплю канадского бальзама (или заменяющего его вещества), а сверху накладывают и прижимают покровное стекло (или прозрачную пластину из иного материала, например из поливинилхлорида) таким же образом, как было описано выше. На биочип или изготовленный из него долговременный препарат может наноситься разметка, облегчающая нахождение нужных пятен при не автоматизированном считывании (оценке) результата.
Осуществляют считывание результата, для этого получают изображение пятен и фоновых участков биочипа (например, путем фотографирования через микроскоп) и определяют плотность связывания клеток (количество клеток, связавшихся на участке поверхности биочипа заданной площади) в области пятен биочипа (фиг.2) и фоновых участков. Процесс может быть автоматизирован.
Осуществляют морфологическое исследование клеток, связавшихся в области каждого пятна биочипа (фиг.3). Его проведение возможно при использовании микроскопии как с применением объективов, не приходящих в контакт с поверхностью препарата, так и с применением иммерсионных объективов. При этом возможно многократное микроскопическое исследование препарата с использованием иммерсионных объективов без каких-либо повреждений препарата и загрязнения объективов. Изображение пятен биочипа и связавшихся в них клеток может быть также получено с помощью проекционной аппаратуры, что в некоторых случаях является более предпочтительным. При проведении морфологического исследования клеток, связавшихся с биочипом, определяют признаки, необходимые для их идентификации (форму и размеры клеток и их ядер, ядерно-цитоплазматическое соотношение, структуру хроматина, наличие или отсутствие ядрышек, наличие перинуклеарного просветления, цвет ядра и цитоплазмы, наличие вакуолей, гранул и других цитоплазматических структур, а также другие признаки). На основании этого определяют, какие именно клетки связались в области того или иного пятна биочипа. При необходимости может осуществляться морфометрическое исследование связавшихся клеток. Морфологическое или морфометрическое исследование связавшихся клеток может осуществляться как без автоматизации (например, путем просмотра каждого пятна биочипа под микроскопом или путем изучения микрофотографий участков соответствующих пятен), так и с помощью компьютерных программ, распознающих изображение и проводящих его анализ. При проведении микроскопического исследования связавшихся на поверхности биочипа клеток могут быть использованы любые виды световой микроскопии.
В случае, если инкубация биочипа с клеточной суспензией осуществлялась без какого-либо перемешивания или подачи потока жидкости, после проведения отмывки, возможно определение содержания в суспензии клеток, экспрессирующих определяемые поверхностные антигены. Для этого определяют плотность связывания клеток в области пятен биочипа (количество клеток связавшихся в области пятна биочипа на участке заданной площади). Плотность связывания клеток в области пятна биочипа пропорциональна содержанию в суспензии клеток, экспрессирующих соответствующий поверхностный антиген. Возможно выражение содержания клеток, экспрессирующих определяемые антигены, в виде доли от общего числа клеток или от числа клеток определенного типа по формуле N=A/B, где N - доля клеток, экспрессирующих данный антиген. А - плотность связывания клеток в области пятна с антителами, специфичными к данному антигену, В - плотность связывания клеток в области пятна с антителами, специфичными к антигену (антигенам), присутствующему на всех исследуемых клетках (например, антигену CD45 или антигену CD44 при исследовании лейкоцитарных суспензий), либо плотность связывания клеток в области пятна с антителами, присутствующими на всех клетках определенного типа, либо максимально возможная плотность связывания клеток, определенная экспериментально иным способом, или расчетным путем.
Доля клеток, экспрессирующих данный антиген, может быть выражена в процентах (фиг.2). Если известна общая концентрация клеток в суспензии, может быть определена концентрация клеток, экспрессирующих каждый определяемый антиген.
Помимо количественного определения плотности связывания клеток в некоторых случаях может быть использовано ее качественное или полуколичественное определение. При этом качественно или полуколичественно может быть оценено содержание в суспензии клеток, экспрессирующих определяемые поверхностные антигены.
При проведении морфологического и (или) морфометрического исследования осуществляется идентификация клеток или определяются какие-либо дополнительные отличительные признаки связавшихся клеток. В каждом пятне биочипа на участках заданной площади подсчитываются связавшиеся клетки, имеющие эти признаки (или совокупность признаков), выявленные при морфологическом исследовании. Может быть определена их доля, от числа клеток, экспрессирующих данный антиген и связавшихся в данном пятне на участке заданной площади или от максимального числа клеток, способного связаться на участке заданной площади или от иной величины. Исходя из этого, может быть определено содержание в суспензии клеток, относящихся к данной субпопуляции, выделяемой на основании одного или нескольких морфологических (морфометрических) признаков.
Любой из этапов проведения исследования может быть автоматизирован для снижения трудоемкости проведения анализа и повышения производительности.
Способ проведения анализа предусматривает контроль получаемых результатов. При проведении эксперимента в некоторых случаях при необходимости могут использоваться дополнительные контрольные биочипы (один или несколько), на которых иммобилизированы антитела, имеющие специфичность к другим эпитопам антигенов, выявляемых с помощью первого биочипа. Могут также использоваться биочипы, содержащие несколько моноклональных антител (нанесенных в разных участках биочипа), специфичным к различным эпитопам каждого определяемого антигена. В этом случае сопоставляются значения плотности связывания клеток в пятнах с антителами, специфичными к разным эпитопам одних и тех же антигенов. Если эти значения оказываются близкими, полученные результаты считаются достоверными, если значения существенно отличаются (при близкой аффинности антител и близкой концентрации их растворов, наносимых на подложку при изготовлении биочипа), результаты признаются спорными и подлежат проверке.
Для анализа одного и того же образца клеточной суспензии может использоваться комплекс из нескольких биочипов (одинаковых или имеющих какие-либо отличия), которые подвергаются окрашиванию различными способами для проведения более детального морфологического исследования клеток, связавшихся в области пятен.
При считывании результата может осуществляться сканирование всей поверхности биочипа с определением локализации каждой связавшейся клетки в двухмерной системе координат. Такой подход позволяет, например, более точно сопоставлять результаты иммунофлюоресцентного, морфологического и морфометрического исследования. Это позволяет четко определять принадлежность дополнительно определяемых морфологических морфометрических и иммунологических признаков каждой конкретной клетке.
В некоторых случаях на любом из этапов проведения анализа может дополнительно осуществляться мечение клеток флюоресцирующим красителем (например, акридиновым оранжевым), позволяющее осуществлять определение количества связавшихся клеток в области заданных участков поверхности биочипа по степени накопления метки. Процесс может быть автоматизирован. Использование дополнительной окраски акридиновым оранжевым не ухудшает качество окрашивания клеток основным способом (например, по Романовскому-Гимзе) и не препятствует проведению морфологического исследования.
Заявленное изобретение направлено на повышение точности, надежности, информативности и диагностической ценности результатов анализа, а также на достижение возможности проверки ранее полученных результатов.
Примеры использования метода.
Пример 1
Использовался биочип с антителами (IgG), специфичными к антигенам: CD2, CD3, CD4, CD5, CD7, CD8, CD9, CD10, CD11a, CD11b, CD16, CD19, CD20, CD21, CD22, CD23, CD27, CD29, CD31, CD36, CD38, CD41, CD44, CD45, CD45RA, CD56, CD71, CD72, CD95, CD98, HLA-DR, IgM.
С помощью биочипа исследовались клетки больного К., 70 лет, с диагнозом хронический В-лимфолейкоз (В-ХЛЛ). Лейкоцитарная фракция клеток была выделена на градиенте плотности («Ficoll pa