Лечение рака
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, в частности к новым лекарственным средствам и препаратам, включающим эффективные противораковые средства вместе с анти-Hsp90 антителом, которые вместе обеспечивают повышенную эффективность при лечении рака и лейкоза. 10 н. и 38 з.п. ф-лы, 25 табл.
Реферат
Настоящее изобретение относится к новым лекарственным средствам и препаратам, включающим эффективные фармацевтические средства вместе с анти-Hsp90 антителом, которые вместе обеспечивают повышенную эффективность при лечении разных форм рака, включая рак ободочной и прямой кишки. Другие аспекты изобретения касаются лечения лейкозов.
Лечение рака и лечение лейкоза
Первый аспект настоящего изобретения относится к новым лекарственным средствам и препаратам, включающим эффективные противораковые средства вместе с анти-Hsp90 антителом, которые вместе обеспечивают повышенную эффективность при лечении рака.
В последние годы появились члены семейства белков теплового шока (Hsp) как играющие важную роль в онкогенезе и гибели клеток. Действительно, белки теплового шока в течение многих лет были идентифицированы как потенциальные мишени для лечения рака (Whitesell L et al., PNAS USA, 1994 Aug 30, 91(18): 8324-8; PMID: 8078881), и члены семейства ансамицина (ранее именовавшиеся ингибиторами тирозинкиназы) были предложены в качестве средств, которые можно применять для осуществления лечения рака (Neckers L et al., Invest New Drugs, 1999, 17(4): 361-73; PMID: 10759403; Schulte TW et al., Cancer Chemother Pharmacol., 1998, 42(4): 273-9; PMID: 9744771).
Считалось, что один белок теплового шока, Hsp90, участвует в развитии карциномы молочных желез, предстательной железы, меланомы, лейкозов и лимфом, ободочной кишки и легких (Banerji U et al., Curr Cancer Drug Targets, 2003 Oct; 3(5): 385-90; PMID: 14529390), а также карцином щитовидной железы. Роль Hsp90 состоит в обеспечении правильной укладки «client proteins», которые участвуют в широком разнообразии клеточных процессов, например передаче сигналов. «Client proteins» Hsp90 включают факторы транскрипции, такие как индуцируемый р53 и гипоксией фактор 1α, и растворимые киназы, включая v-Src, Akt, Raf-1, и Bcr-Abl. Hsp90 конститутивно экспрессирован в опухолевых клетках на уровнях, в 2-10 раз превышающих их уровень в нормальных клетках, свидетельствуя о том, что он может быть важным для роста/выживания опухолевых клеток (Schwartz, J., et al,. 2003, Semin. Hematol. 40:p87-96). Поскольку связывание «client proteins» Hsp90 может регулировать их конформацию, то их устойчивость и судьба Hsp90 в клетке может оказывать существенное воздействие на пути, которые регулируют клеточный исход, включая рост, деление, дифференциацию, движение и гибель клеток (Workman, P., Cancer Lett. 2004 Apr 8; 206(2):149-57; PMID: 15013520). Значительная роль Hsp90 в клеточных процессах означает, что этот белок в настоящее время рассматривается как возможная мишень для разработки терапевтических лекарственных средств. Ингибиторы Hsp90 путем специфического взаимодействия с одиночной молекулярной мишенью вызывают дестабилизацию и конечное разрушение «client protein»s Hsp90.
Второй аспект настоящего изобретения относится к новым лекарственным средствам и препаратам, включающим эффективные противораковые средства вместе с анти-Hsp90 антителом, которые вместе обеспечивают повышенную эффективность при лечении лейкоза.
Лейкоз представляет собой рак, который поражает костный мозг. У людей с лейкозом костный мозг продуцирует большие количества патологических лейкоцитов. Патологические лейкоциты скапливаются в костном мозге, так что костный мозг не может производить достаточного количества нормальных эритроцитов, лейкоцитов и тромбоцитов.
Различные типы лейкоза можно разделить на категории по скорости их развития (острый или хронический) и по типу пораженных лейкоцитов (миелоидные или лимфоидные клетки). Миелоидные лейкоциты представляют собой первую линию защиты иммунной системы против инфекции, и они обнаруживаются главным образом в крови, где они захватывают и уничтожают инородные организмы. Лимфоидные лейкоциты обнаруживаются в лимфатических узлах и в крови.
Четыре наиболее часто встречающихся типа лейкозов включают хронический лимфоидный (лимфоцитарный) лейкоз (CLL), острый миелоидный (миелобластический) лейкоз (AML), острый лимфоидный (лимфобластический) лейкоз (ALL) и хронический миелоидный лейкоз (CML).
CLL представляет собой также рак лимфоцитарных клеток, но он развивается медленнее, чем ALL. Это заболевание представляет собой наиболее часто встречающийся тип лейкоза, поражающего взрослых, и очень редко наблюдается у детей.
AML представляет собой рак, главным образом поражающий миелоидные клетки, известные как гранулоциты. Он создает слишком много миелобластов, которые могут блокировать кровеносные сосуды и недостаточно зрелые миелоидные клетки. Это заболевание возникает главным образом у взрослых, но может также поражать детей.
CML (также именуемый хроническим гранулоцитарным лейкозом) представляет собой обычно медленно прогрессирующий рак нейтрофильных клеток, который редко встречается у детей и обычно больше поражает взрослых мужчин, чем женщин. CML обычно легко диагностируется, потому что лейкозные клетки более чем 95% пациентов имеют отчетливую цитогенетическую аномалию, филадельфийскую хромосому (Ph1) (Kurzrock, R. et al., 2003, Ann. Intern. Med. 138 (10): p819-30, PMID: 12755554; Goldman, J.M. and Melo, J.V., 2003, N. Engl. J. Med. 349 (15): p1451-64, PMID: 14534339). Ph1 возникает в результате реципрокной транслокации между длинными плечами хромосом 9 и 22, и ее можно продемонстрировать во всех гематопоэтических предшественниках (Deininger, M.W. et al., 2000, Blood 96 (10): p3343-56, PMID: 11071626). Эта транслокация приводит к переносу онкогена Abelson (abl) на хромосоме 9 в область хромосомы 22, именуемую областью кластера точечного разрыва (BCR) (Deininger, M.W. et al., 2000, Blood 96 (10): p3343-56, PMID: 11071626). Это, в свою очередь, приводит к получению гибридного гена BCR/ABL, который кодирует химерную мРНК 8,5 т.п.н. Ген BCR/ABL представляет собой онкоген, который достаточен для получения у мышей заболевания, подобного CML. Транскрипт онкогена BCR/ABL транслируется для выхода белка 210 кДа или 190 кДа. Белок Bcr-Abl представляет собой аномальный белок протеинкиназы, который вызывает нарушение миелопоэза, обнаруживаемое при CML. CML прогрессирует через определенные клинические стадии, называемые хронической фазой, ускоренной фазой и бластным кризом. Онкоген BCR/ABL экспрессируется на всех стадиях, но бластный криз характеризуется множественными дополнительными генетическими и молекулярными изменениями (Gorre, M.E., et al., 2002, Blood, 100(8): p3041-3044).
Ph1-негативный CML представляет собой редкое заболевание, которое характеризуется клиническими характеристиками CML без цитогенетических или молекулярных (RT-PCR) доказательств транслокации t(9;22)(q34;q11), приводящей к конденсированной мРНК Bcr-Abl. Ph1-негативный CML представляет собой низко дифференцированную нозологическую форму, которая менее четко отличается от других миелопролиферативных синдромов. Ранее считалось, что Ph1-негативный CML составляет 5-10% всех клинических форм CML, но в настоящее время, при обычной доступности анализа RT-PCR для выявления транскрипта Bcr-Abl, это количество составляет существенно ниже 5%. Интересно, что у некоторых пациентов эта нозологическая форма может возникать в результате альтернативного слияния с Abl. Слияние TEL(ETV6)-ABL как результат t(9;12) было продемонстрировано в двух случаях Ph- CML. Пациенты с Ph1-негативным CML в целом имеют более слабую реакцию на лечение и меньшую продолжительность жизни, чем пациенты с Ph1-положительным CML (Onida, F. et al., 2002: Cancer 95 (8): p1673-84, PMID: 12365015).
ALL представляет собой рак из незрелых лимфоцитарных клеток, известных как лимфобласты. Это заболевание представляет собой самый распространенный тип лейкоза у маленьких детей, обычно в возрасте от 1 до 7 лет, и он достаточно редок у взрослых. ALL вызывает продукцию множества патологических лимфоцитов, которые вытесняют нормальные эритроциты и тромбоциты. Считалось, что белок Bcr-Abl 185 кДа прямо связан с развитием ALL.
Два препарата, гелданамицин (GA) и 17-аллиламино, 17-десметоксигелданамицин (17-AAG), которые действуют в качестве ингибиторов Hsp90, проявили перспективную биологическую и клиническую активность в клинических испытаниях. Действительно, гибридный белок Bcr-Abl 210 кДа (p210Bcr-Abl) зависит от его связи с Hsp90 для его устойчивости, и обработка клеток GA или 17-AAG ведет к быстрому разрушению p210Bcr-Abl.
Ингибитор Hsp90, такой как 17-AAG, в комбинации с обычными цитотоксическими средствами или другими новыми средствами, также были бы терапевтически ценными в воздействии на многоэтапный онкогенез (Workman P., Cancer Lett. 2004 Apr 8; 206(2):149-57; PMID: 15013520). В раковых клетках, которые характеризуются генетической неустойчивостью, возможно, что 17AAG блокированием активности Hsp90 высвобождает разнообразные мутации, которые вместе оказываются «синтетически летальными» для опухоли. Нормальные клетки, которые лишены генетической неустойчивости опухолевых клеток, являются относительно не пораженными (Garber, K., 2002, Journal of the National Cancer Institute, vol. 94, No. 22, p1666-1668). Значительная проблема с 17AAG состоит в том, что препарат является слишком токсичным для длительной терапии, и, следовательно, существует необходимость в нетоксичном замещении (Banerji et al., см. выше).
Иматиниб месилат (Gleevec (RTM)) представляет собой мелкомолекулярный ингибитор тирозинкиназы, который оказывал существенное воздействие на неопластическое заболевание в качестве единственного средства. Первоначально предназначенный в качестве ингибитора тирозинкиназы Bcr-Abl, характерной для злокачественных процессов, несущих патогенную транслокацию 9;22, иматиниб оказался умеренно специфическим и оказывал существенное воздействие на лечение хронического миелогенного лейкоза (CML) и положительного по филадельфийской хромосоме (Ph1+) ALL (Krystal, GW, 2004, Leukemia Research 28S1:pS53-S59). Одной из проблем, связанных с лечением CML иматинибом, является устойчивость к препарату в результате мутаций в тирозинкиназе Bcr-Abl. Важно, что клетки CML, которые стали устойчивыми к иматинибу in vivo, сохраняют их зависимость от Hsp90 и, таким образом, остаются чувствительными к 17AAG.
В последних публикациях речь идет о том, что Hsp90 присутствует полностью в многокомпонентных комплексах, которые содействуют злокачественному прогрессированию, и что они являются привлекательными мишенями для противораковых терапевтических средств. В частности, речь идет о том, что Hsp90 в многокомпонентных комплексах, полученных из опухолевых клеток, имеют аффинитет связывания с 17AAG, который в 100 раз выше, чем Hsp90 из нормальных клеток (т.е. Hsp90 в его латентном, не связанном в комплексы состоянии), указывая на то, что в многокомпонентном комплексе он может проявлять эпитопы (в частности, четвертичные эпитопы), не проявляемые латентным, не связанным в комплексы Hsp90.
Антитело микограб (RTM) может связываться с Hsp90 в его латентном, не связанном в комплексы состоянии, а также в многокомпонентных комплексах без каких-либо побочных эффектов на кинетику связывания.
В WO 01/76627 речь идет о композициях для лечения грибковых инфекций, причем композиции включают комбинацию (i) полиена или противогрибкового средства в виде ингибитора синтазы бета-глюкана; и (ii) антитела, специфичные против грибкового Hsp90, причем композиции эффективны против грибка, вызывающего инфекцию, несмотря на его устойчивость к одному противогрибковому средству.
В соответствии с первым аспектом настоящего изобретения предоставляется применение
(i) антитела или его антиген-связывающего фрагмента, специфичного, по меньшей мере, к одному эпитопу Hsp90; и
(ii) по меньшей мере, одного противоракового средства, выбранного из группы, состоящей из: доксорубицина, даунорубицина, эпирубицина, герцептина, доцетаксела и цисплатина
в способе изготовления лекарственного средства для лечения рака.
Доксорубицин представляет собой антрациклиновое антибиотическое средство, ранее признанное в качестве противоопухолевого средства.
Эпирубицин представляет собой менее токсичный синтетический антрациклиновый антибиотик, также ранее признанный в качестве противоопухолевого средства.
Даунорубицин представляет собой антинеопластическое средство, используемое в ряде терапевтических областей, включая применение в качестве противоракового средства.
Герцептин (трастузумаб) представляет собой моноклональное антитело, применяемое для лечения метастатического рака молочной железы, избыточно экспрессирующего белок HER2.
Доцетаксел представляет собой признанное противораковое средство, и он является ингибитором митоза.
Цисплатин представляет собой признанное противораковое средство и включает комплекс платины.
Как в деталях описано ниже, в экспериментальных результатах («Эксперименты А»), доксорубицин и даунорубицин особенно предпочтительны и проявляют особенно хорошие синергические эффекты с анти-Hsp90 антителом. Герцептин также проявляет хорошие синергические эффекты с анти-Hsp90 антителом. Синергия также наблюдается с доцетакселом и цисплатином при комбинации с анти-Hsp90 антителом. Синергия между даунорубицином и антителом особенно очевидна в клетках, положительных по рецепторам эстрогенов, и, таким образом, лекарственные средства и способы лечения с использованием антитела и даунорубицина можно, в частности, применять (или вводить) по поводу наличия клеток, имеющих рецепторы эстрогенов.
Эксперименты («Эксперименты А») также показывают, что другие противораковые средства при использовании вместе с анти-Hsp90 антителом или проявляют неопределенные результаты (паклитаксел) или антагонизм (иматиниб). Это подтверждает удивительную/неожиданную природу синергии, достигаемой указанными выше противораковыми средствами, при комбинации с анти-Hsp90 антителом.
Предоставляется также комбинированный препарат, включающий:
(i) антитело или его антиген-связывающий фрагмент, специфичный, по меньшей мере, к одному эпитопу Hsp90; и
(ii) по меньшей мере, одно противораковое средство, выбранное из группы, состоящей из: доксорубицина, даунорубицина, эпирубицина, герцептина, доцетаксела и цисплатина,
для одновременного, отдельного или последовательного применения при лечении рака.
Также предоставляется способ лечения рака, включающий введение терапевтически эффективного количества
(i) антитела или его антиген-связывающего фрагмента, специфичного, по меньшей мере, к одному эпитопу Hsp90; и
(ii) по меньшей мере, одного противоракового средства, выбранного из группы, состоящей из: доксорубицина, даунорубицина, эпирубицина, герцептина, доцетаксела и цисплатина,
нуждающемуся в них пациенту.
Пока нет специального другого указания, используемый термин «лечение» имеет широкое значение. Таким образом, под «лечением» или «терапией» подразумевается любое лечение, которое предназначено для излечения, облегчения, устранения или уменьшения симптомов, или предотвращения или снижения вероятности развития расстройств или нарушений функций организма человека или животного. Таким образом, под термином «лечение» подразумевается и лечение патологических состояний, а также их профилактика.
Антитело или его антиген-связывающий фрагмент может быть специфичным для эпитопа, проявляемого пептидом, включающим последовательность SQ ID NO: 1.
Как обсуждено выше, хотя четвертичные эпитопы, проявляемые Hsp90 в многокомпонентных комплексах, были предложены в качестве соответствующих мишеней для лечения, эксперименты (ниже) показывают, что в действительности, линейный эпитоп представляет собой полезную и эффективную мишень для лечения.
Атитела, их получение и способы применения хорошо известны и раскрыты, например, в документе Harlow, E. and Lane, D., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1999.
Антитела можно генерировать, используя стандартные способы, известные в данной области. Примеры антител включают (но не ограничиваются) поликлональные, моноклональные, химерные, одноцепочечные фрагменты Fab, фрагменты, продуцируемые библиотекой экспрессии Fab, и антиген-связывающие фрагменты антител.
Антитела можно получить у ряда хозяев, например коз, кроликов, крыс, мышей, людей и других. Они могут быть иммунизированы инъекцией грибковых стрессовых белков или любого его фрагмента или олигопептида, который имеет иммуногенные свойства. В зависимости от вида хозяина можно использовать различные адъюванты для увеличения иммунологической реакции. Такие адъюванты включают, но не ограничиваются, полный адъювант Фрейнда, минеральные гели, такие как гидроксид алюминия, и поверхностно-активные вещества, такие как лизолецитин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцинанин моллюска Megathura cremulata и динитрофенол. Среди адъювантов, используемых у людей, особенно полезны БЦЖ (бацилла Кальмета-Герена) и Corynebacterium parvum.
Моноклональные антитела к грибковым белкам или их фрагментам или олигопептидам можно получить с использованием любой методики, которая обеспечивает продукцию молекул антител постоянными линиями клеток в культуре. Они включают, но не ограничиваются, методику гибридомы, методику гибридомы человеческих В клеток и методику гибридомы EBV (вируса Эпштейна-Барра) (Koehler et al., 1975, Nature, 256: 495-497; Kosbor et al., 1983, Immunol. Today 4: 72; Cote et al., 1983, PNAS USA, 80: 2026-2030; Cole et al., 1985, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss Inc., New York, pp. 77-96).
Кроме того, можно использовать методики, разработанные для продукции «химерных антител», сплайсинга гена мышиного антитела в гены человеческого антитела для получения молекулы с соответствующей антигенной специфичностью и биологической активностью (Morrison et al., 1984, PNAS USA, 81: 6851-6855; Neuberger et al., 1984, Nature, 312: 604-608; Takeda et al., 1985, Nature, 314: 452-454). Альтернативно, можно адаптировать методики, описанные для получения одноцепочечных антител, используя способы, известные в данной области, для получения специфичных для грибковых стрессовых белков одноцепочечных антител. Антитела с родственной специфичностью, но с отличным идиотипическим составом, можно генерировать перетасовкой цепи из случайных комбинаторных библиотек иммуноглобулина (Burton, D.R., 1991, PNAS USA, 88: 11120-11123).
Антитела можно также получить индукцией выработки in vivo в популяции лимфоцитов или скринингом библиотек рекомбинантного иммуноглобулина или панелей реагентов высокоспецифичного связывания (Orlandi et al., 1989, PNAS USA, 86: 3833-3837; Winter, G. et al., 1991, Nature, 349: 293-299).
Можно также получать антиген-связывающие фрагменты, например, фрагменты F(ab')2, которые можно получить перевариванием молекулы антитела пепсином, и фрагменты Fab, которые можно получать восстановлением дисульфидных мостиков фрагментов F(ab')2. Альтернативно, библиотеки экспрессии Fab можно сконструировать для обеспечения возможности быстрой и легкой идентификации фрагментов моноклонального Fab с желательной специфичностью (Huse et al., 1989, Science, 256: 1275-1281).
Различные иммунные анализы можно использовать для скрининга с целью идентификации антител, обладающих желательной специфичностью. Многочисленные протоколы конкурентного связывания или иммунорадиометрических анализов с использованием или поликлональных, или моноклональных антител с установленной специфичностью хорошо известны в данной области. Такие иммунные анализы обычно включают измерение образования комплексов между грибковым стрессовым белком или его любым фрагментом или олигопептидом и его специфическим антителом. Можно использовать двухсайтовый иммунный анализ на моноклональной основе с использованием моноклональных антител, специфичных к двум не интерферирующим эпитопам грибкового стрессового белка, но также можно использовать конкурентный анализ связывания (Maddox et al., 1983, J. Exp. Med., 158: 1211-1216).
Например, антитело, используемое в композиции или комбинированном препарате, может включать последовательность SEQ ID NO: 2.
Было обнаружено, что формы рака, которые можно успешно лечить, включают фибросаркомы и карциномы, выбранные из группы, состоящей из карциномы молочной железы, предстательной железы, меланомы, лейкоза, лимфом, карциномы ободочной кишки, зародышевоклеточной карциномы семенников, карциномы поджелудочной железы, яичников, эндометрия, щитовидной железы и легких.
В соответствии со вторым аспектом настоящего изобретения предоставляется применение
(i) антитела или его антиген-связывающего фрагмента, специфичного, по меньшей мере, к одному эпитопу Hsp90;
в способе изготовления лекарственного средства для лечения лейкоза.
Также предоставляется применение
(i) антитела или его антиген-связывающего фрагмента, специфичного, по меньшей мере, к одному эпитопу Hsp90; и
(ii) по меньшей мере, одного противоракового средства, выбранного из группы, состоящей из: иматиниба, паклитаксела, доцетаксела, даунорубицина, доксорубицина и гидроксимочевины,
в способе изготовления лекарственного средства для лечения лейкоза.
Иматиниб, производное 2-фениламинопиримидина, представляет собой мелкомолекулярный антагонист с активностью против белковых протеинкиназ и проявляет сильное и специфическое ингибирование Bcr-Abl. Иматиниб показан для лечения пациентов с CML, при бластных кризах, ускоренной фазе или при хронической фазе после неудачи лечения IFN (интерфероном).
Паклитаксел представляет собой химиотерапевтическое средство, которое вводят в качестве лечения по поводу некоторых типов рака. Он чаще всего применяется для лечения рака яичников, молочной железы и не мелкоклеточного рака легких.
Доцетаксел представляет собой противораковое средство и является ингибитором митоза.
Даунорубицин представляет собой антинеопластический препарат, используемый в ряде терапевтических областей, включая применение в качестве противоракового средства.
Доксорубицин представляет собой антрациклиновое антибиотическое средство, ранее признанное в качестве противоопухолевого средства.
Гидроксимочевина представляет собой антинеопластическое средство, являющееся ингибитором рибонуклеотидредуктазы.
Как детально описано ниже, в экспериментальных результатах («Эксперименты В»), доксетаксел и паклитаксел особенно предпочтительны и проявляют особенно хорошие синергические эффекты с анти-Hsp90 антителом. Синергия также наблюдается с иматинибом, доксорубицином, даунорубицином и гидроксимочевиной при комбинации с анти-Hsp90 антителом. Противораковое средство цисплатин при использовании вместе с анти-Hsp90 антителом проявило неопределенные результаты. Это подтверждает удивительную/неожиданную природу синергии, достигаемой указанными выше противораковыми средствами при комбинации с анти-Hsp90 антителом.
Также предоставляется комбинированный препарат, включающий:
(i) антитело или его антиген-связывающий фрагмент, специфичные, по меньшей мере, к одному эпитопу Hsp90; и
(ii) по меньшей мере, одно противораковое средство, выбранное из группы, состоящей из иматиниба, паклитаксела, доцетаксела, даунорубицина, доксорубицина и гидроксимочевины,
для одновременного, отдельного или последовательного применения при лечении лейкоза.
Примеры комбинированных препаратов включают фармацевтические упаковки, содержащие антитело (i) и, по меньшей мере, одно противораковое средство (ii) в отдельных объемах (т.е. не смешанные вместе в одном препарате).
Предоставляется также способ лечения лейкоза, включающий введение терапевтически эффективного количества
(i) антитела или его антиген-связывающего фрагмента, специфичных, по меньшей мере, к одному эпитопу Hsp90; и
(ii) по меньшей мере, одного противоракового средства, выбранного из группы, состоящей из: иматиниба, паклитаксела, доцетаксела, даунорубицина, доксорубицина и гидроксимочевины,
для лечения нуждающегося в нем пациента.
Лейкоз может представлять собой хронический миелоидный лейкоз или острый лимфоидный лейкоз, и, по меньшей мере, одно противораковое средство может представлять собой иматиниб.
Антитело или его антиген-связывающий фрагмент могут быть специфичными к эпитопу, проявляемому пептидом, включающим последовательность SEQ ID NO:1.
Например, антитело, используемое в композиции или комбинированном препарате, может включать последовательность SEQ ID NO:2.
Противораковое средство может представлять собой иматиниб.
Было обнаружено, что лейкозы, которые можно успешно лечить, включают лейкозы, выбранные из группы, состоящей из острого миелобластического лейкоза, острого лимфобластического лейкоза, хронического миелоидного лейкоза и хронического лимфоцитарного лейкоза.
Лейкоз может представлять собой хронический миелоидный лейкоз или острый лимфоидный лейкоз.
Хронический миелоидный лейкоз может быть Ph1-положительным или Ph1-отрицательным, т.е. характеризуется лейкозными клетками, которые содержат филадельфийскую хромосому (Ph1-положительные), или не содержат филадельфийскую хромосому (Ph1-отрицательные).
Было обнаружено, что хронический миелоидный лейкоз, который можно успешно лечить иматинибом, может быть или Ph1-положительным, или Ph1-отрицательным.
Лейкоз может представлять собой хронический миелоидный лейкоз, который является Ph1-положительным, а противораковое средство может представлять собой иматиниб. В частности, заявитель обнаружил лечение CML, который является Ph1-положительным, можно осуществить комбинацией иматиниба и антитела, включающего последовательность SEQ ID NO:2. Не желая быть связанным с какой-либо теорией, заявитель предполагает, что Hsp90, возможно, секвестрируется антителом, включающим последовательность SEQ ID NO:2, что, в свою очередь, означает, что аномальная Bcr-Abl тирозинкиназа (которая вызывает нарушенный миелопоэз, обнаруживаемый при CML), например, неправильно уложена, нацелена на разрушение белка, и/или существуют препятствия оказанию ее эффектов на миелопоэтические пути.
Это лечение, кроме того, эффективно в отношении устойчивых к иматинибу Ph1-положительных клеток CML. Без желаемой связи с какой-либо теорией устойчивость к иматинибу, вероятно, связана с накопленными мутациями в аномальной Bcr-Abl тирозинкиназе, которые могут, например, помешать препарату связываться с белком и/или препятствовать действию препарата. Возможно, что в клетках, устойчивых к иматинибу, секвестрация Hsp90 антителом, включающим последовательность SEQ ID NO:2, вызывает неправильную укладку, нацеливание на разрушение белка и/или препятствие оказанию эффектов на миелопоэтические пути мутированной аномальной тирозинкиназы. Секвестрация Hsp90, которая обычно служит для «забуферивания» генетических мутаций, связанных с раковыми клетками, связыванием с аномальными белками и блокированием их экспрессии может также вызвать высвобождение разнообразных мутаций, которые вместе оказываются синтетически летальными для опухолевой клетки. Нормальные клетки, которые лишены генетической нестабильности опухолевых клеток, являются относительно не пораженными.
Кроме того, и к особому удивлению, заявитель обнаружил, что лечение CML, который является Ph1-отрицательным, можно осуществить комбинацией иматиниба и антитела, включающего последовательность SEQ ID NO:2.
Лейкоз может представлять собой хронический миелоидный лейкоз, который является Ph1-отрицательным, а противораковое средство может представлять собой иматиниб.
Эти данные удивительны, потому что клетки Ph1-отрицательного CML лишены аномального белка тирозинкиназы, связанного с Ph1-положительными клетками. Однако и без желаемой связи с какой-либо теорией, возможно, что имеются низкие или базальные уровни этой киназы (аномальной или иной) в Ph1-отрицательных клетках, и, как описано выше, то, что секвестрация Hsp90 осуществляется антителом, включающим последовательность SEQ ID NO:2, означает, что белок тирозинкиназы, например, неправильно уложен или нацелен на разрушение белка или каким-то образом имеет препятствия оказанию его эффектов на миелопоэтические пути. Может также иметь место то, что путем секвестрации Hsp90, опухолевыми клетками высвобождаются разнообразные мутации, которые вместе оказываются синтетически летальными.
Удивительный эффект иматиниба и анти-Hsp90 антитела в Ph1-отрицательных клетках может быть вызван присутствием слияния TEL(ETV6)-ABL, которое было продемонстрировано в двух случаях Ph1-отрицательного CLM (Krystal, GW, 2004, Leukemia Research 28S1:pS53-S59), и который чувствителен к иматинибу.
Лейкоз может характеризоваться клетками, которые устойчивы к иматинибу.
Композиция или препарат по настоящему изобретению может, кроме того, включать известный ингибитор Hsp90, например AG или 17-AAG.
Третий аспект настоящего изобретения (эксперименты С) относится к новым лекарственным средствам и препаратам, включающим эффективные противораковые средства вместе с анти-Hsp90 антителом, которые вместе обеспечивают повышенную эффективность при лечении рака ободочной и прямой кишки или аденокарцином.
Рак ободочной и прямой кишки представляет собой злокачественную опухоль ободочной и прямой кишки. Рак ободочной и прямой кишки представляет собой ведущую причину осложнений и смертности при раке. Это третья по частоте форма рака у мужчин и вторая по частоте форма рака в Великобритании. 95% раковых опухолей ободочной и прямой кишки представляют собой аденокарциномы, которые представляют собой раковые опухоли из железистых клеток, которые выстилают внутреннюю часть ободочной и прямой кишки.
Стандартное лечение рака ободочной и прямой кишки представляет собой обычно комбинацию 5-фторурацила и лейковорина (фолиновой кислоты).
5-фторурацил (5-FU) используется для лечения ряда солидных опухолей, включая желудочно-кишечные раковые опухоли и рак молочной железы. Он обычно применяется с фолиновой кислотой при запущенном раке ободочной и прямой кишки. 5-FU превращается в FdUMP в клетке, который образует комплекс с тимидилатсинтазой (TS), ингибирующей синтез ДНК, белка и РНК.
Фолиновая кислота (лейковорин) представляет собой витамин, который вводится в комбинации с 5-FU. Фолиновая кислота увеличивает частоту реакции на 5-фторурацил при значительном удлинении выживания без признаков заболевания и общего выживания. Фолиновая кислота увеличивает внутриклеточное количество фолата и стабилизирует комплекс FdUMP/TS.
Другие средства, которые, как обнаружено, оказывают эффект, включают иринотекан и оксалипатин, которые лицензированы в качестве средства первой линии у пациентов с запущенным раком ободочной и прямой кишки в комбинации с 5-фторурацилом и фолиновой кислотой. Иринотекан или ралтитрексед лицензированы для применения в качестве монотерапии второй линии, когда терапия на основе фторурацила неудачна или нецелесообразна.
Оксалиплатин представляет собой признанное противораковое средство и содержит новое соединение диаминоциклогексанплатина, которое образует поперечные сшивки в ДНК и, таким образом, ингибирует репликацию ДНК.
“FOLFOX” представляет собой обычно применяемую комбинированную химиотерапию из 5-фторурацила, фолиновой кислоты и оксалиплатина.
Иринотекан (CPT-11, Campto) ингибирует топоизомеразу I, раскручивающий ДНК фермент, существенный для деления клеток, что приводит к остановке репликации с разрывами однонитевой ДНК. В Великобритании иринотекан лицензирован для применения у пациентов с запущенным раком ободочной и прямой кишки, не подвергавшихся химиотерапии, в комбинации с 5FU/FA и в качестве единственного средства для химиотерапии второй линии у пациентов, у которых установленная схема на основе 5FU была безуспешной.
Ралтитрексед (ZD 1694, Tomudex) ингибирует фермент тимидилат синтетазу, который участвует в синтезе ДНК. Это тот же фермент, на который нацелен 5FU. Ралтитрексед лицензирован в Великобритании для паллиативного лечения запущенного рака ободочной и прямой кишки, когда схемы на основе 5FU/FA или непереносимы, или нецелесообразны (см. Tebbutt et al., 2002, European Journal of Cancer, 38: 1000-1015; Cutsem et al., 2002, Best Practice and Research Clinical Gastroenterology, 16: 319-330; Beretta et al., 2004, Surgical Oncology, 13: 63-73; NICE guidelines for Irinotecan, Oxaliplatin and raltitrexed for advanced colorectal cancer, 2002).
В соответствии с третьим аспектом настоящего изобретения предоставляется применение
(i) антитела или его антиген-связывающего фрагмента, специфичного, по меньшей мере, к одному эпитопу Hsp90; и
(ii) по меньшей мере, одного противоракового средства, выбранного из группы, состоящей из 5-фторурацила, оксалиплатина, иринотекана и ралтитрекседа
в способе изготовления лекарственного средства для лечения рака.
Альтернативно предоставляется комбинированный препарат, включающий:
(i) антитело или его антиген-связывающий фрагмент, специфичный, по меньшей мере, к одному эпитопу Hsp90; и
(ii) по меньшей мере, одно противораковое средство, выбранное из группы, состоящей из: 5-фторурацила, оксалиплатина, иринотекана и ралтитрекседа
для одновременного, отдельного или последовательного применения при лечении рака.
В соответствии с еще одним аспектом настоящего изобретения предоставляется способ лечения рака, включающий введение терапевтически эффективного количества
(i) антитела или его антиген-связывающего фрагмента, специфичного, по меньшей мере, к одному эпитопу Hsp90; и
(ii) по меньшей мере, одного противоракового средства, выбранного из группы, состоящей из 5-фторурацила, оксалиплатина, иринотекана и ралтитрекседа
нуждающемуся в них пациенту.
Предпочтительно, рак представляет собой рак или аденокарциному ободочной и прямой кишки.
Наиболее предпочтительно, противораковое средство 5-фторурацил, кроме того, включает или вводится с фолиновой кислотой (лейковорином).
Дополнительно или альтернативно, 5-фторурацил, фолиновая кислота и оксалиплатин вводятся вместе.
Композиция или препарат в соответствии с любым аспектом настоящего изобретения может дополнительно включать фармацевтически приемлемый носитель, разбавитель или наполнитель. Аналогичным образом, любой способ изготовления по настоящему изобретению или применения может таким же образом также включать применение фармацевтически приемлемого носителя, разбавителя или наполнителя. Примеры фармацевтически приемлемых носителей, разбавителей и наполнителей хорошо известны в данной области, например, см.: Remington's Pharmaceutical Sciences and US Pharmacopoeia, (1984, Mack Publishing Company, Easton, PA, USA).
Лекарственные средства или комбинированный препарат можно, например, вводить перорально, хотя это не означает, что следует исключить другие пути введения.
Антитело или его антиген-связывающий фрагмент в соответствии с настоящим изобретением могут быть меченными выявляемой меткой или могут быть конъюгированы с эффекторной молекулой, например, препаратом, таким как противораковое средство, такое как доксорубицин, даунорубицин, или цисплатин, или 5-фторурацил, оксалиплатин, иринотекан или фармацевтическое средство, которое можно применять при лечении лейкоза, например иматиниб, паклитаксел, доцетаксел, даунорубицин, доксорубицин и гидроксимочевина. Или токсин, такой как рицин, или фермент, используя обычные процедуры, и изобретение распространяется на такие меченые антитела или конъюгаты антител.
При желании смеси антител можно использовать для диагностики или лечения, например, смеси двух или более антител, распознающих различные эпитопы стрессового белка в соответствии с изобретением, и/или смеси антител другого класса, например смеси IgG и IgM антител, распознающих тот же или другой эпитоп(ы) по изобретению.
Как обсуждалось выше, хотя четвертичные эпитопы, проявляемые Hsp90 в многокомпонентных комплексах, были предложены в качестве соответствующих мишеней для лечения, эксперименты (ниже) показывают, что, в действительности, линейный эпитоп представляет собой полезную и эффективную мишень для лечения.
Содержание каждой из обсужденных здесь ссылок, включая приведенные в них ссылки, полностью включено сюда в качестве ссылки.
Когда указано “PMID” и для публикаций приведены номера ссылок, то это идентификационные номера PubMed, присвоенные им Национальной Медицинской Библиотекой США, в которой имеется полная библиографическая информация и реферат для каждой публикации на сайте . Этот сайт может также обеспечить прямой доступ к электронным копиям полных публикаций, в частности, в случае, например, публикаций PNAS, JBC и MBC.
Настоящее изобретение будет еще очевиднее из следующего описания, которое показывает, только в качестве примера, определенные варианты осуществления композиции и экспериментирования с ней.
Эксперименты
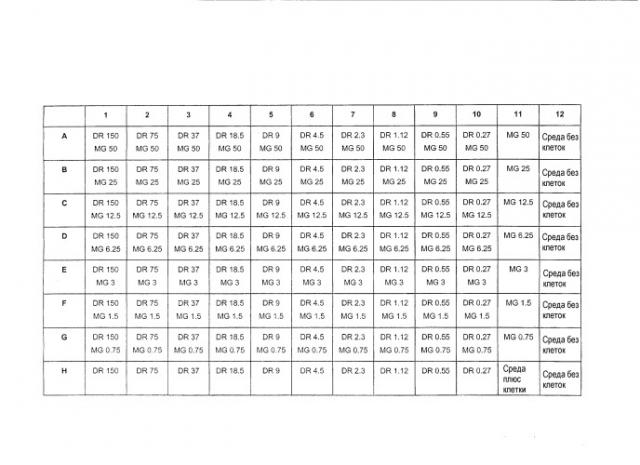
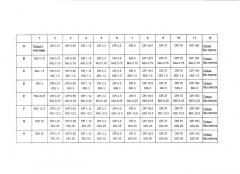
В первой группе экспериментов («Эксперименты А»), описанной ниже, приведены детали исследования противоракового эффекта анти-Hsp90 антитела, имеющего последовательность SEQ ID NO: 2, и специфичного для эпитопа, проявляемого пептидом, имеющим последовательность SEQ ID NO: 1, используемого отдельно или в комбинации с противораковыми средствами доксорубицином, даунорубицином, доцетакселом, герцептином, иматинибом, цисплатин