Способы лечения боли, обусловленной раком кости, путем введения антагониста фактора роста нервов
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована при лечении боли, обусловленной раком кости. Способ заключается во введении пациенту эффективного количества антагониста фактора роста нервов (NGF), представляющего собой антитело против NGF. Набор включает в себя антагонист NGF в виде антитела против NGF и инструкции по его использованию. Изобретения позволяют эффективно купировать указанный болевой синдром, как постоянный, так и вызываемый движением, за счет высокого сродства антитела к NGF без влияния при этом на исходные пороги тепловой и механической чувствительности. 2 н. и 18 з.п. ф-лы, 14 ил., 4 табл.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка имеет приоритет предварительных заявок на патент США № 60/620654, поданной 19 октября 2004 г., и 60/560781, поданной 7 апреля 2004 г., которые полностью включены в данное описание изобретения в качестве ссылки.
Заявление о государственном финансировании исследований или разработок
Настоящее изобретение сделано при поддержке правительства США на основании грантов 5R37-NS23970-16, 5R01-DA11986-05 и 1R01-NS048021-01A1, предоставленных Национальными институтами здравоохранения. Правительство США обладает определенными правами на данное изобретение.
Область техники, к которой относится изобретение
Настоящее изобретение относится к применению антагониста фактора роста нервов (NGF) для профилактики, ослабления или лечения боли, обусловленной раком кости.
Уровень техники
Фактор роста нервов (NGF) был первым идентифицированным нейротрофином, поэтому его роль в развитии и сохранении жизнеспособности периферических и центральных нейронов хорошо исследована. Установлено, что NGF имеет исключительно важное значение для сохранения жизнеспособности в процессе развития периферических симпатических и эмбриональных сенсорных нейронов, а также базальных холинергических нейронов переднего мозга (Smeyne, et al. Nature 368:246-249 (1994); Crowley, et al., Cell 76:1001-1011 (1994)). NGF повышает экспрессию нейропептидов в сенсорных нейронах (Lindsay et al., Nature 337:362-364 (1989)), и его активность опосредована двумя разными мембраносвязанными рецепторами, а именно рецептором тирозинкиназы TrkА и рецептором р75, которые в структурном отношении родственны другим членам семейства рецепторов фактора некроза опухолей (Chao, et al., Science 232:518-521 (1986)).
Помимо воздействия на нервную систему, NGF участвует в процессах, не связанных с нервной системой. Например, установлено, что NGF повышает сосудистую проницаемость у крыс (Otten et al., Eur. J. Pharmacol. 106:199-201 (1984)), усиливает Т- и В-клеточные иммунные реакции (Otten, et al., Proc. Natl. Acad. Sci. USA 86: 10059-10063 (1989)), индуцирует дифференцировку лимфоцитов и пролиферацию мастоцитов (Matsuda et al., Proc. Natl. Acad. Sci. USA 85:6508-6512 (1988); Pearce et al., J. Physiol. 372:379-393 (1986); Bischoff et al., Blood 79:2662-2669 (1992); Horigome et al., J. Biol. Chem. 268:14881-14887 (1993)). Хотя известно, что экзогенно вводимый NGF может оказывать все вышеуказанные действия, необходимо отметить, что эндогенный NGF участвует в указанных процессах in vivo лишь в очень редких случаях (Torcia et al., Cell. 85(3):345-56 (1996)). Поэтому не ясно, каким может быть эффект ингибирования биологической активности эндогенного NGF, если такой эффект вообще будет иметь место.
Фактор роста нейронов продуцируют разные клетки, в том числе мастоциты (Leon et al., Proc. Natl. Acad. Sci. USA 91: 3739-3743 (1994)), B-лимфоциты (Torcia et al., Cell 85:345-356 (1996)), кератиноциты (Di Marco et al., J. Biol. Chem. 268:22838-22846)), клетки гладких мышц (Ueyama et al., J. Hypertens. 11:1061-1065 (1993)), фибробласты (Lindholm et al., Eur. J. Neurosci. 2:795-801 (1990)), эпителиальные клетки бронхов (Kassel et al., Clin. Exp. Allergy 31:1432-40 (2001)), клетки почечного мезангия (Steiner et al., Am. J. Physiol. 261:F792-798 (1991)) и мышечные трубочки скелетных мышц (Schwartz et al., J. Photochem. Photobiol. B66:195-200 (2002)). Рецепторы NGF были обнаружены на клетках разных типов, не относящихся к нервной системе. Например, рецептор TrkA обнаружен на моноцитах, Т- и В-лимфоцитах и мастоцитах человека.
Взаимосвязь между повышенными уровнями NGF и разными воспалительными заболеваниями наблюдается как у людей, так и в нескольких животных моделях. Указанные заболевания включают системную красную волчанку (Bracci-Laudiero et al., Neuroreport 4:563-565 (1993)), рассеянный склероз (Bracci-Laudiero et al., Neurosci. Lett. 147:9-12 (1992)), псориаз (Raychaudhuri et al., Acta Derm. l'enereol. 78:84-86 (1998)), артрит (Falcimi et al., Ann. Rheum. Dis. 55:745-748 (1996)), интерстициальный цистит (Okragly et al., J. Urology 161:438-441 (1991)), астму (Braun et al., Eur. J. Immunol. 28:3240-3251 (1998)), панкреатит и простатит.
Повышенное содержание NGF в периферических тканях также ассоциировано с воспалением и наблюдается в целом ряде форм артрита. В синовиальной оболочке субъектов, страдающих ревматоидным артритом, экспрессированы высокие уровни NGF, в то время как в невоспаленной синовиальной оболочке NGF не был обнаружен (Aloe et al., Arch. Rheum. 35:351-355 (1992)). Аналогичные результаты были получены у крыс, у которых экспериментально индуцировали ревматоидный артрит (Aloe et al., Clin. Exp. Rheumatol. 10:203-204 (1992); Halliday et al., Neurochem. Res. 23:919-22 (1998)). Повышенные уровни NGF были обнаружены у трансгенных мышей, страдающих артритом, наряду с увеличением числа мастоцитов (Aloe et al., Int. J. Tissue Reactions-Exp. Clin. Aspects 15:139-143 (1993)).
Лечение экзогенным NGF усиливает боль и повышает болевую чувствительность. Данное заявление можно проиллюстрировать тем, что инъекция NGF значительно усиливает боль и повышает болевую чувствительность в двух животных моделях (Lewin et al., J. Neurosci. 13:2136-2148 (1993); Amann et al., Pain 64, 323-329 (1996); Andreev et al., Pain 63, 109-115 (1995)) и у человека (Dyck et al., Neurology 48, 501-505 (1997); Petty et al., Annals Neurol. 36, 244-246 (1994)). NGF, по-видимому, воздействует в соответствии с несколькими механизмами, включая индукцию BDNF нейротрофина (Apfel et al., Mol. Cell. Neurosci. 7(2), 134-142 (1996); Michael et al., J. Neurosci. 17, 8476-8490 (1997)), который в свою очередь изменяет обработку болевого сигнала в спинном мозге (Hains et al., Neurosci. Lett. 320(3), 125-8 (2002); Miletic et al., Neurosci. Lett. 319(3), 137-40 (2002); Thompson et al., Proc. Natl. Acad. Sci. USA 96(14), 7714-8 (1999)), вызывая изменение периферических и центральных соединений сенсорных нейронов и других болепередающих нейронов в спинном мозге (Lewin et al., European Journal of Neuroscience 6, 1903-1912 (1994); Thompson et al., Pain 62, 219-231 (1995)), изменение роста аксонов (Lindsay R.M., J. Neurosci. 8(7), 2394-405 (1988)), экспрессию рецептора брадикинина (Peterson et al., Neuroscience 83:161-168 (1998)), изменение экспрессии генов, ответственных за активацию нервов и проводящие пути, такие как ионные каналы (Boettger et al., Brain 125(Pt2), 252-63 (2002); Kerr et al., Neuroreport 12(14), 3077-8 (2001); Gould et al., Brain Res. 854(1-2), 19-29 (2000); Fjell et al., J. Neurophysiol. 81:803-810 (1999), усиление ассоциированного с болью рецептора TRPV1 (Chuang et al., Nature 411 (6840), 957-62 (2001); Shu and Mendell, Neurosci. Lett. 274:159-162 (1999)) и патологические изменения в мышцах (Foster et al., J. Pathol. 197(2), 245-55 (2002)). Многие указанные изменения происходят непосредственно в болепередающих сенсорных нейронах и, по-видимому, не зависят от сопутствующего воспаления. Кроме того, известны по крайней мере два других типа клеток, реагирующих на NGF, которые могут изменять восприятие боли и болевую чувствительность. Вышеуказанные клетки первого типа, мастоцицы, реагируют на NGF утратой зернистости (Yan et al., Clin. Sci. (Lond) 80:565-569 (1991) или, как указано в других исследованиях, увеличивают продуцирование или высвобождение медиаторов совместно с другими агентами (Pearce and Thompson, J. Physiol. 372:379-393 (1986), Kawamoto et al., J. Immunol. 168:6412-6419 (2002)). Как было установлено у крыс, NGF-опосредованные болевые реакции по крайней мере частично обусловлены мастоцитами (Lewin et al., Eur. J. Neurosci. 6:1903-1912 (1994), Woolf, et al., J. Neurosci. 16:2716-2723 (1996)), хотя возможную причастность указанных клеток необходимо продемонстрировать у человека. Кроме того, известно, что первичные симпатические нейроны реагируют на NGF и также участвуют в передаче болевых сигналов (Aley et al., Neuroscience 71:1083-1090 (1996)). Ясно, что устранение иннервации симпатических нейронов изменяет гипералгезию, которая обычно возникает при лечении NGF (Woolf et al., J. Neurosci. 16:2716-2723 (1996)).
В научной литературе описано применение антагонистов NGF, таких как антитело против NGF, при лечении разных типов боли. См., например, заявки на патент США №№ 10/682331, 10/682638, 10/682332 (публикация № 2004/0131615), 10/783730 (публикация № 2004/0253244), 10/745775 (публикация № 2004/0237124), 10/791162, PCT/US03/32089 (WO 04/032870), PCT/US03/32083 (WO 2005/000194), PCT/US03/32113, PCT/US2004/05162 (WO 04/073653), PCT/US03/41252 (WO 04/058184).
Боль, обусловленная раком кости, может быть вызвана у человека первичной опухолью кости или более вероятно метастазами в кость (например, образующимися в результате рака молочной железы, предстательной железы или легкого). См. публикацию Luger et al., Pain 99:397-406 (2002). Созданная модель боли, обусловленной раком кости, у мышей отражает боль от умеренной до сильной, испытываемую человеком в случае рака кости. См. публикации Luger et al., Pain 99:397-406 (2002); Clohisy et al., Clinical Orthopaedics and Related Research 415S:S279-S288 (2003); Schwei et al., J. Neruosci. 19:10886-10897 (1999); Honore et al., Nat. Med. 6:521-529 (2000). В статьях Honore et al. и Schwei et al. указано, что нейрохимическая картина изменений, наблюдаемых в спинном мозге и DRG животных, страдающих раком кости, являются уникальными и отличаются от типичной воспалительной или нейропатической боли, хотя в биохимической картине данной модели могут присутствовать компоненты, аналогичные классической воспалительной и нейропатической боли. Honore et al., Neuroscience 98:585-598 (2000); Schwei et al., J. Neruosci. 19:10886-10897 (1999); Luger et al., Pain 99:397-406 (2002).
Все научные работы, приведенные в данной заявке, в том числе заявки на патент и публикации, полностью включены в настоящее описание изобретения в качестве ссылки.
Сущность изобретения
В основе настоящего изобретения лежит открытие того, что антагонисты NGF, такие как антитело против NGF, позволяют эффективно лечить боль, обусловленную раком кости, включая боль, ассоциированную с метастазированием рака в кость. Такое лечение направлено на устранение одного или нескольких признаков боли, обусловленной раком кости, включая боль, ассоциированную с метастазированием рака в кость, которая описана в настоящей заявке на патент.
Одним объектом настоящего изобретения является способ профилактики или лечения боли, обусловленной раком кости, включая боль, ассоциированную с метастазированием рака в кость (именуемую также “боль, вызываемая метастазами в кость”), путем введение антагониста фактора роста нервов (NGF). В некоторых вариантах осуществления изобретения антагонист NGF вводят вместе с наркотическим аналгетиком. В некоторых вариантах осуществления изобретения антагонист NGF вводят вместе с нестероидным противовоспалительным средством (NSAID). В некоторых вариантах осуществления изобретения антагонист NGF вводят вместе с наркотическим аналгетиком и NSAID. В некоторых вариантах осуществления изобретения антагонист NGF вводят без наркотического аналгетика. В некоторых вариантах осуществления изобретения антагонист NGF вводят без NSAID.
Другим объектом настоящего изобретения являются способы уменьшения вероятности возникновения боли, обусловленной раком кости, включая боль, ассоциированную с метастазированием рака в кость, ослабление боли, обусловленной раком кости, включая боль, ассоциированную с метастазированием рака в кость, временное облегчение боли, обусловленной раком кости, включая боль, ассоциированную с метастазированием рака в кость, и/или замедление появления или развития боли, обусловленной раком кости, включая боль, ассоциированную с метастазированием рака в кость, которые включают введение эффективного количества антагониста NGF. В некоторых вариантах осуществления изобретения антагонист NGF вводят вместе с наркотическим аналгетиком. В некоторых вариантах осуществления изобретения антагонист NGF вводят вместе с NSAID. В некоторых вариантах осуществления изобретения антагонист NGF вводят вместе с наркотическим аналгетиком и NSAID. В некоторых вариантах осуществления изобретения антагонист NGF вводят без наркотического аналгетика. В некоторых вариантах осуществления изобретения антагонист NGF вводят без NSAID.
В некоторых вариантах осуществления изобретения боль, обусловленная раком кости, возникает вследствие образования в кости раковой опухоли. В некоторых вариантах осуществления изобретения боль, обусловленная раком кости, возникает вследствие остеосаркомы. В некоторых вариантах осуществления изобретения боль, обусловленная раком кости, возникает вследствие метастазирования рака в кость. В некоторых вариантах осуществления изобретения метастазы в кость являются следствием метастазирования в кость рака предстательной железы. В некоторых вариантах осуществления изобретения метастазы в кость являются следствием метастазирования в кость рака молочной железы. В некоторых вариантах осуществления изобретения метастазы в кость являются следствием метастазирования в кость рака легкого. В некоторых вариантах осуществления изобретения метастазы в кость являются следствием метастазирования в кость саркомы. В некоторых вариантах осуществления изобретения метастазы в кость являются следствием метастазирования в кость рака почки. В некоторых вариантах осуществления изобретения метастазы в кость являются следствием метастазирования в кость множественной миеломы. В некоторых вариантах осуществления изобретения подлежащая лечению боль, обусловленная раком, находится в пределах от слабой до умеренной. В некоторых вариантах осуществления изобретения подлежащая лечению боль, обусловленная раком, находится в пределах от умеренной до сильной. В некоторых вариантах осуществления изобретения подлежащая лечению боль, обусловленная раком, является сильной.
Антагонистом NGF, пригодным для применения в способах по настоящему изобретению, является любой агент, который может прямо или косвенно уменьшать биологическую активность NGF. В некоторых вариантах осуществления изобретения антагонист NGF (например, антитело) связывается (физически взаимодействует) с NGF, связывается с рецептором NGF (таким как рецептор trkA и/или р75) и/или ослабляет (препятствует и/или блокирует) передачу сигналов рецептора NGF в нижней области (например, ингибиторы передачи сигнала киназы). Таким образом, в некоторых вариантах осуществления изобретения антагонист NGF связывается (физически взаимодействует) с NGF. В другом варианте осуществления изобретения антагонист NGF связывается с рецептором NGF (таким как рецептор TrkA и/или р75). В других вариантах осуществления изобретения антагонист NGF ослабляет (препятствует и/или блокирует) передачу сигналов рецептора NGF в нижней области (например, ингибиторы передачи сигнала киназы). В других вариантах осуществления изобретения антагонист NGF ингибирует (уменьшает) синтез и/или высвобождение NGF. В другом варианте осуществления изобретения антагонист NGF является иммуноадгезином TrkA. В некоторых вариантах осуществления изобретения антагонист NGF связывается с NGF (таким как NGF человека) и по существу не связывается с родственными нейротрофинами, такими как NT-3, NT-4/5 и/или BDNF. В некоторых вариантах осуществления изобретения антагонист NGF выбирают из одного или нескольких нижеследующих агентов: антитело против NGF, антисмысловая молекула к NGF (включая антисмысловую молекулу к нуклеиновой кислоте, кодирующей NGF), антисмысловая молекула к рецептору NGF (такому как trkA и/или р75) (включая антисмысловую молекулу к нуклеиновой кислоте, кодирующей рецептор NGF), ингибитор NGF, структурный аналог NGF, доминантноотрицательная мутация рецептора TrkA и/или р75, связывающего NGF, антитело против TrkA, антитело против р75 и ингибитор киназы. В другом варианте осуществления изобретения антагонистом NGF является антитело против NGF. В других вариантах осуществления изобретения антитело против NGF является гуманизированным антителом (таким как антитело Е3, описанное в настоящем описании изобретения). В некоторых вариантах осуществления изобретения антителом против NGF является антитело Е3 (описанное в настоящем описании изобретения). В других вариантах осуществления изобретения антитело против NGF содержит один или несколько гипервариабельных участков (комплементоопределяющая область, CDR) антитела Е3 (в частности, один, два, три, четыре, пять или в некоторых вариантах осуществления изобретения все шесть гипервариабельных участков антитела Е3). В других вариантах осуществления изобретения антитело является антителом человека. В некоторых вариантах осуществления изобретения данное антитело содержит три CDR из тяжелой цепи антитела Е3. В некоторых вариантах осуществления изобретения данное антитело содержит три CDR из легкой цепи антитела Е3. В других вариантах осуществления изобретения антитело против NGF содержит аминокислотную последовательность вариабельной области тяжелой цепи, показанную в таблице 1 (SEQ ID NO:1). В других вариантах осуществления изобретения антитело против NGF содержит аминокислотную последовательность вариабельной области легкой цепи, показанную в таблице 2 (SEQ ID NO:2). В других вариантах осуществления изобретения антитело против NGF содержит аминокислотную последовательность вариабельной области тяжелой цепи, показанную в таблице 1 (SEQ ID NO:1), и аминокислотную последовательность вариабельной области легкой цепи, показанную в таблице 2 (SEQ ID NO:2). В других вариантах осуществления изобретения антитело содержит модифицированную константную область, в частности иммунологически инертную константную область, которая, например, не запускает комплемент-опосредованный лизис или не стимулирует антителозависимую клеточно-опосредованную цитотоксичность (ADCC). В других вариантах осуществления изобретения константная область модифицирована в соответствии с описанием, приведенным в публикации Eur. J. Immunol. (1999) 29:2613-2624, в заявке РСТ № РСТ/GB99/01441 и/или в заявке на патент Великобритании № 9809951.8.
В некоторых вариантах осуществления изобретения антагонист NGF связывается с NGF. В других вариантах осуществления изобретения антагонистом NGF является антитело, которое специфически связывается с NGF (таким как NGF человека). В других вариантах осуществления изобретения указанное антитело по существу связывается с тем же эпитопом 6 NGF, что и антитело, выбираемое из одного или нескольких нижеследующих моноклональных антител мыши: Mab 911, MAb 912 и MAb 938 (см. публикацию Hongo, et al., Hybridoma 19:215-227 (2000)). В некоторых вариантах осуществления изобретения антагонист NGF связывается с рецептором trkA. Антагонистом NGF может быть моноклональное антитело против NGF человека (против hNGF), которое способно связываться с hNGF и эффективно ингибировать связывание hNGF с TrkA человека (hTrkA) и/или эффективно ингибировать активацию рецептора TrkA человека.
Сродство связывания антитела против NGF с NGF (таким как hNGF) может составлять около 0,10-1,0 нМ, около 0,10-0,80 нМ, около 0,15-0,75 нМ и около 0,18-0,72 нМ. В одном варианте осуществления изобретения сродство связывания составляет примерно 2-22 пМ. В одном варианте осуществления изобретения сродство связывания равно примерно 10 нМ. В других вариантах осуществления изобретения сродство связывания составляет менее примерно 10 нМ. В других вариантах осуществления изобретения сродство связывания равно примерно 0,1 нМ или примерно 0,07 нМ. В других вариантах осуществления изобретения сродство связывания составляет менее примерно 0,1 нМ или менее примерно 0,07 нМ. В других вариантах осуществления изобретения сродство связывания составляет около 100 нМ, около 50 нМ, около 10 нМ, около 1 нМ, около 500 пМ, около 100 пМ, от около 50 пМ до около 2 пМ, около 5 пМ, около 10 пМ, около 15 пМ, около 20 пМ или около 40 пМ. В некоторых вариантах осуществления изобретения сродство связывания составляет около 100 нМ, около 50 нМ, около 10 нМ, около 1 нМ, около 500 пМ, около 100 пМ, около 50 пМ или менее примерно 50 пМ. В некоторых вариантах осуществления изобретения сродство связывания составляет около 100 нМ, около 50 нМ, около 10 нМ, около 1 нМ, около 500 пМ, около 100 пМ или около 50 пМ. В других вариантах осуществления изобретения сродство связывания составляет около 2 пМ, около 5 пМ, около 10 пМ, около 15 пМ, около 20 пМ, около 40 пМ или более примерно 40 пМ. Как хорошо известно в данной области, сродство связывания может быть выражено в виде КD или константы диссоциации, и более высокое сродство связывания соответствует меньшему значению КD. Сродство связывания моноклонального антитела мыши против NGF 911 (Hongo et al., Hybridoma 19:215-227 (2000)) с NGF человека составляет около 10 нМ, и сродство связывания гуманизированного антитела Е3 против NGF (описанного в настоящем описании изобретения) с NGF человека составляет около 0,07 нМ. Значения сродства связывания для антитела 911 и Е3 измеряли, используя их Fab-фрагменты.
Антагонист NGF можно вводить до, во время и/или после диагностирования у субъекта рака кости или метастазирования рака в кость. Антагонист NGF можно вводить любыми способами, известными в данной области, которые включают пероральное, внутривенное, подкожное, внутриартериальное, внутримышечное, интракардиальное, интраспинальное, внутригрудное, внутрибрюшинное, внутрижелудочковое, подъязычное и/или трансдермальное введение. В некоторых вариантах осуществления изобретения антагонистом NGF является антитело против NGF, которое вводят одним или несколькими нижеследующими способами: внутривенно, подкожно, путем ингаляции, внутриартериально, внутримышечно, интракардиально, внутрижелудочково и внутрибрюшинно. Введение может быть системным, например внутривенным, или местным.
В некоторых вариантах осуществления изобретения антагонист NGF вводят в дозе около 0,1-10 мг/кг массы тела и в других вариантах осуществления изобретения антагонист NGF вводят в дозе около 0,3-20 мг/кг массы тела.
Другим объектом настоящего изобретения является композиция для лечения и/или профилактики боли, обусловленной раком кости, включая боль, ассоциированную с метастазированием рака в кость, которая включает эффективное количество антагониста фактора роста нервов (NGF) в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами. В некоторых вариантах осуществления изобретения антагонист NGF вводят вместе с наркотическим аналгетиком. В некоторых вариантах осуществления изобретения антагонист NGF вводят вместе с NSAID. В некоторых вариантах осуществления изобретения антагонист NGF вводят без наркотического аналгетика или NSAID. В некоторых вариантах осуществления изобретения антагонистом NGF является антитело, которое специфически связывается с молекулой NGF. В других вариантах осуществления изобретения антагонистом NGF является любой антагонист, описанный в настоящем описании изобретения.
Другим объектом настоящего изобретения является набор, предназначенный для использования в любых способах, представленных в данном описании изобретения. В некоторых вариантах осуществления изобретения указанный набор включает любые антагонисты NGF, описанные в настоящем описании изобретения, в комбинации с фармацевтически приемлемым носителем. В других вариантах осуществления изобретения указанный набор дополнительно включает инструкции по использованию антагониста NGF в любых способах, описанных в настоящем описании изобретения.
Краткое описание чертежей
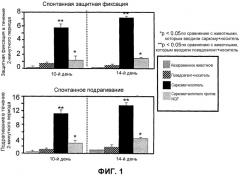
На Фиг.1 изображен график постоянной боли, которую определяли путем измерения спонтанной защитной фиксации и спонтанного подрагивания в течение двухминутного периода наблюдения на 10-й и 14-й день после инъекции саркомы. Определение “незараженный” (Naive) относится к животным, которым не делали никаких инъекций. “Псевдоагент + носитель” (Sham + veh.) относится к животным, которым сначала инъецировали α-минимальную эссенциальную среду в костный мозг бедренной кости и затем инъецировали физиологический раствор. “Саркома + носитель” (Sarc + veh.) относится к животным, которым сначала инъецировали саркому в костный мозг бедренной кости и затем инъецировали физиологический раствор. “Саркома + антитело против NGF” (Sarc + Anti-NGF) относится к животным, которым сначала инъецировали саркому в костный мозг бедренной кости и затем инъецировали антитело против NGF 911.
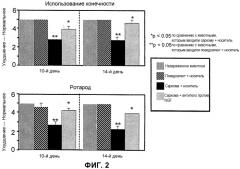
На Фиг.2 изображен график боли, возникающей в конечности при ходьбе, которую определяли по пользованию конечностью и защитной фиксации при принудительной ходьбе («беличье колесо», ротарод) на 10-й и 14-й день после инъекции саркомы. Определение “незараженный” (Naive) относится к животным, которым не делали никаких инъекций. “Псевдоагент + носитель” (Sham + veh.) относится к животным, которым сначала инъецировали α-минимальную эссенциальную среду в костный мозг бедренной кости и затем инъецировали физиологический раствор. “Саркома + носитель” (Sarc + veh.) относится к животным, которым сначала инъецировали саркому в костный мозг бедренной кости и затем инъецировали физиологический раствор. “Саркома + антитело против NGF” (Sarc + Anti-NGF) относится к животным, которым сначала инъецировали саркому в костный мозг бедренной кости и затем инъецировали антитело против NGF 911.
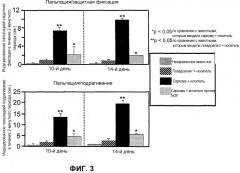
На Фиг.3 изображен график боли, вызываемой прикосновением, которую определяли по индуцированной пальпацией защитной фиксации и индуцированному пальпацией подрагиванию в течение двухминутного периода наблюдения на 10-й и 14-й день после инъекции саркомы. Определение “незараженный” (Naive) относится к животным, которым не делали никаких инъекций. “Псевдоагент + носитель” (Sham + veh.) относится к животным, которым сначала инъецировали α-минимальную эссенциальную среду в костный мозг бедренной кости и затем инъецировали физиологический раствор. “Саркома + носитель” (Sarc + veh.) относится к животным, которым сначала инъецировали саркому в костный мозг бедренной кости и затем инъецировали физиологический раствор. “Саркома + антитело против NGF” (Sarc + Anti-NGF) относится к животным, которым сначала инъецировали саркому в костный мозг бедренной кости и затем инъецировали антитело против NGF 911.
На Фиг.4 представлены фотографии, показывающие, что антитело против NGF не влияет на развитие болезни в кости на 14-й день (d14) после инъекции опухоли. Животные (n=8), которым вводили псевдоагент и носитель, показаны на фотографиях (а) и (d); животные (n=13), которым инъецировали саркому (GFP-трансфицированные) и носитель, показаны на фотографиях (b) и (е); и животные (n=8), которым инъецировали саркому (GFP-трансфицированные) и антитело против NGF, показаны на фотографиях (с) и (f). На Фиг.4а, 4b и 4с представлены рентгенограммы, показывающие наличие или отсутствие разрушения кости. На Фиг.4d, 4е и 4f представлены фотографии, на которых показано иммунное окрашивание антителом против GFP. Масштаб: шкала 1 мм.
На Фиг.5 представлены фотографии, показывающие, что лечение антителом против NGF не оказывает заметного воздействия на иннервацию сенсорных нейронов в коже. Образцы кожи задней лапы мышей, которым инъецировали саркому, (а, b) и незараженных мышей (с, d) подвергали иммунному окрашиванию пептидом, родственным гену кальцитонина нейропептида (CGRP), который метит немиелинизированные пептидергические сенсорные нервные волокна. На данной фигуре показано иммунное окрашивание CGRP образцов кожи задней лапы мышей (а, n=3), которым инъецировали саркому и носитель, мышей (b, n=8), которым инъецировали саркому и антитело против NGF, незараженных мышей, которым вводили носитель, (с, n=8) и незараженных мышей (d, n=8), которым вводили антитело против NGF. Масштаб: шкала 50 мкм.
На Фиг.6 изображены графики, показывающие, что введение антитела против NGF ослабляет боль, обусловленную раком кости. Время защитной фиксации и число спонтанных подрагиваний конечности, в которую инъецировали саркому, в течение двухминутного периода наблюдения использовали в качестве единицы измерения постоянной боли на 8-й, 10-й, 12-й и 14-й дни после инъекции и удерживания раковых клеток в левой бедренной кости (а, b). Показатели боли, возникающей при движении, включали количественное определение времени защитной фиксации и числа подрагиваний в течение двухминутного периода наблюдения с последующей обычно безболезненной пальпацией бедренной кости, в которую инъецировали саркому (с, d). “#” означает Р<0,05 по сравнению с введением псевдоагента и носителя, и “*” означает Р<0,05 по сравнению с введением саркомы и носителя.
На Фиг.7 изображены графики, показывающие, что введение антитела против NGF не влияет на исходный порог тепловой или механической чувствительности и является более эффективным, чем введение морфина (MS), для ослабления боли, обусловленной раком кости. На Фиг.7а и 7b показана тепловая чувствительность (а, n=8 для незараженных животных, которым вводили носитель, n=8 для незараженных животных, которым вводили антитело против NGF), измеренная в виде латентного периода отдергивания лапы под воздействием теплового раздражителя, и механическая чувствительность (b, n=8 для незараженных животных, которым вводили носитель, n=8 для незараженных животных, которым вводили антитело против NGF), измеренная в виде 50% порога механического раздражения при введении антитела против NGF (10 мг/кг, внутрибрюшинно, каждые 5 дней) у незараженных мышей. На Фиг.7с и 7d показана постоянная боль, которую определяли путем измерения спонтанной защитной фиксации (с) в течение двухминутного периода наблюдения, и боль, возникающая при движении, которую определяли путем измерения времени защитной фиксации (d) в течение двухминутного периода наблюдения с последующей обычно безболезненной пальпацией дистального отдела бедренной кости. На данной фигуре показаны значения спонтанной защитной фиксации (с) и защитной фиксации, вызванной пальпацией, (d) для незараженных мышей, псевдозараженных мышей, которым вводили носитель, мышей, которым инъецировали саркому и вводили носитель, мышей, которым инъецировали саркому и вводили морфин (n=8, внутрибрюшинно, 10 мг/кг за 15 минут до испытания), мышей, которым инъецировали саркому и вводили морфин (n=8, внутрибрюшинно, 30 мг/кг за 15 минут до испытания), и мышей, которым инъецировали саркому и антитело против NGF (n=8, внутрибрюшинно, 10 мг/кг каждые 5 дней с 6-го по 14-й день после инъекции опухоли). Планки погрешностей показывают стандартную ошибку средней (S.E.M.). “#”означает Р<0,05 по сравнению с введением псевдоагента и носителя (n=8); “*” означает Р<0,05 по сравнению с введением саркомы и носителя; “+” означает Р<0,05 по сравнению с введением саркомы и морфина.
На Фиг.8 представлены фотографии, показывающие, что введение антагонистического антитела против NGF позволяет уменьшить нейрохимические изменения и инфильтрацию макрофага в ганглий задних корешков (DRG) спинного мозга пораженных опухолью животных. На Фиг.8а и 8b показано иммунофлуоресцентное окрашивание фактора активации транскрипции 3 (ATF-3) в ипсилатеральном DRG L2 пораженных опухолью животных, которым вводили носитель (а, n=8) и антитело против NGF (b, n=8), через четырнадцать дней после имплантации опухоли. В нижнем блоке показано иммунофлуоресцентное окрашивание CD-68, характеризующее плотность активированных и инфильтрующихся макрофагов вокруг пораженных сенсорных нейронов в ипсилатеральном DRG пораженных опухолью животных, которым вводили носитель (с, n=7) и антитело против NGF (d, n=7). Масштаб: шкала для а-d = 5 мкм.
На Фиг.9 представлены микрофотографии, показывающие уменьшение нейрохимических изменений, ассоциированных с сенсибилизацией центральных нейронов, в результате введения антитела против NGF. На Фиг.9А и 9В показано иммуное окрашивание динорфина в заднем роге спинного мозга мышей, которым инъецировали саркому и вводили носитель (А, n=9), и мышей, которым инъецировали саркому и вводили антитело против NGF (B, n=4). На Фиг.9С и 9D показаны типичные конфокальные изображения с-Fos-экспрессирующих нейронов спинного мозга у мышей, которым инъецировали саркому и вводили носитель, (С, n=4) и у мышей, которым инъецировали саркому и вводили антитело против NGF, (D, n=4) с последующим выполнением обычно безболезненной пальпации конечностей, пораженных опухолью. Масштаб: шкала 150 мкм для А и В; 200 мкм для С и D.
На Фиг.10 изображены графики, показывающие, что лечение антителом против NGF ослабляет боль, обусловленную раком кости вследствие поражения опухолью предстательной железы. Лечение антителом против NGF (внутрибрюшинно, 10 мг/кг на 7-й, 12-й и 17-й день после инъекции опухоли) ослабляло постоянную боль, обусловленную раком кости, начиная с 7-го дня после инъекции опухоли на протяжении всего развития болезни. Время защитной фиксации и число спонтанных подрагиваний бедренной кости, в которую инъецировали АСЕ-1, в течение двухминутного периода наблюдения использовали в качестве единиц измерения постоянной боли (А, В). Антитело против NGF (закрашенный квадрат) значительно уменьшало постоянную боль у животных, которым инъецировали опухоль, по сравнению с животными, которым вводили АСЕ-1 и носитель (незакрашенный квадрат), причем все показатели снижались почти до уровней введения псевдоагента на 9-й день (кружок). Как защитная фиксация, так и подрагивание у животных, которым вводили псевдоагент + носитель, значительно отличались от животных, которым вводили АСЕ-1 + носитель, на протяжении всего развития болезни. Лечение антителом против NGF не влияло на основные тепловые или механические реакции при измерении в виде латентного периода отдергивания лапы под воздействием теплового раздражителя или увеличения порога механического раздражения (С, D). Лечение антителом против NGF вызывало более сильное ослабление постоянной боли на 19-й день, чем при введении 10 мг/кг или 30 мг/кг морфина (внутрибрюшинно, за 15 минут до испытания) (Е, F). Боль, вызываемую движением, измеряли путем количественного определения времени защитной фиксации и числа подрагиваний в течение двухминутного периода наблюдения с последующей обычно безболезненной пальпацией бедренной кости, в которую инъецировали АСЕ-1 (G, H). Планки погрешностей показывают стандартную ошибку средней (S.E.M.). На Фиг.10А-F “#” означает Р<0,05 по сравнению с введением псевдоагента и носителя (n=8); “*” означает Р<0,05 по сравнению с введением АСЕ-1 и носителя; “+” означает Р<0,05 по сравнению с введением АСЕ-1 и морфина. На Фиг.10G и 10Н “*” означает Р<0,01 по сравнению с введением псевдоагента и “#” означает Р<0,01 по сравнению с введением АСЕ-1 и носителя.
На Фиг.11 представлены фотографии, показывающие, что лечение антителом против NGF не влияет на опухолевую массу или вызванное опухолью изменение формы кости. У псевдозараженных животных, которым вводили носитель, (А) рентгенографическими или гистологическими методами (H&E) не было обнаружено (D) разрушения кости на 19-й день, в то время как у животных, которым вводили АСЕ-1 и носитель, (В, Е) и у животных, которым вводили АСЕ-1 и антитело против NGF, (C, F) наблюдался значительный рост опухоли и изменение формы кости при рентгенографическом и гистологическом исследовании. Н = гемопоэтические клетки; Т = опухоль; WB = АСЕ-1-индуцированное образование кости; масштаб: шкала = 1,5 мм.
На Фиг.12 представлены изображения, показывающие, что лечение антителом против NGF не вызывает значительного уменьшения индуцированного опухолью остеокластогенеза. TRAP-окрашенные изображения образцов тканей мышей, которым вводили псевдоагент + носитель (А), АСЕ-1 + носитель (В) и АСЕ-1 + антитело против NGF (С), показывают, что пролиферация клеток в данной модели происходит в областях изменения формы кости, индуцированного опухолью, с увеличением числа остеокластов на одном мм2 площади диафизарной интрамедуллярной области у животных, которым вводили антитело против NGF, и у животных, которым вводили носитель, по сравнению с животными, которым вводили псевдоагент и носитель, и незараженными животными, которым вводили носитель. Не наблюдалось каких-либо видимых изменений в гистологических проявлениях остеокластов на поверхности раздела между опухолью и костью или макрофагов в опухоли при сравнении животных, которым вводили антитело против NGF, (С) с животными, которым вводили носитель, (В). У животных, которым вводили псевдоагент и носитель, (А) количество остеокластов, морфология и макрофаги существенно не отличались от незараженных животных. Стрелки = остеокласты; острия стрелок = макрофаги; МВ = минерализованная кость; Н = гемопоэтические клетки; Т = опухоль; масштаб: шкала 50 мкм.
На Фиг.13 представлены фотографии, показывающие, что лечение антителом против NGF не влияет на плотность сенсорных волокон, обладающих иммунореактивностью в отношении пептида, родственного гену кальцитонина (CGRP-IR), в бедренной кости. Не было обнаружено заметных различий в уровнях иммунофлуоресценции или плотности CGRP-IR волокон у животных, которым вводили АСЕ-1 + носитель (А), и у животных, которым вводили АСЕ-1 + антитело против NGF (B). Кроме того, следует отметить, что CGRP-IR волокна сохранялись при лечении антителом против NGF. Т = опухоль; масштаб: шкала 50 мкм.
На Фиг.14 представлены фотографии, показывающие, что лечение антителом против NGF не влияет на плотность сенсорных волокон, обладающих иммунореактивностью в отношении пептида, родственного гену кальцитонина (CGRP-IR), в коже задней лапы. Не было обнаружено заметных различий в уровнях иммунофлуоресценции или плотности CGRP-IR волокон в коже незараженных мышей, которым вводили носитель (А), и незараженных мышей, которым вводили антитело против NGF (B). Аналогичным образом не было обнаружено различий в уровнях иммунофлуоресценции или плотности CGRP-IR нервных волокон у животных, которым вводили АСЕ-1 + носитель (С), и у животных, которым вводили АСЕ-1 + антитело против NGF (D). Кроме того, следует отметить, что не было обнаружено различий в CGRP-IR нервных волокнах у незараженных мышей и мышей, которым инъецировали АСЕ-1 (А, В по сравнению с С, D). Масштаб: шкала 50 мкм.
Подробное описание