Способ получения caco3 или mgco3
Иллюстрации
Показать всеИзобретение может быть использовано для получения карбонатов кальция или магния, применяемых в лакокрасочной, бумажной, косметической и фармацевтической промышленности. Для получения CaCO3 или MgCO3 водную суспензию исходного сырья, содержащего силикат кальция или магния, вводят в контакт с газом, содержащим СО2, с получением водного раствора Са(НСО3)2 или Mg(HCO3)2 и твердого Са- или Mg-истощенного исходного сырья. Весь полученный водный раствор Са(НСО3)2 или Mg(HCO3)2, или его часть отделяют от твердого Са- или Mg-истощенного исходного сырья. СаСО3 или MgCO3 осаждают из отделенного водного раствора Са(НСО3)2 или Mg(HCO3)2 и извлекают в качестве продукта. Предложен также способ получения водного раствора Са(НСО3)2 или Mg(HCO3)2. Изобретение позволяет снизить затраты на утилизацию свободного углекислого газа при получении высокочистых карбонатов кальция или магния. 2 н. и 12 з.п. ф-лы, 1 ил., 1 табл.
Реферат
Область техники
Настоящее изобретение относится к способу получения СаСО3 или MgCO3 из исходного сырья, содержащего Са- или Mg-содержащий смешанный оксид металлов, и к способу получения водного раствора Са(НСО3)2 или Mg(HCO3)2.
Уровень техники
Увеличение концентрации диоксида углерода в атмосфере вследствие увеличения потребления энергии, полученной из ископаемых топлив, потенциально может оказывать большое влияние на климат на планете. Таким образом, существует и все более возрастает интерес к мерам, направленным на уменьшение концентрации диоксида углерода в атмосфере.
В природе стабильный минеральный карбонат и диоксид кремния образуются в результате прохождения реакции между диоксидом углерода и природными силикатными минералами. Данный способ проведения реакции между диоксидом и минеральными веществами также называют карбонизацией или минерализацией, и в результате он приводит к связыванию, то есть изолированию, свободного диоксида углерода. Способ реализуется в соответствии с реакцией:
(Mg,Ca)xSiyOx+2y+xCO2→x(Mg,Ca)CO3+ySiO2
Однако реакция по своей природе протекает при очень низких скоростях реакции.
Недавно была исследована возможность протекания такой реакции в промышленных установках. Данные исследования своей целью главным образом ставят увеличение скорости реакции.
На Интернет сайте Министерства энергетики США http://www.fetc.doe.gov/publications/factsheets/program/-prog006.pdf, например, описывают проведение реакции между тонко измельченным серпентином (Mg3Si2O5(OH)4) или оливином (Mg2SiO4) в растворе из диоксида углерода в сверхкритическом состоянии и воды с получением карбоната магния.
В документе WO 2002/085788 описывают способ карбонизации минерала, в котором диоксид углерода вводят в реакцию с силикатом двухвалентного щелочноземельного металла, где данный силикат погружают в водный раствор электролита. Упоминается, что остаточные вещества, полученные после карбонизации, то есть смесь полученных карбоната и диоксида кремния, можно использовать в качестве наполнителя в строительных материалах.
Природные минералы, подходящие для карбонизации, можно найти в избытке, и теоретически они должны представлять собой достаточный резервуар для хранения, позволяющий изолировать весь диоксид углерода, полученный в мире. Если способ изолирования диоксида углерода будут реализовывать поблизости от места добычи минералов, то тогда транспортные расходы будут невелики, поскольку полученный карбонатный минерал можно будет хранить в отработанных горнопромышленных карьерах. Однако пригодные для разработки минеральные ресурсы в общем случае располагаются далеко от места, где производят диоксид углерода, и где было бы предпочтительно его изолировать. Это может привести к значительным транспортным расходам как для реагента, так и для полученного минерала, что окажет неблагоприятное влияние на применимость способа в промышленности.
Альтернатива использованию природных минералов в качестве материала исходного сырья при изолировании СО2 заключается в использовании отходов промышленного производства, обогащенных минералами. Данные материалы отходов в общем случае доступны поблизости от промышленных площадок, на которых получают отработанные газы, содержащие СО2. В работе «Accelerated carbonation of waste calcium silicate materials" by D.C.Johnson (ISSN 1353-114X) описывается, что подходящими материалами исходного сырья для способа изолирования диоксида углерода являются шлак, получаемый при выплавке нержавеющей стали, зола, получаемая при удалении типографской краски, порошкообразная топливная зола.
Кроме того, способы изолирования СО2, использующие материалы промышленных отходов, экономически непривлекательны, поскольку потребуются большие объемы промышленных отходов, и большие объемы остаточных материалов необходимо будет транспортировать до места хранения.
Известно, что минеральный материал, остающийся после реализации способов карбонизации, можно подвергнуть обработке для извлечения его части, что, таким образом, уменьшит совокупный объем, подлежащий транспортированию до места хранения.
Например, в US 6716408 описывается способ получения аморфного диоксида кремния из силикатов кальция. Описанный способ включает проведение реакции между силикатом кальция и СО2 в водной среде с получением суспензии агломерированных частиц SiO2 и СаСО3. Суспензию подвергают обработке соединением алюминия, бора или цинка с получением раствора, содержащего частицы SiO2 с нанометровыми размерами. Аморфный диоксид кремния получают в результате отделения раствора диоксида кремния от остаточной твердой фазы и последующего осаждения, высушивания или получения геля. СаСО3 можно извлечь из твердого остатка после проведения неоднократных обработок остатка алюминатом натрия (смотрите ПРИМЕР 1В из US 6716408). Реакцию между силикатом и СО2 проводят в автоклаве при давлениях, превышающих давление окружающей среды. Недостаток способа, описанного в US 6716408, заключается в том, что в нем для отделения ценного соединения, то есть диоксида кремния, от исходного сырья, содержащего Са-содержащий смешанный оксид металлов, требуется добавление соединения алюминия, бора или цинка, то есть электролита.
В US 5223181 описывается способ концентрирования магниевого шлака, содержащего радиоактивный торий, в результате извлечения из него MgCO3. В способе из US 5223181 суспензию из воды и магниевого шлака вводят в контакт с диоксидом углерода с получением раствора Mg(HCO3)2. После этого MgCO3 осаждают из раствора Mg(HCO3)2 в результате удаления диоксида углерода. Магниевый шлак, используемый в способе US 5223181, содержит в качестве основного компонента [4MgCO3.Mg(OH)2.4H2O], а в качестве неосновных компонентов BaMg(CO3)2 и [Mg6Al2CO3(OH)16.4H2O], то есть основный карбонат магния, смешанный карбонат металлов и основный смешанный карбонат металлов, соответственно. Как основный карбонат магния, так и основный смешанный карбонат металлов растворяются в воде в присутствии диоксида углерода. Недостаток способа, описанного в US 5223181, заключается в том, что изолируется относительно небольшое количество диоксида углерода, например, в случае компонента [4MgCO3.Mg(OH)2.4H2O] на один моль полученного MgCO3 изолируют 0,2 моля диоксида углерода.
В US 6387212 описывают способ удаления СаСО3 из других нерастворимых веществ, присутствующих в различных водных средах, в частности водных средах от бумаги, отправляемой на переработку для вторичного использования, или от шламов, получаемых при удалении типографской краски. СаСО3 солюбилизируют в результате введения водной среды в контакт с CO2 с получением, таким образом, Са(НСО3)2. Водный раствор Са(НСО3)2 отделяют от твердых компонентов и перемешивают с Са(ОН)2, что в результате приводит к осаждению СаСО3 по механизму:
Са(НСО3)2+Са(ОН)2→2СаСО3+2H2O
Способ из US 6387212 требует добавления Са(ОН)2 для осаждения СаСО3.Са(ОН)2, в общем случае получают в результате проведения реакции между СаО и водой. Однако СаО получают в результате нагревания Са-содержащих минералов. Как сжигание топлива для подвода необходимого тепла, так и превращение из минерала в СаО в результате приводят к выделению значительных количеств CO2.
Раскрытие изобретения
В настоящее время было обнаружено, что, если для изолирования СО2 будут использовать минеральное исходное сырье, содержащее смешанные оксиды металлов, то тогда можно будет получить СаСО3 или MgCO3, характеризующиеся высокой степенью чистоты, при одновременном изолировании относительно большого количества CO2. СаСО3 или MgCO3 можно получать при относительно низких температуре и давлении без необходимости использования дополнительных реагентов. Относительно чистые СаСО3 или MgCO3 используют в бумажной, лакокрасочной, косметической и фармацевтической отраслях промышленности, например, в качестве материала наполнителя и отбеливающего средства.
В соответствии с этим, настоящее изобретение относится к способу получения СаСО3 или MgCO3 из исходного сырья, содержащего Са- или Mg-содержащий смешанный оксид металлов, в котором:
(a) водную суспензию исходного сырья вводят в контакт с газом, содержащим СО2, с получением водного раствора Са(НСО3)2 или Mg(HCO3)2 и твердого Са- или Mg-истощенного исходного сырья;
(b) часть или все количество водного раствора Са(НСО3)2 или Mg(HCO3)2 отделяют от твердого Са- или Mg-истощенного исходного сырья;
(c) СаСО3 или MgCO3 осаждают из отделенного водного раствора Са(НСО3)2 или Mg(HCO3)2; и
(d) осажденные СаСО3 или MgCO3 извлекают в качестве продукта.
Преимущество способа, соответствующего изобретению, заключается в том, что изолируют CO2 и получают по сути ценный продукт. Еще одно преимущество заключается в том, что способ можно реализовать при относительно низких температуре и давлении. Дополнительное преимущество заключается в том, что отсутствует необходимость добавления электролитов или других дополнительных компонентов. Еще одно преимущество заключается в том, что настоящий способ позволяет в промышленном способе эффективно изолировать в его отходах часть полученного в нем CO2. Еще одно дополнительное преимущество заключается в том, что отходы нейтрализуют и, таким образом, делают подходящими для определенных вариантов использования, например, в качестве фундамента или в качестве строительного материала.
В дополнительном аспекте изобретение также относится к промежуточному продукту вышеупомянутого способа получения карбоната и поэтому к способу получения водного раствора Са(НСО3)2 или Mg(HCO3)2 из исходного сырья, содержащего Са- или Mg-содержащий смешанный оксид металлов, при этом способ включает стадии (а) и (b), определенные в настоящем документе ранее.
Таким образом, полученный водный раствор Са(НСО3)2 или Mg(HCO3)2 можно использовать для нейтрализации (сильно) разбавленных сильных кислот или для осаждения органических кислот в виде Са- или Mg-содержащих веществ.
Краткое описание чертежа
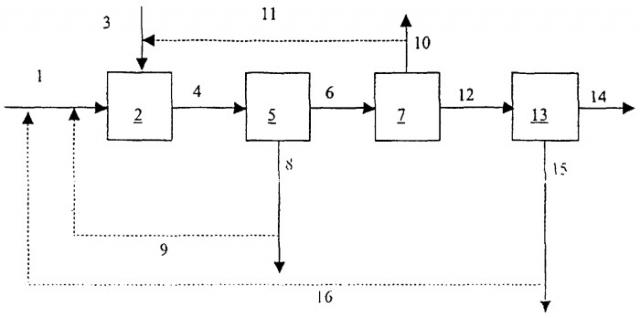
На чертеже продемонстрирована технологическая схема варианта реализации изобретения.
Осуществление изобретения
В способе, соответствующем настоящему изобретению, сами по себе ценные СаСО3 или MgCO3 получают в то время, когда диоксид углерода изолируют в результате введения исходного сырья, содержащего Са- или Mg-содержащий смешанный оксид металлов, в контакт с газом, содержащим CO2.
Смешанный оксид металлов в настоящем документе определяют как оксид, содержащий, по меньшей мере, два металла или металлоидных компонента, при этом, по меньшей мере, один из них представляет собой Са или Mg. Примеры подходящих других металлов или металлоидов представляют собой кремний, железо или их смесь, предпочтительно кремний. Смешанным оксидом металлов могут являться, например, силикат, смешанное силикат-оксидное соединение и/или смешанное силикат-оксид-гидроксидное соединение. Смешанный оксид металлов может находиться в своей гидратированной форме.
Возможно использование любого исходного сырья, содержащего Са- или Mg-содержащий смешанный оксид металлов. Исходное сырье предпочтительно содержит от 5 до 100 мас.% Са- или Mg-содержащего смешанного оксида металлов при расчете на совокупную массу исходного сырья, более предпочтительно от 50 до 95 мас.%.
Примерами подходящего исходного сырья являются встречающиеся в природе Са- или Mg-содержащие минералы, например, волластонит, оливин или серпентин, и потоки промышленных отходов, такие как шлак, получаемый при выплавке стали, зольный остаток при переработке бумаги или летучая зола-унос. Потоки промышленных отходов являются предпочтительным исходным сырьем, поскольку в общем случае они могут быть получены с низкой стоимостью поблизости от установок, где получают CO2. Более предпочтительными типами исходного сырья являются шлак, полученный при выплавке стали, и зольный остаток от переработки бумаги. Шлак, полученный при выплавке стали, получают во время производства стали. Обычно он, помимо прочего, содержит силикаты кальция (например, Ca2SiO4), железосодержащие смешанные оксиды металлов (например, Ca2Fe2O5) и оксид кальция. Зольный остаток от переработки бумаги получают в качестве отходов во время переработки бумаги для вторичного использования, и обычно он, помимо прочего, содержит силикаты кальция (например, Ca2SiO4), силикаты кальция-алюминия и оксид кальция. Точный состав исходного сырья можно определить при использовании в общем случае известных методов анализа, например, рентгеновской дифракцией (XRD). Шлак, получаемый при выплавке стали, в особенности предпочтителен в качестве исходного сырья.
В способе, соответствующем изобретению, также можно получать смеси СаСО3 и MgCO3 в результате использования исходного сырья, содержащего как Са, так и Mg, или в результате использования смеси Са-содержащего исходного сырья и Mg-содержащего исходного сырья. Предпочтительным является способ получения СаСО3 из Са-содержащего смешанного оксида металлов.
В способе, соответствующем изобретению, водную суспензию исходного сырья вводят в контакт с газом, содержащим СО2. Водная суспензия в подходящем случае содержит вплоть до 60 мас.% твердого материала при расчете на совокупную массу водной суспензии, предпочтительно от 10 до 50 мас.%. Водную суспензию, например, можно получить в результате перемешивания частиц исходного сырья, предпочтительно частиц, характеризующихся средним диаметром в диапазоне от 0,5 мкм до 5 см, с водным потоком, предпочтительно водой.
Предпочтительно в водную суспензию исходного сырья никаких электролитов не добавляют.
Газ, содержащий СО2, который вводят в контакт с суспензией исходного сырья, характеризуется парциальным давлением СО2, равным предпочтительно, по меньшей мере, 0,01 бар, более предпочтительно 0,1 бар, еще более предпочтительно 0,5 бар. Парциальное давление CO2 составляет предпочтительно, самое большее, 1 бар, более предпочтительно, самое большее, 0,95 бар. В настоящем документе ссылка на парциальное давление СО2 соответствует парциальному давлению СО2 в условиях стандартных температуры и давления (STP), то есть при 0°С и 1 атм. Газ, содержащий СО2, может представлять собой чистый СО2 или смесь СО2 с одним или несколькими другими газами. Предпочтительно газом, содержащим СО2, является промышленный отработанный газ, например, промышленный дымовой газ. При этом промышленный отработанный газ определяют как любой газ, высвобождаемый во время проведения промышленного технологического процесса.
При введении водной суспензии в контакт с газом, содержащим CO2, СО2 растворяется в водной фазе с одновременным получением бикарбоната в соответствии с:
В случае если суспензия имеет щелочную природу, то есть начальное значение рН суспензии исходного сырья выше рН воды, равновесие реакции (1) будет сдвинуто вправо. Поэтому предпочтительно, чтобы значение рН суспензии было выше, чем рН воды, более предпочтительно находилось бы в диапазоне от 6,5 до 14, еще более предпочтительно от 7 до 13. Потоки промышленных отходов, подобные шлаку, полученному при выплавке стали, и зольному остатку от переработки бумаги, по своей природе обычно являются щелочными вследствие присутствия Са-содержащего смешанного оксида, а зачастую также и оксида кальция (СаО), которые образуют гидроксид кальция (Са(ОН)2) при контакте с водой. Преимущество способа, соответствующего изобретению, заключается в том, что в случае использования в качестве исходного сырья таких потоков щелочных промышленных отходов получающееся в результате Са- или Mg-истощенное исходное сырье по своей природе является менее щелочным по сравнению с первоначальным исходным сырьем. Поэтому менее щелочное истощенное исходное сырье является более подходящим для использования в тех сферах применения, в которых оно находится в непосредственном контакте с природной окружающей средой. В том случае если при перемешивании исходного сырья с водой никакой щелочной суспензии не получается, значение рН известными способами можно отрегулировать для получения щелочной суспензии.
Бикарбонат, полученный в реакции (1), вступает в реакцию со смешанным оксидом металлов с получением бикарбоната кальция или магния и Са- или Mg-истощенного исходного сырья. В случае использования в твердом исходном сырье в качестве смешанного оксида металлов силиката кальция бикарбонат кальция (Са(НСО3)2) и диоксид кремния (SiO2) образуются в соответствии с реакцией (2):
На стадии (а) способа, соответствующего изобретению, водную суспензию в контакторе приводят к контакт с газом, содержащим CO2. Контактором может являться любой подходящий контактор (смотрите, например, работу Perry's Chemical Engineering Handbook 7th Edition chapter 14, pages 23 to 61 or chapter 23, pages 36 to 39).
Стадию (а) способа предпочтительно проводят при температуре в диапазоне от температуры окружающей среды до 200°С, более предпочтительно от температуры окружающей среды до 150°С, еще более предпочтительно от температуры окружающей среды до 100°С, наиболее предпочтительно от температуры окружающей среды до 50°С. Относительно низкая температура выгодна, поскольку при низкой температуре устойчивость бикарбонатных соединений высока, и образуются высокие концентрации растворенных Са- или Mg-содержащих бикарбонатов. Давление, при котором на стадии (а) водную суспензию приводят в контакт с газом, содержащим CO2, предпочтительно находится в диапазоне от 1 до 150 бар (абсолютного давления), более предпочтительно от 1 до 40 бар (абсолютного давления), еще более предпочтительно от 1 до 5 бар (абсолютного давления).
На стадии (b) способа, соответствующего изобретению, водный раствор бикарбоната кальция или магния и Са- или Mg-истощенное твердое исходное сырье направляют в сепаратор для отделения части или всего количества раствора бикарбоната от твердого Са- или Mg-истощенного исходного сырья. Предпочтительно от потока, содержащего твердое исходное сырье, отделяют, по меньшей мере, 40% раствора бикарбоната, более предпочтительно отделяют от 80 до 90 мас.% раствора бикарбоната.
Сепаратором может являться любой механический сепаратор твердой и жидкой фаз, не требующий выпаривания водной среды, предпочтительно сепаратор, в основе работы которого лежат седиментация или фильтрование. Такие сепараторы на современном уровне техники известны (смотрите, например, работу Perry's Chemical Engineering Handbook 7th Edition chapter 18, pages 130 to 133). Необходимо понимать, что количество полученного бикарбоната лимитируется растворимостью бикарбоната в водной среде, и, таким образом, помимо прочего, оно будет зависеть от соотношения между количествами воды и твердого исходного сырья. Пересыщенность раствора бикарбоната в результате приводит к образованию отложений твердого карбоната на истощенном исходном сырье. Данный карбонат можно извлекать в результате направления истощенного исходного сырья на рецикл на стадию (а) способа.
На стадии (с) способа, соответствующего изобретению, СаСО3 или MgCO3 осаждают из отделенного водного раствора Са(НСО3)2 или Mg(HCO3)2. Обычно СаСО3 или MgCO3 осаждают в результате удаления СО2 из отделенного водного раствора бикарбоната. Обычно это осуществляют в десорбере. Десорберы на современном уровне техники известны, например, из работы Perry's Chemical Engineering Handbook 7th Edition Chapter 14, pages 23 to 61.
Раствор бикарбоната находится в равновесии с диоксидом углерода в соответствии с уравнением реакции (3):
Необходимо понимать, что равновесные концентрации определяются такими параметрами, как температура и парциальное давление CO2. В результате удаления диоксида углерода равновесие сдвигается вправо. Поскольку растворимость карбоната значительно ниже, чем у бикарбоната, при удалении диоксида углерода твердый Са- или Mg-содержащий карбонат будет выпадать в осадок.
Предпочтительно температура водного раствора бикарбоната в десорбере находится в диапазоне от 15 до 95°С, более предпочтительно от 25 до 85°С, еще более предпочтительно от 50 до 80°С. CO2 можно удалять при использовании любого подходящего способа. Такие способы на современном уровне техники известны, и они включают сброс избыточного давления СО2, десорбцию под действием инертного газа (азота или воздуха) или воздействие вакуума. Для увеличения выхода карбоната можно использовать комбинацию данных способов удаления СО2, одновременно или последовательно. В случае использования последовательных стадий удаления СО2 может оказаться выгодным уменьшение растворимости карбоната на каждой стадии в результате уменьшения температуры водного раствора бикарбоната после каждой стадии на 5-50°С, более предпочтительно на 10-20°С, по сравнению с предшествующей стадией. Уменьшения температуры, например, можно добиться в результате использования холодного десорбирующего газа или в результате обеспечения испарения части воды в условиях воздействия вакуума.
Предпочтительно все количество или часть десорбированного СО2 отправляют на рецикл в контактор, то есть на стадию (а) способа.
В альтернативном варианте СаСО3 или MgCO3 можно осаждать из отделенного водного раствора Са(НСО3)2 или Mg(HCO3)2 под действием ультразвукового облучения водного раствора бикарбоната, что может привести к осаждению Са- или Mg-содержащего карбоната.
На стадии (d) способа, соответствующего изобретению, осажденный карбонат извлекают в качестве продукта. На стадии (с) получают водную суспензию карбоната. Твердый карбонат можно извлекать из данной суспензии при использовании любого подходящего способа, например, в результате разделения суспензии в сепараторе на по существу чистый твердый карбонат и водный поток. Таким образом, полученный водный поток можно (частично) отправлять на рецикл с получением водной суспензии, содержащей исходное сырье.
При желании любую из вышеупомянутых стадий способа можно объединять или интегрировать с одной или несколькими другими стадиями способа с получением одной стадии способа.
Предпочтительно Са- или Mg-содержащий карбонат, который извлекают в качестве продукта, характеризуется значением степени белизны по ISO, равным, по меньшей мере, 80%, предпочтительно большим 90%, согласно определению в соответствии с документом ISO 2470. Значение степени белизны по ISO представляет собой меру белизны. Необходимо понимать, что белизна, помимо прочего, зависит от степени чистоты, типа и размера кристаллов карбоната и что на значение степени белизны по ISO будут оказывать влияние точные технологические условия на стадии (с) способа, то есть стадии, на которой осаждают карбонат. Специалист в соответствующей области техники знаком с приемами регулирования технологических условий, подобных температуре, концентрации бикарбоната, скорости перемешивания и необязательному присутствию инициаторов кристаллизации на стадии (с), таким образом, чтобы получать карбонат, характеризующийся желательным значением степени белизны по ISO. СаСО3 или MgCO3, полученные при использовании способа, определенного в настоящем документе ранее, являются в особенности подходящими для использования в способе изготовления бумаги. В таком способе СаСО3 или MgCO3 добавляют к суспензии целлюлозной массы, а волокнистую массу, содержащую СаСО3 или MgCO3, отливают и высушивают в желательной форме с получением бумажной продукции.
Изобретение дополнительно иллюстрируется при использовании примера со ссылкой на чертеж. На чертеже схематически показана технологическая схема способа получения СаСО3 из водной суспензии Са-содержащего смешанного оксида металлов.
Водную суспензию шлака, полученного при выплавке стали, подают через трубопровод 1 в контактор 2. В контакторе 2 водную суспензию приводят в контакт с газом, содержащим СО2, который подают в контактор 2 через трубопровод 3. В контакторе 2 получают водный раствор бикарбоната кальция и твердый Са-истощенный шлак, полученный при выплавке стали. Раствор бикарбоната и истощенный шлак совместно направляют через трубопровод 4 в сепаратор 5. В сепараторе 5 их разделяют на не содержащий твердой фазы поток раствора бикарбоната, который через трубопровод 6 направляют в десорбер 7, и поток, содержащий твердую фазу, то есть истощенный шлак, полученный при выплавке стали. Поток, содержащий твердую фазу, выпускают из сепаратора 5 через трубопровод 8. Необязательно часть или все количество истощенного шлака, полученного при выплавке стали, отправляют на рецикл в контактор 2 через трубопровод 9. В десорбере 7 CO2 удаляют из раствора бикарбоната в результате сброса избыточного давления. CO2 выпускают из десорбера 7 через трубопровод 10. В альтернативном варианте СО2 можно удалять в результате подачи в десорбер 7 десорбирующего газа или в результате применения вакуума в трубопроводе 10. Газ, содержащий десорбированный СО2, можно отправлять на рецикл в контактор 2 через трубопровод 11. В десорбере 7 карбонат кальция выпадает в осадок, и, таким образом, получают водную суспензию карбоната. После этого суспензию подают через трубопровод 12 в сепаратор 13. В сепараторе 13 чистый твердый СаСО3 отделяют от суспензии и извлекают в виде продукта через трубопровод 14. Водный поток выпускают из сепаратора 13 через трубопровод 15 и необязательно отправляют на рецикл в контактор 2 через трубопровод 16.
Примеры
Изобретение дополнительно иллюстрируется путем следующих далее неограничивающих примеров. Все примеры соответствуют изобретению.
ПРИМЕР 1
Водную суспензию шлака, полученного при выплавке стали, получали в результате перемешивания 200 г шлака, характеризующегося среднеобъемным размером частиц 7 мкм, и 3900 г воды в реакторе объемом 5 л. В условиях окружающей среды, то есть при температуре 22°С и давлении 1 бар (абсолютное давление), чистый СО2 барботировали через суспензию в течение 24 часов. Водную фазу после этого отделяли от твердой фазы и переносили в отдельную емкость. CO2 удаляли из отделенной водной фазы при комнатной температуре при использовании азота в качестве десорбирующего газа. Осадок СаСО3 высушивали и взвешивали. Выход СаСО3 (масса СаСО3 на единицу объема раствора Са(НСО3)2) приведен в таблице.
ПРИМЕР 2
Водную суспензию зольного остатка от переработки бумаги получали в результате перемешивания 32 г зольного остатка и 412 г воды в реакторе объемом 0,5 л. В условиях окружающей среды, то есть при температуре 22°С и давлении 1 бар (абсолютное давление), чистый СО2 барботировали через суспензию в течение 29 часов.
Количество СО2, которое абсорбировали (в основном в виде СаСО3) при использовании зольного остатка от переработки бумаги, измеряли в различные моменты времени в результате отбора небольшого образца зольного остатка и измерения для него потери массы при нагревании образца до 750°С. Величину абсорбции СО2 рассчитывали в виде процента потери массы образца исходного сырья при расчете на массу образца до нагревания, и она приводится в таблице.
По истечении 29 часов водную фазу отделяли от твердой фазы и переносили в отдельную емкость. CO2 удаляли из отделенной водной фазы при комнатной температуре при использовании азота в качестве десорбирующего газа. Осадок СаСО3 высушивали и взвешивали. Выход СаСО3 (масса СаСО3 на единицу объема раствора Са(НСО3)2) приведен в таблице.
ПРИМЕР 3
Водную суспензию зольного остатка от переработки бумаги получали в результате перемешивания 50 г зольного остатка и 4000 г воды в реакторе объемом 5 л. В условиях окружающей среды, то есть при температуре 22°С и давлении 1 бар (абсолютное давление), чистый СО2 барботировали через суспензию в течение 24 часов. По истечении 24 часов водную фазу отделяли от твердой фазы и переносили в отдельную емкость. СО2 удаляли из отделенной водной фазы в результате нагревания водной фазы до температуры в диапазоне от 75 до 100°С. Полученный таким образом осадок СаСО3 высушивали и взвешивали. Выход СаСО3 (масса СаСО3 на единицу объема раствора Са(НСО3)2) приведен в таблице.
ПРИМЕР 4
В разных экспериментах количество диоксида углерода, абсорбированного шлаком, полученным при выплавке стали, (среднеобъемный размер частиц 7 мкм), измеряли при различных температурах и давлениях. Для каждого эксперимента в результате перемешивания 64 г шлака, полученного при выплавке стали, и 825 г воды в реакторе объемом 1 л получали водную суспензию шлака, и суспензию вводили в контакт с чистым CO2. В экспериментах при 10 и 40 бар в реакторе создавали повышенное давление при помощи чистого газообразного диоксида углерода. В эксперименте через суспензию барботировали диоксид углерода при атмосферном давлении (1 бар). Величину абсорбции CO2 определяли так, как это описывается в ПРИМЕРЕ 2. Результаты приведены в таблице.
ПРИМЕР 5
В двух разных экспериментах количество диоксида углерода, абсорбированного шлаком, полученным при выплавке стали, (среднеобъемный размер частиц 7 мкм), измеряли при парциальном давлении CO2 3·10-4 бар и 0,2 бар, соответственно. Для каждого эксперимента в результате перемешивания 64 г шлака и 825 г воды в реакторе объемом 1 л получали водную суспензию шлака и суспензию вводили в контакт с газом, содержащим CO2, (воздух для эксперимента при парциальном давлении СО2 3·10-4 бар) при атмосферном давлении в результате барботирования газа через суспензию.
Эксперименты проводили при 22°С и 28°С, соответственно. Величину абсорбции CO2 определяли так, как это описывается в ПРИМЕРЕ 2. Результаты приведены в таблице.
| Условия проведения реакции на стадии (а) и результаты для ПРИМЕРОВ 1-5 | |||||||
| ПРИМЕР | Исходное сырье | Т (°С) | p (бар абсолютного давления) | p (CO2) (бар) | Выход СаСО3 (мас.%) | Величина абсорбции СО2 | |
| t | Величина абсорбции (мас.%) | ||||||
| 1 | Шлак, полученный при выплавке стали | 22 | 1 | 1 | 2,6 | ||
| 2 | Зольный остаток от переработки бумаги | 22 | 1 | 1 | 2,2 | 15 мин | 7,3 |
| 60 мин | 7,6 | ||||||
| 3 час | 8,1 | ||||||
| 29 час | 8,6 | ||||||
| 3 | Зольный остаток от переработки бумаги | 22 | 1 | 1 | 1,7 | ||
| 4 | Шлак, полученный при выплавке стали | 28 | 1 | 1 | 60 мин | 12 | |
| То же | 150 | 10 | 10 | 15 мин | 17,0 | ||
| 60 мин | 19,8 | ||||||
| 3 час | 20,4 | ||||||
| 6 час | 22,5 | ||||||
| То же | 28 | 40 | 40 | 30 мин | 19 | ||
| То же | 150 | 40 | 40 | 50 мин | 16 | ||
| 5 | Шлак, полученный при выплавке стали | 22 | 1 | 3.10-4 | 47 час | 5 | |
| То же | 28 | 1 | 0,2 | 2 час | 11 |
1. Способ получения СаСО3 или MgCO3 из исходного сырья, содержащего силикат Са или Mg, в котором(a) водную суспензию исходного сырья вводят в контакт с газом, содержащим CO2, с получением водного раствора Са(НСО3)2 или Mg(НСО3)2 и твердого Са- или Mg-истощенного исходного сырья;(b) часть или все количество водного раствора Са(НСО3)2 или Mg(HCO3)2 отделяют от твердого Са- или Mg-истощенного исходного сырья;(c) СаСО3 или MgCO3 осаждают из отделенного водного раствора Са(НСО3)2 или Mg(HCO3)2; и(d) осажденные СаСО3 или MgCO3 извлекают в качестве продукта.
2. Способ по п.1, в котором на стадии (с) СаСО3 или MgCO3 осаждают в результате удаления СО2.
3. Способ по п.1, в котором силикат Са или Mg дополнительно содержит железо.
4. Способ получения СаСО3 по п.1, в котором исходное сырье включает силикат Са.
5. Способ по п.1, в котором исходным сырьем является отход промышленного производства, предпочтительно шлак, полученный при выплавке стали, или зольный остаток от переработки бумаги, более предпочтительно шлак, полученный при выплавке стали.
6. Способ по п.1, в котором водная суспензия содержит вплоть до 60 мас.% твердого исходного сырья при расчете на совокупную массу водной суспензии, предпочтительно содержит от 10 до 50 мас.%.
7. Способ по п.1, в котором значение pH водной суспензии превышает pH воды, предпочтительно находится в диапазоне от 6,5 до 14, более предпочтительно в диапазоне от 7 до 13.
8. Способ по п.1, в котором газ, содержащий CO2, имеет парциальное давление СО2, равное, по меньшей мере, 0,01 бар, предпочтительно, по меньшей мере, 0,1 бар, более предпочтительно, по меньшей мере, 0,5 бар, и самое большее, 1 бар, предпочтительно, самое большее, 0,95 бар.
9. Способ по п.1, в котором суспензия исходного сырья содержит исходное сырье в форме частиц, предпочтительно частиц со средним диаметром в диапазоне от 0,5 мкм до 5 см.
10. Способ по п.1, в котором стадию (а) проводят при температуре в диапазоне от температуры окружающей среды до 200°С, предпочтительно от температуры окружающей среды до 150°С, более предпочтительно от температуры окружающей среды до 100°С.
11. Способ по п.1, в котором давление во время проведения стадии (а) находится в диапазоне от 1 до 150 бар (абсолютного давления), предпочтительно от 1 до 40 бар (абсолютного давления), более предпочтительно от 1 до 5 бар (абсолютного давления).
12. Способ по п.1, в котором газом, содержащим CO2, является промышленный отработанный газ, предпочтительно промышленный дымовой газ.
13. Способ по п.1, в котором СаСО3 или MgCO3, которые извлекают в качестве продукта, имеют значение степени белизны по ISO, равное, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%.
14. Способ получения водного раствора Са(НСО3)2 или Mg(HCO3)2 из исходного сырья, содержащего силикат Са или Mg, при этом способ включает стадии (а) и (b) по любому одному из пп.1-12.