Хемосенсорные оптоматериалы для определения катионов металлов большого ионного радиуса и ионов диаммония на основе краунсодержащих бисстириловых красителей, иммобилизованных в полимерные пленки, и способы их получения
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к новым краунсодержащим бисстириловым красителям, которые могут быть использованы в составе оптических хемосенсоров на катионы металлов, для мониторинга окружающей среды, в биологических жидкостях и др. Описываются краунсодержащие бисстириловые красители формулы (I):
в которой D - фрагмент бензокраун-эфира или фенилазакраун-эфира, B+ - остаток формулы
где Q - атом серы. Описываются также способы их получения кватернизацией гетарилфенилэтилена или взаимодействием бисчетвертичной соли бисгетероциклического основания с формильным производным бензокраун-эфира или фенилазакраун-эфира. Описываются также композитные материалы на основе соединений формулы (I). Изобретение позволяет получить полимерные пленочные материалы, обладающие оптическими хемосенсорными свойствами на присутствие катионов металлов с большим ионным радиусом и ионов диаммония в водных растворах. 4 н. и 1 з.п. ф-лы, 4 табл.
Реферат
Изобретение относится к области органической химии и химии материалов, а именно к новому типу соединений - бисстириловым красителям общей формулы (I):
в которой A=Cl, Br, I, ClO4, PF6, BF4;
B+ - гетероциклический остаток формулы (II) или (III):
в которых R1-R4 - атом водорода, низший алкил, алкоксильная группа;
в формуле (II) Q - атом серы;
D в формуле (I) - фрагмент бензокраун-эфира формулы (IV) или фрагмент фенилазакраун-эфира формулы (V):
в которых n=0-2;
Е в формуле (I) - фрагмент (CH2)m, где m=0-6, или фениленовая группа C6H4;
а также к новым полимерным мембранам и пленкам на основе красителей (I).
Предлагаемые соединения и композитные материалы на их основе могут быть использованы в составе оптических хемосенсоров на катионы металлов с большим ионным радиусом или на ионы диаммония, например, в составе полимерных мембран и ультратонких пленок для определения микроколичеств указанных ионов в промышленных водах и стоках, в том числе для мониторинга окружающей среды, в биологических жидкостях и др. Изобретение относится также к способам получения таких соединений и материалов.
Полученные нами соединения и хемосенсорные композитные материалы (ХКМ) на их основе, их свойства и способ получения в литературе не описаны. Предлагаемые соединения представляют собой новый тип краунсодержащих стириловых красителей, так как два стириловых хромофора соединены полиметиленовым или ксилиленовым мостиком, характеризующимся определенной длиной и жесткостью. Это создает возможности для селективного дитопного связывания катионов металлов с большим ионным радиусом или диаммонийных соединений. Такое связывание осуществляется посредством одновременной координации катиона металла двумя (аза)краун-эфирными фрагментами красителя или одновременного образования двумя аммонийными группами субстрата водородных связей с двумя (аза)краун-эфирными фрагментами красителя. Природа гетероатома (атома кислорода или атома азота), находящегося в сопряжении со стириловым фрагментом в предлагаемых красителях (I), обеспечивает оптический отклик в синей или зеленой областях видимого спектра. Композитные материалы могут быть получены при введении предлагаемых соединений в полимерную матрицу методом полива. Структура полимерных пленочных материалов обеспечивает сочетание заданных параметров для получения ХКМ со свойствами оптических хемосенсоров.
Известны катионные красители стирилового ряда (Гордон П., Грегори П. «Органическая химия красителей» - М.: Мир, 1987, 344; Фикен Г.Е. Цианиновые красители. В кн. Химия синтетических красителей. Под ред. Венкатарамана К. Т.4, Л.: Химия, 1975, 207; Berlin L., Reister O. «Methoden zur Herstellung von Cyaninen (Polymethinen)», In «Methoden der Organischen Chemie», Edn. Miller Е., B. 5/1d, Georg Thieme Verlag, Stuttgart, 1972, 227; Ведерников А.И., Кузьмина Л.Г., Сазонов С.К., Лобова Н.А., Логинов П.С., Чураков А.В., Стреленко Ю.А., Ховард Дж.А.К., Алфимов М.В., Громов С.П., Изв. АН. Сер. хим., 2007, 1797), особенностью строения которых является наличие четвертичного гетероциклического остатка (при атоме азота гетероциклического остатка содержится алкильный заместитель), связанного посредством двойной углерод-углеродной связи с замещенным бензольным циклом. Эти красители поглощают в видимой области спектра, но не способны к связыванию каких-либо катионов и поэтому не могут использоваться в качестве хемосенсоров.
Описаны стириловые красители, в структуре которых имеется один фрагмент краун-соединения различного строения. При четвертичном атоме азота гетероциклического остатка этих красителей содержится алкильный заместитель или алкил, содержащий концевую группу SO3 - или NH3 + (Громов С.П., Алфимов М.В. Изв. АН. Сер. хим., 1997, 641; Громов С.П., Федорова О.А., Фомина М.В., Алфимов М.В. Патент 2012574 РФ, Бюлл. изоб., 1994, №9; Громов С.П., Федорова О.А., Ведерников А.И., Ещеулова О.В., Федоров Ю.В., Алфимов М.В. Патент 2176256 РФ, Бюлл. изоб., 2001, №33; Gromov S.P., Ushakov Е.N., Fedorova O.A., Baskin I.I., Buevich A.V., Andryukhina Е.N., Alfimov М.V., Johnels D., Edlund U.G., Whitesell J.K., Fox M.A., J. Org. Chem., 2003, 68, 6115; Громов С.П., Ведерников А.И., Лобова И.А., Кузьмина Л.Г., Дмитриева С.Н., Тихонова О.В., Алфимов М.В. Патент 2278134 РФ, Бюлл. изобр., 2006, №17). Для таких красителей характерна выраженная способность к комплексообразованию с катионами металлов, моноаммонийными ионами или склонность к спонтанной димеризации, сопровождающаяся значительными гипсохромными сдвигами в спектрах поглощения. Однако такие красители не проявляют селективности по отношению к катионам металлов с большим ионным радиусом или к диаммонийным соединениям, так как не способны к дитопному связыванию указанных субстратов.
Известны также нейтральные краунсодержащие гетарилфенилэтилены - структурные аналоги стириловых красителей, но не являющиеся красителями, так как не поглощают в видимой области спектра, поскольку гетероциклический остаток гетарилфенилэтиленов не имеет четвертичного азота (Tagaki K., Suddaby B.R., Vadas S.L., Backer C.A., D.G.Whitten, J. Am. Chem. Soc., 1986, 108, 7865; Shayira B.H., Lalitha A., Pitchumani K., Srinivasan C., J. Chem. Soc., Chem. Commun., 1999, 607; Zhang W.-Q., Zhuang J.-P., Li C.-B., Sun H., Yuan X.-N., Chin. J. Chem., 2001, 43, 1283; Zhang W.-Q., Shen G., Zhuang J.-P., Zheng P.W., Ran X.R., J. Photochem. Photobiol. A: Chem., 2002, 147, 25; Громов С.П., Ведерников А.И., Федоров Ю.В., Федорова О.А., Андрюхина Е.Н., Шепель Н.Э., Стреленко Ю.А., Джонелс Д., Эдлунд У., Салтиел Дж., Алфимов М. В., Изв. АН. Сер. хим., 2005, 1524; Kuz'mina L.G., Vedrnmikov A.I., Lobova N.A., Churakov A.V., Howard J.A.K., Alfimov М.V., Gromov S.P., New J. Chem., 2007, 31, 980; Yamada S., Uematsu N., Yamashita K., J. Am. Chem. Soc., 2007, 129, 12100). Эти соединения способны эффективно связывать катионы металлов и моноаммонийные ионы, но, как и родственные стириловые красители, не проявляют селективности к катионам металлов с большим ионным радиусом или к диаммонийным ионам. Кроме того, значительные спектральные изменения при комплексообразовании гетерилфенилэтиленов происходят в УФ-области спектра, что делает их непригодными для создания ХКМ на их основе.
Композитные материалы получают введением соединений, в том числе непредельных красителей, в полимерную матрицу одним из известных способов, в основном методом полива (Гуль В.Е., Дьяконова В.П., Физико-химические основы производства полимерных пленок, Москва: Наука, 1978, 279 стр.; Polymer handbook, Ed. Bloch D.R., V.2, John Wiley & Sons, 2003, 897 pp; Composite materials handbook. Polymer matrix composites guidelines for characterization of structural materials. MIL-HDBK-17-1F, V.1, 2002, 734 pp; Industrial Polymers Handbook, Ed. Wilks Е.S., Ausgabe, 2000, Wiley-VCH, 657 pp). Способ полива технологически прост и доступен как в лабораторной практике, так и в процессе производства и является оптимальным для целей, указанных в данном изобретении. Важным достоинством метода получения пленок из раствора является то, что отлив пленок производится при сравнительно низкой температуре, возможно введение нетермостойких добавок, например, красителей, определяющих дальнейшее применение пленки. Однако бисстириловые красители, содержащие два фрагмента (аза)краун-эфира ранее не вводились в полимерные пленки или композитные материалы указанным или иным способом.
Задачей настоящего изобретения является создание нового типа соединений - бисстириловых красителей, содержащих два фрагмента (аза)краун-эфира, обладающих способностью к дитопному связыванию катионов металлов с большим ионным радиусом или ионов диаммония, в том числе в водной среде, и использование их в составе новых оптических хемосенсорных композитных материалов. Задачей изобретения является также разработка способов получения целевых соединений с высоким выходом и получения сенсорных композитных материалов на их основе.
Решение поставленной задачи достигается структурой заявляемого нового типа бисстириловых красителей общей формулы (I) и способами их получения, заключающимися в том, что:
Способ 1: гетарилфенилэтилен общей формулы (VI):
в которой D - фрагмент бензокраун-эфира или фенилазакраун-эфира, являющийся таким, как определено выше для формулы (I),
В - гетероциклический остаток формулы (VII) или (VIII):
в которых R1-R4 и Q являются такими, как определено выше для формул (II) и (III), подвергают кватернизации по атому азота гетероциклического остатка взаимодействием с дифункциональными производными алканов или ксилолов общей формулы (IX):
где А и Е имеют указанные выше значения для формулы (I),
в среде органического растворителя.
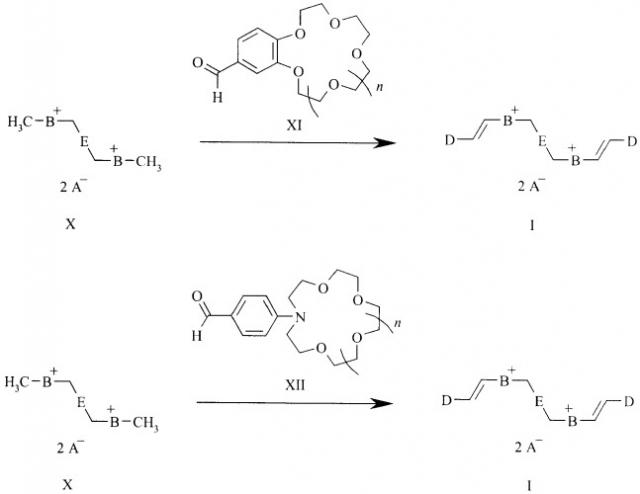
Способ 2: бисчетвертичную соль бисгетероциклического основания общей формулы (X):
в которой А, В и Е являются такими, как определено выше для формулы (I),
подвергают взаимодействию с формильным производным бензокраун-эфира или фенилазакраун-эфира общей формулы (XI) или (XII):
в которых n=0-2,
в среде органического растворителя.
Процесс можно проводить в присутствии органического основания.
Кватернизация (способ 1) указанных гетарилфенилэтиленов общей формулы (VI) дифункциональными производными алканов или ксилолов общей формулы (IX) до настоящего времени не была известна. Согласно предлагаемому способу синтез заявляемых стириловых красителей общей формулы (I) осуществляют кватернизацией краунсодержащих гетарилфенилэтиленов общей формулы (VI) по атому азота гетероциклического остатка дифункциональными производными алканов или ксилолов общей формулы (IX), содержащими легко уходящую группу А. Реакцию можно проводить с последующей заменой анионов в (I) обработкой кислотами с иными противоионами или солями этих кислот (или без замены аниона). Реакцию проводят в среде органического растворителя, например спирта, при температурах 20-150°С.
Конденсация (способ 2) указанных бисчетвертичных солей бисгетероциклических оснований (X) с формильными производными бензокраун-эфиров (XI) и фенилазакраун-эфиров (XII) до настоящего времени не была известна. Согласно предлагаемому способу 2 синтез заявляемых стириловых красителей общей формулы (I) осуществляют конденсацией активированных в бисчетвертичных солях бисгетероциклических оснований (X) двух метальных групп с карбонильными группами формильных производных (аза)краун-эфиров (XI), (XII) с образованием двух двойных углерод-углеродных связей. Реакцию проводят в среде органического растворителя, например, уксусного ангидрида или спирта, в присутствии оснований, таких как пиридин, пиперидин, триэтиламин (или без них) при температурах 20-150°С. Реакцию можно проводить с последующей заменой анионов в (I) обработкой кислотами с иными противоионами или солями этих кислот (или без замены аниона).
Строение полученных соединений (I) доказано с помощью спектроскопии ЯМР 1Н, электронной спектроскопии и подтверждено данными элементного анализа (примеры 1-7).
Пример 1. Диперхлорат 4-[(E)-2-(2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин-18-ил)этенил]-1-[4-({4-[E)-2-(2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин-18-ил)этенил]-1-пиридиниоил}метил)бензил]пиридиния.
В одногорлую колбу объемом 20 мл, снабженную обратным холодильником и хлоркальциевой трубкой, помещают 166 мг (0.40 ммоля) 4-[(E)-2-(2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин-18-ил)-1-этенил]пиридина, 48 мг (0.18 ммоля) 1,4-ди(бромметил)бензола и 5 мл абсолютного этанола. Реакционную смесь нагревают при 80°С на масляной бане в темноте в течение 36 ч, охлаждают до -10°С, образовавшийся осадок отфильтровывают, промывают холодным абсолютным этанолом (2×1 мл) и высушивают под вакуумом при нагревании. Получают 170 мг (0.16 ммоля) дибромидной соли красителя в виде оранжевого порошка. Дибромидную соль растворяют в минимальном количестве горячего абсолютного этанола и добавляют 54 мкл (0.62 ммоля) 70%-ной хлорной кислоты. После охлаждения до -10°С выпавший осадок отфильтровывают, промывают холодным абсолютным этанолом (2×1 мл) и высушивают под вакуумом при нагревании. Получают 134 мг (общий выход 66%) диперхлората красителя в виде оранжевого порошка, т.пл. 257-259°С (с разложением; из этанола).
Спектр ЯМР 1Н (500 МГц, в ДМСО-d6, 60°С): 3.51 (с, 8 Н, 4 CH2O); 3.56 (м, 8 Н, 4CH2O); 3.62 (м, 8 Н, 4 CH2O); 3.79 (м, 8 Н, 4CH2CH2OAr); 4.16 (м, 8 Н, 4 CH2OAr); 5.70 (с, 4 Н, 2CH2N); 7.08 (д, 2 Н, 2H(5'), J=8.4 Гц); 7.30 (д.д, 2 Н, 2 Н(6'), J=8.4 Гц, J=1.8 Гц); 7.38 (д, 2 Н, 2СН=CHPy, 3Jтранс=16.2 Гц); 7.39 (д, 2 Н, 2 Н(2'), J=1.8 Гц); 7.59 (с, 4 Н, C6H4); 7.92 (д, 2 Н, 2CH=CHPy, 3Jтранс=16.2 Гц); 8.16 (д, 4 Н, 2 Н(3), 2 Н(5), J=6.7 Гц); 8.96 (д, 4 Н, 2 Н(2), 2 Н(6), J=6.8 Гц).
УФ-спектр (С=1.4×10-5 моль·л-1, ацетонитрил), нм: 410 (ε=68000).
Найдено, %: C 55.84; H 5.87; N 2.29.
C54H66Cl2N2O20×2H2O.
Вычислено, %: C 55.43; H 6.03; N 2.39.
Пример 2. Диперхлорат 4-[(Е)-2-(2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин-18-ил)этенил]-1-[3-({4-[(-Е)-2-(2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин-18-ил)этенил]-1-пиридиниоил}метил)бензил]пиридиния.
В одногорлую колбу объемом 50 мл, снабженную обратным холодильником и хлоркальциевой трубкой, помещают 100 мг (0.24 ммоля) 4-[(E)-2-(2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин-18-ил)-1-этенил]пиридина, 29 мг (0.11 ммоля) 1,3-ди(бромметил)бензола и 15 мл абсолютного этанола. Реакционную смесь нагревают при 80°С на масляной бане в темноте в течение 25 ч, охлаждают до 5°С, образовавшийся осадок отфильтровывают, промывают холодным абсолютным этанолом (2×3 мл), затем бензолом (3 мл) и высушивают на воздухе. Получают 55 мг (0.05 ммоля) дибромидной соли красителя в виде желтого порошка. Дибромидную соль растворяют в минимальном количестве горячего абсолютного этанола и добавляют 18 мкл (0.20 ммоля) 70%-ной хлорной кислоты. После охлаждения до -10°С выпавший осадок отфильтровывают, промывают холодным абсолютным этанолом (2×3 мл) и высушивают на воздухе. Получают 33 мг (общий выход 26%) диперхлората красителя в виде желтого порошка, т.пл. >221°С (с разложением; из этанола).
Спектр ЯМР 1Н (500 МГц, в ДМСО-d6, 25°С): 3.53 (с, 8 Н, 4 CH2O); 3.56 (м, 8 Н, 4 CH2O); 3.62 (м, 8 Н, 4 CH2O); 3.79 (м, 8 Н, 4CH2CH2OAr); 4.16 (м, 8 Н, 4CH2OAr); 5.73 (с, 4 Н, 2CH2N); 7.07 (д, 2 Н, 2 H(5'), J=8.2 Гц); 7.27 (уш.д, 2 Н, 2 Н(6'), J=8.2 Гц); 7.38 (уш.с, 2 Н, 2 Н(2')); 7.41 (д, 2 Н, 2CH=CHPy, 3Jтранс=15.9 Гц); 7.53 (м, 3 Н, Н(4''), Н(5''), Н(6'')); 7.58 (уш.с, 1 Н, Н(2'')); 7.95 (д, 2 Н, 2CH=CHPy, 3Jтранс=15.9 Гц); 8.17 (д, 4 Н, 2 Н(3), 2 Н(5), J=6.7 Гц); 8.94 (д, 4 Н, 2 Н(2), 2 Н(6), J=6.7 Гц).
УФ-спектр (С=1.6×10-5 моль·л-1, ацетонитрил), нм: 410 (ε=69900).
Найдено, %: C 56.04; H 5.81; N 2.30.
C54H66Cl2N2O20×1.5H2O.
Вычислено, %: C 55.86; H 5.99; N 2.41.
Пример 3. Диперхлорат 4-{(E)-2-[4-(1,4,7,10,13-пентаокса-16-азациклооктадецил)фенил]-1-этенил}-1-{4-[(4-{(E)-2-[4-(1,4,7,10,13-пентаокса-16-азациклооктадецил)фенил]-1-этенил}-1-пиридиниоил)метил]бензил}пиридиния.
В одногорлую колбу объемом 20 мл, снабженную обратным холодильником и хлоркальциевой трубкой, помещают 100 мг (0.23 ммоля) 16-{4-[(E)-2-(4-пиридил)-1-этенил]фенил}-1,4,7,10,13-пентаокса-16-азациклооктадекана, 27 мг (0.10 ммоля) 1,4-ди(бромметил)бензола и 10 мл абсолютного этанола. Реакционную смесь нагревают при 80°С на масляной бане в течение 11 ч, охлаждают до -10°С, образовавшийся осадок отфильтровывают, промывают холодным абсолютным этанолом (2 мл), затем бензолом (2×3 мл) и высушивают на воздухе. Получают 58 мг (0.05 ммоля) дибромидной соли красителя в виде темно-красного порошка. Дибромидную соль растворяют в 25 мл горячего абсолютного этанола и добавляют 68 мг (0.20 ммоля) перхлората тетрабутиламмония. После охлаждения до -10°С выпавший осадок отфильтровывают, промывают холодным абсолютным этанолом (3 мл) и высушивают на воздухе. Получают 44 мг (общий выход 36%) диперхлората красителя в виде темно-красного порошка, т.пл. 232-234°С (с разложением; из этанола).
Спектр ЯМР 1Н (500 МГц, в MeCN-d3, 300С): 3.57-3.63 (м, 48 Н, 20CH2O, 4CH2N); 5.55 (с, 4 Н, 2CH2N+); 6.83 (д, 4 Н, 2 Н(3'), 2 Н(5'), J=9.0 Гц); 7.05 (д, 2 Н, 2CH=CHPy, 3Jтранс=16.0 Гц); 7.48 (с, 4 Н, C6H4); 7.57 (д, 4 Н, 2 Н(2'), 2 Н(6'), J=9.0 Гц); 7.77 (д, 2 Н, 2CH=CHPy, 3Jтранс=16.0 Гц); 7.86 (д, 4 Н, 2 Н(3), 2 Н(5), J=7.0 Гц); 8.37 (д. 4 Н, 2 Н(2), 2 Н(6), J=7.0 Гц).
УФ-спектр (С=1.1×10-5 моль·л-1, ацетонитрил), нм: 494 (ε=90000).
Найдено, %: C 58.57; H 6.47; N 4.64.
C58H76Cl2N4O18.
Вычислено. %: C 58.63; H 6.45; N 4.72.
Пример 4. Диперхлорат 4-{(5)-2-[4-(1,4,7,10,13-пентаокса-16-азациклооктадецил)фенил]-1-этенил}-1-{2-[(4-{(E)-2-[4-(1,4,7,10,13-пентаокса-16-азациклооктадецил)фенил]-1-этенил}-1-пиридиниоил)метил]бензил}пиридиния.
В одногорлую колбу объемом 50 мл, снабженную обратным холодильником и хлоркальциевой трубкой, помещают 150 мг (0.34 ммоля) 16-{4-[(E)-2-(4-пиридил)-1-этенил]фенил}-1,4,7,10,13-пентаокса-16-азациклооктадекана, 41 мг (0.15 ммоля) 1,2-ди(бромметил)бензола и 10 мл абсолютного этанола. Реакционную смесь нагревают при 80°С на масляной бане в течение 12 ч, охлаждают до -10°С, образовавшийся осадок отфильтровывают, промывают холодным абсолютным этанолом (2 мл), затем бензолом (2×3 мл) и высушивают на воздухе. Получают 130 мг (0.11 ммоля) дибромидной соли красителя в виде красно-фиолетового порошка. Дибромидную соль растворяют в минимальном количестве горячего абсолютного этанола и добавляют 155 мг (0.45 ммоля) перхлората тетрабутиламмония. После охлаждения до -10°С выпавший осадок отфильтровывают, промывают холодным абсолютным этанолом (2×2 мл), затем гексаном (3×5 мл) и высушивают на воздухе. Получают 108 мг (общий выход 59%) диперхлората красителя в виде красно-фиолетового порошка, т.пл. 168-171°С (из этанола).
Спектр ЯМР 1H (500 МГц, в ДМСО-d6, 30°С): 3.53-3.59 (м, 32 Н, 12CH2O, 4CH2N); 3.61-3.67 (м, 16 Н, 8CH2O); 5.84 (с, 4 Н, 2CH2N+); 6.79 (д, 4 Н, 2 Н(3'), 2 H(5'), J=8.6 Гц); 7.17 (д, 2 Н, 2CH=CHPy, 3Jтранс=15.9 Гц); 7.25 (д.д, 2 Н, Н(3''), Н(6''), J=5.5 Гц, J=3.4 Гц); 7.52 (д.д. 2 Н, Н(4''), Н(5''), J=5.5 Гц, J=3.4 Гц); 7.56 (д. 4 Н, 2 Н(2'), 2 Н(6'), J=8.6 Гц); 7.92 (д, 2 Н, 2CH=CHPy, 3Jтранс=15.9 Гц); 8.07 (д, 4 Н, 2 Н(3), 2 H(5), J=6.6 Гц); 8.68 (д, 4 Н, 2 Н(2), 2 Н(6), J=6.6 Гц).
УФ-спектр (С=1.1×10-5 моль·л-1, ацетонитрил), нм: 493 (ε=95400).
Найдено, %: C 58.41; H 6.41; N 4.77.
C58H76Cl2N4O18.
Вычислено, %: C 58.63; H 6.45; N 4.72.
Пример 5. Дибромид 2-[(E)-2-(2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-пентаоксабензоциклопентадецин-15-ил)-1-этенил]-3-(3-{2-[(Е)-2-(2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-пентаоксабензоциклопентадецин-15-ил)-1-этенил]-1,3-бензотиазолио-3-ил-3}пропил)-1,3-бензотиазолия-3. Способ 1. В одногорлую колбу объемом 20 мл, снабженную обратным холодильником и хлоркальциевой трубкой, помещают 173 мг (0.32 ммоля) дибромида 2-метил-3-[3-(2-метил-1,3-бензотиазолио-3-ил-3)пропил]-1,3-бензотиазолия-3, 410 мг (1.38 ммоля) (4-формилбензо)-15-краун-5-эфира и 5 мл уксусного ангидрида. Реакционную смесь нагревают при 140°С на масляной бане в темноте в течение 6 ч, охлаждают до комнатной температуры и прибавляют 10 мл диэтилового эфира. Образовавшийся осадок отфильтровывают, промывают диэтиловым эфиром, добавляют 10 мл метанола и кипятят в течение 1 ч. После охлаждения нерастворившееся вещество отфильтровывают и высушивают на воздухе. Получают 165 мг (47%) красителя в виде красно-оранжевого порошка, т.пл. 270-271°С (из метанола).
Способ 2. В одногорлую колбу объемом 20 мл, снабженную обратным холодильником и хлоркальциевой трубкой, помещают 173 мг (0.32 ммоля) дибромида 2-метил-3-[3-(2-метил-1,3-бензотиазолио-3-ил-3)пропил]-1,3-бензотиазолия-3, 200 мг (0.67 ммоля) (4-формилбензо)-15-краун-5-эфира, 4 мл сухого пиридина и 5 мл абсолютного этанола. Реакционную смесь нагревают при 80°С на масляной бане в токе аргона в темноте в течение 9 ч. Растворитель упаривают в вакууме, остаток промывают диэтиловым эфиром, добавляют 10 мл метанола и кипятят в течение 1 ч. После охлаждения нерастворившееся вещество отфильтровывают и высушивают на воздухе. Получают 60 мг (17%) красителя в виде красно-оранжевого порошка, т.пл. 266-268°С (из метанола).
Спектр ЯМР 1Н (500 МГц, в ДМСО-d6, 27°С): 2.50 (м, 2 Н, CH2CH2CH2); 3.65 (м, 16 Н, 8 CH2O); 3.84 (м, 8 Н, 4CH2CH2OAr); 4.19 (м, 4 Н, 2CH2OAr); 4.29 (м, 4 Н, 2CH2OAr); 5.48 (м, 4 Н, 2CH2N); 7.07 (д, 2 Н, 2 H(5'), J=8.4 Гц); 7.75 (уш.д, 2 Н, 2 Н(6'), J=8.4 Гц); 7.75 и 7.81 (2 м, 4 Н, 2 Н(5), 2 Н(6)); 7.89 (д, 2 Н, 2 Н(2'), J=1.6 Гц); 8.14 (д, 2 Н, 2CH=CHHet, J=15.6 Гц); 8.25 (д, 2 Н, 2CH=CHHet, J=15.6 Гц); 8.40 и 8.61 (2 д, 4 Н, 2 Н(4), 2 H(7), J=8.4 Гц, J=7.8 Гц).
УФ-спектр (С=1×10-5 моль·л-1, ацетонитрил), нм: 431 (ε=69000).
Найдено, %: C 53.47; H 5.15; N 2.43.
C49H56Br2N2O10S2×2H2O.
Вычислено, %: C 53.94; H 5.55; N 2.57.
Пример 6. Диперхлорат 2-[(Е)-2-(2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-пентаоксабензоциклопентадецин-15-ил)-1-этенил]-3-(3-{2-[(E)-2-(2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-пентаоксабензоциклопентадецин-15-ил)-1-этенил]-1,3-бензотиазолио-3-ил-3}пропил)-1,3-бензотиазолия-3.
В одногорлой колбе объемом 20 мл растворяют 25 мг (0.023 ммоля) дибромида красителя из примера 5 в 5 мл метанола при нагревании и добавляют 40 мкл (0.34 ммоля) 57%-ного раствора хлорной кислоты. После охлаждения до -10°С выпавший осадок отфильтровывают, промывают холодным метанолом и высушивают на воздухе. Получают 24 мг (94%) перхлората красителя в виде красно-оранжевого порошка, т.пл. 148-150°С (из метанола).
Спектр ЯМР 1Н (500 МГц, в ДМСО-d6, 27°С): 2.50 (м, 2 Н, CH2CH2CH2); 3.65 (м, 16 Н, 8CH2O); 3.84 (м, 8 Н, 4CH2CH2OAr); 4.18 (м, 8 Н, 4CH2OAr); 5.20 (м, 4 Н, 2CH2N); 7.09 (д, 2 Н, 2 Н(5'), J=8.1 Гц); 7.60 (с, 2 Н, 2 Н(2')); 7.61 (д, 2 Н, 2 H(6'), J=8.1 Гц); 7.78 и 7.85 (2 м, 4 Н, 2 Н(5), 2 Н(6)); 7.81 (д, 2 Н, 2CH=CHHet, J=15.6 Гц); 8.15 (д, 2 Н, 2CH=CHHet, J=15.6 Гц); 8.41 и 8.46 (2 д, 4 Н, 2 Н(4), 2 H(7), J=8.4 Гц, J=8.1 Гц).
УФ-спектр (С=2×10-6 моль·л-1, ацетонитрил), нм: 432 (ε=69000).
Найдено, %: C 54.06; H 5.15; N 2.16.
C49H56Cl2N2O10S2.
Вычислено, %: C 53.74; H 5.16; N 2.56.
Пример 7. Диперхлорат 4-[(E)-2-(2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-бензопентаоксациклопентадецин-15-ил)-1-этенил]-1-(3-{4-[(E)-2-(2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-бензопентаоксациклопентадецин-15-ил-1-этенил]-1-пиридиниоил}пропил)пиридиния.
В одногорлую колбу объемом 20 мл, снабженную обратным холодильником и хлоркальциевой трубкой, помещают 0.30 г (0.80 ммоля) 4-[(E)-2-(2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-бензопентаоксациклопентадецин-15-ил)-1-этенил]пиридина, 31 мкл (0.30 ммоля) 1,3-дибромпропана и 5 мл абсолютного этанола. Реакционную смесь нагревают при 80°С на масляной бане в течение 60 ч, охлаждают до -10°С, образовавшийся осадок отфильтровывают, промывают холодным абсолютным этанолом (1 мл), затем бензолом (2×3 мл) и высушивают на воздухе. Получают 0.13 г (0.14 ммоля) дибромидной соли красителя в виде темно-желтого порошка. Дибромидную соль растворяют в 10 мл метанола при нагревании и добавляют 31 мкл (0.35 ммоля) 70%-ной хлорной кислоты. После охлаждения до -10°С выпавший осадок отфильтровывают, промывают холодным метанолом (2 мл), бензолом (2×3 мл) и высушивают на воздухе. Получают 74 мг (общий выход 25%) диперхлората красителя в виде желтого порошка, т.пл. 248-250°С (с разложением; из метанола).
Спектр ЯМР 1Н (500 МГц, в MeCN-d3, 25°С): 2.65 (м, 2 Н, CH2CH2CH2); 3.67 (м, 16 Н, 8CH2O); 3.85 (м, 8 Н, 4CH2CH2OAr); 4.15 (м, 8 Н, 4CH2OAr); 4.59 (м, 4 Н, 2CH2N; 6.98 (д, 2 Н, 2 Н(5'), J=8.5 Гц); 7.22 (д, 2 Н, 2CH=CHPy, J=16.2 Гц); 7.72 (м, 4 Н, 2 Н(2'), 2 Н(6')); 7.76 (д, 2 Н, 2CH-CHPy, J=16.2 Гц); 7.97 (д, 4 Н, 2 Н(3), 2 H(5), J=5.9 Гц); 8.52 (д, 4Н, 2Н(2), 2Н(6), J=5.9 Гц).
УФ-спектр (С=2×10-6 моль·л-1, ацетонитрил), нм: 407 (ε=68000).
Найдено, %: C 54.29; H 5.57; N 3.13.
C45H56Cl2N2O18.
Вычислено, %: C 54.38; H 5.81; N 2.88.
Остальные соединения были получены способами, аналогичными примерам 1, 3, 5 или 7.
Полученные бисстириловые красители были предварительно исследованы в растворах для определения их оптических характеристик, эффективности и селективности комплексообразования с ионами алкандиаммония NH3 +(CH2)nNH3 + (n=2-10, 12) и катионами щелочных и щелочноземельных металлов, а также для оценки величины ионохромного и ионофлуорохромного эффекта. Соединения нового типа указанного строения (I) в ацетонитрильном растворе имеют интенсивное поглощение в области 400-500 нм, которое определяется природой гетероатома краун-эфирного фрагмента красителя, находящегося в пара-положении к двойной связи C=C и участвующего в сопряжении с кватернизованным гетероциклическим остатком, а также электроноакцепторной силой кватернизованного гетероциклического остатка.
Бисстириловые красители способны образовывать с ионами алкандиаммония комплексы состава 1:1, имеющие псевдосэндвичевое строение вследствие дитопного комплексообразования двух аммонийных групп субстрата с двумя краун-эфирными фрагментами красителя. Благодаря этой способности бисстириловые красители значительно лучше связывают диаммонийные ионы по сравнению с моноаммонийными. Термодинамическая устойчивость псевдосэндвичевых комплексов с участием диаммонийных ионов и селективность комплексообразования определяются строением краун-эфирного фрагмента и полиметиленового или ксилиленового мостика в бисстириловом красителе, длиной диаммонийного иона, а также зависит от природы растворителя, состава смеси органических растворителей и их смесей с водой.
Для примера в таблице 1 представлены данные, полученные для ацетонитрильных растворов красителя из примера 1 (краситель 1), где указаны константы устойчивости комплексов этого красителя состава 1:1 и 1:2 с ионами EtNH3 + и NH3+(CH2)2NH3 + (n=2-6), а также основные абсорбционные характеристики красителя и его комплексов. Гипсохромные сдвиги длинноволнового максимума в спектре поглощения красителя 1, наблюдаемые при образовании псевдосэндвичевых комплексов состава 1:1, достигают 22.5 нм и объясняются участием неподеленной электронной пары гетероатома краун-эфирного фрагмента, находящегося в сопряжении со стириловым фрагментом красителя, в комплексообразовании с ионом диаммония с помощью водородной связи. Значения логарифмов констант устойчивости для псевдосэндвичевых комплексов находятся в диапазоне 5.5-5.9. Селективность красителя 1 к диаммонийным ионам относительно моноаммонийных ионов, определяемая отношением констант устойчивости соответствующих комплексов состава 1:1, достигает значения 130.
| Таблица 1. | ||||
| Константы устойчивости1) комплексов красителя из примера 1 (краситель 1) состава 1:1 и 1:2 с ионами EtNH3 + и NH3+(CH2)nNH3 + (n=2-6), основные абсорбционные характеристики2) красителя 1 и его комплексов в MeCN при 23±2°С. | ||||
| Система | lgK | λmax/нм | Δλ/нм | εmax/л·моль-1·см-1 |
| краситель 1 | 409.5 | 68000 | ||
| 1·EtNH3 + | 3.81 | 400 | 9.5 | 66200 |
| 1·(EtNH3 +)2 | 3.12 | 393.5 | 16 | 70500 |
| 1·NH3 +(CH2)2NH3 + | 5.53 | 387.5 | 22 | 64400 |
| 1·(NH3 +(CH2)2NH3 +)2 | 2.20 | 391.5 | 18 | 68100 |
| 1·NH3 +(CH2)3NH3 + | 5.92 | 387 | 22.5 | 64400 |
| 1·NH3 +(CH2)3NH3 +)2 | 2.02 | 390 | 19.5 | 69800 |
| 1·NH3 +(CH2)4NH3 +)2 | 5.60 | 387.5 | 22 | 63900 |
| 1·(NH3 +(CH2)4NH3 +)2 | 2.06 | 391 | 18.5 | 69900 |
| 1·NH3 +(CH2)5NH3 + | 5.56 | 387.5 | 22 | 63900 |
| 1·(NH3 +(CH2)5NH3 +)2 | 2.07 | 391 | 18.5 | 69800 |
| 1·NH3 +(CH2)6NH3 + | 5.55 | 388 | 21.5 | 64200 |
| 1·(NH3 +(CH2)6NH3 +)2 | 2.05 | 392 | 17.5 | 68900 |
| 1) Для комплексов состава 1:1 K=[L·M]/([L]·[M]), для комплексов состава 1:2 K=[L·M2]/([L·M]·[M]); величины lgK измерены при ионной силе раствора 0.02-0.03 моль·л-1. | ||||
| 2) λmax - максимум длинноволновой полосы поглощения, Δλ - величина гипсохромного сдвига λmax для комплексов, εmax - коэффициент молярного поглощения. |
Бисстириловые красители, содержащие два фрагмента 15-краун-5-эфира, способны образовывать сэндвичевые комплексы состава 1:1 с катионами щелочных и щелочноземельных металлов, имеющими большой ионный радиус (например, K+, Sr2+ или Ba2+). Эти комплексы характеризуются повышенной устойчивостью в сравнении с комплексами с участием соответствующих катионов меньшего диаметра. Образование сэндвичевых комплексов сопровождается сильным гипсохромным эффектом и значительным изменением люминесцентных характеристик бисстирилового красителя.
Для примера в таблице 2 представлены данные, полученные для ацетонитрильных растворов красителей из примеров 6 и 7 (соответственно красители 6 и 7); указаны константы устойчивости комплексов красителей 6 и 7 с ионами Mg2+, Ca2+, Sr2+ и Ва2+, а также основные абсорбционные и люминесцентные характеристики этих красителей и их комплексов.
| Таблица 2. | ||||||
| Константы устойчивости1) комплексов красителей из примера 6 (краситель 6) и из примера 7 (краситель 7) с катионами металлов, основные абсорбционные и люминесцентные характеристики2) этих красителей и их комплексов в MeCN при 25°С. | ||||||
| Система | lgK | Поглощение | Люминесценция | |||
| λmax/нм | εmax/л·моль-1·см-1 | λmax fl/нм | φfl | τ/нс | ||
| краситель 6 | 432 | 69000 | 563 | 0.0051 | 0.07 | |
| 6·Mg2+ | 5.97 | 400 | 59600 | - | - | - |
| 6·(Mg2+)2 | 4.38 | 394 | 67900 | - | - | - |
| 6·Са2+ | 5.68 | 380 | 53300 | - | - | - |
| 6·(Са2+)2 | 3.55 | 395 | 64800 | - | - | - |
| 6·Sr2+ | 8.5 | 380 | 52400 | - | - | - |
| 6·Ва2+ | 8.0 | 390 | 59200 | 530 | 0.0031 | 0.04, 1.4 |
| краситель 7 | 407 | 68000 | 569 | 0.048 | 0.33 | |
| 7·Mg2+ | 6.3 | 374 | 62100 | - | - | - |
| 7·(Mg2+)2 | 5.3 | 370 | 74200 | - | - | - |
| 7·Ва2+ | >8 | 368 | 66700 | 568 | 0.029 | 1.3 |
| 1) Для комплексов состава 1:1 K=[LM]/([L][M]), для комплексов состава 1:2 К=[L·M2]/([L·M]·[M]), величины lgK измерены при ионной силе раствора 0.01 моль·л-1. | ||||||
| 2) λmax - максимум длинноволновой полосы поглощения, εmax - коэффициент молярного поглощения, λmax fl - максимум в исправленном спектре люминесценции, φfl - квантовый выход, τ - время жизни. |
Краситель 6 показывает очень высокую селективность к ионам Sr2+ или Ва2+ относительно ионов Mg2+ и Са2+. Коэффициент селективности (отношение констант устойчивости комплексов состава 1:1) в паре Sr2+/Ca2+ достигает 660. Для системы 6/Sr2+ гипсохромный сдвиг длинноволнового максимума в спектре поглощения, связанный с образованием сэндвичевого комплекса, достигает 52 нм. Образование комплексов красителей 6 и 7 с ионами Ва2+ сопровождается снижением квантового выхода люминесценции, при этом время жизни люминесценции значительно возрастает. Появление долгоживущей люминесценции, вероятно, связано с образованием эксимерного состояния в результате взаимодействия двух стириловых хромофоров (возбужденного и невозбужденного) в сэндвичевом комплексе.
Таким образом, предварительные результаты исследования красителей общей формулы (I) показали, что в апротонной среде они способны селективно и с хорошим оптическим откликом связывать катионы металлов большого ионного радиуса и ионы диаммония, то есть проявляют свойства оптических молекулярных сенсоров (ОМС). Эти свойства сохраняются в полимерных композитных пленках, что позволяет создать на основе полученных красителей оптические хемосенсорные материалы.
Для получения ХКМ использовали следующие полимеры: целлюлозы ацетатфталат (ЦАФ), целлюлозы ацетатгидрофталат (ЦАГФ), целлюлозы ацетатбутират (ЦАБ), поливинилбутираль (ПВБ), полистирол (ПС) и поливинилхлорид (ПВХ). Растворы полимеров и красителей готовили в следующих растворителях: хлороформе, 1,2-дихлорэтане, ацетонитриле, ацетоне, тетрагидрофуране. Заявленные бисстириловые красители были введены в полимерные пленочные материалы, получаемые методом полива по следующей общей методике. В раствор полимерного носителя с концентрацией 2-4 мас.% в одном из указанных растворителей вводят раствор красителя в том же растворителе (или в любом другом растворителе из вышеуказанных) с концентрацией 0.01 моль·л-1. Получают раствор, содержащий 1 мас.% красителя в расчете на массу полимера, который затем поливают на кварцевое или предметное стекло. Испарение растворителя приводит к образованию пленки, которую высушивают при комнатной температуре в течение 24 ч. Полученные полимерные матрицы представляют собой желто- или красноокрашенные прозрачные пленки толщиной 10-20 мкм.
Полученные полимерные матрицы, содержащие красители, были исследованы в качестве ион-селективных оптических материалов на присутствие в воде солей алкандиаммония NH3 +(CH2)nNH3 + (n=3-9). Для этого композитные пленки в течение 1.5 ч выдерживали в водных растворах солей алкандиаммония с концентрацией от 1×10-6 до 1×10-3 моль·л-1 и затем исследовали их спектры поглощения и флуоресценции. Чувствительность полученных ХКМ определяли по величине смещения максимумов поглощения и флуоресценции после воздействия водных растворов ионов NH3 +(CH2)nNH3 +. Установлено, что хемосенсорные композитные материалы на основе бистириловых красителей чувствительны к ионам диаммония на уровне концентраций около 10-5 моль·л-1. Исследования показали, что величина сдвига максимума флуоресценции ХКМ увеличивается при повышении концентрации NH3 +(CH2)nNH3 +, что позволяет определять количественное содержание ионов диаммония в растворе. Например, результаты детекции диаммонийных солей пленками на основе красителя из примера 1 (краситель 1) представлены в таблицах 3 и 4.
| Таблица 3. | ||||||
| Изменения в спектрах поглощения ХКМ, содержащих краситель из примера 1 (краситель 1), до и после взаимодействия с водными растворами солей NH3 +(CH2)3NH3 + | ||||||
| Полимер | ПВБ | ЦАБ | ЦАФ | |||
| Концентрация NH3 +(CH2)3NH3 +, моль·л-1 | 10-5 | 10-4 | 10-5 | 10-4 | 10-5 | 10-5 |
| Δλmax, нм 1) | -3 | -4 | 5 | 7 | 3 | 4 |
| Полимер | ЦАГФ | ПВБ | ПВХ | |||
| Концентрация NH3 +(CH2)3NH3 +, моль·л-1 | 10-5 | 10-4 | 10-4 | 10-5 | 10-4 | |
| Δλmax, нм 1) | 3 | 4 | 1 | 2 | -4 | |
| 1) Δλ - величина сдвига λmax для комплексов. | ||||||
| Таблица 4. | ||||||
| Изменения в спектрах поглощения и флуоресценции ХКМ на основе ЦАГФ, содержащих краситель из примера 1 (краситель 1), до и после взаимодействия с водными растворами солей алкандиаммония с концентрацией 1×10-4 моль·л-1. | ||||||
| Ион диаммония | Δλmax, НМ 1) | |||||
| Поглощение | Флуоресценция | |||||
| NH3 +(CH2)3NH3 + | 4 | 11 | ||||
| NH3 +(CH2)5NH3 + | 7 | 15 | ||||
| NH3 +(CH2)7NH3 + | 6 | 11 | ||||
| NH3 +(CH2)9NH3 + | 6 | 12 | ||||
| 1) Δλ - величина сдвига λmax для комплексов. |
Таким образом, получен новый тип бисстириловых красителей, содержащих гибкий полиметиленовый или жесткий ксилиленовый мостик и два фрагмента (аза)краун-эфира, и обнаружена их ярко выраженная способность к селективному связыванию катионов металлов с большим ионным радиусом и ионов алкилдиаммония как в апротонной, так и в водной среде, в том числе в составе полимерных матриц, характеризующаяся существенными спектральными изменениями. Эти свойства позволяют использовать заявленные соединения в составе оптических хемосенсорных материалов, например, для определения солей металлов и солей диаммония в промышленных водах, биологических жидкостях, дл