Способ экстракции рнк из растительных образцов
Иллюстрации
Показать всеИзобретение относится к сельскому хозяйству, а именно к способу экстракции рибонуклеиновой кислоты (РНК) из растительных образцов различного происхождения. На этапе гомогенизации растительных образцов в лизирующий буфер, содержащий 4 М гидрохлорид гуанидина, 0,2 М ацетат натрия, 25 мМ ЭДТА, 2,5% поливинилпирролидон, 20% саркозил, добавляют гидроксипроизводное бензойной кислоты в количестве 20-30 мг на образец. Способ позволяет повысить эффективность выделения РНК, что способствует более успешному протеканию ПЦР и выявлению вирусов в растительном материале. 2 ил., 2 табл.
Реферат
Изобретение относится к сельскому хозяйству, а именно к способу экстракции рибонуклеиновой кислоты (РНК) из растительных образцов различного происхождения.
Известен способ экстракции рибонуклеиновой кислоты (РНК) из растительных образцов для последующей диагностики вирусов методом полимеразной цепной реакции (ОТ-ПЦР) (Rwahnih M. Al et al. Molecular variability of Apple Chlorotic Leaf Spot Virus in different hosts and geographical regions // Journal of Plant Pathology. - 2004. - 86 (2). - P.117-122). Данный способ применяется для выявления вируса хлоротической пятнистости листьев яблони в различных плодовых культурах и предусматривает гомогенизацию растительных образцов в лизирующем буфере, содержащем 6 М гидрохлорида гуанидина, 0,2 М ацетата натрия, 1 М ацетата калия, 25 мМ ЭДТА и 2,5% поливинилпирролидона (ПВП).
Однако данный, несомненно, прогрессивный способ характеризуется недостаточно высокой эффективностью экстракции РНК из образцов при диагностике других вирусов, что связано с отсутствием применения антиоксидантов. В соке плодовых и ягодных культур содержатся высокие количества фенольных соединений, полисахаридов и других ингибирующих ферменты веществ, препятствующих получению препаратов нуклеиновых кислот.
Использование соединений с антиоксидантной активностью позволяет удалять ингибиторы ферментов из растительных экстрактов.
Известно применение гидроксипроизводного бензойной кислоты в составе фосфатного буфера для заражения травянистых растений-индикаторов соком исследуемых растений (Патент РФ №2147173, МПК А01Н 1/04/ Упадышев М.Т., Петрова А.Д. Способ тестирования растений на вирусы. - Заявл. 02.12.1998. - Опубл. 10.04.2000. - Бюл.№10).
Однако назначение препарата, задачи и способы их достижения в предлагаемом способе отличаются от известных способов. К тому же диапазон концентраций гидроксипроизводного бензойной кислоты в предлагаемом способе иной, чем в известном (1×10-5-5×10-4 М в известном способе, тогда как в предлагаемом способе диапазон концентраций составляет 20-30 мг/образец).
Наиболее близким техническим решением к заявляемому является способ экстракции РНК из растительных образцов, при котором для повышения эффективности выявления вирусов к лизирующему буферу, содержащему 4 М гидрохлорида гуанидина, 0,2 М ацетата натрия, 25 мМ ЭДТА, 2,5% поливинилпирролидона, 20% саркозила, в качестве антиоксиданта добавляют метабисульфит натрия в концентрации 1% (Habili N., Afsharifar A., Symons R.H. First detection of an ampelovirus, a maculavirus and two vitiviruses in Iranian table grapes // 14th ICVG Conference, Locorotondo, 12-17th September, 2003. - P.162-163 - прототип).
Недостатком этого известного способа является то, что он разработан применительно к вирусам винограда, и на других культурах экстракция РНК происходит с меньшей эффективностью.
Задачей, на решение которой направлено изобретение, является повышение эффективности экстракции РНК из растительных образцов и последующей диагностики вирусов методом полимеразной цепной реакции.
Поставленная задача решается тем, что в способе экстракции РНК из растительных образцов для последующей диагностики вирусов методом полимеразной цепной реакции, включающем гомогенизацию растительных образцов в лизирующем буфере, новым является то, что на этапе гомогенизации добавляют гидроксипроизводное бензойной кислоты в количестве 20-30 мг на образец.
Технический результат выражается в том, что после добавления к лизирующему буферу гидроксипроизводного бензойной кислоты в количестве 20-30 мг на образец происходит повышение эффективности экстракции РНК, что способствует более успешному протеканию ПЦР и выявлению вирусов в растительном материале.
Отличительными признаками предлагаемого способа по сравнению с прототипом является использование гидроксипроизводного бензойной кислоты в количестве 20-30 мг на образец на этапе гомогенизации.
Проведенный анализ уровня техники, включающий поиск по патентным и научно-техническим источникам информации и выявление источников, содержащих сведения об аналогах заявленного изобретения, позволил установить отсутствие технического решения в источниках, характеризующихся признаками, тождественными признакам заявленного изобретения.
Определение из перечня выявленных аналогов прототипа как наиболее близкого по совокупности признаков аналога позволило установить в заявленном способе совокупность существенных отличительных признаков по отношению к усматриваемому техническому результату, изложенных в формуле изобретения.
Следовательно, заявленное изобретение соответствует условию «новизна».
Результаты проверки проведенного дополнительного поиска известных решений показали, что заявляемый способ имеет «изобретательский уровень», и для специалистов суть заявленного не является очевидным и явным образом не вытекает из известных способов, а является результатом исследований и творческого труда авторов изобретения.
Следовательно, заявленное изобретение соответствует условию «изобретательский уровень».
Способ осуществляют следующим образом.
Пример 1.
ПЦР-тесты проводят с праймерами и реакционными смесями, разработанными в ООО "Агродиагностика", а также с праймерами, синтезированными в компании "СибЭнзим", наборами для ОТ-ПЦР компании "Биоком". При проведении ОТ-ПЦР амплификацию выполняют на программируемом термостате «Терцик», а регистрацию результатов осуществляют на трансиллюминаторе Vilber Lourmat TCP-20. МС с выводом изображений электрофореграмм ПНР-продуктов на компьютер.
Экстракцию РНК осуществляют следующим образом:
1. Берут навеску растительного образца (листья, кору, древесину) в количестве 0,1 г в соотношении 1:15 с буфером, содержащим 4 М гидрохлорида гуанидина, 0,2 М ацетата натрия, 25 мМ ЭДТА, 2,5% поливинилпирролидона, 20% саркозила.
2. Осуществляют гомогенизацию образца в ступке, в которую добавляют гидроксипроизводное бензойной кислоты по 20-30 мг/образец.
3. В промаркированные пробирки (эппендорфы) добавляют по 600 мкл растертого образца + 120 мкл додецилсульфата натрия, тщательно перемешивают и термостатируют на термошейкере при 70°С в течение 10 минут.
4. Перемещают пробирки на лед на 5-10 минут.
5. Центрифугируют в течение 10 минут при 13000 оборотах/мин.
6. Маркируют необходимое количество чистых пробирок.
7. Отцентрифугированный образец в количестве 300 мкл переносят в чистые пробирки.
8. Добавляют по 300 мкл йодида натрия +150 мкл абсолютного этанола +50 мкл силики (тщательно перемешанной).
9. При комнатной температуре встряхивают в течение 20 минут на термошейкере при 1400 об/мин.
10. Центрифугируют 1 мин при 6000 об/мин.
11. Готовят смесь 1:1 из абсолютного спирта и буфера STE.
12. Промывают вышеуказанной смесью образцы (наносят по 500 мкл смеси), центрифугируют 1 мин при 6000 об/мин, надосадочную жидкость сливают.
13. Пункт 11 повторяют.
14. К осадку добавляют 150 мкл воды, перемешивают на вортексе.
15. Термостатируют в течение 4 мин при 70°С.
16. Образцы центрифугируют в течение 5 минут при 13000 об/мин.
Образец РНК готов для проведения обратной транскрипции.
Обратную транскрипцию проводят с применением готовых наборов, предложенных компанией «Агродиагностика». Для этого готовят ОТ - смесь в расчете на 1 образец: в отдельной пробирке 5 смешивают 2,0 мкл ОТ-буфера; 1,0 мкл ОТ-дНТФ и 0,5 мкл MMLV-обратной транскриптазы. В промаркированные пробирки по 0,6 мл вносят по 3,5 мкл От-смеси. После чего переносят пробирки в зону пробоподготовки. Вносят в пробирки по 16,6 мкл образца, встряхивают на вортексе 3-5 сек, осаждают капли кратковременным центрифугированием. Термостатируют пробирки при 40°С в течение 40 мин, затем инактивируют обратную транскриптазу прогреванием при 95°С в течение 10 минут. Далее осаждают капли кратковременным центрифугированием. Полученный кДНК готов к внесению в реакционную смесь для постановки ПЦР.
Для постановки ПЦР используют набор реагентов «ПЦР-ядро» компании «Биоком». В необходимое количество промаркированных пробирок вносят по 5 мкл смеси праймеров (концентрация 0,1-0,5 мкМ), 10 мкл ПЦР-растворителя, 5 мкл готовой кДНК. В качестве отрицательного контроля следует использовать бидистиллированную воду. Во все пробирки добавляют по 20 мкл минерального масла. Переносят пробирки в термоблок программируемого термостата «Терцик» и осуществляют амплификацию.
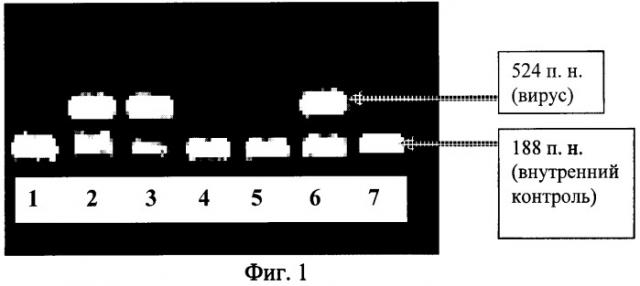
Для экспериментов были подобраны образцы груши, заведомо содержащие вирусы. Как показывают результаты (табл.1, фиг.1), при выполнении ОТ-ПЦР на вирусы хлоротической пятнистости листьев яблони и бороздчатости древесины яблони на груше с применением способа экстракции РНК в соответствии с прототипом оба вируса не удалось диагностировать (образец 5 на фиг.1), тогда как при добавлении гидроксипроизводного бензойной кислоты в количестве 20 (образец 2) или 30 мг/образец (образец 3) вирусы успешно детектировались.
| Таблица 1 | ||
| Эффективность выявления вирусов хлоротической пятнистости листьев яблони (ACLSV) и бороздчатости древесины яблони (ASGV) на груше при выполнении ОТ-ПЦР в зависимости от способа экстракции РНК и концентрации гидроксипроизводного бензойной кислоты (ГПБК) | ||
| Способ выделения РНК | ACLSV | ASGV |
| Прототип | - | - |
| Предлагаемый способ с ГПБК 10 мг/образец | - | - |
| ГПБК 20 мг/образец | + | + |
| ГПБК 30 мг/образец | + | + |
| ГПБК 40 мг/образец | - | - |
| Примечание: - вирус не обнаружен; +вирус обнаружен. |
Более низкая (10 мг) (образец 1) и высокая (40 мг) (образец 4) концентрации гидроксипроизводного бензойной кислоты были неэффективными.
Пример 2. Способ осуществляют по примеру 1. Для проведения ПЦР в реальном времени на этапе амплификации используют систему «Мини-Оптикон» (США) с выводом результатов амплификации в виде графиков флуоресценции на монитор компьютера.
Как видно из таблицы 2, наработка ПЦР-продукта при диагностике растений сливы на вирус шарки в способе выделения по прототипу начинается позже, чем в предлагаемом способе при использовании гидроксипроизводного бензойной кислоты в концентрации 20 или 30 мг/образец.
| Таблица 2 | ||||||
| Эффективность амплификации при выполнении ОТ-ПЦР в реальном времени при тестировании сливы на вирус шарки в зависимости от способа экстракции РНК и концентрации гидроксипроизводного бензойной кислоты (ГПБК) | ||||||
| Способ выделения РНК | Номер порогового цикла амплификации, с которого начинается наработка ПЦР-продукта | Репортерная флуоресценция (экстремум), в ед. | ||||
| Опыт 1 | Опыт 2 | Опыт 3 | Опыт 1 | Опыт 2 | Опыт 3 | |
| Прототип | 24 | 12 | 19 | 0,095 | 0,130 | 0,015 |
| Предлагаемый способ с ГПБК 10 мг/образец | 20 | 12 | 20 | 0,090 | 0,115 | 0,014 |
| ГПБК 20 мг/образец | 10 | 10 | 15 | 0,130 | 0,155 | 0,028 |
| ГПБК 30 мг/образец | 10 | 10 | 13 | 0,113 | 0,138 | 0,030 |
| ГПБК 40 мг/образец | 25 | 13 | 20 | 0,070 | 0,120 | 0,012 |
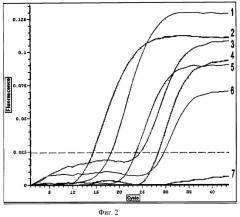
Так, в опыте 1 наработка продукта в предлагаемом способе (20 или 30 мг ГПБК) начиналась уже на 10 цикле амплификации, тогда как в прототипе - только с 24 цикла, что свидетельствует о более низкой эффективности известного способа. Экстремум репортерной флуоресценции в предлагаемом способе был на 19-37% выше (фиг.2, линии 1 и 2) по сравнению с прототипом (линия 4). Репортерная флуоресценция прямо пропорциональна количеству ПЦР-продукта и, соответственно, концентрации вируса. Высокие значения флуоресценции свидетельствуют о более успешной экстракции РНК и более корректной оценке зараженности образцов вирусами.
Указанная закономерность по преимуществу разработанного способа имела место и в опытах 2 и 3. В опыте 2 в предлагаемом способе (20 или 30 мг ГПБК) наработка ПЦР-продукта начиналась с 10 цикла амплификации, в прототипе - с 12-го. Значения репортерной флуоресценции в прототипе были на 6-19% ниже по сравнению с предлагаемым способом. В опыте 3 наработка ПЦР-продукта при использовании разработанного способа начиналась с 13-15 цикла амплификации, в прототипе - с 19-го. Экстремум репортерной флуоресценции в предлагаемом способе в 1,9-2,0 раза превышал соответствующий показатель в прототипе.
Таким образом, экстракция РНК по предлагаемому способу происходит более успешно, что приводит к повышению эффективности выделения РНК из растительных образцов и последующей диагностики вирусов методом полимеразной цепной реакции и выражается в случае ОТ-ПЦР в более достоверном выявлении вирусной инфекции, а при проведении ОТ- ПЦР в реальном времени - в более ранней наработке ПЦР-продукта (с 10-15 цикла в отличие от 12-24 цикла в прототипе) и более высоких значениях репортерной флуоресценции (в среднем на 45% выше) по сравнению с прототипом.
Способ экстракции РНК из растительных образцов для последующей диагностики вирусов методом полимеразной цепной реакции, включающий гомогенизацию образцов в лизирующем буфере, содержащем 4 М гидрохлорида гуанидина, 0,2 М ацетата натрия, 25 мМ ЭДТА, 2,5% поливинилпирролидона, 20% саркозила, отличающийся тем, что на этапе гомогенизации добавляют гидроксипроизводное бензойной кислоты в количестве 20-30 мг/образец.