Модифицированный антагонист рецептора il-4 и предназначенный для его получения очищенный полинуклеотид
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению модифицированного антагониста рецептора мутеина IL-4 (IL-4RA), и может быть использовано для лечения заболеваний дыхательных путей, таких как астма, эмфизема или хронический бронхит. В модифицированной молекуле IL-4RA, которая ингибирует опосредованную IL-4 и IL-13 активность, аминокислотные остатки 37, 38 или 104 представляют собой цистеин. Полинуклеотидом, кодирующим указанный антагонист, в составе вектора экспрессии трансформируют клетку-хозяина и получают IL-4RA. Полученную молекулу IL-4RA ПЭГилируют и используют для устранения нарушений, связанных с повышенной активностью IL-4 и IL-13. Изобретение позволяет получить антагонист с более длительным периодом полураспада по сравнению с немодифицированным IL-4RA. 8 н. и 9 з.п. ф-лы, 1 ил., 7 табл.
Реферат
Область, к которой относится изобретение
Данное изобретение относится к антагонисту рецепторов мутеина IL-4, присоединенному к небелковому полимеру, такому как полиэтиленгликоль. Кроме того, в нем предусмотрены составы, дозированные формы и способы их введения для терапевтических целей. Эти модифицированные антагонисты рецептора мутеина IL-4 и композиции и способы, их использующие, пригодны для лечения индивидуумов, страдающих от тяжелой астмы, хронического обструктивного легочного заболевания и связанных с ними состояний легких.
Предпосылки создания изобретения
Астма характеризуется изменчивой, обратимой обструкцией дыхательных путей и гиперответом дыхательных путей (AHR), связанными с инфильтрацией слизистой оболочки бронхов активированными Т-лимфоцитами (Т-клетками) и эозинофилами. Эти клетки вместе с резидентными тучными клетками дыхательных путей секретируют различные цитокины и медиаторы, которые играют главную роль в патогенезе болезни. Клетки CD4+Th2 за счет выделения специфических цитокинов (IL-4, IL-5, IL-9 и IL-13) управляют развитием болезни. В частности, Th2 цитокины, IL-4 и IL-13, как полагают, являются главными в развитии и сохранении воспаления дыхательных путей и гиперответа дыхательных путей.
В ряде in vivo исследований также поддерживается мнение об основной роли IL-4 и IL-13 в патогенезе астмы. При использовании животных с дефицитом цитокина или реагентов, которые нейтрализуют функцию или IL-4, или IL-13, наблюдается важная роль этих цитокинов в регулировании первичного и вторичного иммунного ответа, приводящего к воспалению дыхательных путей и гиперответу дыхательных путей (3, 4). Взятые вместе, эти данные позволяют предположить, что IL-4 и IL-13 оба могут играть перекрывающиеся и независимые роли в аллергическом ответе дыхательных путей и что нацеливание на оба цитокина может иметь значительное дополнительное преимущество по сравнению с нацеливанием на любой один цитокин.
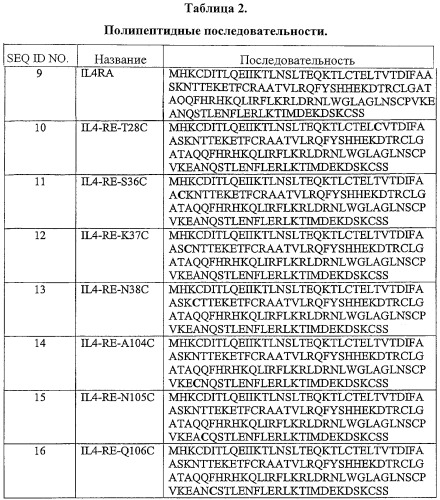
Антагонисты IL-4 описаны в литературе. Мутанты IL-4, которые действуют как антагонисты, включают мутеин IL-4, IL-4/Y124D (Kruse N., Tony H.P., Sebald W., Conversion of human interleukin-4 into a high affinity antagonist by a single amino acid replacement, Embo J. 11:3237-41, 1992) и двойной мутеин IL-4 [R121D/Y124D] Tony H. et al., Design of Human Inerieukin-4 Antagonist in Inhibiting hierleukin-4-dependent and Inerleukin-13-dependent responses in T-cells and B-cells with high efficiency, Eur. J. Biochem. 225: 659-664 (1994)). Единичный мутеин представляет собой тирозин, замещенный аспартовой кислотой в положении 124 в D-спирали. Двойной мутеин представляет собой аргинин, замещенный аспартовой кислотой в положении 121, и тирозин, замещенный аспартовой кислотой в положении 124 в D-спирали. Изменения в этой части D-спирали хорошо коррелируются с изменениями во взаимодействиях на втором участке связывания.
Варианты мутантов IL-4, проявляющие агонизм или антагонизм IL-4 дикого типа, могут быть полезными при лечении состояний, связанных с одним из плейотропных эффектов IL-4. Например, антагонисты IL-4 будут пригодны для лечения состояний, обострившихся при продуцировании IL-4, таких как астма, аллергия или другие воспалительные состояния-ответы. Агонисты IL-4 могут быть полезны для лечения состояний, при которых наличие IL-4 связано с улучшением состояния или ослаблением болезни, например, аутоиммунных болезней, таких как ревматоидный артрит, рассеянный склероз, инсулинзависимый сахарный диабет и т.д. Эти аутоиммунные болезни характеризуются поляризацией при продуцировании популяций Т-клеток-помощников (хелперов), типов 1 и 2 (Th1, Th2). Незараженные СD4+Т-клетки дифференцируют на субпопуляции Th1 или Th2 в зависимости от цитокина, содержащегося во время стимулирования. Агонист IL-4 будет идеально сдвигать продуцирование в сторону Т-клеток-хелперов, а именно, в сторону образования Th2, оказывая тем самым терапевтическое действие.
В заявке PCT/US93/03613 описан вариант IL-4, содержащий Phe-Leu или Туг-Leu последовательность в альфа-области спирали и отрицательно заряженную аминокислоту среди двух аминокислот в 3'-5'-направлении или 5'-3'-направлении от последовательности Phe-Leu или Tyr-Leu, причем этот вариант имеет повышенное сродство к рецептору IL-4 благодаря нейтральной аминокислоте, замещающей отрицательно заряженную аминокислоту. В этой заявке указано также, что специфическое замещение Trp-Leu или Phe-Leu в а-спирали IL-4 в 2-остатках отрицательно заряженного остатка приводит к повышенному сродству. Вариант является IL-4 слитым белком (с дифтерийным токсином).
Рекомбинантный мутеин (IL-4RA), являющийся производным IL-4 человека, мутированным в двух положениях его аминокислотной последовательности, описан в патентах США 6028176 и 6313272. IL-4RA связывается с высоким сродством с альфа-цепью рецептора IL-4 человека, важным функциональным сигнальным компонентом обоих комплексов рецепторов IL-4 и IL-13. Этот мутеин не обладает активностью агониста и действует как сильнодействующий конкурентный антагонист рецепторов IL-4 и IL-13 in vitro (см. патенты США 6028176 и 613272). Значительный недостаток применения IL-4RA состоит в его довольно коротком периоде полураспада (примерно 3-6 часов). Фармакокинетическое/фармакодинамическое моделирование IL-4RA в модели астмы у приматов показывает, что эффективная средняя стабильная концентрация при достижении оптимального терапевтического эффекта составляет около 60 нг/мл.
Одним из подходов к преодолению короткого периода полураспада является частое введение мутеина IL-4RA пациенту, однако, частое введение (обычно путем инъекции или интубации в трахею) создает значительные препятствия переносимости терапии пациентом и проведению терапии в клинических условиях.
Сущность изобретения
Изобретение предусматривает мутеины IL-4RA с более длинным периодом полураспада, чем у ранее описанных мутеинов. Данное изобретение также предусматривает реагенты и способы ингибирования иммунных ответов, опосредованных IL-4 и IL-13. Этот и другие аспекты настоящего изобретения предусмотрены в одном или нескольких вариантах изобретения, указанных ниже.
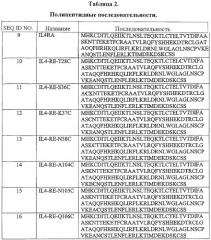
Согласно одному варианту данное изобретение предусматривает очищенный препарат модифицированного антагониста рецептора мутеина IL-4, включающий антагонист рецептора мутеина IL-4, присоединенный к небелковому полимеру, выбранному из группы, состоящей из полиэтиленгликоля, полипропиленгликоля и полиоксиалкиленов. Согласно одному аспекту изобретения очищенный препарат содержит модифицированный полипептидный антагонист рецептора мутеина IL-4, который кодирован нуклеотидной последовательностью, указанной далее в SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7 или SEQ ID NO:8. Согласно другому аспекту полипептид включает аминокислотную последовательность, указанную ниже в SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15 или SEQ ID NO:16.
Согласно одному варианту модифицированный полипептидный антагонист рецептора мутеина IL-4 может быть сопряжен с небелковым полимером в аминокислотном остатке в положении 28, 36, 37, 38, 104, 105 или 106 IL-4. Эти положения пронумерованы согласно аминокислотной последовательности IL-4 дикого типа (то есть интерлейкина-4 человека). Согласно одному аспекту этого варианта аминокислотный остаток в положениях 28, 36, 37, 38, 104, 105 или 106 представляет собой цистеин.
Согласно еще одному варианту модифицированный антагонист рецептора мутеина по изобретению связывается с альфа-цепью рецептора IL-4 с Кd около 0,1 нМ - 10 мкМ, примерно 0,5 нМ - 1 мкМ или примерно 1,0 нМ - 100 нМ.
Согласно другому варианту модифицированный антагонист рецептора мутеина IL-4 ингибирует пролиферативный ответ TF-1-клеток на IL-4 с IC50, равной примерно 0,1 нМ - 10 мкМ, примерно 0,5 нМ - 1 мкМ или примерно 1,0 нМ - 100 нМ.
Согласно еще одному варианту модифицированный антагонист рецептора мутеина IL-4 ингибирует пролиферативный ответ TF-1-клеток на IL-13 с IС50, выбранной из интервалов примерно 0,1 нМ - 10 мкМ, примерно 0,5 нМ - 1 мкМ или примерно 1,0 нМ - 100 нМ.
Согласно дальнейшему варианту модифицированный антагонист рецептора мутеина IL-4 ингибирует пролиферативный ответ В-клеток человека на IL-4 с IС50, выбранной из интервалов примерно 0,1 нМ - 10 мкМ, примерно 0,5 нМ - 1 мкМ или примерно 1,0 нМ - 100 нМ.
Согласно еще одному варианту модифицированный антагонист рецептора мутеина IL-4 ингибирует пролиферативный ответ Т-клеток человека на IL-4 с IС50, выбранной из интервалов примерно 0,1 нМ - 10 мкМ, примерно 0,5 нМ - 1 мкМ или примерно 1,0 нМ - 100 нМ.
Согласно еще одному варианту модифицированный антагонист рецептора мутеина IL-4 по изобретению имеет период полураспада в плазме, который, по меньшей мере, в 2-10 раз больше периода полураспада в плазме не модифицированного антагониста рецептора мутеина IL-4.
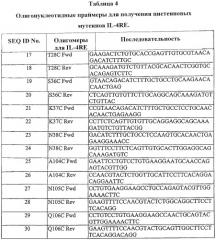
Данное изобретение предусматривает также фармацевтические композиции, содержащие: (а) модифицированный антагонист рецептора мутеина IL-4, который связывается с рецептором IL-4 человека, и (б) фармацевтически приемлемый носитель. Изобретение также предусматривает очищенный полинуклеотид, содержащий (а) нуклеотидную последовательность, показанную ниже в SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7 или SEQ ID NO:8, или (б) нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, показанную ниже в SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15 или SEQ ID NO:16.
Настоящее изобретение предусматривает также векторы экспрессии, содержащие полинуклеотид по изобретению и клетки-хозяева, содержащие вектор экспрессии по изобретению.
Кроме того, данное изобретение предусматривает способы получения модифицированного антагониста рецептора мутеина IL-4, включающий стадии: (а) культивирования клетки-хозяина, описанной выше, в условиях, при которых происходит экспрессия антагониста, и (б) очистки антагониста от культуры клеток-хозяев. Согласно конкретному аспекту антагонист, полученный способом по изобретению, может ингибировать активность, опосредованную IL-4 и IL-13, и сочетается с небелковым полимером, выбранным из группы, состоящей из полиэтиленгликоля, полипропиленгликоля и полиоксиалкиленов.
Изобретение предусматривает также способы лечения нарушения у людей, связанного с повышенной активностью IL-4 и IL-13, включающие стадии: (а) подбора человека с состоянием, при котором увеличена активность IL-4 и IL-13, и (б) введения этому человеку эффективного количества модифицированного антагониста рецептора мутеина IL-4 по изобретению или фармацевтической композиции по изобретению. Согласно одному аспекту это нарушение представляет собой астму, хроническое обструктивное легочное заболевание (такое как эмфизема или хронический бронхит) или связанные с этим легочные нарушения.
Данное изобретение предусматривает также способ получения модифицированного антагониста рецептора мутеина IL-4 в активной форме, антагонисты, полученные этим способом, композиции, содержащие такие антагонисты, и способ лечения расстройств у людей, включающий введение таких антагонистов и фармацевтических композиций, содержащих такие антагонисты. Этот способ включает стадии: (а) культивирования клетки-хозяина, как описано выше, в условиях, при которых происходит экспрессия антагониста; (б) осуществления повторного складывания антагониста в присутствии дитиотреитола и (в) очистки антагониста от культуры клетки-хозяина. Согласно одному варианту способ включает также стадии: (г) сочетания антагониста с небелковым полимером и (д) очистки антагониста, присоединенного к небелковому полимеру.
Конкретные предпочтительные варианты данного изобретения станут очевидны из нижеследующего более подробного описания некоторых аспектов и из формулы изобретения.
На чертеже показана схема протекания реакции пэгилирования.
Подробное описание изобретения
Данное изобретение относится к модифицированным антагонистам рецептора мутеина IL-4, содержащим рецептор мутеина IL-4, присоединенный к небелковому полимеру, предпочтительно, к молекуле полиэтиленгликоля.
Если иное не требуется по контексту, термины в единственном числе включают множественное число и термины во множественном числе включают единственное число.
Определения
Термины «полинуклеотид» или «последовательность нуклеиновой кислоты» или «молекула нуклеиновой кислоты» относятся к последовательности ДНК или РНК. Эти термины охватывают молекулы, образовавшиеся из любого из известных основных аналогов ДНК или РНК, таких как, без ограничения, 4-ацетилцистеин, 8-гидрокси-N6-метиладенозин, азиридинилцитозин, псевдоизоцитозин, 5-(карбоксигидроксиметил)урацил, 5-фторурацил, 5-карбоксиметиламинометил-2-тиоурацил, 5-карбоксиметиламинометилурацил, дигидроурацил, инозин, N6-изо-пентениладенин, 1-метиладенин, 1-метилпсевдоурацил, 1-метилгуанин, 1-метил-инозин, 2,2-диметилгуанин, 2-метиладенил, 2-метилгуанин, 3-метилцитозин, 5-метилцитозин, N6-метиладенин, 7-метилгуанин, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеозин, 5'-метоксикарбонилметилурацил, 5-метоксиурацил, 2-метилтио-N6-изопентениладенин, урацил-5-оксиуксусной кислоты метиловый эфир, урацил-5-оксиуксусная кислота, оксибутоксозин, псевдоурацил, квеозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, N-урацил-5-оксиуксусной кислоты метиловый эфир, урацил-5-оксиуксусная кислота, псевдоурацил, квеозин, 2-тиоцитозин и 2,6-диаминопурин.
Термин «очищенный» или «выделенный» полинуклеотид относится к нуклеиновой кислоте по изобретению, которая (1) была отделена от, по меньшей мере, примерно 50% белков, липидов, углеводов или других материалов, с которыми она содержится, когда общая нуклеиновая кислота выделена из клеток источника, (2) не связана со всем или с частью полинуклеотида, с которым «выделенная нуклеиновая кислота» связана в природе, (3) связана с полинуклеотидом, с которым она не связана в природе, или (4) не встречается в природе как часть более длинной полинуклеотидной последовательности.
Предпочтительно, чтобы выделенная нуклеиновая кислота по изобретению практически не содержала любых других примесных нуклеиновых кислот или других загрязнений, которые обнаружены в ее среде, которые будут участвовать при ее использовании при получении полипептида или при ее терапевтическом, диагностическом, профилактическом применении или применении для исследовательских целей.
Под «нумерацией согласно IL-4 дикого типа» подразумевается идентификация выбранной аминокислоты со ссылкой на положение, в котором эта аминокислота обычно находится в IL-4 дикого типа.
Термин «вектор» относится к любой молекуле (например, нуклеиновой кислоте, плазмиде или вирусу), используемой для передачи кодирующей информации клетке-хозяину.
Термин «вектор экспрессии» относится к вектору, который пригоден для трансформации клетки-хозяина и содержит последовательности нуклеиновой кислоты, которые направляют и/или регулируют экспрессию вставленных последовательностей гетерологичных нуклеиновых кислот. Экспрессия включает, но не ограничивается, такие процессы, как транскрипция, трансляция и сплайсинг РНК, если имеются интроны.
Термин «клетка-хозяин» используется для обозначения клетки, которая была трансформирована или которая способна трансформироваться при помощи последовательности нуклеиновой кислоты и затем к экспрессии выбранного гена. Термин включает потомство родительской клетки, независимо от того, является ли это потомство идентичным по морфологии или организации генетического материала первоначальному родителю, до тех пор, пока имеется выбранный ген.
Термин «трансдукция» обозначает передачу генов от одной бактерии к другой, обычно при помощи фага. «Трансдукция» относится также к приобретению и передаче эукариотных клеточных последовательностей ретровирусами.
Термин «трансфекция» обозначает поглощение инородной или экзогенной ДНК клеткой, и клетка «трансфецирована», когда экзогенная ДНК была введена в клеточную мембрану. Ряд методов трансфекции хорошо известен и описан в уровне техники. См., например, Graham et al., 1973, Virology 52:456; Sambrook et al., Molecular Cloning, A Laboratory Manual (Cold Spring Harbor Laboratories, 1989); Davis et al.. Basic Methods in Molecular Biology (Elsevier, 1986); и Chu et al., 1981, Gene 13:197. Такие методы можно применять для введения одного или более фрагментов экзогенной ДНК в подходящие клетки-хозяева.
Термин «трансформация» относится к изменению генетических характеристик клетки, клетка является трансформированной, когда она была модифицирована и содержит новую ДНК. Например, клетка считается трансформированной, когда она генетически модифицирована в своем естественном состоянии. Вслед за трансфекцией и трансдукцией трансформирующая ДНК может рекомбинироваться с ДНК клетки путем физической интеграции в хромосому клетки, может сохраняться временно в виде эписомального элемента без воспроизводства или может воспроизводиться независимо как плазмида. Считается, что клетка трансформирована стабильно, когда ДНК воспроизведена с делением клетки.
Термин «идентичность», как известно из уровня техники, относится к отношению между последовательностями двух или более молекул полипептида или двух или более молекул нуклеиновой кислоты, что определяется сравнением последовательностей. В уровне техники «идентичность» означает также степень родства последовательностей между молекулами нуклеиновой кислоты или полипептидов, как это может быть и определяется совпадением между нитями двух или более нуклеотидов или двух или более аминокислотных последовательностей. «Идентичность» измеряется в процентном количестве идентичных совпадений между меньшей из двух или более последовательностей с выравниванием гэпов (если они есть) при помощи конкретной математической модели или компьютерной программы (то есть «алгоритмов»).
Термин «подобие» является родственным понятием, но по контрасту с «идентичностью» «подобие» относится к мере родства, которое включает как идентичные совпадения, так и пары консервативного замещения. Если две полипептидных последовательности имеют, например, 10/20 идентичных аминокислот, а остальные все представляют собой неконсервативные замещения, тогда величины степеней идентичности и подобия обе будут равны 50%. Если в том же примере имеется еще пять положений, где содержатся консервативные замещения, тогда величина степени идентичности остается равной 50%, а величина степени подобия будет составлять 75% (15/20). Следовательно, в случаях, когда имеются консервативные замещения, величина степени подобия двух полипептидов будет больше, чем величина степени идентичности этих двух полипептидов.
Степени идентичности и подобия родственных нуклеиновых кислот и полипептидов могут быть легко определены известными методами. Такие методы включают, но не ограничиваются, описанные в COMPUTATIONAL MOLECULAR BIOLOGY (Lesk, A. M., ed.), 1988, Oxford University Press, New York; BIOCOMPUTING: INFORMATICS AND GENOME PROJECTS (Smith, D. W., ed.), 1993, Academic Press, New York; COMPUTER ANALYSIS OF SEQENCE DATA, Part 1 (Griffin, A. M., and Griffin, H. G., eds.), 1994; Humana Press, New Jersey; von Heinje, G., SEQENCE ANALYSIS IN MOLECULAR BIOLOGY, 1987, Academic Press; SEQENCE ANALYSIS PRIMER (Gribskov, M. and Devereux, J., eds.), 1991, M. Stockton Press, New York; Carillo et al., 1988, SIAM J. Applied Math., 48:1073 и Durbin et al., 1998, BIOLOGICAL SEQENCE ANALYSIS, Cambridge University Press.
Предпочтительные методы определения степени идентичности разработаны так, чтобы обеспечить наибольшее совпадение между испытуемыми последовательностями. Методы определения степени идентичности описаны в доступных компьютерных программах. Предпочтительные методы определения степени идентичности двух последовательностей с помощью компьютерных программ включают, не ограничиваясь этим, пакет программ GCG, включая GAP (Devereux, et al., 1984, Nucl. Acid. Res., 12:387; Genetics Computer Group, University of Wisconsin, Madison, WI), BLASTP, BLASTN и FASTA (Altschul et al.. 1990, J. Mol. Biol, 215:403-410. Программа BLASTX общедоступна в Национальном центре информации в области биотехнологии (NCBI) и в других источниках (BLAST Manual, Altschul et al., NCB/NLM/NIH Bethesda MD 20894; Altschul et al., 1990, supra). Для определения степени идентичности можно также применять хорошо известный алгоритм Smith Waterman.
Некоторые схемы выравнивания последовательностей двух аминокислот могут привести к совпадению только короткого участка двух последовательностей, и этот небольшой участок может иметь очень высокую степень идентичности последовательностей, даже хотя нет значительной взаимосвязи между двумя последовательностями с полной длиной. Соответственно, в некоторых вариантах выбранный метод выравнивания (программа GAP) приводит к выравниванию, которое включает, по меньшей мере, 50 смежных аминокислот целевого полипептида.
Например, используя компьютерный алгоритм GAP (Genetics Computer Group, University of Wisconsin, Madison, WI), два полипептида, для которых должна быть определена степень идентичности последовательностей, выравнивают для оптимального совпадения их соответственных аминокислот («совпадающий участок», как определяется алгоритмом). Согласно некоторым вариантам в сочетании с алгоритмом используют штраф за открытие гэпа (который рассчитывается как тройная величина средней диагонали; где «средняя диагональ» является средней величиной диагонали используемой матрицы сравнения; «диагональ» означает балл или число, присвоенное каждому полному совпадению аминокислот при помощи конкретной матрицы сравнения) и штраф за расширение гэпа (который обычно равен 1/10 от штрафа за открытие гэпа), а также матрицу сравнения, такую как РАМ250 или BLOSUM62. Согласно некоторым вариантам в алгоритме используют также стандартную матрицу сравнения (cM.Dayhoff et al., 1978, Atlas of Protein Sequence and Structure, 5:345-352 for the РАМ 250 comparison matrix; Henikoffet al., 1992, Proc. Natl. Acad. Sci. USA, 89:10915-10919 for the BLOSUM 62 comparison matrix).
В некоторых вариантах параметры для сравнения полипептидных последовательностей включают следующие:
Алгоритм: Needleman et al., 1970, J. Mol. Biol., 48:443-453;
Матрица сравнения: BLOSUM 62Henikoff et al., 1992, supra;
Штраф за гэп: 12;
Штраф за удлинение гэпа: 4;
Порог подобия: 0.
С указанными параметрами может быть использована программа GAP. В некоторых вариантах вышеуказанные параметры являются параметрами по умолчанию для сравнения полипептидов (вместе с отсутствием штрафа за концевые гэпы) при использовании алгоритма GAP.
В данной заявке используются общепринятые двадцать обычных аминокислот и их аббревиатуры. См. IMMUNOLOGY - A SYNTHESIS. 2nd Edition (E.S.Golub and D.R.Gren, Eds.), Sinauer Associates: Sunderland, MA, 1991, эта публикация включена в данную заявку в качестве ссылки. Подходящими компонентами для полипептидов по изобретению могут также быть стереоизомеры (например, D-аминокислоты) двадцати обычных аминокислот, неприродные аминокислоты, такие как α-, α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие необычные аминокислоты. Примеры необычных аминокислот включают 4-гидроксипролин, γ-карбоксиглутамат, ε-N,N,N-триметиллизин, ε-N-ацетиллизин, σ-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метил-гистидин, 5-гидроксилизин, σ-N-метиларгинин и другие подобные иминокислоты (например, 4-гидроксипролин). В системе обозначений полипептидов, используемой в данной заявке, левое направление - это направление к N-концу с аминогруппой и правое направление - это направление к С-концу, несущему карбоксильную группу, это стандартные обозначения. Остатки природного происхождения можно разделить на следующие классы на основе общих свойств боковых цепей:
1) гидрофобные: норлейцин (Nor), Met, Ala, Val, Leu, Ile;
2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
3) кислые: Asp, Glu;
4) основные: His, Lys, Arg;
5) остатки, которые влияют на ориентацию цепей: Gly, Pro; и
6) ароматические: Trp, Tyr, Phe.
Консервативные замещения аминокислот могут вовлекать обмен члена одного из этих классов на другой член того же класса. Консервативные замещения могут охватывать остатки аминокислот неприродного происхождения, которые обычно вводятся путем химического синтеза пептидов, а не синтезом в биологических системах. Они включают пептидомиметики и другие обратимые или инвертированные формы аминокислот.
Неконсервативные замещения могут включать обмен члена одного из этих классов на член другого класса. Такие замещенные остатки могут быть введены в участки человеческого белка, которые являются гомологами нечеловеческих белков, или в негомологичные участки молекулы.
При осуществлении таких изменений согласно некоторым вариантам можно рассмотреть гидропатический индекс аминокислот. Каждой аминокислоте был присвоен гидропатический индекс на основе ее гидрофобности и характеристик зарядов. Эти аминокислоты: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин/цистин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серин (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9) и аргинин (-4,5).
Важная роль гидропатического индекса аминокислот при сравнении интерактивной функции белка отмечена в уровне техники (см., например, Kyte et al., 1982, J. Mol. Biol. 157:105-131). Известно, что некоторые аминокислоты могут замещать другие аминокислоты, имеющие сходный гидропатический индекс или балл, и все еще сохранять похожую биологическую активность. При осуществлении изменений на основе гидропатического индекса согласно некоторым вариантам проводят замещение аминокислот, чьи гидропатические индексы равны ±2. Согласно некоторым вариантам используют аминокислоты с величиной указанного индекса ±1 и согласно другим вариантам - с величиной указанного индекса ±0,5.
Из уровня техники известно, что замещение подобных аминокислот можно осуществить эффективно на основе гидрофильности, особенно когда получаемый при этом биологически функциональный белок или пептид предназначен для применения в иммунологии, как описано в данной заявке.
Согласно некоторым вариантам самая большая локальная средняя гидрофильность белка, регулируемая гидрофильностью соседних аминокислот, коррелирует с его иммуногенностью и антигенностью, то есть с биологическим свойством белка.
Остаткам этих аминокислот присвоены следующие величины гидрофильности: аргинин (+3,0); лизин (+3,0); аспартат (+3,0±1); глутамат (+3,0±1); серин (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); треонин (-0,4); пролин (-0,5±1); аланин (-0,5); гистидин (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5) и триптофан (-3,4).
При осуществлении изменений на основе похожих величин гидрофильности согласно некоторым вариантам проводят замещение аминокислот, величина гидрофильности которых составляет ± 2, согласно некоторым вариантам эта величина равна ± 1 и согласно другим вариантам эта величина равна ± 0,5. Можно также на основе гидрофильности идентифицировать эпитопы из последовательностей первичных аминокислот. Эти участки называются также «эпитопными кор-участками».
Примеры замещений аминокислот приведены в Таблице 1.
| Таблица 1 | ||
| Последовательности аминокислот. | ||
| Первоначальные остатки | Примеры заместителей | Предпочтительные заместители |
| Ala | Val, Leu, Ile | Val |
| Arg | Lys, Gln, Asn | Lys |
| Asn | Gln | Gin |
| Asp | Glu | Glu |
| Cys | Ser, Ala | Ser |
| Gln | Asn | Asn |
| Glu | Asp | Asp |
| Gly | Pro,Ala | Ala |
| His | Asn, Gln, Lys, Arg | Arg |
| Ile | Leu, Val, Met, Ala Phe, норлейцин | Leu |
| Leu | Норлейцин, Ilе, Val, Met, Ala, Phe | He |
| Lys | Arg, 1,4-диамино-масляная кислота Gln, Asn | Arg |
| Met | Leu, Phe, Ile | Leu |
| Phe | Leu, Val, Ile, Ala, Tyr | Leu |
| Pro | Ala | Gly |
| Ser | Thr, Ala, Cys | Thr |
| Thr | Ser | Ser |
| Trp | Tyr, Phe | Tyr |
| Tyr | Trp, Phe, Thr, Ser | Phe |
| Val | Ile, Met, Leu, Phe, Ala, норлейцин | Leu |
Специалист в данной области способен определить подходящие варианты полипептида, что описано ниже с применением хорошо известных методов. Согласно некоторым вариантам специалист может определить подходящие участки молекулы, которые могут быть изменены без уничтожения активности нацеленными участками, которые не считаются важными для активности. Согласно другим вариантам специалист может идентифицировать остатки и части молекул, которые сохраняются среди подобных полипептидов. Согласно другим вариантам даже те области, которые могут быть важны для биологической активности или для структуры, могут подвергаться консервативным замещениям аминокислот без уничтожения биологической активности или без вредного влияния на структуру полипептидов.
Кроме того, специалист может изучить работы по изучению структуры-функции, в которых идентифицированы остатки в подобных полипептидах, которые важны для активности или структуры. С учетом такого сравнения специалист может предсказать значение остатков аминокислот в белке, которые соответствуют остаткам аминокислот, важным для активности или структуры в подобных белках. Специалист может выбрать химически подобные заместители для аминокислот в случае таких предсказанных важных остатков аминокислот.
Специалист может также проанализировать трехмерную структуру и аминокислотную последовательность в связи со структурой в подобных полипептидах. Располагая такой информацией, специалист может предсказать выравнивание остатков аминокислот полипептида по отношению к его трехмерной структуре. Согласно некоторым вариантам специалист может решить не осуществлять радикальных изменений остатков аминокислот, которые, как предсказано, находятся на поверхности белка, так как такие остатки могут участвовать в важных реакциях взаимодействий с другими молекулами. Более того, специалист может генерировать опытные варианты, содержащие одно замещение в аминокислотах в каждом желательном остатке аминокислоты. Эти варианты затем можно подвергнуть скринингу, применяя методы определения активности, известные специалистам. Такие варианты можно использовать для сбора информации о подходящих вариантах. Например, если обнаружено, что изменение в конкретном остатке аминокислоты привело к исчезновению, нежелательному снижению активности или появлению неподходящей активности, таких вариантов с такими изменениями нужно избегать. Другими словами, основываясь на информации, полученной из таких рутинных экспериментов, специалист может легко определить аминокислоты, дальнейшего замещения в которых нужно избегать самого по себе или в сочетании с другими мутациями.
Ряд научных публикаций был посвящен предсказанию вторичной структуры. См. Moult, 1996, Curr. Op. in Biotech. 7:422-427; Chou et al., 1974, Biochemistry 13:222-245; Chou et al., 1978, Adv. Enzymol. Relat. Areas Mol. Biol. 47:45-148; Chou et al., 1979, Ann. Rev. Biochem. 47:251-276 и Chou et al., 1979, Biophys. J. 26:367-384. Более того, в настоящее время доступны компьютерные программы, помогающие предсказать вторичную структуру. Один из методов предсказания вторичной структуры основан на моделировании гомологии. Например, два полипептида или белка, у которых степень идентичности равна более 30% или степень подобия более 40%, часто имеют похожие структурные топологии. Расширение базы структурных данных о белках (PDB) в последнее время обеспечило улучшенную предсказуемость вторичной структуры, включая потенциальное число складок в структуре полипептида или белка. См. Holm et al., 1999, Nucl. Acid. Res. 27:244-247. Было высказано предположение, что существует ограниченное число складок в данном полипептиде или белке и что, как только критическое число структур определяется, резко повышается точность предсказания структуры.
Дополнительные методы предсказания вторичной структуры включают «образование нитей» (Jones, 1997, Curr. Opin. Struct. Biol. 7:377-87; Sippi et al., 1996, Structure 4:15-19), «анализ профиля» (Bowie et al., 1991, Science 253: 164-170; Gribskov et al., 1990, Meth. Enzym. 183:146-159; Gribskov et al., 1987, Proc. Nat. Acad. Sci. 84:4355-4358) и «эволюционные связи» (см. Holm, 1999, supra и Brenner, 1997, supra).
В некоторых случаях варианты белков включают варианты гликозилирования, в которых число и/или тип сайтов гликозилирования были изменены по сравнению с аминокислотными последовательностями родительских форм полипептида. В других случаях варианты белка включают большее или меньшее количество N-связанных сайтов гликозилирования, чем нативный белок. N-связанный сайт гликозилирования характеризуется последовательностью Asn-X-Ser или Asn-X-Thr, где остаток аминокислоты, обозначенный X, может быть любым остатком аминокислоты, кроме пролина. Замещение остатков аминокислот для получения этой последовательности обеспечивает потенциальный новый сайт для добавления N-связанной углеводной цепи. Или же замещения, которые удаляют эту последовательность, будут удалять существующую N-связанную углеводную цепь. Предусмотрена также перестройка N-связанных углеводных цепей, когда один или более N-связанных сайтов гликозилирования (обычно те, которые имеют природное происхождение) удаляются и создаются один или более новых N-связанных сайтов. Дополнительные предпочтительные варианты включают цистеиновые варианты, в которых один или более цистеиновых остатков делецированы или замещены на другую аминокислоту (например, серин) по сравнению с последовательностью родительской формы аминокислоты. Цистеиновые варианты могут быть полезны, когда должен осуществиться рефолдинг белков для получения биологически активной конформации, такой как возникающая после выделения нерастворимых тел включения. Цистеиновые варианты обычно содержат меньше цистеиновых остатков, чем нативный белок, и обычно содержат то же число для минимизации взаимодействий, возникающих из-за не спаренных цистеинов. Согласно дополнительным аспектам варианты белков могут включать мутации, такие как замещения, присоединения, делеции или любая их комбинация, и обычно получаются путем сайтнаправленного мутагенеза с использованием одного или более мутагенных олигонуклеотидов в соответствии с методами, описанными в данной заявке, а также методами, известными из уровня техники (см., например, Sambrook et al., MOLECULAR CLONING: A LABORATORY MANUAL, 3rd Ed, 2001, Cold Spring Harbor. N.Y. and Berger and Kimmel, METHODS IN ENZYMOLOGY, Volume 152, Guide to Molecular Cloning Techniques, 1987, Academic Press, Inc., San Diego, CA., которые включены в данную заявку в качестве ссылок).
Согласно некоторым вариантам замещения аминокислоты включают такие, которые (1) уменьшают восприимчивость к протеолизу, (2) уменьшают восприимчивость к окислению, (3) изменяют сродство к связыванию при образовании белковых комплексов, (4) изменяют сродство к связыванию и/или (5) придают или модифицируют другие физико-химические или функциональные свойства таких полипептидов.
Согласно другим вариантам единичное или множественное замещения аминокислот (в некоторых вариантах консервативные замещения аминокислот) могут осуществляться в последовательности природного происхождения (в некоторых вариантах, в части полипептида, которая находится вне домена(-ов), формирующего (-их) внутримолекулярные контакты). Согласно предпочтительным вариантам консервативное замещение аминокислот обычно незначительно изменяет структурные характеристики родительской последовательности (например, замещение аминокислотой не имеет тенденции к разрушению спирали, которая возникает в родительской последовательности, или к разрыву других типов вторичной структуры, которые характеризуют родительскую последовательность). Примеры известных вторичных и третичных структур полипептидов описаны в PROTEINS, STRUCTURES AND MOLECULAR PRINCIPLES (Creighton, Ed.), 1984, W. H. Freeman and Company, New York; INTRODUCTION TO PROTEIN STRUCTURE (C. Branden and J. Tooze, eds.), 1991, Garland Publishing, New York, N.Y. и Thornton et al., 1991, Nature 354:105, причем каждая из этих публикаций включена в данную заявку в качестве ссылки.
Аналоги пептидов обычно применяются в фармацевтической промышленности как непептидные лекарства со свойствами, аналогичными свойствам пептидного темплата. Эти типы непептидного соединения называются «пептидными миметиками» или «пептидомиметиками». См. Fauchere, 1986, Adv. Drug Res. 15:29; Veber & Freidinger, 1985, TINS p.392 и Evans et al., 1987, J. Med. Chem. 30:1299, которые включены в данную заявку в качестве ссылок для любой цели. Такие соединения часто создают при помощи компьютерного молекулярного моделирования. Пептидные миметики, которые структурно похожи на терапевтически применяемые пептиды, могут быть использованы для получения подобного терапевтического или профилактического эффекта. Обычно пептидомиметики структурно подобны эталонному полипептиду (то есть полипептиду, который имеет биохимическое свойство или фармакологическую активность), такому как человеческое антитело, но содержат одну или более пептидных связей, возможно замещенных связью, выбранной из -CH2-NH-, -CH2-S, -CH2CH2-, -СН=СН- (цис- и транс-), -СОСН2-, -СН(ОН)СН2- и -CH2SO-, введенные хорошо известными методами. Систематическое замещение одной или более аминокислот в консенсусной п