Вакцина против вируса гриппа для введения через слизистую и способ предотвращения гриппа
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, вирусологии и медицины. Предложено применение вакцины, включающей двунитевую РНК, включающую Poly (I:C), и антиген вируса гриппа для введения через слизистую оболочку. Изобретение обеспечивает возможность легкого способа вакцинации против вируса гриппа. 2 н. и 8 з.п. ф-лы, 10 ил., 1 табл.
Реферат
Настоящее изобретение относится к новой вакцинной композиции. Конкретнее, настоящее изобретение относится к новой композиции, где в качестве адъюванта используется двунитевая РНК.
Описание предшествующего уровня техники
Имеющиеся в настоящее время утвержденные вакцины имеют описанные ниже ограничения. Например, в вирусах гриппа (в частности, в вирусе гриппа типа А), происходят значительные мутации антигена, приводящие к частому возникновению вирусов, которые не нейтрализуются антителами, продуцируемыми ранее введенными вакцинами (т.е. уже приобретенными инфекциями); эффект вакцины часто продолжается только в течение одного сезона. Также часто возникают иммунологически отличные новые штаммы вследствие точечных мутаций (антигенного дрейфа) в генах, которые кодируют поверхностные гликопротеины (гемагглютинин [HA] и нейраминидаза [NA]), и антигенного сдвига. Следует отметить, что в этом случае белки сохраняются на относительно высоких уровнях даже в пределах постоянно мутирующих штаммов и в пределах прерывисто мутирующих штаммов. Ввиду того, что иммунизация имеющимися в настоящее время вакцинами вызывает лишь гуморальный иммунитет среди однородных штаммов, а не общий иммунитет среди неоднородных штаммов, основанный на клеточном иммунитете, эффект вакцины будет уменьшаться, если эпидемический штамм и штамм вакцины отличаются.
Другой недостаток состоит в том, что иммунизацию нужно выполнять каждый год, потому что титр антител уменьшается, даже если преобладающий эндемический штамм вируса гриппа не подвергся до следующего года значительному антигенному сдвигу или антигенному дрейфу. Сообщалось, что антитела для ингибирования гемагглютинации (HI) и нейтрализации сохраняются в течение периода от нескольких месяцев до нескольких лет, а затем постепенно уменьшаются. Однако даже без таких уменьшений рекомендуется прививка 1 раз в год. Это происходит потому, что в течение одного года после вакцинации титр антител может снижаться.
Есть возможность улучшить эффективность вакцины. Это связано с тем, что разработка вакцины для наступающего сезона зависит от прогноза поступающего эпидемичного штамма. Следовательно, этот прогноз связан с неточностью, и может возникнуть несоответствие между штаммом, используемым для вакцины, и штаммом, который является действительно эпидемичным во внешней среде. Также если возникает штамм нового типа, то прогнозируемая вакцина часто неэффективна, например, против возникновения нового штамма H3N2 (A/Beijing/92) во время сезона гриппа в 1992 и 1993 гг. Новый тип вируса часто клинически не выявляется до наступления поздней стадии сезона гриппа, и защита существующей вакциной часто неудовлетворительна ввиду времени, требуемого для получения и производства одобренной вакцины. Даже если штамм вакцины и эпидемичный штамм достаточно соответствуют друг другу, считается, что утвержденные вакцины предотвращают заболевание только примерно у 70% детей и подростков и 30-40% пожилых лиц.
При обычных вакцинах почти невозможно выполнить иммунизацию слизистой оболочки (например, носовой полости); в частности, было известно, что имеющиеся в настоящее время инактивированные вакцины, компонентные вакцины и т.п., используемые для подкожной прививки, которая является основным путем вакцинации в связи с вирусами гриппа, не способны обеспечить иммунитет слизистых оболочек; существует большая потребность в вакцинной композиции, способной обеспечить иммунитет слизистых оболочек.
Также ввиду того, что обычные вакцины не способны вызвать перекрестный иммунитет даже между различными штаммами, существует также настоятельная потребность в разработке вакцины, способной выработать перекрестный иммунитет по меньшей мере между различными штаммами или между различными подтипами. Для гриппозных вакцин, для которых основной путь представляет собой смесь двух видов штаммов типа А и одного вида штамма типа В, существует потребность, в частности, в разработке вакцины, которая позволит избежать или по меньшей мере снизит необходимость в прогнозе эндемичного штамма.
Кроме того, очень нужна также вакцина, эффективная для прививки через слизистую оболочку, что является удобным способом вакцинации. Поскольку это не было достигнуто для вирусов гриппа и т.п., решения этой проблемы ожидают также в интересах облегчения массовой иммунизации. Альтернативно, существует также большая потребность в вакцине, которая увеличивает длительность существования антител.
В непатентном документе 1 (J. Clinical Investigation, 110(8), 1175-1184 (2002)) указано, что инактивированный УФ цельный вирус гриппа с Poly(I:C) в качестве адъюванта вводили через дыхательные пути. Однако тот факт, что подъем уровня IgG-антител не различается между группами с добавлением и без добавления Poly(I:C), показан на фиг.2 непатентного документа 1. Следовательно, было высказано предположение, что Poly(I:C) не очень эффективен в качестве адъюванта. В том же документе описана также комбинация с короткоцепочечным фосфолипидом для подъема уровня антител.
В непатентном документе 2 (Invest. Ophthalmol., 10(10), 750-759 (1971)) и в непатентном документе 3 (Invest. Ophthalmol., 10(10), 760-769 (1971)) описана интраназальная прививка инактивированным вирусом коровьей оспы с Poly(I:C) в качестве адъюванта. Однако в непатентном документе 2 описана повышенная продукция IgA-антител в слезной жидкости, но не упоминается эффект, предотвращающий инфекцию.
В патентом документе 1 (прошедшая экспертизу заявка на патент Японии № SHO-50-2009 (патент США № 3906092), Merck & Co.) раскрыто, что реакции антител на гриппозные вакцины усиливаются с добавлением полинуклеотида (включающего в себя Poly(I:C)) к адъюванту адсорбционного типа. Однако в патентном документе 1 не упоминается эффект, предотвращающий инфекцию.
В непатентном документе 4 (Veterinary Microbiology, 88(4), 325-338 (2002)) сообщается о значительно повышенных уровнях IgG и IgM после внутрибрюшинной инокуляции инактивированной вакциной с Poly(I:C) в качестве адъюванта, но в нем не показан эффект при введении в слизистую носовой полости и подобным образом, и, к тому же, в нем не упоминается эффект предотвращения инфекции.
В непатентном документе 5 (Proc. Soc. Exp. Biol. & Med., 133, 334-338 (1970)) сообщается, что уровни антител в крови повышаются, когда овечьи эритроциты с Poly(I:C) в качестве адъюванта инъецируют внутривенно для иммунизации, но в нем не упоминается эффект, предотвращающий инфекцию.
В непатентном документе 6 (The Journal of Immunology, 149, 981-988 (1992)) описана возможность применения холерного токсина в качестве адъюванта, но вообще не описана двунитевая РНК.
Патентный документ 1: Прошедшая экспертизу заявка на патент Японии № SHO-50-2009
Непатентный документ 1: J. Clinical Investigation, 110(8), 1175-1184 (2002)
Непатентный документ 2: Invest. Ophthalmol., 10(10), 750-759 (1971)
Непатентный документ 3: Invest. Ophthalmol., 10(10), 760-769 (1971)
Непатентный документ 4: Veterinary Microbiology, 88(4), 325-33Н
Непатентный документ 5: Proc. Soc. Exp. Biol. & Med., 133, 334-338 (1970)
Непатентный документ 6: The Journal of Immunology, 149, 981-988 (1992)
Краткое описание сущности изобретения
Проблемы, которые предстоит решить с помощью настоящего изобретения
В описанных выше обстоятельствах настоящее изобретение предназначено для предоставления адъюванта, который проявляет адъювантный потенциал, превышающий таковой любого обычного адъюванта и способный вызвать защитные реакции в отношении различных штаммов при введении через слизистые оболочки.
Пути решения проблемы
Описанная выше проблема была решена с обнаружением того факта, что двунитевая РНК (например, Poly(I:C)) неожиданно проявляет описанный выше потенциал при использовании в комбинации с субъединичным антигеном.
Хотя имеющиеся в настоящее время инактивированные вакцины НА против гриппа являются эффективными вакцинами, как описано выше, индукция IgA-антител в эпителии слизистой дыхательных путей, являющихся вратами для поступления вирусов гриппа, очень низка; поэтому считается, что улучшение такой индукции дополнительно усилит этот эффект.
Имея это ввиду, авторы изобретения предприняли попытку получения секреторного IgA-антитела, проявляющего высокую перекрестную реактивность в отношении слизистой оболочки дыхательных путей при использовании интраназальной вакцины в комбинации с адъювантом на модели гриппа у мышей. Хорошие результаты были получены, когда субъединицу В холерного токсина (СТВ*) использовали в качестве адъюванта. Однако есть сообщения, что при интраназальном введении человеку холерный токсин вызывает побочные эффекты, такие как паралич лицевого нерва; поэтому считается, что вакцина станет более безопасной при условии, что IgG-антитело может быть индуцировано без использования адъюванта, не включающего в себя холерный токсин. IgA активирует второй путь системы комплемента и играет важную роль в местных иммунных реакциях при инфекциях слизистых оболочек; ввиду того, что IgA сам по себе метаболизируется, с периодом полувыведения из плазмы от 5 до 6 дней, считают, что невозможно прогнозировать предотвращающий инфекцию эффект, например, даже если увеличивается содержание IgA в слезной жидкости.
Следовательно, авторы провели исследование с целью определения того, может ли лиганд, Toll-подобного (Toll) рецептора, который распознает микробные компоненты в организме и стимулирует природную иммунную систему, быть высоко безопасным, сильным адъювантом для вакцин слизистых оболочек, и получили вакцину для введения через слизистые оболочки, имеющую неожиданный, защищающий от инфекции эффект.
Соответственно, настоящее изобретение обеспечивает следующее:
(1) Вакцину для введения через слизистые оболочки, включающую в себя
А) двунитевую РНК; и
В) субъединичный антиген или инактивированный антиген патогена.
(2) Вакцину по п.(1), причем описанная выше слизистая оболочка включает в себя оболочку носовой полости.
(3) Вакцину по п.(1), причем описанный выше патоген выбран из группы, состоящей из вируса ветряной оспы, вируса кори, вируса эпидемического паротита, вируса полиомиелита, ротавируса, вируса гриппа, аденовируса, вируса герпеса, вируса краснухи, вируса тяжелого острого респираторного синдрома (SARS), вируса иммунодефицита человека (ВИЧ), Bordetella pertussis, Neisseria meningitidis, Haеmophilus influenzae типа b, Streptococcus pneumoniae и Vibrio cholerae.
(4) Вакцину по п.(1), причем описанный выше патоген представляет собой вирус гриппа.
(5) Вакцину по п.(1), где описанная выше субъединица включает в себя по меньшей мере одну субъединицу, выбранную из группы, состоящей из субъединиц HA, NA, M1, M2, NP, PB1, PB2, PA и NS2 вируса гриппа.
(6) Вакцину по п.(1), где описанная выше двунитевая РНК присутствует в концентрации, достаточной для выработки секреторного IgA.
(7) Вакцину по п.(1), где описанная выше двунитевая РНК присутствует в концентрации от 0,1 до 10 мг/мл.
(8) Вакцину по п.(1), где размер описанной выше двунитевой РНК составляет от 102 до 108 пар оснований.
(9) Вакцину по п.(1), где описанная выше субъединица включает в себя по меньшей мере NA или HA.
(10) Вакцину по п.(1), где описанная выше двунитевая РНК включает в себя Poly(I:C).
(11) Способ предотвращения инфекционного заболевания, включающий в себя
стадию введения через слизистую оболочку по меньшей мере однократно
А) вакцины для введения через слизистые оболочки, включающей в себя
а) двунитевую РНК; и
b) субъединичный антиген или инактивированный антиген патогена.
(12) Способ по п.(11), где описанная выше вакцина вводится по меньшей мере дважды.
(13) Способ по п.(11), где описанная выше вакцина вводится с интервалом по меньшей мере в 1 неделю или более, предпочтительнее, 3 недели или более.
(14) Способ по п.(11), где описанная выше двунитевая РНК включает в себя Poly(I:C).
(15) Набор вакцины для предотвращения инфекционного заболевания, обеспеченный
А) вакциной для введения через слизистые оболочки, включающей в себя
а) двунитевую РНК; и
b) субъединичный антиген или инактивированный антиген патогена; и
В) листок с инструкцией, предписывающей вводить описанную выше вакцину в слизистую оболочку по меньшей мере однократно.
(16) Набор по п.(15), где описанная выше вакцина вводится по меньшей мере дважды.
(17) Набор по п.(15), где описанная выше вакцина вводится с интервалом по меньшей мере в 1 неделю или более, предпочтительнее, 3 недели или более.
(18) Набор по п.(15), где описанная выше двунитевая РНК включает в себя Poly(I:C).
(19) Применение двунитевой РНК для введения вакцины через слизистую оболочку.
(20) Применение по п.(19), где описанная выше двунитевая РНК включает в себя Poly(I:C).
(21) Применение двунитевой РНК для производства вакцины для введения через слизистые оболочки.
(22) Применение по п.(21), где описанная выше двунитевая РНК включает в себя Poly(I:C).
Эффект изобретения
Настоящее изобретение предоставляет форму вакцины, которая обеспечивает возможность легкой вакцинации путем введения через слизистую оболочку и получения перекрестного иммунитета. Например, в случае вирусов гриппа можно таким образом получить эффективную вакцину без прогнозирования эпидемического штамма, и, следовательно, принять эффективные профилактические меры.
Краткое описание чертежей
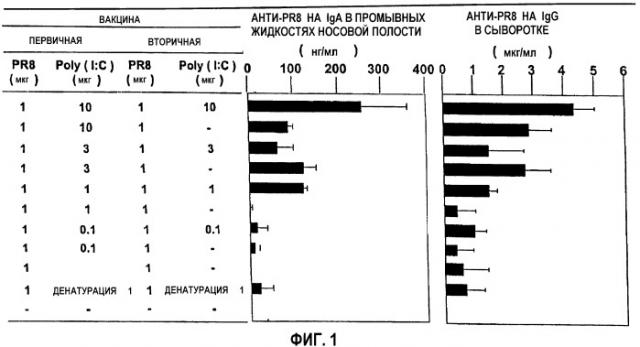
На фиг.1 представлены данные, свидетельствующие об адъювантном эффекте Poly(I:C), как проиллюстрировано в разделе «Примеры». На левой панели приведены лекарственные формы; на средней панели указано содержание IgA в промывных жидкостях носовой полости; на правой панели - содержание IgA в сыворотке.
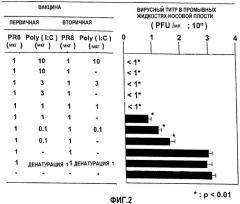
На фиг.2 представлены данные, свидетельствующие об адъювантном эффекте Poly(I:C), как проиллюстрировано в разделе «Примеры». На левой панели указаны лекарственные формы; на правой панели - статус выживания вируса.
Фиг.3 представляет собой чертеж, на котором показаны эффекты вакцинации согласно изобретению по продуцированию IgA на различных вирусных штаммах.
На фиг.4 представлен чертеж, на котором показаны супрессивные эффекты вакцинации согласно изобретению в отношении роста вирусов на различных вирусных штаммах.
Фиг.5 представляет собой чертеж, на котором показана токсичность вакцинации согласно изобретению при внутримозговом введении. На верхней панели показаны данные для Poly(I:C) согласно изобретению; на нижней панели приведены данные для положительного контроля СТВ*.
На фиг.6 показаны иммунные эффекты частиц инактивированного вируса, используемого в качестве гриппозной вакцины для интраназального введения в комбинации с Poly(I:C), т.е. титры анти-НА- и анти-NA-антител в промывных жидкостях носовой полости и сыворотке.
На фиг.7 показаны иммунные эффекты частиц инактивированного вируса, используемого в качестве гриппозной вакцины для интраназального введения в комбинации с Poly(I:C) различных размеров (L, M, H), т.е. титры анти-НА- и анти-NA-антител в промывных жидкостях носовой полости и сыворотке.
На фиг.8 показаны иммунные эффекты двунитевой РНК или однонитевой РНК, используемой в качестве интраназальной гриппозной вакцины, в комбинации с субъединицей НА, т.е. титры анти-НА- и анти-NA-антител в промывных жидкостях носовой полости и сыворотке.
На фиг.9 приведены результаты, показывающие эффективность интраназальной гриппозной вакцины в комбинации с Poly(I:C), вводимой дважды или более с интервалом в 1 неделю или более.
На фиг.10 приведены результаты, показывающие, что Poly(I:C) также повышает защитный иммунитет коклюшной вакцины и также эффективен при усилении защитного иммунитета при вакцинации против негриппозных инфекций.
Наилучшие способы осуществления изобретения
Настоящее изобретение далее описано более подробно. Во всем описании, при отсутствии других указаний, любое выражение в форме единственного числа следует понимать как охватывающее его форму множественного числа. Кроме того, при отсутствии других указаний используемые в описании термины следует понимать как значения, обычно используемые в данной области.
Определения
Используемый в настоящем описании термин «вакцина» относится к антигенной суспензии или раствору, обычно содержащему инфекционный фактор или часть инфекционного фактора, вводимого в организм для создания активного иммунитета. Антигенная часть, которая составляет вакцину, может представлять собой микроорганизм (например, вирус или бактерию и пр.) или натуральный продукт, очищенный из микроорганизма, синтетический или полученный способами генной инженерии белок, пептид, полисахарид или подобный продукт. Примеры живых вакцин включают в себя, не ограничиваясь ими, БЦЖ, вакцины против оспы, полиомиелита, ветряной оспы, кори, краснухи, эпидемического паротита, чумы рогатого скота, NDV (вирус ньюкаслской болезни), болезни Марека и подобные им. Инактивированные вакцины включают в себя, не ограничиваясь ими, вакцины против коклюша, дифтерии (токсоид), столбняка (токсоид), гриппа, японского энцефалита и т.п.
Используемый в настоящем описании термин «инактивированный антиген» относится к антигену, лишенному инфективности, используемому в качестве антигена вакцины; такие антигены включают в себя, не ограничиваясь ими, вирионы полных вирусных частиц, неполные вирусные частицы, частицы, составляющие вирион, вирусные неструктурные белки, антигены, которые защищают против инфекций, эпитопы нейтрализующих эпитопов и т.п. Используемый в настоящем описании термин «инактивированный антиген» относится к антигену, лишенному инфективности, но сохраняющему иммуногенность; когда такой антиген используется в качестве вакцины, он называется «инактивированной вакциной». Примеры таких инактивированных антигенов включают в себя, не ограничиваясь ими, антигены, инактивированные физическим (например, рентгеновским облучением, нагреванием, ультразвуком), химическим (формалин, ртуть, спирт, хлор) или иным воздействием. Субъединичный антиген как таковой также подпадает под определение инактивированного антигена, потому что такие антигены обычно утрачивают инфективность. Альтернативно, можно использовать убитый вирус.
Используемый в настоящем описании термин «субъединичный антиген» вируса также называется «компонентом»; такой субъединичный антиген может быть очищен из такого патогена, как естественно встречающийся вирус, или может быть получен с помощью синтетической или рекомбинантной технологии. Такие способы хорошо известны и обычно используются в данной области и могут выполняться с использованием имеющегося в продаже оборудования, реагентов, векторов и т.п. Например, в случае вирусов гриппа субъединичный антиген предпочтительно представляет собой молекулу, представленную на поверхности частицы, такую как гемагглютинин (НА), нейраминидаза (NA), матрицы (М1, М2), не структуры (NS), полимеразы (PB1, PB2: основные полимеразы 1 и 2, кислая полимераза (РА)) и ядерные белки (NP). В настоящее время известно, что НА встречаются в 15 видах, а NA в 9 видах; изменения их вида может создать новый штамм.
Используемый в настоящем описании термин «адъювант» относится к веществу, которое усиливает или другим образом изменяет иммунные реакции при смешивании с введенным иммуногеном.
Используемый в настоящем описании термин «холерный токсин» относится к экзотоксину, продуцируемому Vibrio cholerae, который представляет собой причинное вещество симптомов диареи вследствие инфекции Vibrio cholerae. Хотя холерный токсин используется в качестве эффективного адъюванта, он не нашел клинического применения ввиду его токсичности. Поэтому холерный токсин обычно используется в качестве положительного контроля при поиске эффективного адъюванта для вакцины.
Используемый в настоящем описании термин «двунитевая РНК» относится к необязательно выбранной двунитевой РНК. Ее размер можно измерить, например, с помощью гель-электрофореза и подобных способов. Традиционно предпринимались попытки использования двунитевой РНК в качестве адъюванта для вакцины, но почти не было сообщений о том, что вакцина была эффективной в защите против инфекций. Такие двунитевые РНК включают в себя, но не ограничиваются ими, Poly(I:C), Poly(A:U), Poly(G:C) и им подобное.
Используемый в настоящем описании термин «Poly(I:C)» относится к двунитевой РНК, включающей в себя полиинозиновую кислоту (pI) и полицитидиновую кислоту (pc), и подпадает под описанный выше объем двунитевой РНК.
В настоящем описании в качестве антигена можно использовать любой инактивированный антиген и субъединичный антиген.
Используемый в настоящем описании термин «введение в слизистые оболочки» относится к лекарственной форме, вводимой через слизистую оболочку. Используемый в настоящем описании термин «слизистая оболочка» относится к внутренней стенке полого органа, в частности органа, который сообщается с внешней стороной тела, такого как желудочно-кишечный орган, дыхательный орган или мочеполовой орган, у позвоночного животного. Соответственно, примеры таких путей введения в слизистые оболочки включают в себя, не ограничиваясь перечисленным, введение в носовую полость (интраназальное введение), защечное введение, внутривлагалищное введение, введение в верхние дыхательные пути, альвеолярное введение и им подобное. Предпочтительно введение в носовую полость. Это связано с тем, что носовая полость является также вратами инфекции при респираторных инфекционных заболеваниях, в частности, вирусов гриппа, и следовательно, может вызвать реакции IgA введением в слизистую оболочку.
Используемый в настоящем описании термин «интраназальное введение» относится к способу введения через слизистую оболочку носовой полости.
Используемый в настоящем описании термин «патоген» относится к организму, способному вызывать заболевание или расстройство у хозяина. Примеры патогенов для человека включают в себя, не ограничиваясь перечисленным, вирусы, бактерии, простейшие, риккетсии, хламидии, грибы и пр. Патогены, против которых вакцины эффективны, обычно включают в себя, но не ограничиваются ими, вирусы, бактерии и им подобное.
Вирус, являющийся мишенью в настоящем изобретении, может быть любого вида и включает в себя, но не ограничивается ими, ДНК-вирусы, РНК-вирусы и им подобное.
Примеры вирусов, которые являются для человека патогенными, включают в себя, но не ограничиваются ими, вирус ветряной оспы, вирус кори, вирус эпидемического паротита, вирус полиомиелита, ротавирус, вирус гриппа, аденовирус, вирус герпеса, вирус краснухи, вирус SARS (вид коронавируса) и ВИЧ. Вирус предпочтительно представляет собой вирус гриппа.
Бактерии, являющиеся мишенью в настоящем изобретении, могут представлять собой любую бактерию и включают в себя, не ограничиваясь ими, грамположительные бактерии и грамотрицательные бактерии.
Бактерии, которые являются патогенами для человека, включают в себя, но ими не ограничиваются, Bordetella pertussis, Neisseria meningitides, Haemophilus influenzae типа b, Streptococcus pneumoniae, Vibrio cholerae и им подобные.
Используемый в настоящем описании термин «вирус гриппа» относится к вирусу однонитевой РНК, относящемуся к семейству Orthomyxoviridae. Вирус имеет оболочку из двойной липидной мембраны, поддерживаемой М1 (мембранным белком), в которую встроены характерные мембранные белки, такие как М2, НА (гемагглютинин), NA (нейраминидаза) и гликопротеид М2. РНК встречается в восьми сегментах, которые, наряду с ядерными белками, образуют сложный RNP (рибонуклеозидный капсид) и слабо связаны с поддерживающим оболочку белком М1.
Из белков вируса гриппа НА и NA продуцируются в виде встроенных в мембрану эндоплазматического ретикулума и экспонируемых на клеточной поверхности через аппарат Гольджи. Поэтому и НА, и NA являются хорошими иммуногенами и используются в качестве основных исходных материалов для вакцин.
Используемый в настоящем описании термин «концентрация, достаточная для продуцирования секреторного IgA» относится к способности адъюванта или вакцины как таковых, т.е. концентрации адъюванта или вакцины как таковых, которая обеспечивает возможность продуцирования секреторного IgA после начала иммунной реакции после введения. Такая концентрация может быть достигнута in vitro или in vivo с использованием способа, общеизвестного в данной области.
Используемый в настоящем описании термин «секреторный IgA» относится к IgA, который секретируется. IgA представляет собой основной иммуноглобулин в экзокринных жидкостях и помогает в защите против инфекций на поверхности слизистых оболочек. Хотя IgA в изобилии обнаруживается в слюне, выделениях из носовой полости и жидкостях, секретируемых из кишечника, трахеи и им подобных органов, или в молозиве, он также присутствует и в сыворотке. Содержание IgA как такового можно измерить, например, способом иммунодиффузии, который, однако, не следует рассматривать как ограничивающий; в качестве примеров предпочтительно используемых способов можно упомянуть способы, описанные в разделе «Примеры».
Описание общих биохимических методик, которые можно использовать в настоящем изобретении
Способ получения вакцины
В настоящем описании субъединичный антиген или инактивированный антиген, содержащиеся в вакцине, можно получить из натурального материала путем инактивации, очистки и подобными способами, как описано выше, или же искусственно, путем получения полипептида, используя технологию генетической инженерии или синтеза. Обычно вакцину согласно изобретению можно получить, выращивая вирус или подобный патоген с использованием развившегося яйца и ему подобной среды и инактивируя выращенный вирус или подобный патоген или отделяя и очищая из него компонент.
В настоящем описании вакцина согласно изобретению может поставляться в жидкой или высушенной форме в плотно закупоренном флаконе, шприце, распылителе или подобных контейнерах или в термически запаянной ампуле.
При производстве вакцины вируса гриппа можно использовать следующие процедуры, но их не следует рассматривать как ограничивающие.
Примеры желательного штамма вируса гриппа включают в себя, но не ограничиваются ими, A/Beijing/352/89(H3N2); A/Texas/36/91(H1L1); B/Panama/45/90; A/Georgia/03/93; A/New Caledonia/20/99(H1L1), A/Panama/2007/99(H3N2); B/Shangdong/7/97; B/Johannesburg/5/99 и т.п.
Эти вирусы выращивают, например, путем инкубации пересевом в 9-11-дневные развивающиеся эмбрионы яиц, при необходимости, выращивают в культивируемых клетках (например, клетках MDCK). Вирусы можно очистить способом, описанным Massicot et al. (Virology 101, 242-249 (1980)), или его модификацией. Вкратце, суспензию вирусов осветляют центрифугированием при 8000 об/мин (например, на центрифуге Sorvall RC5C, роторе GS-3), затем осаждают центрифугированием с использованием ротора модели Beckman 19 при 18000 об/мин в течение 2 часов.
Осажденный вирус ресуспендируют в среде STE (0,1 М NaCl, 20 мМ Tris, рН 7,4, 1 мМ ЭДТА) и центрифугируют при 4000 об/мин в течение 10 минут (центрифуга Hermle Z360K), и агрегат удаляют. 2 мл надосадочной жидкости наслаивают на ступенчатый градиент сахарозы, состоящий из 2 мл 60% сахарозы и 7 мл верхнего слоя 30% сахарозы, забуференной STE, и центрифугируют при 36000 об/мин (ротор SW-40, Beckman) в течение 90 минут.
Сегментированный вирус собирают на границе раздела, 10-кратно разводят STE и осаждают при 30000 об/мин в течение 2 часов (ротор Beckman Ti45). Затем осажденный вирус замораживают при -70°С.
Субъединичный антиген вируса можно получить путем культивирования (например, клеток СНО-К1) с использованием технологии рекомбинантной ДНК. Векторы экспрессии, которые можно использовать, включают в себя, не ограничиваясь ими, pCXN (Matsunami K. Et al. (Clinical & Experimental Immunology 126(1), 165-172 (2001)) и ему подобные. Трансформированные клетки растворяют в солюбилизирующем буферном растворе (8% Triton X-100, 2 M HCl, 10 мМ буфер фосфата натрия (рН 7,0)) или подобном растворе и суспендируют, добавляя равный объем PBS (солевой раствор с фосфатным буфером), с последующим, например, центрифугированием при 360000 об/мин (например, центрифуге Beckman XL-70 с ротором типа 55.1Ti), посредством чего извлекается растворимая фракция. Извлеченная растворимая фракция может быть адсорбирована на аффинной колонке, где белок, пептид или подобное вещество, такое как моноклональное антитело или поликлональное антитело, обладающее специфическим аффинитетом к желательному антигену или пептидной последовательности, добавленной к ней, соединяется с носителем, и элюируют и очищают, используя раствор, который ослабляет силу связывания вследствие изменения рН или другого влияния, такого как 0,1 М глицин-HCl или 0,1% Tween 80 (рН 2,7). Также можно использовать такие методики как экстракция растворителя, обессоливание выпадением в осадок под воздействием осаждения сульфатом аммония, осаждение органическим растворителем, анионообменная хроматография с использованием такой смолы, как диэтиламиноэтил (DEAE)-сефароза или DIAION HPA-75 (Mitsubishi Chamical Corporation), хроматография гидрофобности с использованием такой смолы, как бутил-сефароза или фенил-сефароза, гель-фильтрация с использованием молекулярного сита, хроматофокусировка и изоэлектрическая фокусировка. Очищенный антиген диализуют против буферного раствора, такого как PBS, и он может быть заморожен, например, при -70°С.
В таких формах может быть получена вакцина.
Адъювант
Термин «адъювант» в целом относится веществам, которые увеличивают продукцию антител и усиливают иммунные реакции при комбинации с антигеном; в более предпочтительном варианте способа осуществления используется модуляторный или эффективный, нетоксичный адъювант. Требуется, чтобы адъюванты использовались наряду с обычным вакцинным антигеном, с тем, чтобы вызвать более быстрые, более сильные или длительные реакции. Адъюванты как таковые можно также использовать в случаях, когда подача антигена ограничена или продукция антигена является дорогостоящей.
Адъюванты относятся, например, к минералам, бактериям, растениям, синтетическим продуктам или продуктам организма-хозяина.
Адъюванты первого класса представляют собой минеральные адъюванты, например, соединения алюминия. Первое применение соединения алюминия в качестве адъюванта было описано в 1926 г. С тех пор антигены, совместно осажденные с соединением алюминия или антигенами, смешанными или адсорбированными к ранее образованному соединению алюминия использовались для усиления иммунных реакций у животных и человека. Представляется, что соединения алюминия и подобные адъюванты действуют по описанному выше механизму. Алюминий физически связывается с антигеном для образования частиц и замедляет скорость поглощения антигена в ткани после инъекции, таким образом, продлевая период взаимодействия между антигеном и клетками, представляющими антиген, например, макрофагами или фолликулярными-дендритными клетками. Альтернативно, адъюванты, кроме того, активируют такие взаимодействия. Показано, что частицы алюминия появляются локально в лимфоузлах кролика через 7 дней после иммунизации и могут направлять антиген в область, содержащую Т-клетки в самих лимфоузлах с другой функцией. Было показано, что активность адъюванта коррелирует с активацией релевантного лимфоузла. Хотя в большом количестве исследований продемонстрировали, что антиген, введенный вместе с алюминием, активирует гуморальный иммунитет, представляется, что клеточный иммунитет увеличивается лишь незначительно. Было также описано, что алюминий активирует пути комплементов. Этот механизм может играть роль в местных воспалительных реакциях и иммуноглобулиновой памяти.
Соединения алюминия представляют собой почти единственный безопасный адъювант, который в настоящее время используется у человека. Однако вакцины, содержащие алюминий, иногда вызывают местные реакции. Хотя начало аллергий обычно не вызывает большого клинического беспокойства, сообщается, что соединения алюминия привлекают эозинофилы в участки инъекции посредством механизма, зависимого от Т-клеток, для индукции реакций IgE после примирования антигеном и активации популяции специфических клеток, имеющих хелперную функцию, для реакций IgE.
Недавно были очищены и синтезированы адъюванты бактериального происхождения (например, муранилдипептид, липид А). Также были клонированы полученные в организме хозяина иммунологически активные белки (интерлейкин 1 и интерлейкин 2). В последние годы на лабораторном уровне начал использовать Bordetella pertussis, липополисахариды и полный адъювант Фрейнда (FCA).
В качестве адъюванта начали также использовать и разные другие вещества. Они включают в себя растительные продукты, например, сапонин, животные продукты, например, хитин, и большое количество синтетических химических веществ.
В настоящем описании в качестве адъюванта используется двунитевая РНК. Эту двунитевую РНК можно получить в соответствии с описанным выше способом получения молекулы нуклеиновой кислоты, и можно использовать способ, хорошо известный в данной области. В качестве примеров, можно использовать наборы от компании Sigma Aldrich Japan, YAMASA Corporation, Fluka.
Poly(I:C) можно получить с использованием способов, хорошо известных в данной области. Такие способы описаны в непатентных документах 1-3 и прочих, и примеры предпочтительных способов включают в себя, не ограничиваясь перечисленным, смешивание двух отобранных гомополимеров в растворе, забуференном фосфатом, при рН 7,0 (0,006 моль фосфата натрия, 0,15 моль хлорида натрия) в эквимолярной концентрации, и пр. Комплекс может образовываться сразу после смешивания.
Компьютерный скрининг
Для скрининга конформационных данных можно использовать фактор (например, антиген или инактивированный антиген, антитело), полипептид или молекулу нуклеиновой кислоты согласно изобретению. Скрининг можно выполнять с использованием системы in vitro, in vivo или другой системы с использованием существующего вещества или с использованием библиотеки, созданной с использованием системы скрининга в кремнии. Понятно, что соединения желательной активности, полученные путем скрининга, также охватываются объемом настоящего изобретения. В настоящем изобретении также предполагается, что препарат, созданный с помощью компьютерного моделирования, предоставляется на основе описания настоящего изобретения. Соответственно, препарат, полученный путем такого скрининга, можно также использовать в качестве компонента для вакцины согласно изобретению.
Заболевания
Заболевания, на которые может быть направлено настоящее изобретение, согласно описанию, можно предотвратить введением вакцины. Такие заболевания включают в себя, не ограничиваясь перечисленным, бактериальные заболевания, вирусные заболевания, аллергические заболевания и пр.; примеры включают в себя, не ограничиваясь перечисленным, ветряную оспу, корь, эпидемический паротит, полиомиелит, ротавирусную инфекцию, грипп, краснуху, тяжелый острый респираторный синдром (SARS), коклюш, менингит и холеру, инфекцию вирусом RS (респираторного синцития), Haemophilus influenzae типа b, инфекции Streptococcus pneumoniae, синдром приобретенного иммунодефицита (СПИД) и др.
Демонстрация терапевтической активности или профилактической активности
Соединение или фармацевтическая композиция согласно изобретению предпочтительно тестируют для выявления желательной терапевтической активности или профилактической активности in vitro, затем in vivo и на уровне организма животных перед применением у человека. Воздействия соединения или композиции на клеточный штамм и/или образец ткани можно определить с использованием методики, известной специалистам в данной области. В качестве анализов in vitro, которые можно использовать для определения того, показано ли введение конкретного соединения в соответствии с настоящим изобретением, можно упомянуть наблюдение связывания антигена с антителом и подобные способы. При тестировании на уровне организма животных суждение возможно в результате введения испытуемой вакцины, например, человеку, и подтверждения увеличения титра антител (определяемого, например, способом ELISA (иммуноферментный анализ)) или активации цитотоксических Т-клеток и тому подобных явлений.
Композиция и ее ведение для профилактики
Фармацевтически приемлемые носители, которые можно использовать в композиции, вакцине и подобных препаратах согласно изобретению, включают в себя, не ограничиваясь перечисленным, антиоксиданты, консерванты, красящие вещества, ароматизирующие агенты и разбавители, эмульгаторы, суспе