Способ получения антигена из micobacterium tuberculosis
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Последовательно обрабатывают клеточную массу Micobacterium tuberculosis 25%, 50%-ными водными растворами ацетона. Затем проводят 15-минутную гомогенизацию осадка 10%-ным водным раствором диметилсульфоксида и трехсуточный диализ против дистиллированной воды с ежедневной сменой последней. Проводят центрифугирование при 7000 об/мин и повторяют обработку осадка 15% и 20%-ными водными растворами диметилсульфоксида с последующим диализом. Объединяют полученные супернатанты (в количестве 3) и выдерживают их при комнатной температуре 30-40 дней с ежедневным встряхиванием. Замораживание и размораживание проводят не менее чем через 72 часа. Собирают нижнюю треть опалесцирующего раствора. Способ используют для приготовления антигена из Micobacterium tuberculosis для изучения гуморального иммунного ответа в реакции иммуноблот анализа, а также может быть использован в клинической лабораторной диагностике. 4 ил.
Реферат
Изобретение относится к области медицины и касается способа приготовления антигена из Micobacterium tuberculosis для изучения гуморального иммунного ответа в реакции иммуноблот анализа, может быть использовано в клинической лабораторной диагностике, иммунологии и микробиологии.
Туберкулез представляет собой важную социально-экономическую и медицинскую проблему во всем мире. Анализ сложившейся эпидемиологической ситуации показывает, что заболеваемость туберкулезом в нашей стране носит характер эпидемии [1, 2, 3]. По данным Всемирной Организации Здравоохранения в промежутке времени с 2000 по 2020 гг. туберкулезом в мире заболеют около 200 млн. человек, умрут около 35 млн. человек, будет инфицировано приблизительно 1 млрд. человек [4]. В связи с этим, одной из важных задач мировой медицины является разработка надежных (эффективных и специфических), простых в использовании, методов для быстрой диагностики туберкулеза.
В нашей стране при диагностике туберкулеза большое внимание уделяется культуральным методам, за рубежом - микроскопии мазка. Однако оба эти метода имеют существенные недостатки. Так культивирование с момента посева составляет три месяца, причем процент положительных результатов не превышает 0,5-14% [5, 6, 7]. При микроскопии мазка (флуоресцентный метод) наблюдается лишь 14% положительных результатов [8]. Известны и другие способы диагностики туберкулеза, такие как: кожная проба с туберкулином, радиологические исследования, однако все они не имеют необходимой диагностической чувствительности.
Фактически, самые лучшие средства для клинической и эпидемиологической работы в диагностике туберкулеза - это серологические тесты, такие как гемагглютинация, фиксация комплемента, иммунофлуоресценция, иммуноферментный анализ (ИФА) и радиоиммунодиффузные методы, так как для анализа используется легко доступный клинический материал - сыворотка крови человека. Но для выполнения туберкулезных тестов с использованием вышеуказанных методов требуются высококвалифицированные специалисты и дорогостоящий материал. В связи с этим является актуальным разработка новых методов диагностики туберкулеза, обладающих высокой специфической активностью, экспрессностью и информативностью.
В настоящее время основным способом серологической диагностики туберкулеза является ИФА на тест-системах «АТ-ТУБ-БЕСТ-стрип», производитель ЗАО «Вектор-Бест», в основу которых положен принцип взаимодействия специфических антител, присутствующих в сыворотке крови с антигеном молекулярной массой 38-40 кДа, либо культуральным фильтратом. Однако данный диагностический тест не позволяет определять наличие специфических антител к другим серологически активным структурным компонентам Micobacterium tuberculosis, позволяющих получать более развернутую картину антителогенеза на внедрение чужеродного агента - микобактерий, характеризующих развитие гуморального иммунного ответа.
Целью изобретения является выделение ряда серологически активных структурных компонентов возбудителя Micobacterium tuberculosis (антигенов), представляющих более широкую информацию о формировании гуморального иммунного ответа на внедрение возбудителя в серологической реакции иммуноблот анализа.
В качестве прототипа изобретения мы рассматриваем способ получения антигена [9], включающий культивирование Micobacterium tuberculosis на среде Левенштейна-Иенсена, трехкратную промывку от остатков питательной среды, получение бактериальной взвеси в сухом виде путем трехкратной обработки ацетоном, а затем эфиром, встряхивания смеси 40 мг сухой бактериологической массы и 10 мл изотонического раствора хлорида натрия в течение 30 минут, 24-часового выдерживания при комнатной температуре, 20-минутного центрифугирования при 9000 об/мин, отбрасывании осадка, использование в работе надосадка (супернатанта), представляющего собой комплекс поверхностных структурных компонентов возбудителя.
Предлагаемый способ выделения антигена из Micobacterium tuberculosis отличается от прототипа тем, что для его получения используется последовательная обработка клеточной массы Micobacterium tuberculosis 25% и 50%-ными водными раствороми ацетона, 15-минутная гомогенизация осадка 10%-ным водным раствором диметилсульфоксида, трехсуточный диализ против дистиллированной воды с ежедневной сменой последней, центрифугирование при 7000 об/мин, повторением обработки осадка 15% и 20%-ми водными раствороми диметилсульфоксида с последующим диализом, объединение полученных супернатантов (в количестве 3), выдерживание их при комнатной температуре 30-40 дней с ежедневным встряхиванием, замораживание и размораживание не менее чем через 72 часа, сбора нижней трети опалесциирующего раствора. Данный способ позволяет производить щадящую делипидизацию и солюбилизацию поверхностных компонентов клеточной стенки возбудителя с минимальными деструктивными изменениями выделяемых структур.
Антиген из Micobacterium tuberculosis для изучения гуморального иммунного ответа в реакции иммуноблот анализа получали следующим способом.
Пример 1. В работе использовали Micobacterium tuderculosis «штамм Академия», полученный из Государственного Института Стандартизации и Контроля им. Л.А.Тарасевича (г. Москва). Микобактерий засевали на среду Левенштайна-Иенсена и выращивали при температуре 37°С в течение 30 дней. Микобактерий смывали с поверхности питательной среды забуференным физиологическим раствором (ЗФР) рН 7,2, осаждали центрифугированием при 7000 об/мин в течение 30 мин на центрифуге ОПн-8. После ресуспендирования осадка в ЗФР, центрифугирование повторяли еще 2 раза для удаления остатков питательной среды. Отмытые микобактерии подвергали обработке по схеме:
I этап: Клеточный осадок гомогенизировали 1-3 мин в 25%-ном водном растворе ацетона, центрифугировали при 7000 об/мин; гомогенизировали осадок 1-3 мин в 50%-ном водном растворе ацетона, центрифугировали при 7000 об/мин; (осадок № 1);
II этап: Гомогенизировали осадок № 1 15 мин в 10%-ном водном растворе диметилсульфоксида (ДМСО, производитель Fluka); диализировали взвесь против дистиллированной воды в течение 3-х суток с ежедневной сменой последней; осаждали взвесь при 7000 об/мин (супернатант 1); Гомогенизировали осадок № 2 15 мин в 15%-ном водном растворе ДМСО; диализовали взвесь против дистиллированной воды в течение 3-х суток с ежедневной сменой последней; осаждали взвесь при 7000 об/мин (супернатант 2); Гомогенизировали осадок № 3 15 мин в 20%-ном водном растворе ДМСО; диализировали взвесь против дистиллированной воды в течение 3-х суток с ежедневной сменой последней; осаждали взвесь при 7000 об/мин (супернатант 3).
III этап: Объединяли супернатанты 1, 2, 3 и выдерживали полученный раствор не мене 30-40 дней при комнатной температуре с ежедневным встряхиванием. Замораживали раствор до -20°С на 72 часа. Размораживали в течение ночию. Отбирали нижнюю треть раствора.
IV этап: Стандартизация полученной взвеси по оптической плотности (ОП). Полученный антигенный материал подвергался изучению методом электрофореза в полиакриламидном геле в присутствии детергента додецилсульфата натрия (SDS) по методу [10].
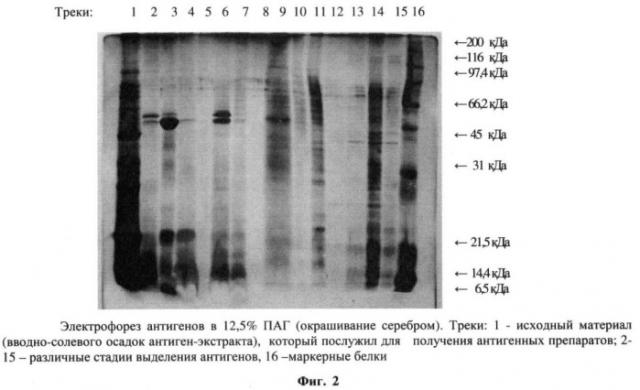
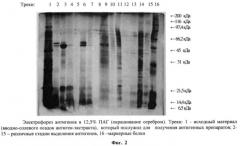
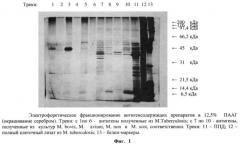
Пример 2. Полипептидный состав антигенов, полученный из нативных клеток Micobacterium tuberculosis в сравнении с близкородственными антигенами, полученными из Micobacterium bovis, Micobacterium avium, Micobacterium non, Micobacterium scot, изучали при помощи вертикального диск-электрофореза в 12,5% полиакриламидном геле (ПААГ) [10]. После электрофореза пластины фиксировали в 40%-ном спиртовом растворе, содержащем 10% уксусной кислоты, отмывали в дистиллированной воде и окрашивали кумасси ярко-синим G-250, с последующим окрашиванием раствором азотнокислого серебра, фиг.1, 2.
При определении молекулярных масс было установлено, что близкородственные микобактериальные антигены имеют четко обозначенные фракции, большая часть которых располагается в диапазоне молекулярных масс 46,5 кД - 38,5 кДа. В целом фракции обнаруживаются в диапазоне молекулярных масс 66,5 кД - 31 кДа. Причем эти фракции лежат в области, скорость миграции которых в геле совпадает со скоростью миграции мажорного белка туберкулина - ППД с молекулярной массой 40 кДа. Антигены из Micobacterium tuberculosis имели основные фракции с малекулярной массой 60-65 кДа и низкомолекулярные 10-25 кДа.
Пример 3. Электроперенос антигенных препаратов, фракционированных в ПААГ на нитроцеллюлозную мембрану 0,45 мкм проводили по методу [11] при силе тока 200 мА в течение 180-200 минут в полусухой системе с использованием угольных электродов с охлаждением до +4 - +8°С. Маркерные белки после электропереноса окрашивали красителем Понсо С (0,04% Понсо С в 12,5% трихлоруксусной кислоте) фиг.3. Мембрану с нанесенным антигенным материалом выдержи 20 мин в блок-растворе, содержащем 1% сухое обезжиренное молоко на фосфатно-солевом буферном растворе (ФБР) рН 7,2-7,4; промывали 3 раза дистиллированной водой и высушивали.
Пример 4. Нитроцеллюлозную мембрану маркировали цифрами и нарезали на стрипы шириной 2-3 мм (готовые для проведения реакции иммуноблот тест-стрипы).
В качестве положительной сыворотки использовали сыворотку крови больных туберкулезом с подтвержденным диагнозом, а в качестве отрицательной - сыворотку крови доноров, дополнительно тестированную иммуноферментным анализом (ИФА) с использованием тест-систем «АТ-ТУБ-Бест-стрип», производитель ЗАО «Вектор-Бест». Иммуноблот реакцию проводили следующим образом.
1. Тест-стриповые полоски помещали в специальные ячейки лотков маркировочными номерами вверх.
2. Вносили по 2 мл ФСР-Т (фосфатно-солевой раствор, содержащий детергент твин 20) и выдерживали не менее 5 мин (регидратация).
3. Добавляли в раствор по 20 мкл исследуемых положительных и отрицательных сывороток крови человека (разведение 1:100); инкубировали 2 часа при комнатной температуре (15-30°С), при медленном покачивании лотка на шейкере Wemixx (Denley Instruments Ltd, Великобритания).
4. Раствор из ячеек лотков аспирировали в емкость с дезинфицирующим раствором; каждый стрип промывали 2-я мл ФСР-Т 4 раза с 1 мин инкубацией; после последней промывки раствор удаляли.
5. В каждую ячейку вносили раствор конъюгата (античеловеческий IgG (H+L), меченный щелочной фосфатазой); продолжительность инкубации 1 ч.
6. Процедуру промывки повторяли как в п.4.
7. В каждую ячейку вносили субстратный раствор для щелочной фосфатазы (5бром-4хлор-3-индолил-фосфат (BCIP) и нитросиний тетразоль (NBT) в диметилформамиде) на 30-40 мин при медленном покачивании.
8. По окончании инкубации субстратную смесь аспирировали и добавляли стоп-реагент 0,1 М раствор серной кислоты на 10-20 минут, после чего стрипы промывали дистиллированной водой и высушивали.
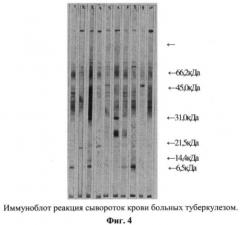
Результаты реакции оценивали визуально и инструментально в отраженном свете на сканере Sharp Jx-330 с использованием программы Image Master 10 Prime, версия 3,00 (Pharmacia Biotech). Интенсивность окрашенных полос (количественный анализ сканированных фракций) выражалась в оптических единицах плотности (Pixel). Полученные результаты обрабатывали с использованием программы Microsoft Excel и представляли в виде табличных данных и линейных графических изображений. Пример иммуноблот анализа сывороток крови больных туберкулезом представлен на фиг.4. Полученные результаты свидетельствуют о наличии серологической активности зон с молекулярной массой 80-90 кДа (в 60% случаев), 60-65 кДа (в 100% случаев), 30-40 кДа (в 100% случаев), 10-25 кДа (в 100% случаев). Данный факт свидетельствует о серологической значимости полипептидов обозначенных молекулярных масс, которые являются стимуляторами антителогенеза В-зависимой клеточной системы.
Источники информации
1. Онищенко Г.Г. (Материалы к докладу) - Главного государственного санитарного врача РФ на VIII Всероссийском съезде эпидемиологов, микробиологов и паразитологов. // Ь, 26-28 марта 2002.
2. Онищенко Г.Г. Эпидемиологическая ситуация в Российской Федерации и меры по ее стабилизации. // Проблемы туберкулеза и болезней легких, 2003, № 11, с.4-9.
3. Пунга В.В., Капков Л.П. Туберкулез в России. // Проблемы туберкулеза, 1999, № 1, с.14-16.
4. WHO Fact Sheet / Tuberculogia // №104, April, 2000/
5. Клименко M.T., Гинсбург T.C., Сокало С.В., Бочко И.В., Крикун А.И. Микробиологическая диагностика туберкулеза почек. // Проблемы туберкулеза, 1985, № 8, с.37-40.
6. Клименко М.Т., Гинсбург Т.С., Сокало С.В., Бочко И.В., Крикун А.И. Микробиологическая диагностика туберкулеза почек. // Проблемы туберкулеза, 1985, № 8, с.37-40.
7. Литвинов В.И. Иммунодиагностика туберкулеза. // Проблемы туберкулеза, 1996, № 1, с.56-59.
8. Канюк А.Н. Комплексные бактериологические исследования в диагностике туберкулеза // Туберкулез и этиология, 1995, № 3, с.31-33.
9. Справочник по микробиологическим и вирусологическим методам исследования. М.: Медицина, 1982.
10. Laemmli U.K. Cleavage of structural proteins during the assembly of the bacteriophage T4.- Nature.London, 1970, v.227, pp.680-685.
11. Towbin H., and Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc. Natl. Acad. Sci. U.S.A. 76, 4350, 1979.
Способ получения антигена из Micobacterium tuberculosis, включающий трехкратную промывку от остатков питательной среды, получение бактериальной взвеси в сухом виде путем трехкратной обработки ацетоном, а затем эфиром, высушивание и последующее встряхивание смеси 40 мг сухой бактериологической массы и 10 мл изотонического раствора хлорида натрия в течение 30 мин, 24-часовое выдерживание при комнатной температуре, 20-минутное центрифугирование при 9000 об./мин и использование в работе надосадка (конечного продукта), дающего в реакции иммуноблот анализа с серопозитивными сыворотками две диффузные фракции (58 и 65 кДа), отличающийся тем, что для получения антигена используют последовательную обработку клеточной массы Micobacterium tuberculosis 25- и 50%-ными водными растворами ацетона, 15-минутную гомогенизацию осадка 10%-ным водным раствором диметилсульфоксида, трехсуточный диализ против дистиллированной воды с ежедневной сменой последней, центрифугирование при 7000 об./мин, повторение обработки осадка 15- и 20%-ными водными растворами диметилсульфоксида с последующим диализом, объединение всех полученных супернатантов, выдерживание их при комнатной температуре 30-40 дней с ежедневным встряхиванием, замораживание и размораживание не менее чем через 72 ч и отбор нижней трети опалесцирующего раствора (конечный продукт), дающего в реакции иммуноблот анализа с серопозитивными сыворотками 4 группы дискретных фракций с молекулярными массами в 80-90 кДа (в 60% случаев), 60-65 кДа (в 100% случаев), 30-40 кДа (в 100% случаев), 10-25 кДа (в 100% случаев), что позволяет получать большую информацию о формировании гуморального иммунного ответа на внедрение Micobacterium tuberculosis в организм.