Способ получения трансгенных млекопитающих, которые продуцируют экзогенные белки в молоке, и трансгенные млекопитающие, полученные таким способом
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, животноводства и медицины. Предложено трансгенное животное из рода быков, которое продуцирует в своем молоке рекомбинантный гормон роста человека в среднем на месяц, по меньшей мере, 92 нг/мл. Раскрыт также способ получения такого трансгенного животного, который предусматривает клонирование генетической конструкции, кодирующей ген hGH и промотор бета-казеина, в экспрессирующем векторе. Далее проводят трансфекцию в фетальные соматические клетки крупного рогатого скота, обычно фибробласты, и ядерный перенос в энуклеированные ооциты крупного рогатого скота, с образованием, таким образом, трансгенных эмбрионов. Заявленное изобретение позволяет получать большие количества гормона роста человека. Изобретение может быть использовано в животноводстве и медицине. 6 н. и 37 з.п. ф-лы, 16 ил., 3 табл.
Реферат
УРОВЕНЬ ТЕХНИКИ
Белковые факторы и гормоны, используемые в здравоохранении, в настоящее время получают в фармацевтической промышленности путем экстракции или - в последние десятилетия - с применением рекомбинантной технологии. Экспрессию генетических конструкций, содержащих требуемые гены, успешно осуществляли в бактериях, дрожжах или линиях клеток млекопитающих. Однако применение культур клеток млекопитающих для получения сложных белков, таких как белки, которые требуют правильного типа гликозилирования, включает в себя дорогостоящие способы.
В последнее десятилетие все больше и больше использовали методику рекомбинантной ДНК для получения коммерчески важных биологических материалов. С этой целью клонированы последовательности ДНК, кодирующие множество важных с медицинской точки зрения белков человека. К ним относятся инсулин, активатор плазминогена, альфа-1-антитипсин и факторы коагуляции VIII и IX. В настоящее время даже при наличии новых методик на основе рекомбинантной ДНК указанные белки обычно очищают из крови и ткани дорогостоящим и требующим много времени способом, который может быть сопряжен с риском передачи инфекционных агентов, таких как агенты, вызывающие СПИД и гепатит.
Хотя экспрессия последовательностей ДНК в бактериях для получения требуемого важного с медицинской точки зрения белка выглядит привлекательной, на практике бактерии часто оказываются неудовлетворительными в качестве хозяев, поскольку в бактериальной клетке чужеродные белки являются нестабильными и не могут подвергаться правильному процессингу.
Признавая указанную проблему, предпринимали попытки экспрессировать клонированные гены в культуре ткани млекопитающих и в некоторых случаях получили пригодную методику. Однако периодическая ферментация клеток животных представляет собой дорогой и требующий определенных технических условий способ.
Поэтому существует необходимость в высокопродуктивном дешевом способе получения биологических веществ, таких как правильно модифицированные эукариотические полипептиды. Отсутствие агентов, которые являются инфекционными для человека, может быть преимуществом такого способа.
Возможность получения трансгенных в отношении требуемого гена животных, подобных крупному рогатому скоту, с целью получения большого количества белка человека в молоке представляет большой интерес для промышленности. Несколько групп исследователей сообщают в литературе о своих успехах в получении у трансгенных коров или коз сывороточного альбумина человека, альфа-антитрипсина и некоторых других примерах.
Множество экспериментов было проведено ранее на мышах или крысах и при этом всегда предпочитали, чтобы трансгенная экспрессия была ограничена молочными железами, так как использовали промоторы бета-казеина или лактальбумина, которые отвечают только на факторы транскрипции молочной железы у самок в период лактации.
Экспрессия гетерологичного белка исключительно в молоке подразумевает возможность избегать нежелательного влияния на здоровье животного-хозяина и обеспечивать простой способ очистки.
В настоящее время внимание посвящено разработке нескольких систем для повышения выхода трансфекции или селекции клеток и выбору источника гомологичной эмбриональной соматической клетки для повышения жизнеспособности и состояния иммунитета клонированных животных.
С другой стороны, существует огромный интерес в переносе ядер соматических клеток, главным образом чтобы сделать возможным размножение элитных домашних животных и конструирование трансгенных животных для сельскохозяйственных и биомедицинских целей. Коротко, перенос ядер (NT) заключается в удалении ядра из ооцита реципиента, с последующим переносом донорского ядра в перивителлиновое пространство в близком контакте с цитоплазмой реципиента и их слиянием. Развитие индуцируют искусственно путем химической или физической активации. Получение клонированного потомства посредством переноса ядра соматической клетки успешно достигнуто у овец (Campbell, К.H., et al., Nature 380:64-66 (1996), 1996; Wells, D.N., et al., Biol Reprod 57:385-393 (1997); Wilmut, I., et al., Nature 385:810-813 (1997)); коз (Baguisi, A., et al., Nat. Biotechnol. 17: 456-461 (1999)) и коров (Cibelli, J. В., et al., Science 280:1256-1258 (1998); Kato, Y., et al., Science 282:2095-2098 (1998); Wells, D. N., et al., Reprod Fertil Dev 10:369-378 (1998)).
Существует несколько факторов, которые влияют на результаты NT, включая способы удаления ядер, слияния, активации и синхронизации клеточного цикла донора-реципиента. Высокие эффективности удаления ядер из ооцитов реципиентов достигнуты с использованием красителей, специфичных в отношении ДНК и используемых прижизненно для визуализации хроматина (Stice, S.L., и Keefer, С.L., Biol Reprod 48:715-719 (1993); Westhusin, M.E., et al., J Reprod Fertil 95:475-480 (1992)). Слияние донорской клетки с ооцитом реципиента зависит от точности совмещения клеток в импульсном поле, контакта донорской клетки c ооцитом реципиента и размера донорских клеток (Collas, P., et al., Anal. Biochem. 208:1-9 (1993)). Усовершенствована активация реконструированного в результате NT эмбриона, и показатели развития в бластоцисты эквивалентны показателям в случае оплодотворенных in vitro ооцитов (Liu, L., et al., Mol. Reprod. Dev. 49: 298-307 (1998)).
Успешное развитие NT-эмбрионов осуществили при использовании зрелых ооцитов (Willadsen, S. M., Nature 320:63-65 (1986)), зигот (McGrath, J., and Solter, D., Dev. Biol. NY 4:37-55 (1985)) и эмбрионов на стадии дробления (Tsunoda, Y., et al., J. Reprod. Fertil. 96:275-281 (1992)) в качестве реципиентных цитопластов; однако это зависит от источника донорского ядра. Совместимость клеточного цикла между реципиентными цитопластами и донорскими клетками является одним из важных факторов, которые влияют на развитие NT-эмбрионов. Соответствующая синхронизация необходима для предотвращения плоидии реконструированного эмбриона.
Митотический клеточный цикл имеет следующие последовательные фазы: интервал, предшествующий репликации (G1), фазу синтеза ДНК (S), интервал, предшествующий митозу (G2), и митоз (M). В течение одного клеточного цикла вся геномная ДНК реплицируется один раз перед митозом. Интерфазное донорское ядро, перенесенное в лишенный ядра зрелый ооцит (метафаза II), подвергается нескольким морфологическим изменениям. После слияния, но перед разрушением оболочки донорского ядра (NEBD), хромосомы конденсируются (PCC). Указанные изменения индуцируются активностью фактора, стимулирующего созревание/митоз/мейоз (MPF) и активируемой митогеном протеинкиназы (MAPK) (Collas, P., and Robl, J. M., Biol. Reprod. 45: 455-465 (1991)). Активности MPF и MAPK обнаружены во всех мейотических и митотических клетках и становятся наиболее высокими в метафазе, и в ооцитах млекопитающих указанные высокие уровни также индуцируют задержку в метафазе II. Снижение активности MPF и MAPK при оплодотворении или активации кальциевым ионофором является сигналом для завершения мейоза, выделения второго полярного тельца, деконденсации ядра сперматозоида и образования пронуклеуса.
Прямое влияние NEBD и PCC на донорский хроматин зависит от клеточного цикла донорского ядра во время переноса. Диплоидные ядра G0/G1 подвергаются конденсации с образованием отдельных хроматид, а тетраплоидные ядра G2 подвергаются конденсации с образованием двойных хроматид. Однако ядра в S-фазе во время переноса имеют характерный «распыленный» вид; PCC вызывает большое повреждение ДНК. Поэтому правильная плоидность может быть получена в результате переноса ядер в G1 или G0 в ооциты в метафазе II во время активации или перед активацией. Второй способ заключается в переносе ядер в предварительно активированный ооцит в S-фазе, в данном случае можно использовать донорскую клетку в фазе G1, G0 или S. Поскольку активности MPF и MAPK являются низкими, хроматин деконденсирует и подвергается репликации ДНК без PCC и NEBD.
Третью схему синхронизации сообщали для мышей, у которых развитие живого потомства получали с использованием донорской клетки в G2 или метафазе и лишенного ядра ооцита в метафазе 2 (Cheong, H.Т., et al., Biol Reprod 48:958-963 (1993); Kwon, O.Y., and Kono, Т., Proc Natl Acad Sсi USA 93:13010-13013 (1996)). Сообщали об экструзии полярного тельца из реконструированного посредством NT эмбриона, с получением в результате одного диплоидного эмбриона и диплоидного полярного тельца (Kwon, O.Y., and Kono, T., Proc. Natl. Acad. Sci. USA 93: 13010-13013 (1996)). Однако нет сообщений об образовании полярных телец после NT в лишенные ядер ооциты MII у крупного рогатого скота, овец или свиней, что свидетельствует о различиях между видами в механизмах регулирования образования интактного веретена деления и экструзии полярных телец.
Подтверждено, что стадии клеточного цикла донорской клетки и реципиента также имеют важное значение для перепрограммирования ядер донорских клеток. Увеличение периода между переносом донорских ядер и транскрипцией в зиготе может улучшать перепрограммирование ядра. По этой причине несколько авторов активировали ооцит через несколько часов после слияния (Сibelli, J. В., et al., Science 280:1256-1258 (1998); Wakayama, Т., et al., Nature 394:369-374 (1998); Wells, D. N. et al., Biol Reprod 60:996-1005 (1999)). В других сообщениях применяли последовательный перенос ядер (Stice, S.L., and Keefer, C. L., Biol. Reprod. 48: 715-719 (1993)).
Неисследованный способ увеличения времени перепрограммирования донорского ядра состоит в переносе ядер перед метафазой II. После разрушения зародышевого пузырька (GVBD) все ядерные события регулируются посредством значительного увеличения в ооците цитозольных MPF и MAPS, которые предотвращают восстановление ядерной оболочки и вхождение в S-фазу вплоть до оплодотворения или активации. Поэтому созревающий ооцит может быть универсальным реципиентом для донорской клетки в метафазе или G2. Можно даже использовать клетки в G1 или G0 в качестве донорских клеток, если активация индуцирует S-фазу перед клеточным делением.
Когда в качестве донорских клеток используют бластомеры в G2 или M, возможно перепрограммирование ядер (Cheong, H. Т., et al., Biol Reprod 48:958-963 (1993); Kwon, O. Y., и Kono, Т., Proc Natl Acad Sci USA 93:13010-13013 (1996); Liu, L., et al., Mol Reprod Dev 47:255-264 (1997)). Одним объяснением является то, что некоторые факторы вытесняются из хроматина в результате конденсации хромосом. Действительно, в случае ядерного переноса считалось, что NEBD и PCC являются морфологическими признаками перепрограммирования ядра. Кроме того, во время оплодотворения хроматин сперматозоида в высшей степени конденсирован, и его объем значительно меньше, чем объем ядер соматических клеток, и ооцит обладает способностью удалять ядерные белки сперматозоида. Хромосомы ооцита во время слияния спематозоид-ооцит также конденсированы. Возможно, конформация конденсированного хроматина может иметь некоторое биологическое значение. Следовательно, при имитации указанной ситуации посредством переноса метафазных ядер лишенный ядра метафазный реципиент может улучшать результат NT. Однако несколько исследователей использовали указанный подход для домашних животных и использовали бластомеры в качестве донорских клеток (Liu, L., et al., Mol. Reprod. Dev. 47: 255-264 (1997)).
Одной из целей данного изобретения является характеристика и усовершенствование существующего способа переноса ядер соматических клеток для разработки надежного и экономичного способа получения генетически идентичных телят из донорских клеток взрослого организма.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к трансгенному млекопитающему, отличному от человека, отличающемуся продукцией неожиданно высоких уровней рекомбинантного гормона роста в молоке. Рекомбинантным гормоном роста может быть гормон роста человека, но без ограничения указанным. Трансгенным млекопитающим, отличным от человека, может быть, без ограничения, животное, относящееся к виду крупного рогатого скота.
Изобретение, кроме того, относится к плазмиде, которая обеспечивает экспрессию представляющего интерес белка в клетках млекопитающих, в которой экспрессия регулируется промотором бета-казеина. Представляющим интерес белком может быть, без ограничения, гормон роста человека.
Изобретение также относится к различным способам получения трансгенного млекопитающего, отличного от человека, которое продуцирует рекомбинантный гормон роста в молоке. Рекомбинантным гормоном роста может быть гормон роста человека, но без ограничения указанным. Трансгенным млекопитающим, отличным от человека, может быть, без ограничения, животное, относящееся к виду крупного рогатого скота.
Изобретение также относится к способу получения представляющего интерес белка, включающему в себя получение трансгенного млекопитающего, отличного от человека, которое продуцирует указанный белок в молоке, получение указанного молока от трансгенного млекопитающего, отличного от человека, и очистку указанного представляющего интерес белка из молока. Представляющим интерес белком может быть гормон роста человека, но без ограничения указанным. Трансгенным млекопитающим, отличным от человека, может быть, без ограничения, животное, относящееся к виду крупного рогатого скота.
Изобретение также относится к способу получения и очистки рекомбинантного гормона роста из молока трансгенного животного. Рекомбинантным гормоном роста может быть гормон роста человека, но без ограничения указанным. Трансгенным млекопитающим может быть, без ограничения, животное, относящееся к виду крупного рогатого скота.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
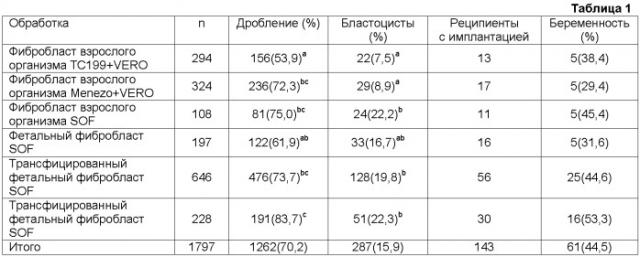
На фиг. 1A-1B показан суточный объем молока, собранного от трансгенной коровы, полученной слиянием лишенного ядра ооцита и фибробласта, предварительно трансфицированного плазмидой, содержащей ген, который кодирует гормон роста человека (hGH), и промотор, который управляет его экспрессией в клетках молочной железы.
На фиг. 2A-2C показан подсчет бактерий, обнаруженных в молоке, собранном от той же самой трансгенной коровы.
На фиг. 3A-3B показана биологическая активность hGH, находящегося в молоке той же самой трансгенной коровы.
На фиг. 4A показана суточная масса hGH, продуцируемого в молоке той же самой трансгенной коровы. Указанная величина и суточный объем молока, собранного от трансгенной коровы, вместе изображены графически на фиг. 4B.
На фиг. 5A показана концентрация hGH и инсулиноподобного фактора роста-1 (IGF-1) в сыворотке той же самой трансгенной коровы и суточная масса hGH, продуцируемого в молоке той же самой трансгенной коровы. Концентрация hGH в сыворотке трансгенной коровы и суточная масса hGH, продуцируемого в молоке трансгенной коровы, вместе изображены графически на фиг. 5B. На фиг. 5C вместе графически изображены временные профили концентраций hGH и IGF-1 в сыворотке трансгенной коровы.
На фиг. 6A и 6B показана сывороточная концентрация hGH и инсулиноподобного фактора роста-1 (IGF-1) у двух трансгенных телят, полученных путем субклонирования коровы, которая является трансгенной по продукции hGH в молоке. На фиг. 6C и 6D вместе графически изображены временные профили сывороточных концентраций hGH и IGF-1 для каждого из указанных трансгенных телят.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к трансгенному млекопитающему, отличному от человека, отличающемуся продукцией неожиданно высоких уровней рекомбинантного гормона роста в молоке. Указанным млекопитающим может быть, без ограничения, животное, относящееся к виду крупного рогатого скота. Другими видами трансгенных млекопитающих могут быть, без ограничения, вид свиней, вид овец, вид коз или вид грызунов.
Рекомбинантным гормоном роста может быть, без ограничения, гормон роста человека. Указанная молекула, также известная как соматотропин, представляет собой белок, состоящий из 191 аминокислоты, с молекулярной массой примерно 22 кД. Он имеет важное значение для линейного роста, и его применения хорошо известны.
Изобретение также относится к трансгенному млекопитающему, отличающемуся тем, что рекомбинантный гормон роста, продуцируемый в его молоке, осуществляет самостимуляцию молочных желез животного к продуцированию большего количества молока, содержащего указанный гормон.
Изобретение также относится к плазмиде, содержащей ген, кодирующий представляющий интерес белок, оперативно связанный с промотором бета-казеина и геном β-лактамазы. Указанным представляющим интерес белком может быть, без ограничения, гормон роста человека. Указанной плазмидой может быть плазмида pRβhGH.
В следующем варианте плазмида дополнительно содержит ген резистентности к неомицину для селекции клеток, резистентных к генетицину. Примером такой плазмиды является плазмида pRNeo.
В следующем варианте плазмида содержит ген, кодирующий зеленый флуоресцирующий белок, такой как GFP, который находится под контролем промотора цитомегаловируса (CMV). Примером такой плазмиды является плазмида pRNeoGreen.
Изобретение, кроме того, относится к плазмиде, такой как описанные выше плазмиды, которая была линеаризована посредством рестрикционного расщепления. В частности, используют фермент рестрикции ApaLI и вырезают ген β-лактамазы.
Проводится процедура депонирования указанных выше плазмид по условиям Будапештского договора. Наименование и адрес депозитария DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Mascheroder Weg 1b, 38124 Braunschweig, Germany. Соответствующие номера доступа будут представлены со временем.
Изобретение, кроме того, относится к плазмиде, сконструированной на основе плазмиды, содержащей ген резистентности Neo, в которую встраивали модифицированную более короткую область бета-казеина выше области, кодирующей hGH, такой как pVEβcashGH. Линейный фрагмент получали из плазмиды pVEβcashGH путем вырезания гена бета-лактамазы.
Изобретение, кроме того, относится к способу трансфекции генетических конструкций с использованием комбинации катионных липидов для применения в липосомах.
Также описаны способы селекции клеток, резистентных к неомицину, в соответствующих средах, которые представляют собой способы селекции трансгенных клеток с зеленой флуоресценцией. Указанные клетки осторожно собирали так, чтобы избежать повреждения клеток.
Изобретение также относится к способу переноса ядер клеток, задержанных в G0, или в других периодах клеточного цикла в лишенные ядер ооциты коров.
Изобретение относится к способу переноса трансгенного эмбриона в стимулированную гормонами матку коровы.
Описан способ определения параметров здоровья животного согласно изобретению. Анализы осуществляют, используя как сыворотку, так и молоко животного, чтобы определить такие параметры.
Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя получение гена, который кодирует гормон роста, клонирование гена в плазмиде, при этом ген оперативно связывают с промотором, который будет управлять экспрессией гена в клетках млекопитающего, получая в результате экспрессирующую плазмиду, трансфекцию соматических клеток экспрессирующей плазмидой, для того чтобы включить плазмиду в геном клеток, с получением в результате трансгенных соматических клеток, удаление ядра из зрелого ооцита, с получением энуклеированного ооцита, слияние трансгенной соматической клетки с энуклеированным ооцитом, с получением в результате одноклеточного эмбриона, имплантацию эмбриона в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя извлечение соматических клеток из организма самки млекопитающего, которая является трансгенной по продукции рекомбинантного гормона роста в молоке, необязательно фибробластов, удаление ядра из зрелого ооцита, с получением в результате энуклеированного ооцита, слияние одной трансгенной соматической клетки с энуклеированным ооцитом, с получением одноклеточного эмбриона, имплантацию эмбриона в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции рекомбинантного гормона роста в молоке, искусственное оплодотворение млекопитающего спермой, полученной от самца нетрансгенного млекопитающего, отличного от человека, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции рекомбинантного гормона роста в молоке, искусственное оплодотворение млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции указанного рекомбинантного гормона роста, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Изобретение, кроме того, относится к способу получения трансгенного млекопитающего, отличного от человека, включающему в себя суперовуляцию самки нетрансгенного млекопитающего, отличного от человека, искусственное оплодотворение млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции рекомбинантного гормона роста, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Рекомбинантным гормоном роста может быть, без ограничения, гормон роста человека. Трансгенным млекопитающим, отличным от человека, может быть, без ограничения, животное, относящееся к виду крупного рогатого скота.
Изобретение, кроме того, относится к способу получения белка, включающему в себя получение трансгенного млекопитающего, отличного от человека, которое продуцирует неожиданно высокие уровни представляющего интерес белка в молоке, получение молока от трансгенного млекопитающего, отличного от человека, и очистку представляющего интерес белка из молока.
Изобретение также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя получение гена, который кодирует указанный представляющий интерес белок, клонирование гена в плазмиде, при этом ген оперативно связывают с промотором, который будет управлять экспрессией гена в клетках млекопитающего, получая в результате экспрессирующую плазмиду, трансфекцию соматических клеток, необязательно фибробластов, плазмидой, для того чтобы включить плазмиду в геном указанных соматических клеток, получая трансгенные соматические клетки, удаление ядра из зрелого ооцита, с получением энуклеированного ооцита, слияние одной трансгенной соматической клетки с энуклеированным ооцитом, с получением одноклеточного эмбриона, имплантацию эмбриона в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Изобретение, кроме того, также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя извлечение соматических клеток из организма самки млекопитающего, которая является трансгенной по продукции указанного представляющего интерес белка в молоке, необязательно фибробластов, удаление ядра из зрелого ооцита, с получением энуклеированного ооцита, слияние одой трансгенной соматической клетки с энуклеированным ооцитом, с получением одноклеточного эмбриона, имплантацию эмбриона в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Изобретение также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции указанного представляющего интерес белка в молоке, искусственное оплодотворение млекопитающего спермой, полученной от самца нетрансгенного млекопитающего, отличного от человека, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Изобретение также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя суперовуляцию самки млекопитающего, отличного от человека, которая является трансгенной по продукции указанного представляющего интерес белка в молоке, искусственное оплодотворение млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции указанного представляющего интерес белка, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Изобретение также относится к способу получения представляющего интерес белка у трансгенного млекопитающего, отличного от человека, полученного способом, включающим в себя суперовуляцию самки нетрансгенного млекопитающего, отличного от человека, искусственное оплодотворение млекопитающего спермой, полученной от самца млекопитающего, отличного от человека, который является трансгенным по продукции указанного представляющего интерес белка, чтобы получить эмбрионы, сбор эмбрионов, имплантацию эмбрионов в матку готового к оплодотворению млекопитающего и мониторинг беременности вплоть до рождения трансгенного млекопитающего.
Трансгенными млекопитающими, характеризующимися продукцией неожиданно высоких уровней представляющего интерес белка в их молоке, могут быть, без ограничения, животные вида крупного рогатого скота. Другими видами трансгенных млекопитающих могут быть, без ограничения, вид свиней, вид овец, вид коз или вид грызунов. Представляющим интерес белком, без ограничения, может быть гормон роста человека.
Изобретение, кроме того, относится к трансгенному млекопитающему, отличному от человека, относящемуся к виду крупного рогатого скота, который продуцирует рекомбинантный гормон роста человека в молоке, геном которого содержит интегрированную плазмиду, при этом указанная плазмида содержит ген гормона роста человека и промотор бета-казеина, который управляет экспрессией указанного гена в клетках молочной железы млекопитающего.
Изобретение, кроме того, относится к трансгенному млекопитающему, которое продуцирует неожиданно высокие уровни hGH, однако не наблюдается физического роста, ожидаемого при таком высоком уровне продукции hGH. Так как трансгенный крупный рогатый скот подвергается влиянию присутствия гормона роста человека, можно предполагать, что животные могли бы расти со скоростью, превышающей скорости роста нетрансгенных животных, и страдать в результате от таких состояний как сахарный диабет, гипертония, повышенный риск сердечно-сосудистого заболевания и укрупнение органов тела, включая печень, селезенку, почки и сердце. Такие высокие уровни hGH теоретически должны делать животное нежизнеспособным. Однако дело обстоит не так. Млекопитающее, такое как корова, с опасно высокими уровнями чужеродного гормона в крови, но которая имеет прекрасное здоровье и имеет превосходную производительность рекомбинантного белка, составляет неожиданный изобретательский вклад.
Рекомбинантный гормон роста человека согласно изобретению продуцируется на неожиданно высоких уровнях. Уровень продуцируемого гормона роста человека составляет примерно более 1,0 г/л молока. Уровень hGH может быть более примерно 2,0 г/л молока. Уровень продуцируемого hGH также может примерно превышать 3,0 г/л молока. В другом варианте продуцируемый уровень hGH может составлять примерно более 4,0 г/л молока. В еще одном варианте уровень продуцируемого hGH может составлять примерно более 5,0 г/л молока. В следующем варианте уровень продуцируемого hGH может составлять примерно более 6,0 г/л молока. В следующем варианте уровень продуцируемого hGH составляет примерно от 1,0 г/л молока до 7,0 г/л молока. В следующем варианте уровень продуцируемого hGH составляет примерно от 2,0 г/л молока до 6,0 г/л молока. В другом варианте уровень продуцируемого hGH составляет примерно от 2,0 до 5,0 г/л молока.
Кроме того, изобретение относится к способу очистки рекомбинантного гормона роста из молока трансгенного млекопитающего, а также к анализам указанного гормона. Способы очистки могут включать в себя стадии хроматографии и концентрирования. Можно использовать различные типы хроматографии, и они включают в себя ионообменную хроматографию, обращенно-фазовую хроматографию, молекулярную эксклюзионную хроматографию или аффинную хроматографию. Ионообменная хроматография может представлять собой анионообменную хроматографию. Аффинная хроматография может представлять собой иммуноаффинную хроматографию. Кроме того, могут быть осуществлены многократные стадии хроматографии.
Изобретение, кроме того, относится к способу очистки рекомбинантного гормона роста из молока трансгенного млекопитающего, отличного от человека, которое продуцирует рекомбинантный гормон роста, включающему в себя осветление молока трансгенного млекопитающего, отличного от человека, с получением осветленного молока и осуществление хроматографии осветленного молока, с получением в результате очищенного рекомбинантного гормона роста.
Изобретение, кроме того, относится к способу очистки рекомбинантного гормона роста из молока трансгенного млекопитающего, отличного от человека, которое продуцирует рекомбинантный гормон роста, включающему в себя осветление молока трансгенного млекопитающего, отличного от человека, с получением осветленного молока, осуществление хроматографии осветленного молока посредством анионообменной хроматографии с использованием увеличенного слоя, с получением материала, подвергнутого анионообменной хроматографии, осуществление обращенно-фазовой хроматографии материала, подвергнутого анионообменной хроматографии, с получением материала, подвергнутого обращенно-фазовой хроматографии, осуществление анионообменной хроматографии материала, подвергнутого обращенно-фазовой хроматографии, с получением материала, подвергнутого анионообменной хроматографии, осуществление молекулярной эксклюзионной хроматографии материала, подвергнутого анионообменной хроматографии, с получением материала, подвергнутого молекулярной эксклюзионной хроматографии, концентрирование материала, подвергнутого молекулярной эксклюзионной хроматографии, с получением концентрированного материала и осуществление молекулярной эксклюзионной хроматографии концентрированного материала, с получением очищенного рекомбинантного гормона роста.
Изобретение также относится к способу очистки рекомбинантного гормона роста из молока трансгенного млекопитающего, отличного от человека, которое продуцирует рекомбинантный гормон роста, включающему в себя осветление молока, полученного от трансгенного млекопитающего, с получением осветленного молока, осуществление иммуноаффинной хроматографии осветленного молока с получением материала, подвергнутого иммуноаффинной хроматографии, осуществление обращенно-фазовой хроматографии материала, подвергнутого иммуноаффинной хроматографии, с получением материала, подвергнутого обращенно-фазовой хроматографии, осуществление анионообменной хроматографии материала, подвергнутого обращенно-фазовой хроматографии, с получением материала, подвергнутого анионообменной хроматографии, осуществление молекулярной эксклюзионной хроматографии материала, подвергнутого анионообменной хроматографии, с получением материала, подвергнутого молекулярной эксклюзионной хроматографии, осуществление концентрирования материала, подвергнутого молекулярной эксклюзионной хроматографии, с получением концентрированного материала и осуществление молекулярной эксклюзионной хроматографии концентрированного материала с получением очищенного рекомбинантного гормона роста.
Рекомбинантным гормоном роста в описанных выше способах очистки без ограничения может быть гормон роста человека. Трансгенным млекопитающим без ограничения может быть млекопитающее вида крупного рогатого скота.
Следующие примеры являются иллюстративными, но не ограничивающими способ и композиции согласно настоящему изобретению. Другие подходящие модификации и адаптации множества условий и параметров, обычно встречающихся при ферментативном получении химических веществ и в способах очистки белка, которые очевидны для специалистов в данной области, составляют сущность изобретения и входят в объем изобретения.
ПРИМЕР 1
Конструирование экспрессирующих плазмид
Авторы создали конструкцию, несущую большую часть промотора гена бычьего бета-казеина, включая короткий фрагмент 5'-некодирующей области гена бета-казеина, слитую с кодирующей последовательностью гена гормона роста человека. Область бета-казеина, используемую в различных конструкциях, уменьшали от 3,8 т.п.н. до примерно 1,3 т.п.н. Ген hGH охватывает примерно от 2 до 2,2 т.п.н., в зависимости от того, включен ли внутренний сигнал полиA.
Экспрессирующую кассету размещали в полилинкере обычного вектора для клонирования типа pUC или pBS.
Указанный промотор обеспечивает тканеспецифическую и регулируемую в развитии экспрессию генов под его контролем, подобных бета-казеину, и в данном случае гетерологичного hGH.
Наиболее типичной плазмидой является pRβhGH, которая несет полноразмерный промотор бычьего бета-казеина, слитый с кодирующей последовательностью гена гормона роста человека.
Другие описанные конструкции главным образом получают из исходной плазмиды, которая указана так, чтобы улучшить селекцию трансфицированных клеток или повысить эффективность интеграции ДНК в геном бычьей клетки.
В начальный период осуществляли котрансфекцию плазмидой, содержащей ген резистентности к генетицину, способствуя селекции, но затем использовали другие конструкции, несущие ген NPT резистентности к неомицину в том же самом векторе, содержащем кассету экспрессии hGH. Примером такой плазмиды является плазмида pRNeo.
Получали другую плазмиду для конститутивной экспрессии зеленого флуоресцирующего белка, которая содержит промотор CMV, энхансер растительного происхождения (альфа-альфа) и ген зеленого флуоресцирующего белка из медузы A. victoria. Примером такой плазмиды является плазмида pRNeoGreen.
Кроме этого, создавали другую плазмиду. Плазмиду конструировали на основе плазмиды, содержащей ген резистентности Neo, в которую встраивали область модифицированного более короткого промотора бета-казеина выше области, кодирующей hGH. Данная плазмида представляет собой плазмиду pVEβcashGH.
Создавали другие конструкции, в которых область β-лактамазы вырезали посредством рестрикции ApaLI, и линейный фрагмент, содержащий полную экспрессирующую кассету, очищали после электрофореза в агарозном геле и экстрагировали из геля.
Конструкции анализировали, используя ферменты рестрикции и секвенирование ДНК, и их способность вызывать экспрессию hGH предварительно тестировали в линии клеток молочной железы, используя узнавание флуоресцирующим антителом.
Получение плазмиды pVEβcashGH будет подробно описано в виде примера в данной части, посвященной генетическим конструкциям.
Получение pVEβcashGH
Целью данной конструкции является получение минимального удлинения области промотора бета-казеина для управления специфично регулируемой транскрипцией гена hGH, слитого непосредственно далее вместе с е