Способ диагностики немелкоклеточного рака легкого и набор для его осуществления
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности онкологии, и молекулярной биологии и касается способа диагностики немелкоклеточного рака легкого и набора для его осуществления. Сущность изобретения включает способ диагностики немелкоклеточного рака легких гена NPRL2, основанный на измерении содержания мРНК методом ПЦР в режиме реального времени и набор для его осуществления. Сниженное содержание мРНК в предположительно пораженной раком ткани человека по сравнению с ее уровнем в здоровой ткани служит диагностическим признаком немелкоклеточного рака легкого. Преимущество изобретения заключается в разработке способа, позволяющего с высокой достоверностью диагностировать немелкоклеточный рак легкого, в первую очередь плоскоклеточный рак, в том числе на самой ранней стадии прогрессии опухолевой трансформации. 2 н. и 5 з.п. ф-лы, 3 табл., 4 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности онкологии, и молекулярной биологии и может быть использовано для ранней диагностики немелкоклеточного рака легкого (НМРЛ), в первую очередь плоскоклеточного рака легкого (ПКРЛ).
Уровень техники
Рак легкого (РЛ) остается одной из основных причин смерти онкологических больных в мире. Смертность от этого заболевания превышает смертность от рака молочной железы, толстой кишки и простаты, вместе взятых [Jemal A., Siegel R., Ward Е., Murray Т., Xu J., Smigal С., Thun M.J. 2006. Cancer statistics. CA Cancer J Clin. 56, 6-30]. В России показатели смертности от рака легкого у мужчин 68,2 случая на 100 тысяч населения, у женщин - 6,8 случая [Заридзе Д.Г. 2004. Эпидемиология и этиология злокачественных новообразований, стр.29-85 - в кн. Канцерогенез / под ред. Д.Г.Заридзе. - М.: Медицина]. Различают два основных вида РЛ: мелкоклеточный (МРЛ) и немелкоклеточный (НМРЛ), составляющих 15-20 и 75-80% соответственно. К НМРЛ относят плоскоклеточный рак легкого (ПКРЛ), аденокарциному легкого (АК) и крупноклеточный рак. Среди разных форм РЛ по частоте встречаемости ПКРЛ занимает первое место, АК - второе.
Диагноз в половине случаев НМРЛ устанавливают на далеко зашедшей стадии опухолевого процесса, что делает малоэффективным радикальное излечение. Современные методы лечения повышают среднюю пятилетнюю продолжительность жизни больных НМРЛ не более чем на 15%. Этот показатель может быть существенно улучшен с помощью разработки методов ранней диагностики.
Основными методами диагностики РЛ служат инструментальные - рентгеновские и эндоскопические. Используют также анализ мокроты на атипичные клетки, биопсию тканей легких, компьютерную томографию, флуоресцентную фиброскопию. Иммунологические методы диагностики находят пока ограниченное клиническое применение. Практическую значимость имеет определение опухолевых маркеров: СЕА - раково-эмбриональный антиген - онкомаркер рака прямой кишки, но может использоваться в оценке РЛ; NSE - нейрон-специфическая энолаза - в ряде случаев используют в оценке состояния пациентов с РЛ; тканевой полипептидный антиген (ТРА) - фрагмент цитокератина, более специфичный маркер РЛ. Эти маркеры применяют для контроля лечения, выявления рецидивов, но не для диагностики РЛ на ранней стадии. Для диагностики НМРЛ широко используют маркеры SCCA или SCC -антиген плоскоклеточной карциномы (SCC - squamous cell carcinoma) и фрагмент цитокератина 19 (CYFRA 21.1 - cytokeratin fragment) [Pastor A., Menendez R., Cremades M.J., Pastor V., Llopis R., Aznar J. 1997. Diagnostic value of SCC, CEA and CYFRA 21.1 in lung cancer: a Bayesian analysis. Eur Respir J. 10, 603-609; Buccheri G., Torchio P., Ferrigno D. 2003. Clinical Equivalence of Two Cytokeratin Markers in Non-small Cell Lung Cancer. A Study of Tissue Polypeptide Antigen and Cytokeratin 19 Fragments. Chest. 124, 622-632], которые, однако, малопригодны для ранней диагностики РЛ.
Диагностическими признаками злокачественной трансформации клеток могут служить также изменения генома в опухолевых клетках - точечные мутации в кодирующих и регуляторных участках генов, микросателлитная нестабильность, аллельные потери, изменение содержания мРНК генов, метилирование промоторных участков генов и др., а также изменения функциональной активности многих генов. В отличие от белковых, молекулярно-генетические маркеры обладают значительно большей чувствительностью. В числе перспективных потенциальных маркерных генов, вовлеченных в канцерогенез разных форм РЛ, рассматривают новые гены, потенциальные супрессоры опухолевого роста (TSG, tumor suppressor genes) на коротком плече хромосомы 3 человека [Zabarovsky E.R., Lerman M.I., Minna J.D. 2002. Tumor Suppressor Genes on Chromosome 3p Involved in the Pathogenesis of Lung and Other Cancers. Oncogene. 21, 6915-6935; Киселев Л.Л., Сенченко В.Н., Опарина Н.Ю., Брага Э.А., Забаровский Е.Р. 2005. Гены-супрессоры опухолевого роста, локализованные на коротком плече хромосомы 3 человека. Молекулярная медицина. 3, 17-28]. Цитогенетический район 3р21 по сравнению с другими обогащен белок-кодирующими генами [Bertone P., Stole V., Royce T.E., Rozowsky J.S., Urban A.E., Zhu X., Rinn J.L., Tongprasit W., Samanta M., Weissman S., Gerstein M., Snyder M. 2004. Global identification of human transcribed sequences with genome tiling arrays. Science. 24, 2242-46]. С целью идентификации новых TSG проведено детальное картирование геми- и гомозиготных делеций на 3p при мелкоклеточном и немелкоклеточном РЛ и других карциномах человека с использованием различных методов [Брага Э.А., Киселев Л.Л., Забаровский Е.Р. 2004. От идентификации геномного полиморфизма к диагностическим и прогностическим маркерам эпителиальных опухолей. Молекулярная биология. 38, 145-154]. Полученные данные подтвердили существенную роль генов из района 3р21 в канцерогенезе, как и предполагали ранее [Zabarovsky E.R., Lerman M.I., Minna J.D. 2002. Tumor suppressor genes on chromosome 3p involved in the pathogenesis of lung and other cancers. Oncogene. 21, 6915-35]. В критичной области LUCA (3р21.3), для которой характерна высокая частота делеций в вышеперечисленных опухолях, картирован участок гомозиготных делеций, содержащий 17 генов [Zabarovsky E.R., Lerman M.I., Minna J.D. 2005. Chromosome 3 abnormalities in lung cancer. In: Lung Cancer: Principles and Practice. Third Edition. Lippincott Williams & Wilkins, Philadephia. 118-134]. В число этих генов входит ген NPRL2 (PubMed ID: 11085536. другие обозначения: tumor suppressor candidate 4 - TUSC4, NPR2, NPR2L, G21) протяженностью 3.3 т.п.н., содержащий 11 экзонов и кодирующий основной транскрипт длиной 18 т.п.н. с множественными сплайсированными изоформами, которые экспрессируются во всех нормальных тканях, включая ткани легкого [Lerman M.I. and Minna J.D. 2000. The International Lung Cancer Chromosome 3р21.3 Tumor Suppressor Gene Consortium. The 630-kb lung cancer homozygous deletion region on human chromosome 3р21.3: identification and evaluation of the resident candidate tumor suppressor genes. Cancer Res. 60: 6116-6133; Li J., Wang F., Haraldson K., Protopopov A., Duh F.M., Geil L., Kuzmin I., Minna J.D., Stanbridge E., Braga E., Kashuba V.I., Klein G., Lerman M.I., Zabarovsky E.R. 2004. Functional characterization of the candidate tumor suppressor gene NPRL2 located in 3p21.3C. Cancer Res. 64(18): 6438-43]. Главный продукт, кодируемый геном NPRL2, - растворимый белок ядерной локализации, состоящий из белок-связывающего домена, имеющего сходство с коровым доменом белка MutS и домена, регулирующего пермеазу азота, осуществляющую транспорт азота через клеточные мембраны. Белок NPRL2 может быть вовлечен в процесс репарации неспаренных оснований в ДНК, регуляции клеточного цикла и активации путей апоптоза [Zabarovsky E.R., Lerman M.I., Minna J.D. 2005. Chromosome 3 abnormalities in lung cancer. In: Lung Cancer: Principles and Practice. Third Edition. Lippincott Williams & Wilkins, Philadephia. 118-134].
Эти функции относят к ключевым для нормального функционирования клетки и ее нарушение, несомненно, важное звено в канцерогенезе.
Для выявления супрессорной активности белковых продуктов TSG, т.е. способности к частичному или полному подавлению роста опухолевых клеток, существует несколько методов [Брага Э.А., Киселев Л.Л., Забаровский Е.Р. 2004. От идентификации геномного полиморфизма к диагностическим и прогностическим маркерам эпителиальных опухолей. Молекулярная биология. 38, 145-154; Ito I., Ji L., Tanaka F., Saito Y., Gopalan B., Branch C.D., Xu K., Atkinson E.N., Bekele B.N., Stephens L.C., Minna J.D., Roth J.A., Ramesh R. 2004. Liposomal vector mediated delivery of the 3p FUS 1 gene demonstrates potent antitumor activity against human lung cancer in vivo. Cancer Gene Therapy. 11, 733-739]. Сравнительно новый функциональный тест GIT (Gene Inactivation Test) основан на инактивации TSG в опухолевых клетках in vivo и in vitro. Инактивация TSG осуществляется с помощью эукариотических векторов с регулируемой экспрессией, при этом тестируемые гены подвергаются мутациям или делециям в экспериментальных опухолях у иммуннодефицитных SCID-мышей или в опухолевых клеточных линиях. Потеря способности к подавлению роста опухолевых клеток мутантными трансгенами может служить свидетельством принадлежности гена к TSG. «Супрессорная» активность гена NPRL2 показана in vivo и in vitro по отношению к клеткам мелкоклеточного и немелкоклеточного рака различными методами, в том числе с помощью GIT [Li J., Wang F., Haraldson К., Protopopov A., Duh F.M., Geil L., Kuzmin I., Minna J.D., Stanbridge E., Braga E., Kashuba V.I., Klein G., Lerman M.I., Zabarovsky E.R. 2004. Functional characterization of the candidate tumor suppressor gene NPRL2 located in 3p21.3C. Cancer Res. 64(18): 6438-43].
Данные по количественной оценке содержания мРНК гена NPRL2 при развитии НМРЛ и в том числе ПКРЛ практически отсутствуют. Таким образом, до последнего времени детальное сравнение содержания мРНК этого гена в опухолях легкого и нормальных тканях легкого не проводилось.
Согласно данным литературы снижение содержания мРНК показано для нескольких генов при НМРЛ. В работе [Terauchi К., Shimada J., Uekawa N., Yaoi Т., Maruyama M., Fushiki S. 2006. Cancer-associated loss of TARSH gene expression in human primary lung cancer. J. Cancer Res. din. Oncol. 132, 28-34] выявлено уменьшение транскрипции гена TARSH, одного из генов, связанных со старением клеток, в опухолевых клеточных линиях и образцах НМРЛ по сравнению с нормой. На основе полученных результатов авторы выдвинули предположение о возможном использовании этого гена в качестве биомаркера для диагностики НМРЛ. Однако в данной работе проведен анализ только 8 образцов ПКРЛ - наиболее распространенной формы РЛ, и необходимы дальнейшие исследования.
Изобретение, предлагающее способ диагностики различных карцином человека, в том числе РЛ, а также лимфом и лейкемий, основано на выявлении цитогенетических изменений и аллельных потерь для 10 генов-супрессоров опухолевого роста, расположенных в критичной области LUCA хромосомы 3, в том числе и NPRL2 [Ji L., Minna J., Roth J., Lerman M. Chromosome 3p21.3 genes are tumor suppressors. 2002. Международные патенты № WO 0204511, № US 2004016006].
Изобретение, относящееся к способу диагностики рака молочной железы, толстой кишки, мочевого пузыря, основано на обнаружении повышения содержания мРНК множественных сплайсированных форм гена поверхностного гликопротеина CD44 в опухолевых тканях, соответствующих метастазах и биоптатах по сравнению с нормальными тканями, предполагает проведение ПЦР с радиоактивно меченными праймерами [Tarin D., Matsumura Y. Diagnostic method. 1994. Международный патент № WO 94/02633].
Изобретение, предлагающее способ диагностики лимфом, основано на сравнении относительного содержания мРНК генов легких λ- и κ- иммуноглобулинов, вовлеченных в развитие лимфом, методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) [Stalberg A., Kubista M. Method to measure gene expression ratio of key genes. 2002. Патент №20004100112 РФ, международный патент № WO 02/099135 A1].
В работе [Cheng M., Chen Y., Yu X., Tian Z., and Wei H. 2008. Diagnostic utility of LunXmRNA in peripheral blood and pleural fluid in patients with primary non-small cell lung cancer. BMC Cancer. 8, 156] методом ПЦР в реальном времени (с использованием абсолютных измерений по стандартной кривой) оценили уровень mRNA генов LunX, СК19, СЕА, VEGF-C and hnRNP A2/B1 в периферической крови и плевральной жидкости у больных с диагнозом НМРЛ, рак пищевода, молочной железы и у здоровых добровольцев. В крови мРНК гена LunX обнаружили в 75.0% (33/44) больных только с НМРЛ. Помимо этого мРНК всех других генов обнаружили как у всех исследованных больных, так и здоровых людей. Содержание мРНК гена LunX уменьшалось у больных после лечения. Сделан вывод, что уровень мРНК гена LunX - специфический маркер для рака легкого, который может иметь применение для диагностики НМРЛ. Данный аналог наиболее близок по технической сущности заявленному изобретению и принят за прототип.
В указанных выше, а также других изобретениях не использовали снижение содержания мРНК гена NPRL2, в том числе с использованием метода ПЦР-РВ, для диагностики рака легкого.
Для оценки содержания мРНК генов используют различные методы. Современный высокочувствительный метод ПЦР-РВ отличается от традиционных качественных и полуколичественных методов тем, что позволяет быстро и точно определить количество копий ДНК или кДНК в широком диапазоне концентраций [Livak K.J., Flood S.J., Marmaro J., Giusti W., Deets K. 1995. Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization. PCR Methods Appl.4, 357-362]. Метод широко используют в мире, как для научных, так и клинических целей, благодаря высокой производительности, обычно проводят 96 реакций в одном опыте и в последних моделях приборов - 384 реакции. В отличие от обычной ПЦР, когда количество продуктов определяют на конечной стадии реакции, ПЦР-РВ позволяет следить за накоплением продуктов в экспоненциальной фазе реакции. В этой системе наряду с праймерами используют зонд (пробу), меченный флуоресцентным красителем. Зонд является олигонуклеотидом, который гибридизуется с последовательностью ДНК/кДНК между двумя фланкирующими праймерами. ПЦР-РВ состоит из двух основных этапов: 1) гибридизации исследуемой матрицы с зондом и 2) ПЦР, катализируемой TaqДHK-полимеразой, обладающей 5'-экзонуклеазной активностью, расщепляющей зонд, что приводит к появлению и нарастанию флуоресцентного сигнала. Обычно реакция продолжается около 2 часов (40 циклов), в приборах нового поколения - всего 40 мин. Результаты анализа становятся доступными сразу после завершения реакции. На мировом рынке представлены различные модели приборов для ПЦР-РВ, разработанные известными фирмами-изготовителями - Applied Biosystems, Bio-Rad, Invitrogene, Eppendorf и др., а также отечественные приборы ДТ-322 (ДНК-Технология), АНК-32 (Институт Аналитического Приборостроения РАН, http://www.syntol.ru/productank.htm).
Несмотря на широкое использование ПЦР-РВ, основного метода количественной оценки содержания мРНК генов на сегодняшний день, в России этот метод еще не получил достаточного распространения как в фундаментальных исследованиях, так и в клинике. Основная причина, ограничивающая его использование, - относительно высокая стоимость приборов и реактивов. Обнадеживает появление на отечественном рынке недорогих приборов, разработанных российскими фирмами, а также недорогих отечественных наборов реактивов («Синтол», «ДНК-Технологии», «Изоген» и др.), сравнимых по эффективности с зарубежными наборами [Манзенюк О.Ю., Малахо С.Г., Пехов В.М., Косорукова И.С., Полтараус А.Б. Характеристика универсальных отечественных наборов реагентов для ПЦР в реальном времени. Опыт использования в молекулярной онкодиагностике. 2006. Молекулярная биология. 40, 349-356].
Методики и протоколы, описанные в данном изобретении, предполагают, в основном, использование отечественных наборов и, хотя выполнены на приборе ABI Prism 7000 (Applied Biosystems, США), могут быть адаптированы для отечественных приборов. Сочетание недорогих приборов и отечественных наборов реактивов позволит сделать доступным этот технологичный метод для отечественных научных и клинических лабораторий.
Из изложенного ясно, что изменение содержания мРНК в качестве молекулярного маркера для диагностики эпителиальных опухолей, и в частности РЛ, пока не нашло широкого практического применения в клиниках. В данной области существует настоятельная потребность в поиске новых диагностических маркеров РЛ, позволяющих достоверно и уже на ранних стадиях диагностировать заболевание, а также в разработке на их основе простого, чувствительного, надежного, применимого в условиях клинических или поликлинических медицинских учреждений способа диагностики РЛ, в частности НМРЛ.
Раскрытие изобретения
Данное изобретение стало возможным в результате проведенного авторами сравнительного анализа содержания мРНК гена NPRL2 в различных опухолевых тканях легкого на разных этапах злокачественного перерождения и открытия того факта, что уже ранние стадии развития злокачественной трансформации сопровождаются значительным снижением содержания мРНК гена NPRL2.
Настоящее изобретение в своем первом аспекте относится к новому маркеру для диагностики немелкоклеточного рака легкого (НМРЛ), который представляет собой изменение содержания мРНК гена NPRL2. Снижение содержания мРНК гена в предположительно пораженных раком тканях легкого человека по сравнению с его содержанием в нормальных/здоровых тканях служит диагностическим маркером различных типов НМРЛ, в первую очередь плоскоклеточного рака легкого (ПКРЛ).
В одном из воплощений рак легкого, маркером которого является снижение содержания мРНК гена NPRL2, является немелкоклеточным раком легкого.
В своем следующем аспекте настоящее изобретение относится к применению изменения содержания мРНК гена NPRL2 в качестве маркера для диагностики немелкоклеточного рака легкого человека.
В одном из воплощений рак легкого, в отношении которого изменение содержания мРНК гена NPRL2 служит в качестве диагностического маркера, является плоскоклеточным раком легкого.
В еще одном аспекте настоящее изобретение относится к способу диагностики немелкоклеточного рака легкого, в первую очередь плоскоклеточного рака легкого. Данный способ включает следующие стадии:
а) получение исходной пары образцов тканей от пациента, где один из образцов получен из предположительно пораженных раком тканей, а второй получен из прилегающих гистологически нормальных (условно-нормальных) тканей;
б) выделение и очистка препаратов РНК из исходной пары образцов;
в) синтез одноцепочечной или двуцепочечной кДНК на матрице РНК с использованием олигонуклеотидных праймеров;
г) нормирование концентрации кДНК NPRL2 по контрольному гену, содержание мРНК которого относительно постоянно в норме и опухоли;
д) проведение количественной или полуколичественной реакции амплификации фрагмента гена NPRL2 с использованием кДНК, полученной на стадии в), в качестве матрицы и пары геноспецифичных олигонуклеотидных праймеров и зонда (в случае ПЦР-РВ);
е) сравнение количества амплифицированного фрагмента ДНК NPRL2 в образце, полученном из предположительно пораженных раком тканей легкого, с количеством амплифицированного фрагмента ДНК в образце, полученном из нормальных тканей, где указанные количества амплифицированного фрагмента ДНК отражают содержание мРНК гена NPRL2, причем его уменьшение служит диагностическим маркером рака легкого.
В одном из воплощений заявленный способ предназначен для диагностики плоскоклеточного рака легкого.
В одном из воплощений способа изобретения на стадии в) олигонуклеотидные праймеры, используемые для синтеза одноцепочечной или двуцепочечной кДНК, выбирают из числа олиго(dT)-содержащих праймеров, случайных гексамеров, или их комбинации, а также геноспецифичных праймеров.
В следующем воплощении способа настоящего изобретения для амплификации кДНК на стадии д) используют олигонуклеотидные праймеры и зонд, подобранные таким образом, что они специфически гибридизуются с кДНК даже в присутствии в препарате примеси геномной ДНК.
В отдельном предпочтительном воплощении данного изобретения последовательность праймеров и зонда представлена SEQ ID NO: 1, 2 и 3.
В еще одном воплощении способа настоящего изобретения на стадии д) количественная или полуколичественная реакция амплификации фрагмента гена NPRL2 представляет собой ПНР в реальном времени или ОТ-ПЦР.
В одном воплощении заявленного способа на стадии г) в качестве контрольного гена используют ген GAPDH, кодирующий белок глицеральдегид-3-фосфат-дегидрогеназу.
Еще одним аспектом настоящего изобретения является набор праймеров и зонда для осуществления полимеразной цепной реакции с целью определения содержания мРНК гена NPRL2, имеющих последовательности SEQ ID NO: 1, 2 и 3.
Перечень чертежей
Далее изобретение будет более подробно раскрыто со ссылкой на отдельные иллюстративные примеры и чертежи, где
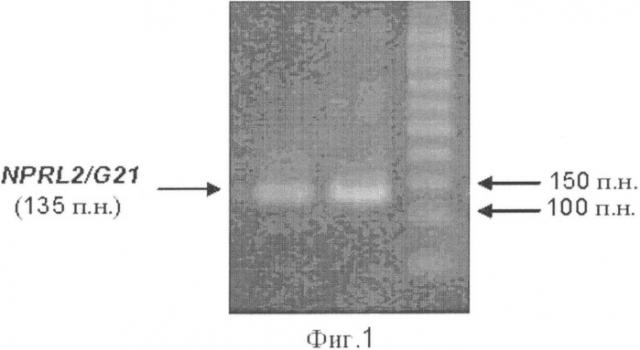
Фиг.1. Электрофоретическое разделение в 2%-ном агарозном геле продукта ПЦР-РВ - транскрипта гена NPRL2 (размер 135 п.н.). 1-я и 2-я дорожки транскрипт гена NPRL2 ожидаемого размера в норме и опухоли, 3-я дорожка - М50, маркер молекулярных масс ДНК от 50 до 500 п.н. («Лаборатория Изоген»).
Фиг.2. Изменение порогового цикла Ct, отражающего начальное содержание мРНК контрольного гена GAPDH в норме (N) и опухоли (Т). Рассчитанные значения величины R (относительного содержания мРНК с учетом полученных Ct, см. формулу) для гена GAPDH не превышало 1.5-2 раз (Р<0.05) как в опухоли, так и норме, что свидетельствует о незначительной вариабельности содержания мРНК и приемлемости этого гена для нормирования данных ПЦР-РВ.
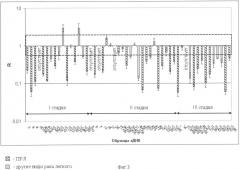
Фиг.3. Относительное содержание мРНК гена NPRL23 (R) в различных гистологических типах РЛ (см. формулу). Значение R, равное 1, соответствует отсутствию изменений содержания мРНК исследуемого гена в опухоли по сравнению с нормой, нормированных относительно данных для контрольного гена GAPDH. Пунктиром показана вариабельность содержания мРНК для гена GAPDH. Значения R, равные 0.1 и 0.01, соответствуют снижению содержания мРНК в 10 и 100 раз соответственно. Как видно, снижение содержания мРНК гена RBSP3 обнаружено в большинстве исследованных образцов.
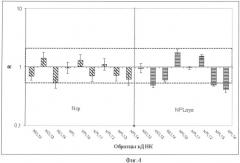
Фиг.4. Относительное содержание мРНК гена NPRL2 (R) в образцах тканей легкого центральной и периферической локализаций от здоровых доноров: NCL(10-14), NPL(10-14) и пула NPL, рассчитанное относительно усредненной условной нормы Ncp от 14 пациентов с диагнозом НМРЛ (левая часть чертежа), а также относительно пула NPL (правая часть чертежа). Как видно из чертежа, содержание мРНК гена в нормальных тканях варьировало не значительно, что показывает приемлемость использования условных норм в качестве образцов сравнения при количественных изменениях методом ПЦР-РВ, а также дополнительных образцов сравнения от здоровых доноров и/или их пулов.
Осуществление изобретения
В данном изобретении предложен способ диагностики немелкоклеточного рака легких (НМРЛ) методом ПЦР в режиме реального времени, в первую очередь плоскоклеточного рака легкого (ПКРЛ), основанный на измерении содержания мРНК гена NPRL2, а также набор для осуществления этого способа. Это простой и надежный способ диагностики ПКРЛ, а также других типов НМРЛ на разных стадиях развития злокачественной трансформации, включая начальные. Достоверно обнаруживаемое различие в содержании мРНК гена NPRL2 в нормальных и опухолевых тканях может быть использовано для обнаружения рака легкого.
Образцы тканей легких для анализа
В качестве образцов для проведения анализа могут быть использованы биоптаты, пунктаты, в том числе материал, полученный при бронхоскопии с прямой биопсией (центральный рак легкого) и трансторакальной (чрезкожной) пункции опухоли (периферический рак).
Выделение РНК из образцов тканей легких
Способы выделения суммарной РНК из образцов тканей млекопитающих хорошо известны специалистам и, как правило, включают следующие стадии: измельчение в жидком азоте образцов опухолевых и нормальных тканей, лизис клеток, выделение РНК и ее очистку, проверку качества РНК электрофорезом в 1%-ном агарозном геле в присутствии красителя бромида этидия или в денатурирующем полиакриламидном геле, а также спектрофотометрическое определение количества РНК. Гомогенизацию кусочков тканей можно проводить вручную, растирая пестиком в керамической ступке, или с помощью механических гомогенизаторов, например, Omni Mixer или Micro-Dismembrator U фирмы Sartorius (Германия). Для выделения РНК могут быть использованы различные протоколы, широко известные специалистам в данной области. В классических методах выделения РНК используют сильные хаотропные агенты, такие как гуанидинхлорид и гуанидинизотиоцианат, растворяющие белки, и последовательные экстракции фенолом и хлороформом для денатурации и удаления белков [Sambrook J., Fritsch E.F., Maniatis Т., Molecular Cloning. A laboratory Manual. 2nd Edition ed. 1989, Cold Spring Harbour: CSHL Press]. Широко используют также метод с использованием реагента Trizol [GIBCO/Life Technologies]. Для предотвращения разрушения РНК ферментами РНКазами могут быть использованы ингибиторы, такие как ингибитор RNAsin плацентарного или рекомбинантного происхождения или, например, ванадил-рибозидный комплекс - неспецифический ингибитор РНКаз широкого спектра действия.
Быстрое и качественное выделение РНК можно проводить с использованием ряда коммерчески доступных наборов (Клоноген, Санкт - Петербург; RNeasy kits (Qiagen); SV Total RNA Isolation System, Promega (США) и т.д.). Использование различных приборов, например, QuickGene-810 (Life Science, Япония), позволяет исключить работу с агрессивными агентами, ускорить и упростить выделение РНК. Для экстракции РНК в этом приборе используют 80 мкм пористую мембрану, которая в 12,5 раз тоньше обычно используемого в таких приборах стеклянного фильтра (1000 мкм), что позволяет уменьшить деградацию РНК и увеличить ее выход.
Реакция обратной транскрипции: синтез кДНК на матрице РНК, выделенной из образцов тканей легких, перевод в двуцепочечную форму
Реакция обратной транскрипции, в результате которой на РНК-матрице синтезируют одноцепочечную цепь ДНК, при необходимости, с достройкой второй цепи, позволяет перейти от нестабильных молекул РНК к более стабильным молекулам ДНК. Дальнейшая ПЦР-амплификация позволяет использовать очень малые количества исходной РНК (на уровне нескольких нанограмм), а следовательно, и количества исследуемых легочных тканей, из которых выделяют РНК.
Реакцию обратной транскрипции можно проводить с использованием коммерчески доступных препаратов обратных транскриптаз, таких как обратная транскриптаза вируса лейкоза мышей Молони (M-MLV), вируса миелобластоза птиц (AMV), PowerScript (точечная мутация M-MLV-RT), С.Therm Polymerase и др., с помощью которых можно получать продукты амплификации длиною до нескольких тысяч и даже несколько десятков тысяч пар нуклеотидов (т.п.н.). Может быть использована термостабильная ДНК-полимераза Thermus thermophilus (Tth), обладающая обратной транскриптазной активностью в присутствии ионов Mn2+.
Для обратной транскрипции могут быть использованы различные праймеры, например:
1) Олиго(dT)n-содержащие праймеры связываются с эндогенным полиА-хвостом на 3'-конце мРНК (число n обычно равно 12-18, но может достигать и большей величины). Эти праймеры наиболее часто используют для получения полноразмерных кДНК. К олиго(dT)-последовательности часто добавляют на 3'-конце нуклеотиды А, С или G, чтобы «заякорить» праймер на границу транскрипта и поли-А тракта;
2) Случайные гексануклеотидные праймеры (статистические затравки) гибридизуются с РНК в многочисленных участках. При обратной транскрипции с этими праймерами получают короткие кДНК. Случайные гексамеры используют для преодоления трудностей, связанных с вторичной структурой РНК, они более эффективны при обратной транскрипции 5'-областей мРНК;
3) Гексамеры или другие короткие олигонуклеотиды (10-12 нуклеотидов) случайного состава могут быть также использованы в комбинации с олигоdT-содержащими праймерами;
4) Специфические олигонуклеотидные праймеры используют для транскрипции участка мРНК, представляющего интерес для исследования. Эти праймеры успешно применяют для диагностических целей.
Анализ транскрипции генов можно проводить, используя одноцепочечную или двуцепочечную кДНК. Для синтеза второй цепи и ее амплификации наиболее часто используют специфичные праймеры. В продаже имеются наборы для синтеза кДНК, основанные на применении различных обратных транскриптаз и различных праймеров для затравки. Для получения кДНК разработан также SMART- метод (switching mechanism at the 5' end of RNA templates of reverse transcriptase), в основе которого лежит свойство обратных транскриптаз добавлять на 3'-конец синтезированной первой цепи кДНК несколько нуклеотидных остатков, преимущественно dC. Эта олиго(dC)-последовательность служит местом отжига олигонуклеотидного адаптера, имеющего комплементарную олиго(dG)-последовательность на 3'-конце. Обратная транскриптаза воспринимает праймер как продолжение РНК-матрицы и продолжает синтез первой цепи [Schmidt W.M., Mueller M.W. 1999. CapSelect: a highly sensitive method for 5' CAP-dependent enrichment of full-length cDNA in PCR-mediated analysis of mRNAs. Nucleic Acids Res. 27, e31]. Таким образом, первая цепь кДНК оказывается фланкирована с одной стороны последовательностью 3'-праймера с олиго(dT) на 3'-конце, а с другой - последовательностью, комплементарной адаптеру. Эти праймеры имеют одинаковые внешние последовательности, отличаясь только на 3'-конце. Затем первую цепь амплифицируют в ПЦР с праймером, соответствующим внешней части 3'-праймера и адаптера. Нуклеотидную последовательность общей части этих праймеров подбирают в зависимости от дальнейших целей, например получения клонотек, применения вычитающей гибридизации и т.д. В результате получают двуцепочечную ДНК, обогащенную полноразмерными последовательностями. За счет использования адаптера с заблокированным 3'- концом достигается существенное снижение фоновой амплификации. При использовании модифицированного SMART-метода за короткое время происходит амплификация исходного материала более, чем в 105 раз, что позволяет работать с очень небольшими количествами РНК (меньше 1 нанограмма), а следовательно, и с небольшим количеством исследуемых тканей [Zhu Y.Y., Machleder Е.М., Chenchik A., Li R., Siebert P.D. 2001. Reverse transcriptase template switching: a SMART approach for full-length cDNA library construction. Biotechniques 30, 892-897]. Наборы для получения кДНК этим способом выпускают различные фирмы, например, Евроген, Россия (набор MINT), Clontech, США и т.п.
Выбор специфических праймеров и зондов
Выбор специфических праймеров и зондов осуществляют способом, хорошо известным специалистам в данной области, для чего используют имеющиеся программы, многие из которых находятся в свободном доступе в Интернете. Среди таких программ можно упомянуть Oligo (версия 6.42), PrimerSelect из пакета Lasergene (www.dnastar.com). Primer Express (Applied Biosystems, USA), Primer Designer (ИМБ), FastPCR (http://www.biocenter.helsinki.fi/bi/Programs/fastpcr.htm), PrimerQuest (http://scitools.idtdna.com/Primerquest/) и др. Высокая специфичность ПЦР-РВ обеспечивается за счет использования зонда, содержащего на 5'-конце флуорофор или флуоресцентный краситель (в данном случае, FAM - 6-carboxy-fluoroscein), а на 3'-конце - т.н. гаситель (в данном случае - DABCYL - 4-(dimethylammoazo)benzene-4-carboxylic acid). В процессе ПЦР взаимодействие FAM и DABCYL нарушается за счет расщепления зонда Taq ДНК полимеразой, благодаря ее 5'-экзонуклеазной активности, при этом происходит эмиссия флуоресценции, регистрируемая прибором. Подбор зондов для проведения ПЦР-РВ осуществляется в соответствии со стандартными рекомендациями и требованиями метода (протоколы фирмы Applied Biosystems, http://docs.appliedbiosystems.com).
В предпочтительном воплощении используют праймеры и зонд:
NPRL2_F (SEQ ID NO: 1) 5'-GGACCTCACTACACAACAAATCCTG-3';
NPRL2_R (SEQ ID NO: 2) 5'-GTCACAACGCCGTAGTACAGCA-3';
NPRL2_Z (SEQ ID NO: 3) 5'-[FAM]-ACATCCAGAAGATTTCAGCAGAG-
GCAGAT-[Dabcyl]-3'.
Анализ содержания мРНК гена NPRL2 методом ПЦР-РВ
Количественная оценка содержания мРНК достигается с помощью параллельного проведения ПЦР-РВ с тестируемым и контрольным образцами. В качестве внутреннего контроля, относительно которого проводилось нормирование продуктов амплификации исследуемого гена NPRL2, выбран «ген домашнего хозяйства» - GAPDH, кодирующий глицеральдегид-3-фосфат-дегидрогеназу. Согласно предпочтительной форме осуществления количественной оценки содержания мРНК генов необходимо выбрать контрольный ген, имеющий незначительную вариабельность содержания мРНК в опухолевых и нормальных тканях легкого по сравнению вариабельностью содержания мРНК исследуемых генов. Выбору подходящего контрольного гена для нормирования количественных данных посвящено много обзоров [Radonic A., Thuike S., Mackay I.M., Landt O., Siegert W., Nitsche A. 2004. Guideline to reference gene selection for quantitative real-time PCR. Biochem Biophys Res Commun. 313, 856-862; Huggett J., Dheda K., Bustin S., Zumla A. 2005. Real-time RT-PCR normalisation; strategies and considerations. Genes and Immunity. 6. 279-284; Wong M.L, Medrano J.F. 2005. Real-time PCR for mRNA quantification. BioTechniques. 39, 1-11]. Чаще всего в качестве контрольных выбирают гены «домашнего хозяйства», хотя для этой цели может быть использован любой ген с относительно постоянным содержанием мРНК в исследуемых образцах. Решение о выборе того или иного гена в качестве контрольного на самом деле зависит от степени выбранной/требуемой точности. В настоящем изобретении выбран традиционный и часто используемый контрольный ген GAPDH. Согласно данным литературы этот ген наиболее приемлем в качестве контрольного для образцов НМРЛ и нормальных тканей легкого [D.W.Liu, S.T.Chen, H.P.Liu. Choice of endogenous control for gene expression in nonsmall lung cancer. 2005. Eur. Respir.J. 26, 1002-1008]. Однако вариабельность содержания мРНК необходимо проверять для каждой исследуемой выборки образцов данного типа тканей.
Оценка содержания мРНК генов может быть основана на абсолютном и относительном измерении количества копий исследуемых транскриптов - абсолютный метод (метод стандартной кривой) и метод относительных измерений (ΔΔCt - метод, http://docs.appliedbiosystems.com/pebiodocs/04303859.pdf). Согласно предпочтительной форме осуществления количественной оценки содержания мРНК генов в качестве основного метода измерений выбран второй из них. Этот метод позволяет проводить двойное сравнение данных для исследуемого и контрольного генов в опухоли и норме и не требует выравнивания концентраций опухолевых и нормальных образцов РНК/кДНК, которое необходимо при использовании других методов, например ОТ-ПЦР.
Выбор образцов сравнения
Согласно предпочтительной форме осуществления количественной оценки содержания мРНК генов важно проверить пригодность образцов сравнения, в данном случае условных норм. «Условной нормой» принято считать образец ткани легкого с отсутствующими макро- и микроскопическими признаками опухолевого роста. При «непригодности» образца условно-нормальной ткани (т.е. в случаях, когда при микроскопии обнаруживали опухолевые клетки, или материал был трудно интерпретируемый) использовали дополнительные образцы сравнения, полученные от «здоровых» доноров (доноры, не страдавшие при жизни раком легкого) или усредненные нормы нескольких имеющихся условных норм.
Поскольку не для всех опухолевых образцов имелись пригодные парные условные нормы, расчеты относительного содержания мРНК гена NPRL2 (RкДНК) проводили, используя разные образцы сравнения - парные условные нормы, если они были, и усредненные условные нормы от нескольких больных, если парных норм не было. В качестве дополнительных образцов сравнения использовали по 5 образцов от здоровых доноров центральной и периферической локализации, для которых усредняли значение ΔCt=Ct(NPRL2)-Ct(GAPDH) и далее проводили расчеты RкДНК.
Учет эффективностей реакций
Согласно предпочтительной форме осуществления количественной оценки содержания мРНК генов необходимо учитывать эффективности проводимых реакций, которые могут оказать значительное влияние на конечный результат. Для этого разработана программа математической обработки экспериментальных данных ПЦР-РВ, позволяющая рассчитывать эффективность реакций. Программа совместима с файлами экспериментальных данных (Ct, ΔRn и др.) из программного обеспечения Applied Biosystems (ABI Prism SDS Software) и также позволяет проводить статистическую оценку достоверности измеряемых изменений и оценку пригодности выбранного контрольного гена.
Далее настоящее изобретение будет подробно проиллюстрировано со ссылкой на конкретные примеры, представляющие собой наиболее предпочтительные воплощения изобретения. Изобретение не ограничивается описанными воплощениями, напротив, предполагается, что оно включает любые альтернативы, модификации или эквиваленты, допустимые с учетом сущности и объема изобретения.
Пример 1. Образцы тканей легкого
Образцы тканей различных гистологических типов РЛ (Т), морфологически нормальные ткани, прилегающие к опухолям (т.н. условные нормы (N), а также нормальные ткани легких центральной (NCL) и периферической локализации (NPL) от скоропостижно скончавшихся доноров собраны и охарактеризованы независимо двумя различными группами сотрудников НИИ КО ГУ РОНЦ им Н.Н.Блохина РАМН. Клинический диагноз установлен с учетом данных ретроспективного анализа первичной медицинской документации больных, цито- и гистологических исследований биоптатов, полученных при фибробронхоскопии, трансторакальных пункциях) и операционного материала. Образцы тканей легкого (опухоль, условно-нормальная ткань) получены непосредственно после удаления опухоли. Каждый образец делили примерно на 3 равные части и хранили в жидком азоте. Общая коллекция опухолевых образцов, подлежащих исследованию, составила 52 (31+21) образца различных гистологических типов рака легкого, из которых 38 - плоскоклеточный рак, 11 - аденокарцинома легкого (3 - бронхиоло-альвеолярная аденокарцинома легкого, 1 - мелкоклеточный рак легкого, 1 - крупноклеточный рак легкого, 1 - карциноид), а также 50 образцов условной нормы. Кроме того, использовали ткани легких, полученные постмортально от 10 человек, не имевших в анамнезе заболеваний раком (норма): пять образцов, взятых в центральных областях легких, и пять - в периферических областях. «Морфологически нормальной» принято считать ткань, в которой при микроскопическом исследовании не определялись признаки клеточной атипии, ткань могла быть представленной клетками мерцательного эпителия, кубического эпителия, альвеолярными макрофагами, лимфоидными элементами. Средний возраст пациентов, среди которых 45 мужчин, 6 женщин, для 1 пациента - нет данных относительно пола и возраста, составляет около 60 лет (диапазон 31-76 лет). Диагноз в каждом случае устанавливали на основании результатов клинического, морфологического, эндоскопического и рентгенологического обследований. Все опухолевые образцы охарактеризованы согласно международной системе клинико-морфол