Способ получения клеточной матрицы кожи
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано в тканевой инженерии для формирования новой функциональной ткани необходимого типа. Культивируют стволовые плюрипотентные клетки подкожной жировой клетчатки и эмбриональные фибробласты раздельно в присутствии основного фактора роста фибробластов, который затем удаляют. Осуществляют совместное культивирование стволовых плюрипотентных клеток подкожной жировой клетчатки и эмбриональных фибробластов в культуральной среде, содержащей коллаген-хитозановую конструкцию, на которую сначала наносят эмбриональные фибробласты в полной питательной среде, затем на них наслаивают кондиционированную питательную среду и стволовые плюрипотентные клетки подкожной жировой клетчатки в полной питательной среде. Изобретение позволяет получить клеточную матрицу кожи in vitro, которая, благодаря присутствию в ней хитозанового биополимера, обладает свойствами, повышающими адгезию клеток, исключающими цитогенотоксичность подложки, и пригодна для прямой трансплантации. 3 з.п. ф-лы, 11 ил., 5 табл.
Реферат
Изобретение относится к биологии и медицине, а именно к клеточной биотехнологии и биоинженерии, трансплантологии, и может быть использовано для культивирования, пролиферации и дифференцировки стволовых клеток различного происхождения, культивирования и пролиферации их дифференцированных производных, а также для подготовки клеточных матриц с целью трансплантации и биоинженерии.
Тканевая инженерия развивается как альтернативная стратегия по отношению к ксено- и аллотрансплантатам, которые имеют естественные ограничения к использованию, например, различные осложнения у донора, риск передачи инфекционных заболеваний и иммунные реакции отторжения у реципиента. Цель тканевой инженерии - дать возможность клеткам, способным к запуску и поддержке процесса регенерации, сформировать новую функциональную ткань необходимого типа. Это может быть достигнуто с помощью подложки или матрицы, создающей геометрическую архитектурную форму новой ткани, которая затем может быть внедрена в организм конкретного пациента, или при индустриальных масштабах ex vivo (в биореакторе), с последующим повторным внедрением реконструированной ткани пациенту. Известны технические решения [1], где используют матрицы из инертных материалов (металлов, синтетических конструкций, керамики), покрытых природными биополимерами. Однако такие конструкции не являются биоразрушаемыми, используемые белковые рекомбинантные компоненты могут иметь иммуногенность при трансплантации. В большинстве случаев используется суспензия клеток в среде без твердой подложки или же в смеси с различными компонентами.
Ряд изобретений близок по составу к заявляемому решению, но в них материалы не использовали для культивирования стволовых мультипотентных клеток или дифференцированных клеток, а использовали как многослойную комбинированную повязку на рану [2] или сополимер винилового спирта, винилацетата и винилглутарата в виде порошка с размером частиц 10-1500 мкм [3], которые не включают в свой состав хитозан. В изобретениях [4, 5] описаны матрицы, включающие в свой основной состав, кроме коллагена, альгинат и хитозан, сополимер винилового спирта и винилацетата, сшитый глутаровым альдегидом, однако эти конструкции не использовали для культивирования клеток и предназначали для первичной обработки неповрежденной и поврежденной кожи.
Наиболее близкими к предлагаемому по составу являются матрицы [6], которые представляют собой субстрат с развитой поверхностью на основе коллагена, или желатина, или деминерализованного костного матрикса, которая производится в форме геля, измельченной губки, пленки и трехмерной конструкции, соответствующей дефекту соединительной ткани. Дополнительно в матрицу включают адгезионные белки, выбранные из группы энтегрин, фибронектин, ламинин, в концентрации от 0,1 до 100 мкг/мл, антисептики, выбранные из группы ионов металлов серебра, меди, золота, и антибиотики широкого спектра действия, факторы роста фибробластов, и/или трансформирующий фактор роста (ТФРα и ТФРβ), и/или фактор роста, выделяемый тромбоцитами, и/или фактор роста гепатоцитов в концентрации от 1 до 300 нг/мл, содержит клеточные культуры мононуклеаров костного мозга и (или) мультипотентных мезенхимальных стромальных клеток и (или) фибробластов человека. Однако предлагаемые матрицы для культивирования клеток не содержат коллаген-хитозанового комплекса с включенными в него компонентами полной и кондиционированной питательных сред, повышающими их биосовместимость, биодеградируемость, исключающих цито- и генотоксичность, предусматривают присутствие трансформирующего фактора роста (ТФР). Известные технические решения не позволяют культивируемые клетки переносить непосредственно для трансплантации вместе с матрицей. Пассирование клеток или их трансплантация осуществляются путем снятия их с подложки с применением процедуры обработки клеточной массы ферментами, которые повреждают поверхностные рецепторы при переносе и вызывают реакцию запрограммированной клеточной гибели.
Известные матрицы из полилактата, коллагена и полиэтиленгликоля [9] не имеют высоких гидрофобных и адгезионных свойств из-за отсутствия заряженных групп на поверхности биополимерной конструкции, что снижает прикрепление клеток к поверхности матрицы, трансплантаты готовят непосредственно перед использованием путем перемешивания всех компонентов.
Задача изобретения - повысить качество и стабильность культивирования, пролиферативную активность стволовых плюрипотентных клеток различного происхождения и их производных, исключить цито-генотоксичность клеточной подложки и обработку клеток ферментами в процессе пассирования при смене питательной среды, повысить прикрепление клеток к поверхности матрицы, обеспечить получение клеточной матрицы, пригодной для прямой трансплантации.
Задачу решают за счет того, что в качестве подложки используют коллаген-хитозановую конструкцию, содержащую полную и кондиционированную питательные среды без основного фактора роста фибробластов, на которую первоначально наносят эмбриональные фибробласты в полной питательной среде, после их прикрепления к конструкции на них наслаивают кондиционированную питательную среду, плюрипотетнтные клетки или их производные в полной питательной среде, при этом коллаген-хитозановая конструкция представляет собой губку, пленку, микросферы, волокна, кроме того, все клетки раздельно предварительно культивируют в присутствии основного фактора роста фибробластов, который затем удаляют, а для получения кондиционированной среды осуществляют культивирование эмбриональных фибробластов в полной питательной среде с последующим их удалением; культивирование при получении клеточной матрицы осуществляют в течение 72 часов.
Способ осуществляют следующим образом. На первом этапе проводили подготовку коллаген-хитозановых матриц «Коллахит-бол» [7, 8], которые предварительно замачивают в течение 20-30 минут в стерильном бикарбонатном буфере для понижения их кислотных свойств. После фазы нейтрализации матрицу в виде губки, пленки, микросфер или волокон промывают трижды стерильным фосфатным буфером Дульбекко, помещают во флаконы. На втором этапе осуществляют выделение и культивирование эмбриональных клеток различного происхождения (табл.1). Для этого получают культуру эмбриональных фибробластов из 7-10 дневных фетусов беспородных крыс. Культивирование клеток проводят при 37°С в среде ДМЕМ с добавлением 10% эмбриональной телячьей сыворотки (ЭТС), 100 мкг/мл канамицина сульфата, 1 мМ L-глутамина. Среду на третьи сутки собирают, фильтруют через 0,22 мкм ацетат-целлюлозный фильтр и в дальнейшем используют в качестве кондиционированной среды. Пересев клеток на новые культуральные матрасы проводят с помощью раствора Версена с целью получения клеточного монослоя. Далее клетки переносят на предварительно подготовленную на первом этапе коллаген-хитозановую конструкцию «Коллахит-бол», состоящую из 2% раствора ацетата коллагена, 2% раствора аскорбата хитозана молекулярной массы 100-700 kDa и степенью дезацетилирования свыше 95%, содержащего в своем составе аскорбиновую кислоту - 1,8 г/г сухого хитозана, хондроитинсерную кислоту - 5-100 мг/г сухого хитозана, D-глюкуроновую кислоту - 10-100 мг/г сухого хитозана, гепарин - 2,5-5 мг/г сухого хитозана и сывороточный фактор роста крупного рогатого скота «адгелон» - 11-220 мкг/г сухого хитозана. Одновременно с культивированием эмбриональных фибробластов осуществляют выделение стволовых клеток различного происхождения. Для этого получают стромальные (мультипотентные) клетки жировой ткани крысы (клетки из подкожной жировой ткани крысы после ее диспергирования). Для наращивания биомассы этих клеток используют среду ДМЕМ с добавлением 10% эмбриональной телячьей сыворотки (ЭТС), 100 мкг/мл канамицина сульфата, 1 мМ L-глутамина, в которую дополнительно добавляют еще 4 нг/мл основного фактора роста фибробластов (bFGF), 1 мМ раствор незаменимых аминокислот. Для получения и культивирования эмбриональных стволовых клеток первоначально для наращивания биомассы используют основную среду коДМЕМ с добавлением 10% SR, 100 мкг/мл канамицина сульфата, 1 мМ L-глутамина, 4 нг/мл основного фактора роста фибробластов (bFGF), 1 мМ раствор незаменимых аминокислот. Смену среды проводят ежедневно. Состояние колоний оценивают визуально с помощью микроскопа Olympus ВХ51. После пересева на матрицы клетки культивируют либо в кондиционированной среде (фильтрованной через 0,22 мкм ацетат-целлюлозный фильтр, сорбирующий белки), либо в основной среде в зависимости от поставленных задач. На третьем этапе для дифференцировки стволовых мультипотентных или эмбриональных стволовых клеток, например, в дермально-эпидермальном направлении их высевают на уже предварительно посаженные на коллаген-хитозановую конструкцию эмбриональные фибробласты кожи крысы в кондиционированную эмбриональными фибробластами среду со всеми добавками, кроме bFGF.
Оценка хромосомной стабильности фибробластов человека.
Для оценки хромосомной стабильности клеток используют первичную культуру эмбриональных фибробластов кожи 7 медицинских абортусов. Полученный после операции материал помещают в стерильные флаконы с 20-30 мл физ.раствора с антибиотиками. Получение первичной культуры эмбриональных фибробластов и последующую процедуру получения метафазных пластинок для кариотипирования проводят по стандартной методике [10], используя вместо плодных оболочек кожу абортусов.
Для опытов используют культуру эмбриональных фибробластов человека 3-го пассажа. Через день после посева на матрицы «Коллахит-бол» клетки переводят в среду ДМЕМ, содержащую 0,5% эмбриональную телячью сыворотку (ЭТС) и культивируют в течение 72 часов. В этих условиях клетки переходят в состояние пролиферативного покоя и культура синхронизируется. По истечении трех суток клетки переводят в среду, содержащую 10% ЭТС. Таким образом, на 5-й день культивирования клеток проводят кариотипирование. Фиксацию клеток для цитогенетических исследований осуществляют по стандартной методике с использованием 0,6% раствора цитрата натрия с целью гипотонии и фиксации (метанол/ледяная уксусная кислота в соотношении 3-1). Дифференциальное окрашивание препаратов хромосом осуществляют с помощью 0,1% раствора трипсина на фосфатном буфере и 4% раствора красителя Гимза [11]. Для получения изображений и анализа кариограмм используют флюоресцентный микроскоп «Olympus BX-51» и программные продукты «Applied Spectral Imaging» (USA).
Оценка физиологического состояния эмбриональных фибробластов крысы.
Для оценки физиологического состояния клеток после культивирования на матрице определяют такие параметры, как содержание внутриклеточного кальция и NAD(P)H, pH и микровязкость клеточных мембран. Для этого часть крысиных фибробластов снимают с флаконов 0,25% раствором трипсина на фосфатном буфере Дульбекко и через 24, 48, 72 часа в клетках определяют апоптоз с помощью Hoechst 33342 и Propidium iodide на микроскопе Olympus BX51 [12]. Концентрацию ионов
Са2+ [13,14], pH [14] и микровязкость мембран [15] определяют с помощью зондов Fura-2AM (2,5 мкМ) и флуоресцеина изотиоцианата изомера I (1 мг/мл), пирена (3 мкМ) соответственно. Содержание NAD(P)H [16] определяют по его собственной флуоресценции. Измерения проводят на спектрофлуориметре Aminco Bowman Series 2, Thermo Spectronic. Основные этапы экспериментов представлены в таблице 1.
| Таблица 1 | ||
| Условия культивирования эмбриональных клеток | ||
| Задачи эксперимента | Условия культивирования | Особые условия |
| Исследование апоптоза, содержания ионов кальция и pH | Опыт - фибробласты крысы на матрицах «Коллахит-бол» в среде ДМЕМ со всеми добавками. Контроль - фибробласты крысы во флаконах со средой ДМЕМ со всеми добавками. | Исследование запрограммированной гибели клеток через 24, 48 и 72 ч, а также более длительный срок |
| Исследования качественного и количественного хромосомного состава | Опыт - фибробласты человека на матрицах «Коллахит-бол» в среде ДМЕМ со всеми добавками. Контроль - фибробласты человека во флаконах со средой ДМЕМ со всеми добавками. | Исследование на 5-е сутки |
| Примечания: | ||
| 1. Получение первичной культуры фибробластов медицинских абортусов, ведение культуры до третьего пассажа в среде с 10% ЭТС. | ||
| 2. Посев на матрицы и синхронизация культур на третьем пассаже путем смены среды с 0.5% ЭТС и культивирование в ней 3-е суток (оценка апоптоза). | ||
| 3. Добавление ЭТС до 10% с целью стимуляции пролиферации и дифференцировки. | ||
| 4. Культивирование в течение 3-х суток (оценка физиологических показателей). | ||
| 5. Сбор материала на кариотипирование. |
Результаты исследований.
Запрограммированная клеточная гибель.
Посев на матрицы вызывал апоптоз фибробластов в культуре через 24 часа (52% апоптотических клеток). До обработки клеток в состоянии апоптоза было 16% (Р<0,05). В дальнейшем происходило уменьшение числа апоптотических клеток: через 48 часов до 36%, а через 72 часа до 8% (Р<0,05) (таблица 2). Пролиферация фибробластов возобновлялась и продолжалась в течение последующих 9 суток инкубации, количество клеток в апоптозе при этом уменьшалось практически до 0%. Доля клеток в некрозе практически не менялась на протяжении всего эксперимента и составляла в среднем 10%. Большой процент клеток в состоянии апоптоза, вероятно, связан со стрессом при пересеве клеток (различные условия) и обработкой раствором Версена.
Очевидно, что динамика таких показателей как Са2+ активные формы кислорода и pHin характеризует изменение функционального состояния клеток в ходе культивирования на матрицах. Поэтому одной из вспомогательных задач нашего исследования было определение показателей клеточного метаболизма.
| Таблица 2 | |
| Динамика числа клеток в состоянии апоптоза | |
| Доля клеток в апоптозе, % | |
| Контроль (отсутствие хитозановой матрицы) | 15±1,9 |
| 1 сутки культивирования на «Коллахит-бол» | 52±7** |
| 2 сутки культивирования на «Коллахит-бол» | 34±3* |
| 3 сутки культивирования на «Коллахит-бол» | 7,9±0,9** |
| 9 сутки культивирования на «Коллахит-бол» | 0,6±0,5* |
| 10 сутки культивирования на «Коллахит-бол» | 1,1±0,4 |
| 11 сутки культивирования на «Коллахит-бол» | 0 |
| Примечание: достоверность различий по сравнению с контролем * Р<0,05; ** Р<0,01. |
Уровень внутриклеточного кальция.
Известно, что внутриклеточный кальций является одним из вторичных мессенджеров, регулирующих процессы пролиферации, дифференцировки, апоптоза и др. [17, 18, 19, 20, 21, 22, 23, 24]. С другой стороны, известно, что нейтрализация кислородных радикалов подавляет пролиферацию [25, 26]. Более того, показано, что активные формы кислорода выступают в роли посредника между внеклеточным сигналом и внутриклеточными эффекторами. Именно они определяют уровень окислительно-восстановительного потенциала в клетке, регулирующего клеточный метаболизм, в том числе, уровень экспрессии генов [27]. Важнейшим свойством двухвалентных металлов, в первую очередь, кальция и магния является их способность взаимодействовать с отрицательно заряженными фосфатными остатками ДНК. При этом наибольшей аффинностью к ДНК обладает именно Са2+ [28]. Его взаимодействие с ДНК приводит к компактизации (фолдингу) хроматина, стабилизирует изолированные митотические хромосомы. Связывание кальция хелатными агентами приводит к нарушению прогрессии митоза, например, блокирует сепарацию сестринских хроматид в конце метафазы [20]. Увеличение концентрации внутриклеточного кальция - стимул к возобновлению клеточного цикла при оплодотворении [17, 22]. Свидетельства в пользу роли кальция в митозе получены многими исследователями [17, 19], в частности, велика его роль при переходе из метафазы в анафазу [17, 21, 29]. Периодические изменения концентрации кальция во время клеточного цикла стимулируются ассоциированными с клеточным циклом изменениями Са2+-мобилизирующего инозитол-(1,4,5)-трифосфата [30]. Искусственно вызванное увеличение концентрации кальция ускоряет переход в митоз.
До культивирования концентрация Са2+ в фибробластах была 12,4 нМ, а через 24 часа инкубации увеличивалась до 67 нМ (Р<0,01), возможно вследствие интенсификации апоптотических процессов. Однако через 2-е суток культивирования, несмотря на то, что количество клеток в апоптозе все еще оставалось достаточно большим, концентрация Са2+ в клетках была сравнима с контролем и составляла 12,3 нМ. При дальнейшем культивировании фибробластов на матрицах содержание кальция в клетках изменялось незначительно и составляло от 5,11 до 7,9 нМ (табл.3).
| Таблица 3 | |
| Изменение концентрации кальция в эмбриональных фибробластах | |
| Внутриклеточная концентрация Са2+, нМ | |
| Контроль (отсутствие хитозановой матрицы) | 11,39±3,11 |
| 1 сутки культивирования на матрице «Коллахит-бол» | 66,02±5,90** |
| 2 сутки культивирования на матрице «Коллахит-бол» | 12,3 5±2,70** |
| 3 сутки культивирования на матрице «Коллахит-бол» | 5,11±1,20 |
| 9 сутки культивирования на матрице «Коллахит-бол» | 4,26±1,50 |
| 10 сутки культивирования на матрице «Коллахит-бол» | 5,02±1,13 |
| 11 сутки культивирования на матрице «Коллахит-бол» | 7,9±2,0 |
| Примечание: ** достоверность различий по сравнению с контролем Р<0,01. |
Внутриклеточный уровень рН.
Величина рНin регулирует активность факторов, контролирующих экспрессию генов и клеточный цикл. Доказано, что снижение рНin тормозит G2/M переход клеточного цикла, а его повышение, наоборот, активирует [31, 32].
Na+/H+-обменник регулирует гомеостаз внутриклеточной рН и обладает разрешающим эффектом на запуск клеточной пролиферации [33]. Активация Nа+/Н+ обменника и возрастание pHin - ранние универсальные механизмы, ответственные за митогенную стимуляцию [34]. Стимуляция Na+/H+ обмена всегда приводит к защелачиванию, и, как следствие, в покоящихся клетках возникают рост-индуцирующие факторы [32]. Активированный белок р21 в отличие от неактивированного вызывает в мышиных фибробластах морфологическую трансформацию и клеточную пролиферацию, сопровождающуюся увеличением рНin [35]. Имплантация иммуннодефицитным мышам клеточной линии с мутациями Na+/H+-обменника вызывает опухолевый рост [36]. Механизм, обеспечивающий внутриклеточное защелачивание, - ключевое событие в онкогенной трансформации и необходим для развития и поддержания трансформированного фенотипа [31], поэтому контроль за внутриклеточной рН существенен с точки зрения возможности дальнейшего использования клеток, подвергавшихся культивированию на матрицах [33, 37].
Через 24 часа культивирование на матрицах «Коллахит-бол» вызывало закисление в фибробластах, однако рН восстанавливалась до контрольного значения через 72 часа (табл.4). Небольшого увеличения рНin достаточно для запуска перехода G2/M.
| Таблица 4 | |
| Изменение рН в фибробластах после добавления ингибитора метилазы и биосинтеза белка | |
| Внутриклеточная рН, условные единицы флуоресценции | |
| Контроль (отсутствие хитозановой матрицы) | 0,77±0,013 |
| 1 сутки культивирования на Коллахит-бол | 0,57±0,033** |
| 2 сутки культивирования на Коллахит-бол | 0,39±0,040** |
| 3 сутки культивирования на Коллахит-бол | 0,858±0,020** |
| 9 сутки культивирования на Коллахит-бол | 0,96±0,014* |
| 10 сутки культивирования на Коллахит-бол | 0,99±0,030 |
| 11 сутки культивирования на Коллахит-бол | 0,96±0,015 |
| Примечание: достоверность отличий по сравнению с контролем * Р<0,05; **Р<0,01 |
Хромосомная стабильность.
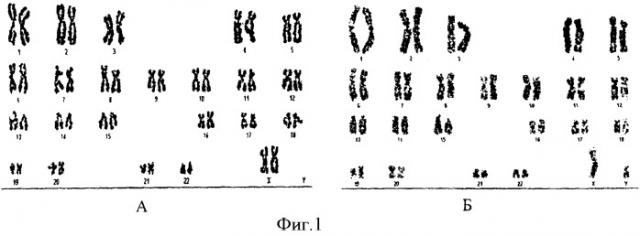
Исследование морфологии дифференциально окрашенных хромосом в культурах, культивируемых и не культивируемых на матрицах, показало, что данные коллаген-хитозановые матрицы в течение 5 суток не вызывали изменения числа хромосом и их морфологии (фиг.1). На фиг.1 отображен кариотип клеток первичной культуры фибробластов (А - контрольные интактные клетки, Б - клетки, культивированные на матрице «Коллахит-бол»).
Уровень окислительно-восстановительных реакций эмбриональных клеток.
Окислительно-восстановительный статус - один из рычагов, управляющих деятельностью клетки. Его состояние быстро и обратимо меняется при действии малых окисляющих молекул, к которым относятся активные формы кислорода (АФК). АФК образуются во всех типах клеток и как побочные продукты общего метаболизма, и как продукты деятельности специализированного ферментативного комплекса NADPH-оксидаза. В малых концентрациях (мкМ) АФК модулируют те же клеточные функции, что и многие естественные активаторы (рост, пролиферация, секреция, локомоция, фагоцитоз, синтез белков). При этом АФК действуют на те же звенья каскада сигналов, что и естественные активаторы, в частности на активность тирозинкиназ, фосфолипаз, МАР-киназ, ионных каналов плазматической мембраны и саркоплазматического ретикулума, на фосфорилирование белков по тирозину, концентрацию внутриклеточного Са2+, рН. Известно, что при изменении стационарных уровней АФК меняется соотношение окисленных и восстановленных форм глютатиона, NAD(P)+/NAD(P)H, FAD/FADH2, тиоредоксина и других редокс-активных соединений в клетке при том, что многие регуляторные пути и каскады зависят от редокс-потенциала цитоплазмы и окружающей клетку среды [38, 39]. Сам редокс-потенциал определяется балансом окислительно-восстановительных эквивалентов в динамическом равновесии, основную роль в котором играют 2 пары - NAD+/NADH и NADP+/NADPH, а метаболические волны NAD(P)H ответственны за реализацию передачи межклеточных сигналов [16] через образование АФК. Во-вторых, высокий уровень АФК ответственен за активацию ядерного фактора транскрипции NF-kB [40]. Суммируя все вышесказанное, можно утверждать, что при определенных условиях АФК способствуют клеточной пролиферации, и могут запускать апоптоз, а в других - активировать пролиферативные процессы. АФК в малых концентрациях модулируют клеточные функции, они образуются в клетках как побочные продукты общего метаболизма и деятельности NADPH-оксидазы. Культивирование эмбриональных фибробластов на матрицах «Коллахит-бол» в течение первых 48 часов не приводило к значительному увеличению содержания NAD(P)H в клетках (табл.5). В течение следующих 48 часов содержание NAD(P)H практически не менялось и было сравнимо со значением в контрольных фибробластах. Однако через 3 суток содержание NAD(P)H уменьшалось, что указывало на увеличение количества АФК в фибробластах.
| Таблица 5 | |
| Изменение содержания NAD(P)H в фибробластах | |
| Содержание NAD(P)H, условные единицы флуоресценции | |
| Контроль (отсутствие хитозановой матрицы) | 0,90±0,055 |
| 1 сутки культивирования на Коллахит-бол | 0,92±0,064 |
| 2 сутки культивирования на Коллахит-бол | 0,84±0,066 |
| 3 сутки культивирования на Коллахит-бол | 0,21±0,033* |
| 9 сутки культивирования на Коллахит-бол | 0,13±0,028 ** |
| 10 сутки культивирования на Коллахит-бол | 0,08±0,020** |
| 11 сутки культивирования на Коллахит-бол | 0,12±0,027** |
| Примечание: достоверность различий по сравнению с контролем * Р<0,05; ** Р<0,01. |
Микровязкость клеточных мембран.
При инкубации фнбробластов на матрицах микровязкость белок-липидных контактов была выше, чем в контроле (0,040±0,002 отн. ед. и 0,034±0,002 отн. ед., соответственно, Р<0,05), что могло приводить к ингибированию мембранных ферментов. 24- и 48-часовая инкубация фибробластов на коллаген-хитозановом комплексе приводила к сопровождающему пролиферацию уменьшению жесткости липидного бислоя мембран (0,12±0,01 отн. ед.) по сравнению с контролем (0,16±0,01 отн. ед., Р<0,05). Однако уже через 72 часа из-за увеличения уровня АФК и интенсификации перекисных процессов жесткость липидного бислоя мембран фибробластов увеличивалась до 0,15±0,01 отн. ед., Р<0,05. Таким образом, для использования, в качестве подложки для клеточных технологий коллаген-хитозановой конструкции необходима его предварительная нейтрализация в стерильном бикарбонатном буфере. Нанесение эмбриональных фибробластов на эту биополимерную конструкцию сопровождается в первые 24 часа культивирования временной адаптацией и увеличением их апоптотической активности. Культивирование в течение 72 часов на коллаген-хитозановой губке снижает существенно процессы запрограммированной клеточной гибели, увеличивает как пролиферацию, так и способность к дифференцировке клеток. Это свидетельствует об отсутствии цитотоксической реакции. Через трое суток культивирования эмбриональных фибробластов на коллаген-хитозановой губке основные физиологические показатели клеток: концентрация внутриклеточного кальция, рН, НАДН, вязкость мембран возвращаются в норму. Культивирование эмбриональных фибробластов на коллаген-хитозановой конструкции не приводит к возникновению хромосомных нарушений, выявляемых методом кариотипирования. Коллаген-хитозановая конструкция является благоприятной матрицей для культивирования, пролиферации и направленной дифференцирован стволовых клеток, выделенных из подкожно-жировой клетчатки эмбриона. Применение кондиционированной среды, полученной при культивировании эмбриональных фибробластов, в комплексе с коллаген-хитозановой конструкцией без искусственного добавления основного фактора роста фибробластов увеличивает пролиферативную активность как культуры самих эмбриональных фибробластов (фиг.2, 3), так и мультипотентных стволовых клеток. На фиг.2 показаны эмбриональные фибробласты. культивированные на матрице «Коллахит-бол» в свежей среде ДМЕМ со всеми добавками. На фиг.3 показано культивирование фибробластов на матрице «Коллахит-бол» в кондиционированной среде ДМЕМ со всеми добавками. Совместное культивирование на раневых покрытиях эмбриональных фибробластов и стволовых клеток подкожно-жировой клетчатки крысы формирует признаки дермально-эпидермального эквивалента кожи (фиг.4, 5), что может иметь прикладное значение для реконструкции пораженной или отсутствующей кожи. На фиг.4 показано культивирование мезенхимных стволовых клеток на слое эмбриональных фибробластов и матрице «Коллахит-бол» в среде для стволовых клеток с добавлением bFGF. На фиг.5 показано образование слоя кератиноцитов на слое эмбриональных фибробластов и матрице «Коллахит-бол» на 4-й день культивирования в среде для стволовых клеток без добавления bFGF. Таким образом, клеточная матрица с прочно прикрепленными эмбриональными и мультипотентными клетками пригодна к прямой трансплантации без ферментных и иных обработок для переноса клеточной массы.
Роль кондиционированной среды в регуляции дифференцировки клеток.
Известно, что культивируемые клетки секретируют в среду различные факторы (в том числе и ростовые), поддерживающие пролиферативную активность или состояние дифференцировки клеток. Использование кондиционированной клетками среды в качестве добавки к матрице может дать предпосылки для создания подложек для культивирования клеток разных типов, в том числе и стволовых. Для проверки этого предположения при культивировании фибробластов каждые третьи сутки отбирали среду ДМЕМ со всеми добавками. Эту кондиционированную среду фильтровали через фильтр 0,22 мкм, затем переносили во флакон с раневым покрытием «Коллахит-бол». В эту систему затем высевали мультипотентные клетки крысы. Оценивали возможность стволовых клеток дифференцироваться в кератиноциты в присутствии культивируемых на покрытии фибробластов.
Поддержание мультипотентности эмбриональных стволовых клеток (ЭСК)
Исследование морфологий колоний ЭСК показало, что культивирование на подложках может поддерживать в течение 7 суток нормальное морфологическое состояние колоний мультипотентных клеток, характерное для ЭСК человека. На фиг.6 показано культивирование эмбриональных стволовых клеток на матрице «Коллахит-бол». На фиг.7 демонстрируется культивирование эмбриональных стволовых клеток на «фидере» (питательном слое) из эмбриональных фибробластов мыши в стандартных условиях.
Иммуноцитохимическое исследование маркеров мультипотентности показало, что в эмбриональных стволовых клетках (ЭСК), культивируемых на матрице, экспрессируются ядерные белки oct-4 (фиг.8), TRA1-60 (фиг.9), cd30 (фиг.10) и антиген SSEA4 (флюоресцентное красное свечение) (фиг.11).
Таким образом, предлагаемый способ позволяет повысить качество и стабильность культивирования, поддерживать у стволовых плюрипотентных клеток нормальные уровни внутриклеточного кальция, рН, НАДН, вязкость мембран, пролиферативную активность, исключить цито-генотоксичность коллаген-хитозановой подложки, исключить на конечном этапе получения клеточной матрицы обработку клеток ферментами в процессе пассирования при смене питательной среды, повысить прикрепление клеток к поверхности матрицы, а следовательно, их потерю при пересеве на питательные среды благодаря присутствию в ней хитозанового биополимера, обеспечить получение клеточной матрицы, пригодной для прямой трансплантации.
ЛИТЕРАТУРА
1. Заявка на изобретение №95121756/13, МПК6 А61F 2/06, А61F 2/10, С12N 5/00, публ. 1998.05.27.
2. Патент РФ №2240140, МПК7 А61L 15/28, А61F 13/00, публ. 2004.11.20.
3. Патент РФ №2115436, МПК6 А61L 15/24, публ. 1998.07.20.
4. Патент РФ №2049480, МПК6 А61L 15/22, публ. 1995.12.10.
5. Патент РФ №2031646, МПК6 А61К 9/12, публ. 1995.03.27.
6. Заявка на изобретение №2006127271/15, МПК А61К 35/32, А61К 35/12, А61К 35/28, C12N 5/08/.
7. Патент РФ №2252787, МПК7 А61L 15/28, А61L 15/32, А61L 27/60, публ. 2005.05.27.
8. Патент РФ №2254145, МПК7 А61L 15/28, А61L 15/32, А61L 26/00, публ. 2005.06.20.
9. Швед Ю.А., Кухарем Л.В., Зорин И.М., Блинова М.И., Билибин А.Ю., Пинаев Г.П. Взаимодействие культивированных клеток кожи с разными структурными формами коллагена, нанесенного на полиллактидную матрицу. Цитология, 2007. - Т.49. - №1.-С.32-40.
10. Назаренко С.А., Васильева Е.О. Тест-система внешнего контроля качества цитогенетических исследований в учреждениях медико-генетической службы: Пособие для врачей. - Томск: «Печатная мануфактура», 2003. - 34 с.
11. Rooney D.E Human cytogenetics: constitutional analysis. Oxford University Press. 2001. 282 р.
12. Izumov D.S., Avetisyan A.V., Pletjushkina O.Yu. "Wages of Fear": transient threefold decrease in intracellular ATP level imposes apoptosis // Biochim. Biophys. Acta. - 2004. - V.1658. - P 141-147.
13. Grinkievich Y., Poenie M., Tsien R.I. A new generation of Ca2+ indicators with greatly improved fluorescence properties // J.Biol.Chem. - 1985. - V.260. - P.3440-3450.
14. Gore M.G. Spectrophotometry and spectrofluorimetry. Practical Approach. - New York: Oxford University Press Inc. - 2000. - 368.
15. Бордюшков Ю.Н., Горошинская И.А., Франциянц Е.М., Ткачева Г.Н., Горло Е.И., Нескубина И.В. Структурно-функциональные свойства мембран лимфоцитов и эритроцитов под воздействием переменного магнитного поля // Вопросы мед. химии. 2000. №1. - С.72-80.
16. Petty H.R., Kindzelskii A.L. Dissipative metabolic patterns respond during neutrophil transmembrane signaling // PNAS. Biophysics. - 2001. - V.98. - №6. - P.3145-3149.
17. Poenie M., Alderton J., Tsien R.Y., Steinhardt R.A. Changes of free calcium levels with stages of the cell division cycle // Nature. - 1985. - V.315. - P.147-149.
18. Fluck R.A., Miller A.L., Jaffe L.F. Slow calcium waves accompany cytokinesis in medaka fish eggs // J. Cell Biol. - 1991. - V.115. - P.1259-1265.
19. Tombes R.M., Simerly C., Borisy G.G., Schatten G. Meiosis, egg activation, and nuclear envelope breakdown are differentially reliant on Ca2+, whereas germinal vesicle breakdown is Ca2+ independent in the mouse oocyte // J. Cell Biol. - 1992. - V.117. - P.799-811.
20. Hepler P.K. The role of calcium in cell division // Cell calcium. - 1994. - V.16. - P.322-330.
21. Muto S., Kume Т., Inoue H., Okano K. Calcium waves along the cleavage furrows in cleavage-stage Xenopus embryos and its inhibition by heparin // J. Cell Biol. - 1996. - V.135. - P.181-190.
22. Stricker S.A. Comparative biology of calcium signaling during fertilization and egg activation in animals // Dev. Biol. - 1999. - V.211. - P.157-176.
23. Whitaker M., Larman M.G. Calcium and mitosis // Sem. Cell Dev. Biol. - 2001. - V.21. - P.53-58.
24. Azhar M., Kennady P.K., Pande G., Espiritu M., Hollowman W., Brazil D., Gomer R.H., Nanjundiah V. Cell Cycle phase, cellular Ca2+ and development in Dictyostelium discoideum // Int. J. Dev. Biol. - 2001. - V.45. - P.405-414.
25. Benhar M., Engelberg D., Levitzki A. ROS, stress-activated kinases and stress signaling in cancer // EMBO Rep. - 2002. - V.3. - P.420-425.
26. Laurent А. С. Niccol, С.Chéreaul, С.Goulvestrel, J. Alexandre, A. Alves, E. Lévy, F. Goldwasser. Y.Panis, O.Soubrane, B.Weill, F.Batteux. Controlling Tumor Growth by Modulating Endogenous Production of Reactive Oxygen Species // Cancer Res. - 2005. - V.65 - P.948-956.
27. O'Loghlen. M.I. Perez-Morgado, M.Salinas, M.E.Martin. Identification of a hydrogen peroxide-induced PP1-JNKl-Sp1 signaling pathway // Cellular Signalling. - 2006. - V.18. - P.21-31.
28. Strick R., Stissel P.L., Gavrilov K., Levi-Setti R. Cation-chromatin binding as shown by ion microscopy is essential for the structural integrity of chromosomes // J. Cell. Biol. - 2001. - V.155. P.899-910.
29. Snow P., Nuccitelli R. Calcium buffer injections delay cleavage in Xenopus laevis blastomeres // J. Cell Biol. - 1993. - V.122. - P.387-394.
30. Ciapa В., Pesando D., Wilding M., Whitaker M. Cell-cycle calcium transients driven by cyclic changes in inositol trisphosphate levels //Nature. - 1994. - V.368. - P.875-878.
31. Reshkin S.J., Bellizzi A., Caldeira S., Albarani V., Malanchi I., Poignee M., Alunni-Fabbroni M., Casavola V., Tommasino M. Na+/H+ exchanger-dependent intracellular alkalinization is an early event in malignant transformation and plays an essential role in the development of subsequent transformation-associated phenotypes // The FASEB Journal. - 2000. - V.14. - P.2185-2197.
32. Wakabayashi S., Shigekawa M., Pouyssegur J. Molecular physiology of vertebrate Na+/H+ exchangers // Physiol. Rev. - 1997. - V.77. - P.51-74.
33. Putney I.K., Barber D.L. Na-H Exchange-dependent Increase in Intracellular pH Times G2/M Entry and Transition // J.Biol. Chem. - 2003. - V.278 [45]. - P.44645-44649.
34. Putney L.K Denker S.P., Barber D.L. The changing face of the Na+/H+ exchanger, NHE1: structure, regulation, and cellular actions // Annu. Rev. Pharmacol. Toxicol. - 2002. - V.42. P.527-552.
35. Kaplan D.I.. Boron W.F. Long-term expression of c-H-ras stimulates Na-H and Na+-dependent Cl-НСО3 exchange in NIH-3T3 fibroblasts // J. Biol. Chem. - 1994. - V.269. - P.4116-4124.
36. Rotin D., Steele-Norwood D., Grinstein S., Tannock I. Requirement of the Na+/H+ exchanger for tumor growth // Cancer Res. - 1989. - V.49. - P.205-211.
37. Shrode I.D., Tapper H., Grinstein S. Role of intracellular pH in proliferation, transformation, and apoptosis // J. Bioenerg. Biomembr. - 1997. - V.29[4]. - P.393-399.
38. Den Hertog J., Groen F., van der Wijk T. Redox regulation of protein-tyrosine phosphatases // Arch. Biochem. Biophys. - 2005. - V.434. - P.11-15.
39. Forman H.I., Fukuto J.M., Torres M. Redox signaling thyol chemistry defines wich reactive oxygen and nitrogen species can act as second messengers // Am.J.Cell Physiol. - 2004. - V.287. - P.246-256.
40. Gupta A., S.F. Rosenberger, G.T.Bowden. Increased ROS levels contribute to elevated transcription factor and MAP kinase activities in malignantly progressed mouse keratinocyte cell lines // Carcinogenesis. - 1999. - V.20. - P.2063-2073.
1. Способ получения клеточной матрицы кожи, включающий:а) подготовку коллаген-хитозановой конструкции, которую нейтрализуют в стерильном бикарбонатном буфере, состоящую из 2% раствора ацетата коллагена, 2% раствора аскорбата хитозана молекулярной массой 100-700 кДа и степенью дезацетилирования свыше 95%, содержащего в своем составе аскорбиновую кислоту - 1,8 г/г сухого хитозана, хондроитинсерную кислоту - 5-100 мг/г сухого хитозана, D-глюкороновую кислоту - 10-100 мг/г сухого хитозана и сывороточный фактор роста крупного рогатого скота «адгелон» - 11-22 мкг/г сухого хитозана;б) предварительное культивирование стволовых плюрипотентных клеток кожи и эмбриональных фибробластов раздельно в присутствии основного фактора роста фибробластов, который затем удаляют;в) культивирование стволовых плюрипотентных клеток кожи в культуральной среде, содержащей подготовленную на стадии а) коллаген-хитозановую конструкцию, на которую сначала наносят эмбриональные фибробласты в полной питательной среде, затем после их прикрепления к конструкции на них наслаивают кондиционированную питательную среду и стволовые плюрипотентные клетки кожи в полной питательной среде с получением таким образом клеточной матрицы кожи.
2. Способ по п.1, отличающийся тем, что коллаген-хитозановая конструкция представляет собой губку, пленку, микросферы, волокна.
3. Способ по п.1, отличающийся тем, что получение кондиционированной среды осуществляют путем культивирования эмбриональных фибробластов в полной питательной среде с последующим их удалением.
4. Способ по п.1, отличающийся тем, что культивирование при получении клеточной матрицы кожи осуществляют в течение 72 ч.