Способ получения рекомбинантного мутантного цитохрома с
Иллюстрации
Показать всеИзобретение относится к биотехнологии. В частности, к способу получения рекомбинантного мутантного цитохрома с лошади. Данный способ осуществляют введением мутаций К27Е/Е69К/К72Е/К86Е/К87Е/Е90К или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К с помощью метода сайт-направленного мутагенеза, в ген цитохрома с лошади, который находится в составе плазмидной ДНК pBPCYCS/3. Далее проводят трансформацию штамма Escherichia coli JM-109 полученной рекомбинантной плазмидной ДНК, экспрессию и выделение целевого белка с помощью катионообменной и адсорбционной хроматографии. Изобретение позволяет использовать рекомбинантный мутантный цитохром с лошади в качестве тест-системы для измерения скорости генерации супероксида в мембранных препаратах. 3 ил.
Реферат
Изобретение относится к области биохимии, молекулярной биологии и биотехнологии. Может быть использовано для измерения скорости генерации супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с-редуктазной и цитохром с-оксидазной активностью, а также в медицинской биохимии для исследования роли супероксида в патогенезе нейродегенеративных заболеваний.
Цитохром с - небольшой белок с ковалентно присоединенной железопорфириновой группой. У эукариот цитохром с локализован на поверхности внутренней мембраны митохондрий, обращенной в межмембранное пространство. Основная его функция - участие в переносе электронов от убихинол: цитохром с-оксидоредуктазы (комплекс III) на цитохром с-оксидазу (комплекс IV) дыхательной цепи. Кроме того, известна его способность окислять супероксид . Мутантные варианты цитохрома с, лишенные дыхательной функции, но сохранившие способность окислять , являются потенциальной основой для создания тест-систем определения супероксида.
Известен способ получения цитохрома с лошади из ткани сердца (Dickerson R.E., Kopka M.L., Borders C.L., Varnum J., Weinzierl J.E., Margoliash E.A centrosymmetric projection at 4 Å of horse heart oxidized cytochrome с // J. Mol. Biol. 1967. Vol.29, pp.77-80).
Известен способ получения рекомбинантного цитохрома с лошади (Долгих Д.А., Латыпов Р.Ф., Абдуллаев З.Х., Колон В., Родер X., Кирпичников М.П. Экспрессия мутантных генов цитохрома с лошади в Escherichia coli // Биоорганическая химия, 1998. т.24, №10, с.756-759).
Однако цитохром с дикого типа, добавленный к митохондриальным препаратам (в частности, к субмитохондриальным частицам), восстанавливается в большей степени компонентами дыхательной цепи, чем супероксидом, и, следовательно, не может служить надежным агентом для количественного определения скорости генерации супероксида.
Известен способ получения частично ацетилированного цитохрома с (АсС), (Azzi A., Montecucco С., Richter С.The use of acetylated ferricytochrome c for the detection of superoxide radicals produced in biological membranes // Biochem. Biophys. Res. Commun. 1975. Vol.22, pp.597-603). Частично ацетилированный цитохром с получают путем химической реакции между цитохромом с и уксусным ангидридом. АсС обладает сниженной способностью к окислительно-восстановительным реакциям с компонентами дыхательной цепи митохондрий и микросом. АсС восстанавливается митохондриальными или микросомальными редуктазами и окисляется цитохромоксидазой с меньшими скоростями по сравнению с цитохромом с дикого типа, способность АсС к восстановлению супероксидом сохраняется.
Недостатком способа является то, что при ацетилировании цитохрома с уксусным ангидридом образуется достаточно гетерогенная смесь молекул цитохрома с с различным числом модифицированных лизиновых остатков. Реакционная способность цитохрома с по отношению к природным восстановителям и окислителям зависит от степени ацетилирования. При ацетилировании снижается общий положительный заряд цитохрома с, что ведет к снижению сродства к супероксиду. Неспецифическое взаимодействие АсС с с компонентами дыхательной цепи уменьшают добавлением фосфата или хлорида калия в сравнительно высоких концентрациях (до 100 мМ), однако, высокие концентрации К+ вызывают частичное разобщение дыхательной цепи, что ведет к снижению истинной скорости генерации супероксида. Перечисленные недостатки АсС приводят к низкой точности измерения скорости генерации супероксида при использовании АсС.
Изобретение решает задачу получения рекомбинантного мутантного цитохрома с лошади, обладающего низкой способностью к окислительно-восстановительным реакциям с компонентами дыхательной цепи.
Поставленная задача решается за счет способа получения рекомбинантного мутантного цитохрома с лошади, включающего введение мутаций K27E/E69K/K72E/K86E/K87E/E90K или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K с помощью метода сайт-направленного мутагенеза, основанного на полимеразной циклической реакции, в ген цитохрома с лошади, находящийся в составе плазмидной ДНК pBPCYCS/3, с последующей трансформацией штамма Escherichia coli JM-109 полученной рекомбинантной плазмидной ДНК, экспрессию и выделение целевого белка с помощью катионообменной и адсорбционной хроматографии.
Способ получения рекомбинантного мутантного цитохрома с лошади основан на конструировании мутантного гена цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K с аминокислотными заменами в сайте взаимодействия с окислительно-восстановительными партнерами дыхательной цепи: убихинол: цитохром с-оксидоредуктазой (комплекс III) и цитохром с-оксидазой (комплекс IV). За счет замены положительнозаряженных остатков лизина (К), окружающих гемовую впадину цитохрома с дикого типа, на отрицательные остатки глутаминовой кислоты (Е) достигается снижение способности к окислительно-восстановительным реакциям с комплексом III и комплексом IV. Используется подход направленного изменения поверхностных зарядов цитохрома с с целью «перемещения» сайта связывания от гемовой впадины к переферии. Для сохранения суммарного положительного заряда белка вне сайта взаимодействия вводятся обратные замены (E→K).
Плазмидную ДНК pBPCYCS/3 получают встраиванием по сайтам Xho I и ВатН I гена цитохрома с лошади (CYCS), полученного путем ПЦР с плазмиды рАВ, в плазмиду pBP(Xho 1/ВатН I)/CYC3 (Долгих Д.А., Латыпов Р.Ф., Абдуллаев З.Х., Колон В., Родер X., Кирпичников М.П. Экспрессия мутантных генов цитохрома с лошади в Escherichia coli // Биоорганическая химия, 1998. т.24, №10, с.756-759).
Плазмидная ДНК pBPCYCS/3 содержит мутантный ген цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K (SEQ ID NO 13) или K8E/E62K/E69K/K72E/K86E/K87E (SEQ ID NO 14), или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K (SEQ ID NO 15), встроенный между сайтами рестрикции Xho I и ВатН I, кодирующий синтез мутантного рекомбинантного белка цитохрома с K27E/E69K/K72E/K86E/K87E/E90K (SEQ ID NO 13) или K8E/E62K/E69K/K72E/K86E/K87E (SEQ ID NO 14) или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K (SEQ ID NO 15), промоторы lac и trc перед геном цитохрома с, ген bla, обеспечивающий синтез β-лактамазы (устойчивость к ампициллину), ген дрожжевой гем-лигазы (CYC3), кодирующий фермент, осуществляющий лигирование рекомбинантного цитохрома с с гемом бактериальных клеток.
Плазмидной ДНК pBPCYCS/3, содержащей мутантный ген цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K, трансформируют клетки бактерий Escherichia coli штамма JM-109. Проводят экспрессию целевого белка в бактериальных клетках, его выделение и очистку с помощью хроматографичеких методов (ионообменной хроматографии на MonoS и адсорбционной хроматографии на гидроксиапатите).
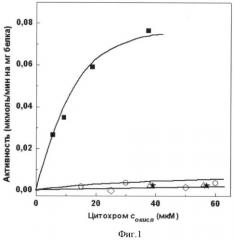
полученного мутантного цитохрома с лошади проводят окислительно-восстановительные реакции с комплексом III (сукцинат: цитохром с-редуктазная) и комплексом IV (цитохром с-оксидазная) дыхательной цепи митохондрий. Сукцинат: цитохром с-редуктазная активность митохондрий в присутствии АсС составляет 8% от активности в присутствии цитохрома с лошади дикого типа. Сукцинат: цитохром с-редуктазная активность митохондрий в присутствии мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K составляет 3% от активности в присутствии цитохрома с лошади дикого типа (фиг.1). Цитохром с-оксидазная активность митохондрий в присутствии АсС составляет 3% от активности в присутствии цитохрома с лошади дикого типа. Цитохром с-оксидазная активность митохондрий в присутствии мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K не выявлена (фиг.2).
Технический результат заявленного способа заключается в том, что полученный мутантный цитохром с лошади обладает способностью к окислительно-восстановительным реакциям с компонентами дыхательной цепи ниже по сравнению с АсС и может быть использован в качестве тест-системы для измерения скорости генерации супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с-редуктазной и цитохром с-оксидазной активностью.
Изобретение иллюстрируют фиг.1-3:
Фиг.1. Зависимость сукцинат: цитохром с-редуктазной активности митохондрий печени крысы, специфически обедненных по цитохрому с, от концентрации добавленных белков:
■ - цитохрома с лошади дикого типа, ○ - АсС, ◊ - мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K, Δ - мутантного цитохрома с лошади K8E/E62K/E69K/K72E/K86E/K87E, * - мутантного цитохрома с лошади K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K.
Фиг.2. Зависимость цитохром с-оксидазной активности митохондрий печени крысы, специфически обедненных по цитохрому с, от концентрации добавленных белков:
■ - цитохрома с лошади дикого типа, ○ - АсС, ◊ - мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K, Δ - мутантного цитохрома с лошади K8E/E62K/E69K/K72E/K86E/K87E, * - мутантного цитохрома с лошади K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K.
Фиг.3. Спектр поглощения цитохрома с лошади дикого типа (А) и мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K(Б).
Изобретение иллюстрируют примеры:
Пример 1. Конструирование мутантного гена цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K
Для введения мутаций K27E/E69K/K72E/K86E/K87E/E90K в ген лошадиного цитохрома с в составе экспрессионного плазмидного вектора pBPCYCS/3 используют метод сайт-направленного мутагенеза, основанный на полимеразной циклической реакции. Введение указанных мутаций осуществляют за четыре этапа.
На первом этапе для введения мутаций K86E/K87E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3, мутагенезная смесь в объеме 50 мкл содержит: 5 мкл буфера с MgSO4 для Pfu ДНК-полимеразы (Fermentas, Литва), 15 нг матричной (плазмидной) ДНК, по 125 нг прямого (SEQ ID NO 1) и обратного (SEQ ID NO 2) олигонуклеотидных праймеров, 2 мМ каждого из четырех дезоксинуклеотидтрифосфатов и 2.5 ед. акт. термостабильной Pfu ДНК-полимеразы (Fermentas, Литва). Поверх реакционной смеси наслаивают минеральное масло в объеме 30 мкл. Проводят 20 циклов реакции амплификации по следующей схеме: плавление матричной ДНК при 95°С (45 с), отжиг праймеров при 55°С (60 с) и элонгация полинуклеотидной цепи при 74°С (10 мин). Наработку мутантной ДНК контролируют при помощи электрофоретического анализа в 1%-ном агарозном геле. Для расщепления исходной метилированной плазмидной ДНК 19 мкл мутагенезной смеси обрабатывают 2.5 ед. акт. рестриктазы Dpn I в буфере В (Promega, США) в течение 1 ч при 37°С. Затем проводят трансформацию мутагенезной смесью клеток штамма E.coli XL I-Blue, наработку клеточной биомассы и выделение из нее плазмидной ДНК pBPCYCS/3-K86E/K87E. Определение нуклеотидной последовательности мутантной плазмидной ДНК pBPCYCS/3-K86E/K87E для установления факта введения мутаций проводят на автоматическом секвенаторе ABI Prism 3100-Avant Genetic Analyzer (Applied Biosystems, США).
На втором этапе проводят введение мутации E90K в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3-K86E/K87E по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 3 и SEQ ID NO 4.
На третьем этапе проводят введение мутации K27E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3-K86E/K87E/E90K по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 5 и SEQ ID NO 6.
На четвертом этапе проводят введение мутаций E69K/K72E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3 -K27E/K86E/K87E/E90K по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 7 и SEQ ID NO 8.
Результатом проделанной работы является рекомбинантная плазмидная ДНК pBPCYCS/3-K27E/E69K/K72E/K86E/K87E/E90K, содержащая ген цитохрома с K27E/E69K/K72E/K86E/K87E/E90K (SEQ ID NO 13), кодирующий мутантный цитохром с K27E/E69K/K72E/K86E/K87E/E90K (SEQ ID NO 13).
Пример 2. Конструирование мутантного гена цитохрома с лошади K8E/E62K/E69K/K72E/K86E/K87E
Для введения мутаций K8E/E62K/E69K/K72E/K86E/K87E в ген лошадиного цитохрома с в составе экспрессионного плазмидного вектора pBPCYCS/3 используют метод сайт-направленного мутагенеза, основанный на полимеразной циклической реакции. Введение указанных мутаций осуществляют за четыре этапа.
На первом этапе для введения мутаций K86E/K87E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3, мутагенезная смесь в объеме 50 мкл содержит: 5 мкл буфера с MgSO4 для Pfu ДНК-полимеразы (Fermentas, Литва), 15 нг матричной (плазмидной) ДНК, по 125 нг прямого (SEQ ID NO 1) и обратного (SEQ ID NO 2) олигонуклеотидных праймеров, 2 мМ каждого из четырех дезоксинуклеотидтрифосфатов и 2,5 ед. акт. термостабильной Pfu ДНК-полимеразы (Fermentas, Литва). Поверх реакционной смеси наслаивают минеральное масло в объеме 30 мкл. Проводят 20 циклов реакции амплификации по следующей схеме: плавление матричной ДНК при 95°С (45 с), отжиг праймеров при 55°С (60 с) и элонгация полинуклеотидной цепи при 74°С (10 мин). Наработку мутантной ДНК контролируют при помощи электрофоретического анализа в 1%-ном агарозном геле. Для расщепления исходной метилированной плазмидной ДНК 19 мкл мутагенезной смеси обрабатывают 2,5 ед. акт. рестриктазы Dpn I в буфере В (Promega, США) в течение 1 ч при 37°С. Затем проводят трансформацию мутагенезной смесью клеток штамма E.coli XL I-Blue, наработку клеточной биомассы и выделение из нее плазмидной ДНК pBPCYCS/3-K86E/K87E. Определение нуклеотидной последовательности мутантной плазмидной ДНК pBPCYCS/3-K86E/K87E для установления факта введения мутаций проводят на автоматическом секвенаторе ABI Prism 3100-Avant Genetic Analyzer (Applied Biosystems, США).
На втором этапе проводят введение мутаций E69K/K72E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3-K86E/K87E, по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 7 и SEQ ID NO 8.
На третьем этапе проводят введение мутации K8E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3-E69K/K72E/K86E/K87E, по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 9 и SEQ ID NO 10.
На четвертом этапе проводят введение мутации E62K в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3-K8E/E69K/K72E/K86E/K87E по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 11 и SEQ ID NO 12. Результатом проделанной работы является рекомбинантная плазмидная ДНК pBPCYCS/3 - K8E/E62K/E69K/K72E/K86E/K87E, содержащая ген цитохрома с K8E/E62K/E69K/K72E/K86E/K87E (SEQ ID NO 14), кодирующий мутантный цитохром с K8E/E62K/E69K/K72E/K86E/K87E (SEQ ID NO 14).
Пример 3. Конструирование мутантного гена цитохрома с K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K
Для введения мутаций K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K в ген лошадиного цитохрома с в составе экспрессионного плазмидного вектора pBPCYCS/3 используют систему сайт-направленного мутагенеза, основанный на полимеразной циклической реакции. Введение указанных мутаций осуществляют в шесть этапов.
На первом этапе для введения мутаций K86E/K87E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3, мутагенезная смесь в объеме 50 мкл содержит: 5 мкл буфера с MgSO4 для Pfu ДНК-полимеразы (Fermentas, Литва), 15 нг матричной (плазмидной) ДНК, по 125 нг прямого (SEQ ID NO 1) и обратного (SEQ ID NO 2) олигонуклеотидных праймеров, 2 мМ каждого из четырех дезоксинуклеотидтрифосфатов и 2,5 ед. акт. термостабильной Pfu ДНК-полимеразы (Fermentas, Литва). Поверх реакционной смеси наслаивают минеральное масло в объеме 30 мкл. Проводят 20 циклов реакции амплификации по следующей схеме: плавление матричной ДНК при 95°С (45 с), отжиг праймеров при 55°С (60 с) и элонгация полинуклеотидной цепи при 74°С (10 мин). Наработку мутантной ДНК контролируют при помощи электрофоретического анализа в 1%-ном агарозном геле. Для расщепления исходной метилированной плазмидной ДНК 19 мкл мутагенезной смеси обрабатывают 2,5 ед. акт. рестриктазы Dpn I в буфере В (Promega, США) в течение 1 ч при 37°С. Затем проводят трансформацию мутагенезной смесью клеток штамма Е.coli XL I-Blue, наработку клеточной биомассы и выделение из нее плазмидной ДНК pBPCYCS/3-K86E/K87E. Определение нуклеотидной последовательности мутантной плазмидной ДНК pBPCYCS/3-K86E/K87E для установления факта введения мутаций проводят на автоматическом секвенаторе ABI Prism 3100-Avant Genetic Analyzer (Applied Biosystems, США).
На втором этапе проводят введение мутации E90K в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3-K86E/K87E по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 3 и SEQ ID NO 4.
На третьем этапе проводят введение мутации K27E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3 - K86E/K87E/E90K по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 5 и SEQ ID NO 6.
На четвертом этапе проводят введение мутаций E69K/K72E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3 - K27E/K86E/K87E/E90K по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 7 и SEQ ID NO 8.
На пятом этапе проводят введение мутации K8E в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3 - K27E/E69K/K72E/K86E/K87E/E90K, по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 9 и SEQ ID NO 10.
На шестом этапе проводят введение мутации E62K в ген лошадиного цитохрома с, находящийся в составе плазмидной ДНК pBPCYCS/3 - K8E/K27E/E69K/K72E/K86E/K87E/E90K по схеме, описанной выше. Используют олигонуклеотидные праймеры SEQ ID NO 11 и SEQ ID NO 12. Результатом проделанной работы является рекомбинантная плазмидная ДНК pBPCYCS/3 - K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K, содержащая ген цитохрома с K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K (SEQ ID NO 15), кодирующий мутантный цитохром с K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K (SEQ ID NO 15).
Пример 4. Наработка и выделение мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K из биомассы клеток штамма Е.coli JM-109, содержащего рекомбинантную плазмидную ДНК pBPCYCS/3
Экспрессию мутантного гена цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K, находящегося в составе рекомбинантной плазмидной ДНК pBPCYCS/3-K27E/E69K/K72E/K86E/K87E/E90K осуществляют в штамме E.coli JM109 (Bortolotti C.A., Borsari M., Sola M., Chertkova R., Dolgikh D., Kotlyar A. and Facci P. Orientation-dependent kinetics of heterogeneous electron transfer for cytochrome с immobilized on gold: electrochemical determination and theoretical prediction // J. Phys. Chem. C. 2007. Vol.111, pp.12100-12105). Клетки, трансформированные плазмидной ДНК, содержащей мутантный ген, выращивают в жидкой питательной среде SB с ампицилином (конечная концентрация 200 мкг/мл) при 37°С и интенсивном перемешивании (250 об/мин) в течение 24 ч.
По окончании экспрессии гена мутантного цитохрома с клетки E.coli осаждают центрифугированием при 4000 g и 4°С в течение 20 мин. Надосадочную жидкость тщательно удаляют, а осадок ресуспендируют в 35 мл буфера А для MonoS (25 мМ Na2HPO4, 25 мМ NaH2PO4, 1 мМ NaN3, pH 6.0) и хранят при -20°С.
Гомогенизацию клеток осуществляют продавливанием под давлением 2000 psi на установке "French Press" (Spectronic Instruments, Inc., США). Клеточный дебрис осаждают центрифугированием при 100000 g в течение 20 мин.
Выделение и очистку целевого белка из полученного супернатанта проводят с использованием жидкостной хроматографической системы "BioLogic HR System" (BIO-RAD, США). Клеточный экстракт наносят на катионообменную колонку Mono S HR 10/10 (BIO-RAD, США), уравновешенную буфером А. Мутантный цитохром с элюируют линейным градиентом буфера В для MonoS (25 мМ Na2HPO4, 25 мМ NaH2PO4, 1 M NaCl, 1 мМ NaN3, pH 6.0) со скоростью 3 мл/мин.
Фракции, полученные после очистки на Mono S, анализируют спектрофотометрически и электрофоретически в SDS-ПААГ, диализуют против буфера А для адсорбционной хроматографии (10 мМ Na2HPO4, 10 мМ NaH2PO4, 1 мМ NaN3, pH 7.0) и наносят на колонку CHT-I (BIO-RAD, США). Мутантный цитохром с элюируют линейным градиентом буфера В для адсорбционной хроматографии (500 мМ Na2HPO4, 500 мМ NaH2PO4, 1 мМ NaN3, pH 7.0) со скоростью 2 мл/мин.
Степень очистки и концентрацию мутантного цитохрома с в полученных фракциях определяют спектрофотометрически и электрофоретическим анализом в SDS-ПААГ, наиболее чистые фракции объединяют, окисляют с помощью феррицианида калия, добавленного в эквимолярных концентрациях, дважды диализуют против 10 мМ аммоний-карбонатного буфера, рН 7.9 и лиофилизуют на установке ALPHA 1-5.
Экспрессию мутантных генов цитохрома с лошади K8E/E62K/E69K/K72E/K86E/K87E и K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K, находящихся в составе рекомбинантной плазмидной ДНК pBPCYCS/3 - K27E/E69K/K72E/K86E/K87E/E90K и pBPCYCS/3 - K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K соответственно и очистку мутантных белков цитохрома с лошади K8E/E62K/E69K/K72E/K86E/K87E и K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K проводят по схеме, описанной выше.
Получают 20 мг мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K, 10 мг мутантного цитохрома с лошади K8E/E62K/E69K/K72E/K86E/K87E и 10 мг мутантного цитохрома с лошади K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K с 1 л клеточной культуры.
Для проверки спектральных характеристик полученного мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K снимают спектр поглощения на спектрофотометре Сагу 50 Bio (Varian, США) в среде, содержащей 0,25 М сахарозу, 50 мМ Tris-HCl (рН 8.0) и 0.2 мМ ЭДТА. Для окисления цитохрома с лошади дикого типа (Sigma) или мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K в среду измерения добавляяют 20 мкМ феррицианида калия (фиг.3, линия 1). Для восстановления цитохрома с лошади дикого типа или мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K в спектрофотометрическую кювету добавляют несколько кристаллов дитионита натрия (фиг.3, линия 2). Указанные замены не влияют на спектр поглощения мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K. Изменение молярного поглощения при восстановлении цитохрома с лошади дикого типа или мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K в максимуме при 550 нм составляет ε550=20000 М-1см-1 (фиг.3). Спектральные характеристики мутантного цитохрома с лошади K8E/E62K/E69K/K72E/K86E/K87E и мутантного цитохрома с K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K идентичны спектральным характеристикам цитохрома с лошади дикого типа и мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K.
Пример 5. Тестирование мутантных цитохромов с лошади в митохондриях печени крысы, специфически обедненных по цитохрому с.
5.1. Получение препарата митохондрий печени крысы
Крысу весом 250 г обезглавливают, печень извлекают из вскрытой брюшной полости. Изолированную печень погружают в 30 мл ледяной среды выделения, содержащей 0.25 М сахарозу, 1 мМ ЭДТА, рН 7.4. После трехкратного промывания охлажденную ткань помещают на чашку Петри, стоящую на льду, и быстро измельчают ножницами. Измельченную ткань вновь помещают в свежую среду выделения и тщательно промывают. После оседания кусочков ткани жидкость осторожно сливают и описанную операцию повторяют еще дважды.
Промытую таким образом ткань переносят в гомогенизатор, добавляют 40 мл среды выделения и гомогенизируют в течение 40 с. К полученному гомогенату добавляют еще 40 мл среды выделения, перемешивают с помощью медленно вращающегося пестика и разливают гомогенат в два центрифужных стакана. Гомогенат центрифугируют при 600 g и 0-2°С в течение 10 мин для удаления обломков клеток и ядерной фракции.
Супернатант осторожно сливают и хранят на льду, а осадки объединяют и вновь гомогенизируют в течение 20 с в 20 мл среды выделения. Гомогенат центрифугируют при 600 g 10 мин, и полученный супернатант объединяют с полученным ранее.
Для осаждения митохондрий супернатант центрифугируют при 14000 g в течение 10 мин. Полученные осадки объединяют и тщательно суспендируют в небольшом объеме среды выделения (около 0.5 мл). Небольшими порциями при осторожном встряхивании добавляют 40 мл среды выделения и осаждают митохондрий (14000 g, 10 мин). Осадок суспендируют в 0.25 М сахарозе, не содержащей ЭДТА, и вновь центрифугируют (14000 g, 10 мин). Супернатант сливают, а на полученный осадок митохондрий осторожно наслаивают 0.3 мл 0.25 М сахарозы. Легким встряхиванием смывают рыхлый слой осадка. Эту операцию повторяют еще дважды, полученный плотный осадок митохондрий тщательно суспендируют в 0.5 мл 0.25 М сахарозы. Полученную густую суспензию митохондрий переносят в пробирку и хранят на льду.
5.2. Получение препарата митохондрий печени крысы, специфически обедненных по цитохрому с
40 мл препарата митохондрий печени крысы (концентрация белка 50 мг/мл) помещают в гипотонический раствор, содержащий 0.01 М сахарозу и 15 мМ KCI. Инкубируют 10 мин во льду при помешивании. Затем центрифугируют при 20000 g в течение 15 мин. Осадок ресуспендируют в небольшом количестве 0.25 М сахарозы с помощью гомогенизатора с тефлоновым пестиком. Затем препарат помещают в раствор, содержащий 150 мМ KCI. Инкубируют 10 мин во льду при помешивании и центрифугируют при 20000 g в течение 15 мин. К осадку добавляют небольшое количество 0.25 М сахарозы, гомогенизируют, разливают на аликвоты по 1.5 мл. Полученный препарат замораживают и хранят в жидком азоте.
5.3. Измерение сукцинат: цитохром с-редуктазной активности митохондрий печени крысы, специфически обедненных по цитохрому с
Сукцинат: цитохром с-редуктазную активность измеряют по восстановлению цитохрома с спектрофотометрически при 550 нм. Проба объемом 2 мл содержит среду инкубации (0.15 М сахарозу, 20 мМ KCI, 20 мМ Tris-HCI, pH 7.4, 5 мМ NaN3), препарат митохондрий (9 мкг/мл) и окисленный цитохром с лошади дикого типа или АсС (Sigma), или мутантный цитохром с лошади K27E/E69K/K72E/K86E/K87E/E90K, или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K. Концентрацию окисленного цитохрома с лошади дикого типа варьируют от 1 до 40 мкМ, мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K, или АсС - от 1 до 60 мкМ. Реакцию начинают добавлением 10 мМ сукцината. Активность выражают в мкмоль восстановленного цитохрома с/мин на 1 мг белка митохондрий (фиг.1).
Сукцинат: цитохром с-редуктазная активность митохондрий в присутствии АсС составляет 8% от активности в присутствии цитохрома с лошади дикого типа. Сукцинат: цитохром с-редуктазная активность митохондрий в присутствии мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K составляет 3% от активности в присутствии цитохрома с лошади дикого типа (фиг.1).
5.4. Измерение цитохром с-оксидазной активности митохондрий печени крысы, специфически обедненных по цитохрому с
Цитохром с-оксидазную активность измеряют полярографически. Проба объемом 1.3 мл содержит среду инкубации (0.15 М сахарозу, 20 мМ KCI, 20 мМ Tris-HCI, pH 7.4, 10 мМ аскорбат), препарат митохондрий (43 мкг/мл) и окисленный цитохром с лошади дикого типа или АсС, или мутантный цитохром с K27E/E69K/K72E/K86E/K87E/E90K, или K8E/E62K/E69K/K72E/K86E/K87E, K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K. Концентрацию окисленного цитохрома с лошади дикого типа или мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K, или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K, или АсС варьируют от 1 до 90 мкМ. Реакцию начинают добавлением 0.2 мМ тетраметил-пара-фенилендиамина (ТМФД). Активность выражают в мкмоль окисленного цитохрома с/мин на 1 мг белка митохондрий (фиг.2).
Цитохром с-оксидазная активность митохондрий в присутствии АсС составляет 3% от активности в присутствии цитохрома с лошади дикого типа. Цитохром с-оксидазная активность митохондрий в присутствии мутантного цитохрома с лошади K27E/E69K/K72E/K86E/K87E/E90K или K8E/E62K/E69K/K72E/K86E/K87E, или K8E/K27E/E62K/E69K/K72E/K86E/K87E/E90K не выявлена (фиг.2).
Способ получения рекомбинантного мутантного цитохрома с лошади, включающий введение мутаций К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К с помощью метода сайт-направленного мутагенеза, основанного на полимеразной циклической реакции, в ген цитохрома с лошади, находящийся в составе плазмидной ДНК pBPCYCS/3, с последующей трансформацией штамма Escherichia coli JM-109 полученной рекомбинантной плазмидной ДНК, экспрессию и выделение целевого белка с помощью катионообменной и адсорбционной хроматографии.